不同盐分类型胁迫对豌豆幼苗离子吸收、累积及运输的影响
董放,曹靖*,李先婷,张琳捷,岳小红,耿杰,张金林
(1.草地农业生态系统国家重点实验室,兰州大学生命科学学院,甘肃 兰州 730000;2.信阳市环境监测站,河南 信阳 464000;3.草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
不同盐分类型胁迫对豌豆幼苗离子吸收、累积及运输的影响
董放1,曹靖1*,李先婷2,张琳捷1,岳小红1,耿杰1,张金林3
(1.草地农业生态系统国家重点实验室,兰州大学生命科学学院,甘肃 兰州 730000;2.信阳市环境监测站,河南 信阳 464000;3.草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
为了探究不同类型盐分(NaCl、混合Na盐和混合Cl盐)胁迫下3个品种(‘银豌1号’、‘S5001-1’和‘737’)的豌豆幼苗对离子吸收与运输的生理机制,采用水培方法对3个品种的豌豆幼苗的盐分离子吸收、分布、累积特性进行了研究。结果表明,1)3个品种的豌豆幼苗在NaCl和混合Na盐处理下,地上部和根系Na+含量较对照均显著增加,而K+、Ca2+含量则显著降低;混合Cl盐处理下,豌豆幼苗地上部和根系Na+含量较对照均无显著差异,而Cl-、K+、Ca2+和Mg2+含量均显著高于NaCl处理和混合Na盐处理。2)3个品种的豌豆幼苗在正常生长条件下均优先吸收并富集K+,其次是Ca2+;在NaCl和混合Cl盐处理下优先吸收并富集K+,其次是Na+和Cl-;混合Na盐处理下则优先吸收并富集Na+和K+,其次是Ca2+,但不同处理下离子的分布和累积状况在不同品种的豌豆幼苗间有所不同。3)NaCl和混合Na盐处理下,3个品种的豌豆幼苗的离子选择性吸收系数SAK,Na、SACa,Na和SAMg,Na显著升高,而在混合Cl盐处理下显著降低。同一处理下,3个品种的豌豆幼苗间的离子选择性运输系数也表现不同,NaCl和混合Na盐处理下,‘S5001-1’的STK,Na和STCa,Na较对照显著升高,而‘银豌1号’的STK,Na和STCa,Na在混合Na盐和混合Cl盐处理下较对照显著降低,3个品种的豌豆幼苗间的STK,Na在混合Cl盐处理下无显著差异。以上结果说明,NaCl和混合Na盐处理下,豌豆幼苗地上部对Ca2+、K+和Mg2+的累积量明显下降,同时为了应对盐分胁迫,根系对Ca2+、K+和Mg2+的吸收及运输能力则显著增强;在混合Cl盐处理下,豌豆幼苗地上部对Ca2+、K+和Mg2+的吸收及累积量较其他两种盐分处理明显增加,但根系对于Ca2+、K+和Mg2+的吸收及运输能力则显著低于其他两种盐分处理,而且品种间差异显著。本结果对于阐明不同盐分类型胁迫下植物对离子吸收与运输的生理机制提供一定的理论依据。
盐分类型;盐分胁迫;离子吸收与运输;豌豆
盐渍化土壤影响了世界范围内超过8×107hm2的可耕种土地[1],是当今世界最严重的农业和生态学问题之一[2],尤其是干旱和半干旱地区土壤中高浓度的可溶性盐严重危害作物的生长和产量[3-4]。盐渍化土壤中Na+和Cl-是主要盐分离子,NaCl占土壤可溶性盐总量的50%~80%[5]。盐胁迫对植物主要有3种效应:第一,降低土壤水势导致渗透胁迫,引起细胞内的离子含量失衡,尤其是K+、Ca2+和NO3-;第二,引发离子毒害(主要是Na+和Cl-);第三,抑制植物生长,由于渗透胁迫和离子毒害,在植物个体水平上的表现就是死亡或减产[1]。有研究表明植物能够耐受盐分胁迫的关键性因素不是渗透调节,而是对离子吸收与运输的调控,重建细胞内离子平衡对于植物体在盐渍化环境中维持正常代谢和生长至关重要[6]。当植物体内矿质离子的含量被扰乱从而引起渗透胁迫时,将影响植物对营养元素的选择性吸收和运输,导致细胞内离子含量的失衡,此时盐渍化的危害将表现得十分明显[7]。由于大多数植物都不能耐受储存在细胞质中的大量盐分离子,故采取各种机制来抵御盐分离子在植物体内的积累,所以,盐胁迫下植物对离子的选择性吸收、运输及分配均发生了变化。可见,植物对盐分的耐受能力与植物能否保持体内的阴阳离子平衡有关,有关单一盐分(如NaCl)胁迫对植物离子吸收与运输影响的研究报道较多[8-10],而对于不同类型盐分胁迫对植物体离子吸收与运输影响的研究甚少。
豌豆(Pisumsativum)是一种较耐盐的豆科植物,在我国西北干旱、半干旱地区广泛种植。根据3个品种豌豆在永登秦王川盐渍化土壤的田间产量试验表现,本研究通过水培实验,比较不同类型盐分胁迫下豌豆幼苗的离子分布及吸收运输特点,探明3个品种豌豆幼苗对盐分胁迫的适应机制,以期为干旱半干旱区盐渍化农田推广种植耐盐的豌豆作物提供参考依据。
1 材料与方法
1.1 实验材料
实验所用豌豆品种为 ‘银豌1号’(甘肃省白银市农业科学研究所提供,产量4095.0 kg/hm2)、‘S5001-1’(甘肃省农业科学院提供,产量4714.5 kg/hm2)和‘737’(青海省农林科学院提供,产量2715.0 kg/hm2),以上产量均为在永登县盐渍化农田的试验结果。
1.2 实验处理
实验于2013年在兰州大学人工气候室内进行,温室条件为:昼/夜温度28 ℃/23 ℃,湿度70%,光周期14 h,光强为400~450 μmol/(m2·s)。培养容器为不透光的长方形塑料盆(长36 cm,宽24 cm,高22 cm),盖板为1.2 cm厚塑料泡沫板,其上有 25个直径为1 cm的小孔。选择大小均一、籽粒饱满的豌豆种子萌发,先用自来水浸泡4 h后用10%的NaClO消毒5 min,再用自来水和蒸馏水分别冲洗3次,将种子平铺在有两层滤纸的培养皿中,然后置于25 ℃恒温培养箱萌发。把露白的豌豆种子夹在脱脂棉中,放在小孔内。在装有6 L 1/4 Hoagland营养液(用H2SO4/KOH调整营养液pH至6.8~7.0)的塑料盆中生长7 d,每两天更换一次营养液。待出现第三片叶时在1/2 Hoagland营养液中添加相应盐分进行处理[11],混合Na盐处理为在1/2 Hoagland营养液中添加浓度分别为15 mmol/L Na2SO4、15 mmol/L Na2HPO4和40 mmol/L NaNO3的混合盐;混合Cl盐处理为在1/2 Hoagland营养液中添加浓度分别为15 mmol/L CaCl2、15 mmol/L MgCl2和40 mmol/L KCl的混合盐;NaCl处理为在1/2 Hoagland营养液中添加浓度为100 mmol/L的NaCl。盐分处理以每天25 mmol/L的速度递增,不加盐分的相应营养液为对照组(CK)。每个处理设置3个重复,达到既定目标浓度(即盐分离子总浓度为100 mmol/L)后培养7 d收获,植物地上部和根系干样用于测定离子含量。
1.3 无机离子含量的测定
Na+、K+、Ca2+和 Mg2+的含量测定用HNO3∶HClO4=4∶1消煮提取[12],用等离子体发射光谱仪 (IRIS ER/S, America) 测定。Cl-含量用AgNO3滴定法测定[13],取约50 mg干样粉末放入50 mL具塞刻度试管中,加15 mL去离子水, 于沸水浴中浸提2 h,定容至50 mL容量瓶后过滤,用滴定法测定。
1.4 数据处理
K+、Ca2+和Mg2+的选择性吸收系数(SA)和选择性运输系数(ST) 计算[14]:
SAX,Na=(根系[X+]/[Na+])/(介质[X+]/[Na+]);STX,Na=(地上[X+]/[Na+])/(根系[X+]/[Na+]),式中:[X+]为K+、Ca2+或Mg2+的含量。SA值越大,表示根系排出Na+、吸收 [X+]的能力越强,即根系选择性吸收能力越强;ST值越大,表示根系控制Na+、促进[X+]向地上部的运输能力越强,即根系选择性运输能力越强。“介质”是指植物根系生长的介质(如土壤、培养液等),以下简称介质。
采用Excel 2003和SPSS 17.0进行数据处理及统计分析,采用One-way ANOVA的方法比较均值之间的差异,若差异显著,则采用LSD法进行多重比较(P=0.05)。
2 结果与分析
2.1 盐分离子在豌豆幼苗中的分布特征
在NaCl和混合Na盐处理下(图1A),3个品种的豌豆幼苗地上部和根系Na+的含量较对照均显著增加(P<0.05),且在混合Na盐处理下‘银豌1号’地上部Na+含量显著高于NaCl处理组(P<0.05),且远高于相应的根系Na+含量,‘737’变化趋势与‘银豌1号’相似,而‘S5001-1’根系Na+含量较地上部增加明显。混合Cl盐处理下,3个品种的豌豆幼苗地上部和根系Na+的含量较对照无显著差异(P>0.05)。
对Cl-而言(图1B),在NaCl和混合Cl盐处理下,3个品种的豌豆幼苗地上部和根系Cl-含量较对照均显著增加(P<0.05),其中‘银碗1号’和‘737’地上Cl-含量高于根系。混合Na盐处理下,3个品种的豌豆幼苗地上部和根系Cl-含量较对照无显著差异(P>0.05)。
对K+而言(图1C),在NaCl和混合Na盐处理下,3个品种的豌豆幼苗地上部和根系的K+含量较对照显著减少(P<0.05),且混合Na盐处理下减少最为显著,其中‘银豌1号’地上部K+含量较对照减少40.31%,‘737’根系K+含量较对照减少93.34%。混合Cl盐处理下,3个品种的豌豆幼苗地上部和根系K+含量较对照均显著增加(P<0.05),其中‘银豌1号’地上部K+含量较对照增加85.22%,而‘S5001-1’根系K+含量较对照增加25.57%。

图1 不同类型盐分胁迫下豌豆幼苗地上部和根系中各盐分离子的含量(平均值±标准差)Fig.1 Contents of salt ions in shoots and roots of pea seedlings under various types of salt stress (mean±SD) 不同小写字母表示地上部处理间差异显著(P<0.05),不同大写字母表示根系处理间差异显著(P<0.05)。Different small letters show significant differences in shoots (P<0.05) and different capital letters show significant differences in roots(P<0.05).
对Ca2+而言(图1D),在NaCl和混合Na盐处理下,3个品种的豌豆幼苗地上部Ca2+含量较对照显著减少(P<0.05),其中‘银豌1号’地上部Ca2+含量在混合Na盐处理下较对照减少54.08%,而‘S5001-1’根系Ca2+含量在NaCl处理下较对照减少38.16%。混合Cl盐处理下,3个品种的豌豆幼苗根系Ca2+含量较对照均显著增加(P<0.05),其中‘737’根系Ca2+含量较对照增加265.65%,增加最为显著,且‘737’根系Ca2+含量高于地上部。对Mg2+而言(图1E),不同盐分类型处理下,3个品种的豌豆幼苗的Mg2+和Ca2+含量趋势相似,但在混合Cl盐处理下,3个品种的豌豆幼苗地上部Mg2+含量均高于根系。
2.2 盐胁迫下豌豆幼苗的离子累积特性
如表1所示,对照处理下,‘银豌1号’和‘737’幼苗离子累积顺序为K+>Ca2+>Cl->Mg2+>Na+,而‘S5001-1’幼苗离子累积顺序为K+>Ca2+>Mg2+>Cl->Na+,表明了正常生长时,豌豆幼苗优先吸收并富集K+,其次是Ca2+;NaCl处理下,‘银豌1号’和‘737’幼苗离子累积顺序为K+>Na+>Cl->Ca2+>Mg2+,而‘S5001-1’幼苗离子累积顺序为K+>Na+>Ca2+>Cl->Mg2+,表明豌豆幼苗优先吸收并富集K+,其次是Na+;混合Na盐处理下,‘银豌1号’和‘737’幼苗离子累积顺序为Na+>K+>Ca2+>Cl->Mg2+,‘S5001-1’幼苗离子累积顺序为K+>Na+>Ca2+>Mg2+>Cl-,这表明‘银豌1号’和‘737’优先吸收并富集Na+,而‘S5001-1’优先吸收并富集K+;混合Cl盐处理下,‘银豌1号’和‘737’幼苗离子累积顺序为K+>Ca2+>Cl->Mg2+>Na+,而‘S5001-1’幼苗离子累积顺序为K+>Cl->Ca2+>Mg2+>Na+,表明豌豆幼苗优先吸收并富集K+,其次是Ca2+和Cl-。

表1 不同盐分类型胁迫下豌豆幼苗中各盐分离子的累积量(平均值±标准差)
2.3 豌豆幼苗的离子选择性吸收和运输
不同处理间豌豆幼苗的离子选择性吸收系数差异较大(表2),NaCl和混合Na盐处理下,3个品种的豌豆幼苗的SAK,Na、SACa,Na和SAMg,Na均显著高于对照和混合Cl盐处理(P<0.05),而对照显著高于混合Cl盐处理(P<0.05)。同一处理下,3个品种的豌豆幼苗间的离子选择性吸收系数也表现不同,对照处理中‘737’的SAK,Na和SACa,Na显著高于其他品种(P<0.05);NaCl处理下,‘S5001-1’的SAK,Na和SACa,Na显著低于其他两个品种(P<0.05);混合Na盐处理下,‘银豌1号’和‘S5001-1’的SAK,Na和SAMg,Na均显著高于‘737’(P<0.05),而‘S5001-1’的SACa,Na则显著低于其他两个品种(P<0.05);混合Cl盐处理下,3个品种的豌豆幼苗的SAK,Na、SACa,Na和SAMg,Na均无显著差异(P>0.05)。

表2 不同盐分类型胁迫下豌豆幼苗的离子选择性吸收系数
注:不同小写字母表示同一品种不同处理间差异显著(P<0.05),不同大写字母表示同一处理不同品种间差异显著(P<0.05),下同。
Note:Different lowercase letters show significant differences between treatments (P<0.05), different capital letters show significant differences between varieties (P<0.05). The same below.
不同处理间豌豆幼苗的离子选择性运输系数差异较大(表3),NaCl和混合Na盐处理下,‘S5001-1’的STK,Na、STCa,Na和STMg,Na均显著高于对照和混合Cl盐处理(P<0.05),而混合Cl盐处理较对照无显著差异(P>0.05)。同一处理下,3个品种的豌豆幼苗间的离子选择性运输系数也表现不同,对照处理中‘银豌1号’的STK,Na、STCa,Na和STMg,Na均显著高于其他品种(P<0.05);NaCl处理下,‘S5001-1’的STK,Na、STCa,Na和STMg,Na均显著高于其他品种(P<0.05);混合Na盐处理下,‘S5001-1’的STCa,Na和STMg,Na均显著高于其他品种(P<0.05);混合Cl盐处理下,3个品种的豌豆幼苗的STK,Na无显著差异(P>0.05),而‘S5001-1’的STCa,Na显著高于其他品种(P<0.05),‘737’的STMg,Na显著高于其他品种(P<0.05)。
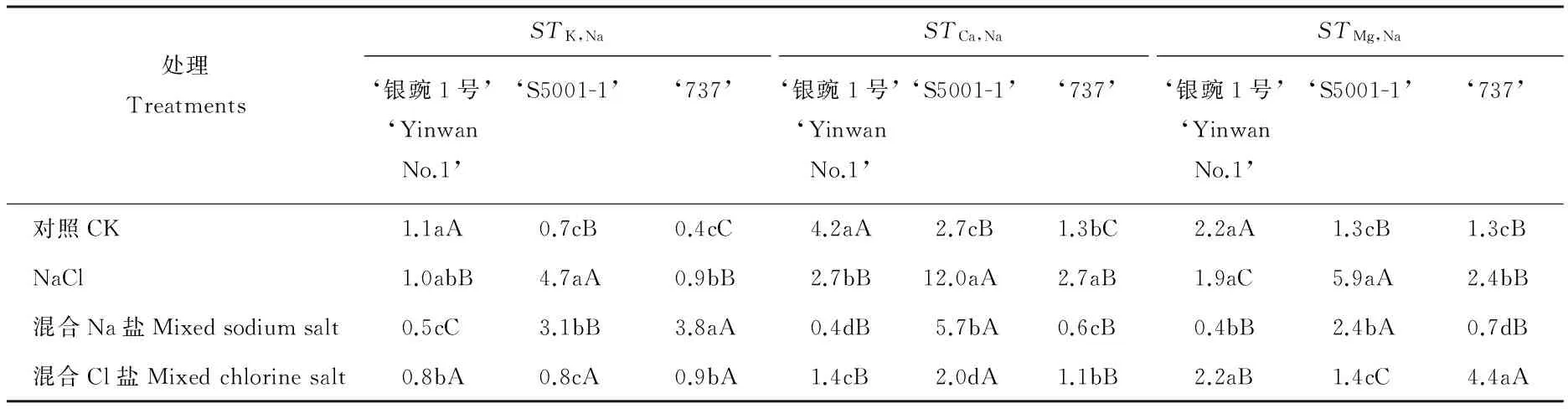
表3 不同盐分类型胁迫下豌豆幼苗的离子选择性运输系数
3 结论与讨论
3.1 盐分胁迫下离子在植物中的分布与累积
耐盐植物能通过盐分离子的区隔化维持体内离子平衡, 以提高耐盐性[1]。Na+在不同器官中的分配是植物耐受盐分的重要机制[15]。但不同植物对Na+的分布方式不同, 例如, 啤酒大麦(Horduemvulgare)和野生大豆(Glycinesoja)的耐盐品种将Na+优先积累在地上部[16-17],而杂交狼尾草(Pennisetumamericanum×P.purpureum)将Na+优先积累在根系中[18]。本实验中,NaCl处理下,3个品种的豌豆幼苗均表现为根系Na+含量高于地上部;而在混合Na盐处理下,豌豆幼苗在品种间表现不同,‘银豌1号’和‘737’将Na+优先积累在地上部,而‘S5001-1’将Na+优先积累在根系中;混合Cl盐处理对3个品种的豌豆幼苗地上部和根系Na+的分布没有显著影响。Tester等[19]认为,根对Na+的截留量增加到一定程度后,会达到平衡点,当超过平衡点时,根系中的Na+外排率上升,地上部的Na+含量会迅速增加,从而保持根的离子平衡,这也许可以解释本实验中NaCl和混合Na盐处理下的‘银豌1号’和‘737’的表现,而‘S5001-1’表现不同说明了同种植物的不同品种对盐分胁迫的反应存在着明显的差异。NaCl渐进胁迫下,啤酒大麦组织中Na+的含量会显著增加,而K+的含量会显著减少[15],本实验中NaCl处理下的3个品种的豌豆幼苗的表现与此一致,这也许是因为NaCl可以使细胞膜电位去极化,从而使K+通过K+内流通道时运输受阻[20],或是植物体内的质膜Na+/H+逆向转运蛋白(plasma membrane Na+/H+antiporter)抑制了高亲和性K+转运蛋白HKT(high-affinity K+transporter)的结果[21]。
在植物个体水平上,盐分通常会引起Na+和Cl-含量增加的同时 K+和Ca2+含量的减少[22],这与杨小菊等[23]对盐胁迫下砂蓝刺头(Echinopsgmelinii)的研究结果一致,本实验NaCl处理下的‘银豌1号’和‘S5001-1’表现也与此一致,混合Na盐处理下的‘银豌1号’和‘737’表现更加明显,而混合Cl盐处理下,3个品种的豌豆幼苗K+和Ca2+含量反而有所增加,这表明混合Cl盐对于豌豆幼苗在个体水平上累积K+和Ca2+有明显的促进作用。李品芳等[24]认为可能是由于Cl-与K+和Ca2+具有协同效应的原因,这还有待进一步探究。Ca2+和Mg2+是促进植物生长的矿质离子,大量Ca2+和Mg2+的积累有助于维持较低的细胞渗透势、促进根系吸水,根系Ca2+的积累对保持细胞膜的完整性和稳定性也具有重要作用[25], Grattan等[7]指出植物根系维持足够的Ca2+含量对减少Na+和Cl-毒害有重要作用,本实验NaCl和混合Na盐处理下,‘银豌1号’和‘S5001-1’根系Ca2+含量较对照均显著减少,且在NaCl处理下减少最为显著;而‘737’根系Ca2+含量在混合Na盐处理下较对照显著增加,这表明‘737’根系在混合Na盐胁迫下能累积更多的Ca2+,从而维持根系正常的生理功能;在混合Cl盐处理下,3个品种的豌豆幼苗地上部和根系Ca2+和Mg2+的含量均显著高于对照,这表明Cl盐能够显著提高豌豆幼苗对Ca2+和Mg2+的吸收,提高了豌豆幼苗对盐分胁迫的耐受能力,这也是3个品种的豌豆幼苗在混合Cl盐胁迫下不同于其他盐分胁迫的特点。
李洪燕等[26]对籽粒苋(Amaranthushypochondriacus)幼苗的研究表明,NaCl和混合Na盐胁迫下,植物体内Na+和Cl-的累积量均显著高于对照,混合Cl盐胁迫下,K+累积量显著高于对照、NaCl和混合Na盐处理。NaCl处理下,橄榄树(Oleaeuropaea)的Ca2+累积量显著减少[27],牧豆树(Prosopisstrombulifera)幼苗中Ca2+的累积量较对照无显著变化,而Cl-累积量显著高于对照[28]。本实验NaCl胁迫下,3个品种的豌豆幼苗表现出K+的累积量最高,其次是Na+,这可能是豆科植物幼苗应对NaCl胁迫的一种共同机制,累积K+和Ca2+也许是缓解Na+毒害的一种响应机制。
3.2 盐分胁迫下植物对离子的选择性吸收及运输
植株整体水平的离子区域化是通过各器官对不同离子吸收和运输的调控实现的[1]。由于各离子不同的离子半径所造成的与酶的亲和能力不同,从而导致了植物对不同离子的吸收和运输存在选择性[29]。选择性吸收系数(SA)和选择性运输系数(ST)反映的是阳离子之间的协同或拮抗关系。对不同物种的比较研究表明,NaCl处理下海蓬子(Salicorniaeuropaea)的STK,Na显著降低,而向日葵(Helianthusannuus)的STK,Na则显著升高,芦荟(Aloevera)幼苗的SAK,Na和STK,Na升高,且随NaCl浓度的增大呈显著上升趋势[30]。NaCl和混合Na盐处理下,籽粒苋幼苗的SAK,Na和STK,Na较对照均显著升高[26]。本实验中,NaCl和混合Na盐处理下,3个品种的豌豆幼苗的SAK,Na均显著升高,而混合Cl盐处理下,3个品种的豌豆幼苗的SAK,Na均显著降低,进而表明NaCl和混合Na盐胁迫可能提高了豌豆根系对K+的吸收能力,而混合Cl盐会抑制豌豆根系对K+的吸收。当在NaCl处理下,‘S5001-1’与‘737’的STK,Na显著升高,而‘银豌1号’的STK,Na较对照无显著差异;混合Na盐处理下,‘银豌1号’的STK,Na显著降低,‘S5001-1’和‘737’的STK,Na显著升高;Cl盐处理下,‘银豌1号’的STK,Na显著降低,‘737’的STK,Na显著升高,这表明豌豆在盐分胁迫下SAK,Na的变化趋势与芦荟相同,而3个品种的豌豆幼苗STK,Na的变化趋势不尽相同,其中‘S5001-1’与‘737’对于K+的选择性运输能力较‘银豌1号’更强。由于K+是大多数陆生植物体内一种非常重要的无机离子,有超过50种酶需要K+来激活,而K+的这种功能无法由Na+替代[31],故在盐分胁迫下植物根系对K+的选择性吸收能力提高(即SAK,Na增大),同时植物体要尽可能地将根系所吸收的K+运输至地上部(即STK,Na增大),以维持细胞正常的代谢活动,这也许是豌豆应对盐分胁迫的一种重要机制,也是SAK,Na与STK,Na之间的一种互动响应,即在盐分胁迫下,SAK,Na和STK,Na均增大的植物能够更好地耐受盐分胁迫,张金林等[32]也发现耐盐品种的SA与ST均显著高于盐敏感品种。
对于库拉索芦荟而言,NaCl胁迫下,STCa,Na显著低于无盐处理, 且随着盐浓度增加而降低[33]。随NaCl浓度的提高,青钱柳(Cyclocaryapaliurus)幼苗STK,Na上升,STCa,Na下降,STMg,Na变化不明显[34]。披碱草(Elymusdahuricus)随着盐分浓度的增加,STK,Na显著降低[35]。对于盐角草(Salicorniaeuropaea)和新疆杨(Populusalba),在碱性土壤中,无论SA还是ST都有相同的大小顺序,即SK,Na>SMg,Na>SCa,Na,且SACa,Na和SAMg,Na显著小于SAK,Na[36-37],证明盐角草和新疆杨等都是优先保证对K+的吸收和运输,其次是Ca2+和Mg2+,从而维持植物体正常的生理活动。本实验中,不同处理下3个品种的豌豆幼苗的离子选择性运输系数表现不同,NaCl处理下,‘S5001-1’与‘737’的STCa,Na和STMg,Na均显著高于对照,而‘银豌1号’的STMg,Na较对照无显著差异;混合Na盐处理下,‘银豌1号’和‘737’的STCa,Na和STMg,Na较对照均显著降低,而‘S5001-1’的STCa,Na和STMg,Na较对照均显著升高;混合Cl盐处理下,‘银豌1号’和‘S5001-1’的STCa,Na均显著降低,STMg,Na较对照无显著差异, 这表明在盐分胁迫下,大多数植物对于Ca2+的吸收和运输能力均会下降,这在一定程度上体现了盐分对于植物的毒害作用,而豌豆将Ca2+从根系运输至地上部的能力在品种间存在差异,其中‘S5001-1’与‘737’对于Ca2+的选择性运输能力强于‘银豌1号’,即‘S5001-1’与‘737’在盐分胁迫下维持细胞渗透势和根系吸水的能力较强。盐分胁迫下,3个豌豆品种的STMg,Na的变化趋势与其他盐生植物大体相同,这也许表明对于豌豆而言,Mg2+在维持细胞渗透势和根系吸水能力方面的作用不及Ca2+,这还有待进一步的探究。综合实验结果来看,‘S5001-1’对盐分胁迫的耐受能力最强,‘银豌1号’次之,可在盐渍化地区推广种植。
[1] Munns R, Tester M. Mechanisms of salinity tolerance. Annual Review of Plant Physiology and Plant Molecular Biology, 2008, 59: 651-681.
[2] Hasegawa P M. Sodium (Na+) homeostasis and salt tolerance of plants. Environmental and Experimental Botany, 2013, 92: 19-31.
[3] Hammer E C, Nasr H, Pallon J,etal. Elemental composition of arbuscular mycorrhizal fungi at high salinity. Mycorrhiza, 2011, 21: 117-129.
[4] Hajiboland R. Role of Arbuscular Mycorrhiza in Amelioration of Salinity[M]// Salt Stress in Plants. New York: Springer, 2013: 301-354.
[5] Rengasamy P. Soil processes affecting crop production in salt-affected soils. Functional Plant Biology, 2010, 37: 613-620.
[6] Munns R, James R A, Lauchli A. Approaches to increasing the salt tolerance of wheat and other cereals. Journal of Experimental Botany, 2006, 57: 1025-1043.
[7] Grattan S R, Grieve C M. Salinity-mineral nutrient relations in horticultural crops. Scientia Horticulturae, 1999, 78: 127-157.
[8] Teakle N L, Tyerman S D. Mechanisms of Cl-transport contributing to salt tolerance. Plant, Cell and Environment, 2010, 33: 566-589.
[9] Evelin H, Giri B, Kapoor R. Contribution ofGlomusintraradicesinoculation to nutrient acquisition and mitigation of ionic imbalance in NaCl stressedTrigonellafoenum-graecum. Mycorrhiza, 2012, 22: 203-217.
[10] Li J, Bao S Q, Zhang Y H,etal.Paxillusinvolutusstrains MAJ and NAU mediate K+/Na+homeostasis in ectomycorrhizalPopulus×canescensunder sodium chloride stress. Plant Physiology, 2012, 159: 1771-1786.
[11] Tavakkoli E, Rengasamy P, McDonald G K. High concentrations of Na+and Cl-ions in soil solution have simultaneous detrimental effects on growth of faba bean under salinity stress. Journal of Experimental Botany, 2010, 61(15): 4449-4459.
[12] Bao S D. Soil Agro-chemistrical Analysis[M]. Beijing: China Agriculture Press, 2000.
[13] Tang C X. Factors affecting soil acidification under legumes I. Effect of potassium supply. Plant and Soil, 1998, 199: 275-282.
[14] Flowers T J, Yeo A R. Ion Relations of Salt Tolerance[M]// Baker D A, Hall J L, eds. Solute Transport in Plant Cells and Tissues. New York: John Wiley and Sons, 1988: 392-416.
[15] Serrano R, Mulet J M, Rios G,etal. A glimpse of the mechanisms of ion homeostasis during salt stress. Journal of Experimental Botany, 1999, 50: 1023-1036.
[16] Li X T, Cao J, Wei X J,etal. Effect of extended exposure to NaCl stress on the growth, ion distribution and photosynthetic characteristics of malting barley (Hordeumvulgare). Acta Prataculturae Sinica, 2013, 22(6): 108-116.
[17] Chen H Z, Ladatko N, Zhu D F,etal. Absorption and distribution of Na+and K+in rice seedling under salt stress. Chinese Journal of Plant Ecology, 2007, 31(5): 937-945.
[18] Wang D, Yuan F, Wang B S,etal. Response of plant biofuel hybrid pennisetum to NaCl stress and its salinity threshold. Chinese Journal of Plant Ecology, 2012, 36(6): 572-577.
[19] Tester M, Davenport R. Na+tolerance and Na+transport in higher plants. Annals of Botany, 2003, 91: 503-527.
[20] Shabala S, Cuin T A. Potassium transport and plant salt tolerance. Physiologia Plantarum, 2007, 133: 651-669.
[21] Fuchs I, Stölzle S, Ivashikina N,etal. Rice K+uptake channel OsAKT1 is sensitive to salt stress. Planta, 2005, 221: 212-221.
[22] Shokri S, Maadi B. Effect of arbuscular mycorrhizal fungus on the mineral nutrition and yield ofTrifoliumalexandrinumplants under salinity stress. Journal of Agronomy, 2009, 8(2): 79-83.
[23] Yang X J, Zhao X, Shi Y,etal. Effects of salt stress on ion distribution in differentEchinopsgmeliniorgans. Acta Prataculturae Sinica, 2013, 22(4): 116-122.
[24] Li P F, Bai W B, Yang Z C. Effects of NaCl stress on ions absorption and transportation and plant growth of tall fescue. Scientia Agricultura Sinica, 2005, 38(7): 1458-1565.
[25] Kopittke P M. Interactions between Ca, Mg, Na and K: alleviation of toxicity in saline solutions. Plant Soil, 2012, 352(1): 353-362.
[26] Li H Y, Zheng Q S, Jiang C Q,etal. A comparison of stress effects between chloridion and sodium ion on grain amaranth seedlings under NaCl stress. Acta Prataculturae Sinica, 2010, 19(5): 63-70.
[27] Bader B, Aissaoui F, Kmicha I,etal. Effects of salinity stress on water desalination, olive tree (OleaeuropaeaL. cvs ‘Picholine’, ‘Meski’ and ‘Ascolana’) growth and ion accumulation. Desalination, 2015, 364: 46-52.
[28] Reginato M, Sosa L, Llanes A,etal. Growth responses and ion accumulation in the halophytic legumeProsopisstrombuliferaare determined by Na2SO4and NaCl. Plant Biology, 2014, 16(2): 97-106.
[29] Maathuis F J M. Sodium in plants: perception, signalling, and regulation of sodium fluxes. Journal of Experimental Botany, 2014, 65(3): 849-858.
[30] Zheng Q S, Liu Z P, Liu Y L,etal. Effects of salt and water stresses on growth and ionic absorption and distribution inSalicorniaeuropaea,AloeveraandHelianthusannuusseedlings. Journal of Nanjing Agricultural University, 2004, 27(2): 16-20.
[31] Bhandal I S, Malik C P. Potassium estimation, uptake, and its role in the physiology and metabolism of flowering plants. International Review of Cytology, 1988, 110: 205-254.
[32] Zhang J L, Li H R, Guo S Y,etal. Research advances in higher plants adaptation to salt stress. Acta Prataculturae Sinica, 2015, 24(12): 220-236.
[33] Ning J F, Liu Z P, Liu L,etal. Study of effect of NaCl stress onAloevera. Acta Agriculturae Boreal-Sinica, 2005, 20(5): 70-75.
[34] Li Y Q, Fang S Z, Yao R L,etal. Effects of NaCl stress on ion distribution, absorption and transportation inCyclocaryapaliurusseedling from different provenances. Journal of Plant Resources and Environment, 2007, 16(4): 29-33.
[35] Zhu H S, Fang Z H, Yang G Y,etal. Biomass formation and selective absorption for K+/Na+ofElymusdahuricusgrown in different saline grassland. Acta Agrestia Sinica, 2010, 18(3): 383-387.
[36] Liu J, Feng C Q, Jin J,etal. Study on absorption and transport selectivity of saltions ofPopulusalbavar.pyamidals. Journal of Arid Land Resources and Environment, 2007, 21(11): 118-122.
[37] Zhang K, Zhang D Y, Wang L,etal. Study on the ionic absorption and transport inSalicorniaeuropaeaL. growing in natural habitats in Xinjian. Arid Zone Research, 2007, 24(4): 480-486.
[12] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
[16] 李先婷, 曹靖, 魏晓娟, 等. NaCl渐进胁迫对啤酒大麦幼苗生长、离子分配和光合特性的影响. 草业学报, 2013, 22(6): 108-116.
[17] 陈惠哲, Ladatko N, 朱德峰, 等. 盐胁迫下水稻苗期Na+和K+吸收与分配规律的初步研究. 植物生态学报, 2007, 31(5): 937-945.
[18] 王殿, 袁芳, 王宝山, 等. 能源植物杂交狼尾草对NaCl胁迫的响应及其耐盐阈值. 植物生态学报, 2012, 36(6): 572-577.
[23] 杨小菊, 赵昕, 石勇, 等. 盐胁迫对砂蓝刺头不同器官中离子分布的影响. 草业学报, 2013, 22(4): 116-122.
[24] 李品芳, 白文波, 杨志成. NaCl胁迫对苇状羊茅离子吸收与运输及其生长的影响. 中国农业科学, 2005, 38(7): 1458-1565.
[26] 李洪燕, 郑青松, 姜超强, 等. 籽粒苋幼苗对不同盐离子胁迫响应的比较研究. 草业学报, 2010, 19(5): 63-70.
[30] 郑青松, 刘兆普, 刘友良, 等. 盐和水分胁迫对海蓬子、芦荟、向日葵幼苗生长及其离子吸收分配的效应. 南京农业大学学报, 2004, 27(2): 16-20.
[32] 张金林, 李惠茹, 郭姝媛, 等. 高等植物适应盐逆境研究进展. 草业学报, 2015, 24(12): 220-236.
[33] 宁建凤, 刘兆普, 刘玲, 等. NaCl对库拉索芦荟的胁迫效应研究. 华北农学报, 2005, 20(5): 70-75.
[34] 李彦强, 方升佐, 姚瑞玲, 等. NaCl胁迫对不同种源青钱柳幼苗离子分配、吸收与运输的影响. 植物资源与环境学报, 2007, 16(4): 29-33.
[35] 朱慧森, 方志红, 杨桂英, 等. 不同盐碱化草地披碱草生物量形成及根系对K+、Na+的选择性吸收. 草地学报, 2010, 18(3): 383-387.
[36] 刘静, 冯长青, 金娟, 等. 新疆杨对盐分离子吸收选择性和运输选择性的研究. 干旱区资源与环境, 2007, 21(11): 118-122.
[37] 张科, 张道远, 王雷, 等. 自然生境下盐角草的离子吸收-运输特征. 干旱区研究, 2007, 24(4): 480-486.
Effects of various types of salt stress on ion absorption, accumulation and transportation in pea (Pisumsativum) seedlings
DONG Fang1, CAO Jing1*, LI Xian-Ting2, ZHANG Lin-Jie1, YUE Xiao-Hong1, GENG Jie1, ZHANG Jin-Lin3
1.StateKeyLaboratoryofGrasslandAgro-ecosystems,SchoolofLifeScience,LanzhouUniversity,Lanzhou730000,China; 2.EnvironmentalMonitorStationofXinyang,Xinyang464000,China; 3.StateKeyLaboratoryofGrasslandAgro-ecosystems,CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China
In order to investigate the physiological mechanisms of ion absorption, accumulation and transportation in pea seedlings under various types of salt stress (NaCl, mixed sodium salts and mixed chlorine salts, the control treatment was Hoagland nutrient solution), the characteristics of absorption and accumulation of ions in three varieties of pea (‘Yinwan NO.1’, ‘S5001-1’ and ‘737’) seedlings were studied using a hydroponic method. Key findings were: 1) Under NaCl and mixed sodium salt stress, Na+contents in shoots and roots were significantly higher than control, whereas contents of K+and Ca2+were significantly lower. Under mixed chlorine salt stress, Na+contents in shoots and roots did not differ significantly from those of control plants. However, contents of Cl-, K+, Ca2+and Mg2+were significantly higher than for the other two salt treatments. 2) Under the control treatment, K+was absorbed and accumulated prior to other ions in three varieties of pea, followed by Ca2+. Under NaCl and mixed chlorine salt stress, K+was absorbed and accumulated prior to other ions, followed by Na+and Cl-. Under mixed sodium salt stress, Na+and K+was absorbed and accumulated prior to other ions, followed by Ca2+, while the characteristics of transportation and accumulation of salt ions among three varieties of pea were different under various types of salt stress. 3) Under NaCl and mixed sodium salt stress, the selective absorption coefficientsSAK,Na、SACa,NaandSAMg,Nain the three varieties of pea were significantly higher than in control plants, while significantly lower than under mixed chlorine salt. TheSTK,NaandSTCa,Nain ‘S5001-1’ seedlings were significantly higher under NaCl and mixed sodium salt stress than in control plants, whereas theSTK,NaandSTCa,Nain ‘Yinwan NO.1’ under mixed sodium salt and mixed chlorine salt treatments were significantly lower than for controls. TheSTK,Naof the three varieties of pea were similar under mixed chlorine salt stress. The study showed that the accumulation of Ca2+, K+and Mg2+in shoots under NaCl and mixed sodium salt stress was lower than control, whereas the ability of roots of pea seedlings to absorb and transport Ca2+, K+and Mg2+was weakened in response to salt stress. Under mixed chlorine salt stress, the absorption and accumulation of Ca2+, K+and Mg2+in shoots was higher than under the other two salt treatments (NaCl and mixed sodium salts), whereas in roots they were significantly lower than under other two salt treatments.
saline types; salt stress; ion absorption and transportation; pea (Pisumsativum)
10.11686/cyxb2016019
http://cyxb.lzu.edu.cn
2016-01-12;改回日期:2016-04-01
国家自然科学基金项目(31071866)资助。
董放(1989-),男,甘肃白银人,在读硕士。E-mail: dongf13@lzu.edu.cn*通信作者Corresponding author. E-mail: caojing@lzu.edu.cn
董放,曹靖,李先婷,张琳捷,岳小红,耿杰,张金林. 不同盐分类型胁迫对豌豆幼苗离子吸收、累积及运输的影响. 草业学报, 2016, 25(11): 66-75.
DONG Fang, CAO Jing, LI Xian-Ting, ZHANG Lin-Jie, YUE Xiao-Hong, GENG Jie, ZHANG Jin-Lin. Effects of various types of salt stress on ion absorption, accumulation and transportation in pea (Pisumsativum) seedlings. Acta Prataculturae Sinica, 2016, 25(11): 66-75.

