无机工业流程题解题思路
范发强

无机工业流程题以现代工业生产为依托,与化工生产成本、产品提纯、环境保护等相融合,考查物质的制备、检验、分离提纯等基本实验原理在化工生产中的实际应用,要求考生依据流程图分析原理,紧扣信息,抓住关键、准确答题。
一、无机工业流程图构成
1.题干部分:介绍原材料。
2.流程图部分:用框图形式将主要生产工艺流程表示出来。
主要框架是:原料处理分离提纯核心反应主要产品
3.问题部分:以流程图为框架,提出各类化学问题。试题本质是从混合物中提取纯净物。
二、读题
1.粗读
从题干部分分析哪个是需要的元素,哪些是杂质元素。分析元素走向。
从框图部分分析主线是目标产品,支线为副产品,回头线为循环产品。明确原料、杂质和目标产品
2.精读
工业流程题主要考查核心反应条件的控制及原因,核心反应方程式书写,除杂试剂的选择、PH值的控制,分离提纯操作,滤液滤渣成分,相关计算。针对问题再精读,分析细节,根据问题去研究某一步或某一物质。
例如2015年全国卷Ⅰ27题.
硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
从题干部分可知:硼元素是要提纯的元素,硅、铝、铁、钙、镁是杂质元素,从框图主线可知主要产品是粗硼酸,支线中第一次酸浸过滤得到浸渣是二氧化硅、硫酸钙(微溶),镁盐最后一次过滤得到,中间的滤渣应有铁、铝元素。
三、无机工业流程图可能提的问题及解题策略
化学问题的思考要有一定的方向,要在基础理论框架下结合实际问题进行思考。工业流程图由四部分组成,即原料处理、分离提纯、核心反应、主要产品。
主要解决两个问题,一个是发生了什么反应,另一个是采取了什么分离方法,这两处问题能理清,其余迎刃而解。下面针对流程图遂个分析。
首先是原料的预处理:原料处理阶段的常见方法有
(1)溶解:通常用酸溶、碱溶、水溶。
浸出:固体加水(酸、碱)溶解得到离子
(2)灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质高温下氧化、分解
该阶段常提出的问题是如何加快反应速率,可从反应速率的影响因素分析。
第二要分析的核心反应的问题:
如何分析化学反应呢?
(1)分析反应物与生成物,箭号流入的是反应物,流出的是生成物。
(2)分析化合价是否发生变化判断是氧化还原反应还是非氧化还原反应。然后按复分解反应或氧化还原规律思考。
(3)配平时注意反应介质(酸性、碱性等)
如2015年全国卷Ⅰ27题问题部分,
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式__________。这题中反应物是Mg2B2O5·H2O与硫酸,生成物中有硼酸(H3BO3),没有化合价变化,按复分解反应分析,应还有硫酸镁,至于有无水通过配平可知。
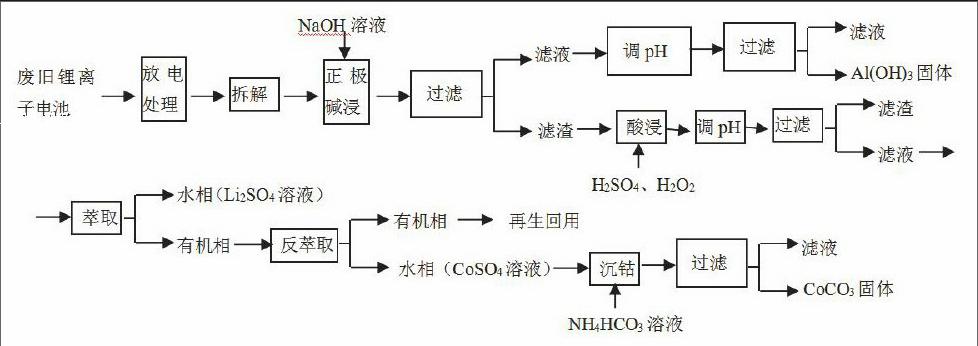
又如2013年全国卷Ⅰ27题,
27.(15分)锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6,现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
回答下列问题:
(2)写出“正极碱浸”中发生反应的离子方程式。
根据题干正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等,其中只有铝箔可与NaOH溶液反应,易推知是铝与NaOH溶液反应,所以离子方程式为: 2Al+2OH—+2H2O=2AlO2—+3H2↑
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式;
根据工艺流程中反应物有LiCoO2、H2SO4、H2O2,生成物有 Li2SO4溶液、CoSO4(Co+2价)溶液,所以加H2SO4、H2O2酸浸的过程中发生氧化还原反应有2LiCoO2+3H2SO4+H2O2= Li2SO4+2 CoSO4+O2↑+4H2O,
因为反应是温度80℃,还会发生双氧水制氧气的反应:2H2O 2O2↑+2H2O;
(4)写出“沉钴”过程中发生反应的化学方程式。
2CoSO4+2 NH4HCO3=CoCO3↓+ (NH4)2SO4+H2O+CO2↑
第三是物质的分离提纯问题
工业流程图就是把杂质除去并把杂质分离的过程。这里涉及除杂试剂选择反应条件控制,及物质的分离提纯问题。
1.反应条件的控制及除杂试剂选择:
(1)调pH值除杂
a.控制溶液的酸碱性使其某些金属离子形成氢氧化物沉淀
b.调节pH所需的物质一般应满足两点:
能与H+反应,使溶液pH值增大;不引入新杂质。
例如:若要除去Cu2+溶液中混有的Fe3+,可加入 等物质来调节溶液的pH值。
(2)温度控制
控制温度有控制反应速率、防止副反应发生、有利于分离得到纯物质(如趁热过滤),有利于化学平衡移动等。
2.常见的分离提纯方法有结晶、过滤、洗涤、蒸馏、萃取与分液等。如上例13年高考试题就涉及过滤、萃取与分液操作。这部分会考一些基本操作问题。
例如:(1)洗涤(冰水、热水)洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。洗涤的方法、洗净的标志、洗涤试剂的选择等。
如:洗涤除去NaCl晶体表面附带的少量KCl,选用的最佳试剂为 。
A、饱和Na2CO3溶液 B、四氯化碳
C、NaOH溶液 D、75%乙醇
(2)蒸发浓缩、冷却结晶、过滤:如最后所得晶体带结晶水:CuSO4.5H2O等以及从溶液中析出FeCl3、AlCl3、MgCl2等溶质时,应在 的气流中加热,以防其 。
(3)蒸发结晶、重结晶、趁热过滤:如除去NaCl中的少量KNO3。
最后涉及产品及产率问题。流程图中主线分析主产品,副线分析副产品,回头线分析循环品。而产率问题主要涉及化学计算。同时答题时一定要按要求回答,注意语言表达规范准确。

