CeO2-TiO2催化剂低温协同控制燃煤NOx与汞
李立清,吴绍康,李海龙,马卫武,杨建平,赵永椿,张军营
(1. 中南大学 能源科学与工程学院,湖南 长沙,410083;2. 华中科技大学 煤燃烧国家重点实验室,湖北 武汉,430074)
CeO2-TiO2催化剂低温协同控制燃煤NOx与汞
李立清1,吴绍康1,李海龙1,马卫武1,杨建平2,赵永椿2,张军营2
(1. 中南大学 能源科学与工程学院,湖南 长沙,410083;2. 华中科技大学 煤燃烧国家重点实验室,湖北 武汉,430074)
采用溶胶−凝胶法合成了CeO2-TiO2(CeTi)催化剂,并采用BET,XRD和XPS等分析技术对催化剂进行表征。在固定床实验装置上研究CeTi催化剂的低温选择性催化还原(SCR)脱硝及汞氧化性能。研究结果表明:铈氧化物在催化剂表面高度分散,催化剂比表面积较大,具有丰富的表面活性氧;在250 ℃下,CeTi催化剂的汞氧化效率可达80%以上,NO还原效率可达99%;在无O2条件下,NH3显著降低催化剂的汞氧化性能,在有O2条件下,NH3微弱抑制催化剂的汞氧化活性;NO在无O2条件下会抑制汞的氧化,在有O2条件下,NO对汞的氧化起促进作用;SCR脱硝及汞氧化过程的相互影响不明显;采用CeTi催化剂可以在低温条件下实现NO与汞的协同控制。
溶胶−凝胶;CeO2-TiO2;单质汞;NO;低温
煤是当今中国最重要的储量最丰富的化石能源,占中国主要能源供应的65%以上[1]。我国绝大部分煤炭产能均在国内消费,且其中至少50%以上用于发电,火电装机容量占全国发电设备总容量的70%以上[2]。燃煤火电厂在保障我国社会、经济高速发展的同时,向大气排放了大量的颗粒污染物、温室气体、NOx和SOx以及多种有害痕量元素[3]。其中,燃煤烟气中的NOx不仅直接危害人体健康、植物的生长,还会造成光化学烟雾等二次污染,具有巨大的危害性。燃煤烟气中的汞因具有极强的挥发性、持久性、剧毒性以及生物富集效应,越来越受到国际社会的关注[4]。加强燃煤NOx及汞的控制迫在眉睫。选择性催化还原(SCR)是目前世界上应用最多、最为成熟且最有成效的一种烟气脱硝技术,我国的烟气脱硝工程中大多采用SCR法[5]。目前商业应用的SCR催化剂主要是钒基催化剂,它可以促进烟气中汞的非均相氧化[6],从而有助于后续颗粒物控制设备(PMCD)及湿法脱硫系统(WFGD)对汞的脱除。然而,传统钒基SCR催化剂在实际应用中仍存在一些不足:1) 毒性较大;2) 比表面积较小;3) SO2易被氧化为SO3,SO3在H2O及NH3的作用下反应生成(NH4)2SO4,(NH4)2S2O7以及H2SO4等物质,造成催化剂孔道堵塞和设备腐蚀;4) 钒基SCR催化剂上汞的氧化因烟气中HCl,SO2和NH3等组分的影响波动范围很大;5) 钒基SCR催化剂温度窗口较窄(通常为300~350 ℃),在低温条件下催化活性低[7−8]。近年来,铈基SCR催化剂因其具有温度窗口宽、无毒、储氧能力巨大以及优秀的抗水能力等优点引起了人们的关注[9]。GAO等[10]用溶胶−凝胶法制备了CeO2-TiO2(CeTi)催化剂,并证实了该催化剂是一种高效的低温SCR催化剂,但没有研究CeTi催化剂对汞的催化氧化。LI等[11]采用浸渍法合成了一系列CeTi催化剂,发现其具有良好的催化氧化汞的能力,但没有讨论CeTi催化剂对NOx和汞的协同控制。目前商业应用的钒基SCR催化剂因反应活性温度要求需放置于除尘设备之前,导致高浓度飞灰影响催化剂的化学反应稳定性以及使用寿命。如果CeTi催化剂在低温条件下高效脱除NOx的同时能将单质汞高效氧化为二价汞,继而利用后续的污染物控制设备将二价汞脱除,那么应用CeTi作为SCR催化剂的SCR脱硝设备可以置于除尘设备之后,避免了钒基SCR催化剂的不足,同时,在脱除NOx的同时协同脱除燃煤汞,避免了因控制汞排放造成的额外投资,有效降低燃煤电厂控制汞污染的成本。本文作者采用溶胶−凝胶法制备了CeTi催化剂,在固定床实验装置上研究其在低温条件下对NOx及汞的协同控制,研究了SCR过程参与气体NH3与NO对催化剂的汞氧化过程的影响机理,考察了CeTi催化剂上氨法SCR过程与汞氧化过程间的相互影响,为利用现有的SCR脱硝设备实现NOx与汞的一体化控制提供理论基础。
1 实验方法
1.1催化剂制备与表征
采用溶胶−凝胶法制备纯TiO2和CeO2/TiO2质量比为0.6的CeTi催化剂。首先将一定量的Ce(NO3)3·6H2O (99.95%,分析纯)溶解在33 mL含去离子水、无水乙醇(分析纯)、硝酸(分析纯)体积比为1:1:0.2的溶液中,得到溶液A;将钛酸四丁酯(15 mL,CP)和无水乙醇(60 mL,分析纯)混合制得溶液B;将溶液B在剧烈磁力搅拌下以1 mL/min的速度逐滴加入到溶液A中,滴定完成后,继续磁力搅拌3 h形成淡黄色透明溶胶;将溶胶放入干燥箱中恒温80 ℃老化24 h形成凝胶;将凝胶放入马弗炉中,在500 ℃并通入1.2 L/min的干燥空气的条件下焙烧4 h,焙烧后的固体产物经研磨,筛分后得到颗粒粒径小于150 μm的催化剂。将Ce(NO3)3·6H2O在80 ℃干燥24 h后,放入马弗炉中,在500 ℃并通入流量为1.2 L/min的干燥空气的条件下焙烧5 h,待冷却后取出,经研磨、筛分制得纯CeO2。
采用ASAP−2020比表面积及孔径分析仪(Micromeritics)通过等温氮吸附法测定催化剂的Brunauer−Emmett−Teller (BET)比表面积;XRD分析采用X'Pert PRO X线衍射仪(PANalytical,Cu Kα,λ= 0.154 2 nm),扫描角(2θ)为20°~80°,步长为0.02 (°)/s;XPS分析采用Thermo Scientific Escalab 250Xi系统(Al-Kα),采用C 1s结合能(284.6 eV)校正XPS能谱图,然后通过Thermo Avantage程序分析、拟合XPS图谱,计算催化剂表面原子浓度。
1.2实验装置与方法
1.2.1实验系统
固定床催化实验系统如图1所示,主要由配气系统,反应器,汞测试系统,汞形态转化系统以及烟气测试系统组成。模拟烟气各组分均来自钢瓶气,通过D07−19B型质量流量控制器(北京七星华创公司)控制各组分的浓度。汞发生源为置于恒温水浴锅中的汞渗透管(VICI Metronics),并以高纯N2作为载气,通过调节温度向模拟烟气中提供稳定浓度的汞蒸气。SCR催化剂填充在带砂芯的石英玻璃反应器(自制)中,其内径为10 mm,反应器置于可精确控温(±1 ℃)的GSL−1100X程序控温管式炉(合肥科晶公司)中。反应器进口、出口汞的质量浓度通过VM−3000在线汞监测仪实时检测。汞形态转化系统由分别装有10%KCl溶液(100 mL)和10% SnCl2(100 mL)溶液的洗气瓶并联组成,用以测试反应器出口二价汞的含量。KANE−950烟气分析仪(Kane International)通过切换管路阀门测定反应器进出口NOx的浓度。进入烟气分析仪前,采用10%磷酸溶液洗去气体中的NH3,避免NH3对NO测试的影响,磷酸溶液对NO浓度的测试没有影响。所有管路均采用特氟龙管,并用加热带保温,控制温度为100 ℃以减少管路对汞的吸附作用。在室温条件下,向纯N2中添加NO,NH3以及让模拟烟气经过空反应器以考察模拟烟气组分及空反应器对测汞仪汞浓度测试的影响,在整个过程中,汞浓度的变化小于5%,表明模拟烟气组分以及空反应器对汞浓度测试的影响可以忽略不计。
1.2.2实验方法
本文设计了7组实验对CeTi催化剂上NO还原与汞的催化氧化进行了探讨,实验条件如表1所示。第1组实验考察CeTi催化剂的脱硝性能;第2组实验的目的是探讨CeTi催化剂在有O2条件下催化氧化汞的能力;第3组实验在有/无O2条件下考察NH3对催化剂的汞氧化性能的影响;第4组实验在有/无O2条件下考察NO对催化剂的汞氧化性能的影响;第5组实验将CeTi催化剂在无汞条件下脱硝12 h后,切断NH3和NO,进行汞氧化实验,探讨脱硝过程对后续汞氧化的影响;第6组实验将第2组实验后的CeTi催化剂进行脱硝实验,探讨汞氧化过程对后续脱硝过程的影响;第7组实验考察CeTi催化剂的协同NO还原及汞氧化的性能。
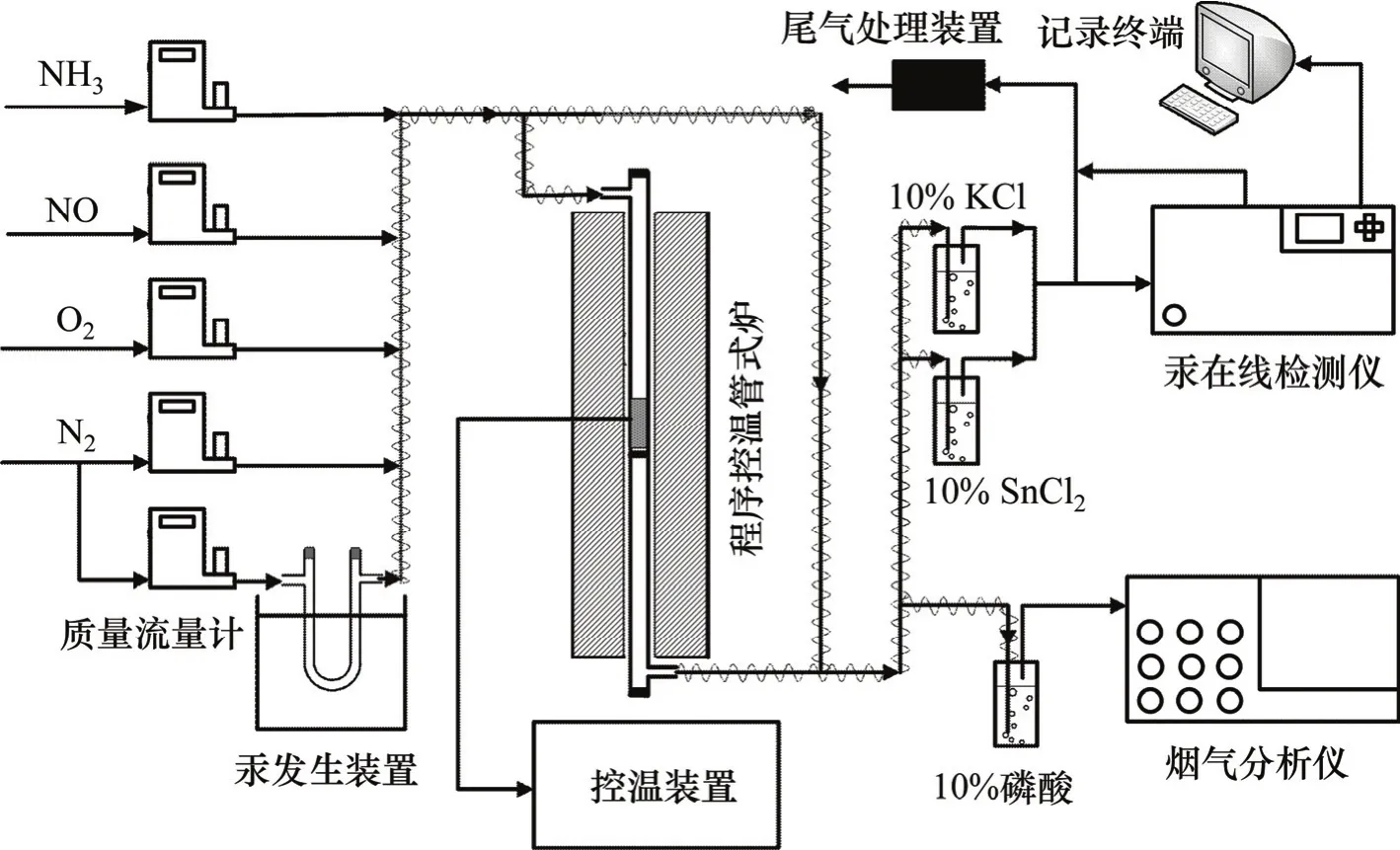
图1 实验系统示意图Fig. 1 Schematic diagram of experimental system
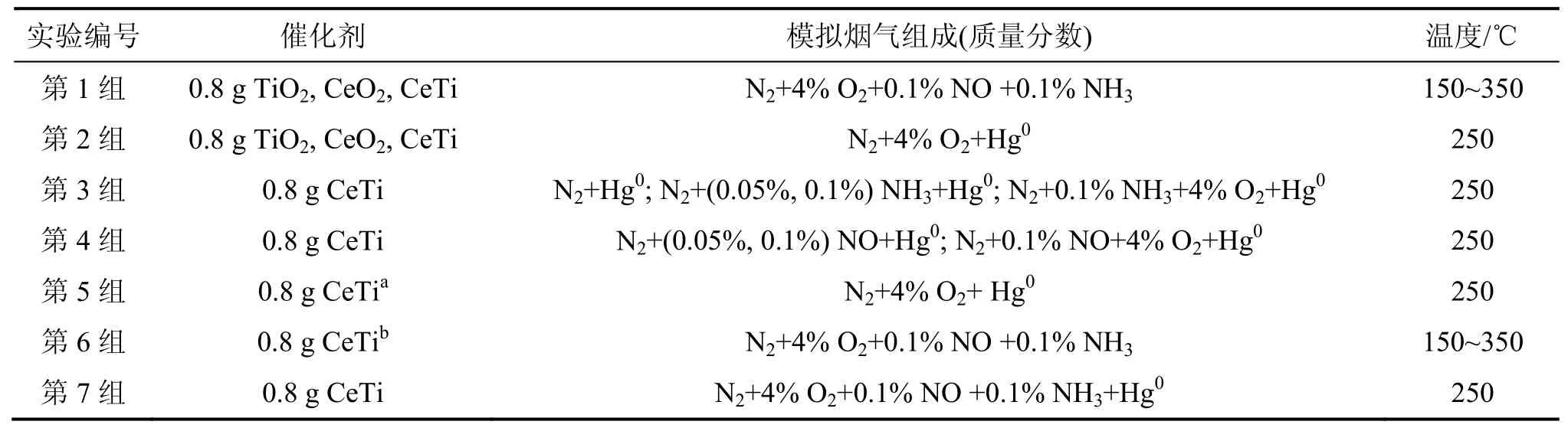
表1 实验条件Table 1 Experimental conditions
在室温条件下,含汞气流经过催化剂后,汞浓度变化如图2所示。由旁路切换至反应器后,汞的质量浓度迅速降低至120 μg/m3,并在15 min内恢复至初始水平,说明CeTi催化剂在室温条件下的汞吸附量极小,CeTi对汞的物理吸附作用对进出口汞浓度的变化的影响可忽略不计。升温抑制汞的吸附作用,因此,在实验温度下的反应器进出口汞浓度的变化不是CeTi对汞的吸附作用造成的,而是由于CeTi对汞的催化氧化作用。
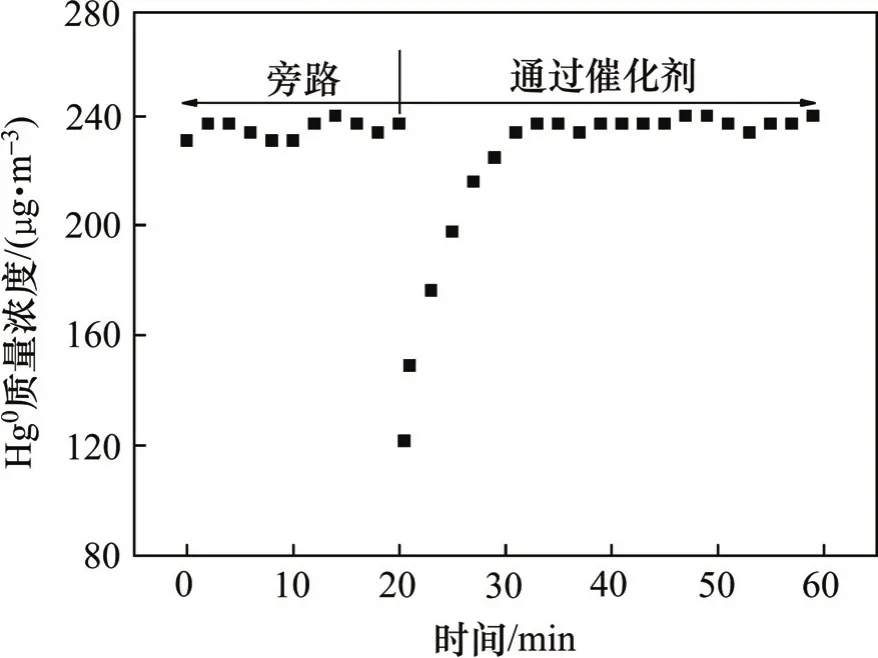
图2 室温条件下CeTi催化剂的汞吸附性能Fig. 2 Performance of mercury adsorption over CeTi catalyst at room temperature
汞的氧化效率Eoxi和NO还原效率Ered的计算方法如下:

2 结果与讨论
2.1催化剂表征
催化剂比表面积如表2所示。从表2可见:与纯CeO2、TiO2以及浸渍法制备的CeTi催化剂相比,溶胶−凝胶法制备的CeTi催化剂具有更大的比表面积。催化剂XRD结果如图3所示。从图3可见:纯TiO2中存在锐钛矿及金红石2种晶相,CeTi催化剂中未检测到金红石型TiO2的特征峰,说明Ce的加入阻止了焙烧过程中TiO2由锐钛矿型向金红石型转变。CeTi催化剂中仅有少量微弱的四方晶相的CeO2特征峰,说明活性CeO2以微晶形式存在或大部分CeO2以非晶相形式高度分散在催化剂表面。当CeO2与TiO2质量比大于0.2时,采用浸渍法合成的CeTi催化剂中即开始出现CeO2晶体,并随着CeO2质量分数的增大,CeO2晶体特征峰变强[9]。当CeO2与TiO2质量比为0.6时,溶胶−凝胶法合成的CeTi催化剂上才仅有微弱的CeO2特征峰,说明采用溶胶−凝胶法可以提高活性组分CeO2在催化剂表面的分散度,有助于提高催化剂的活性。
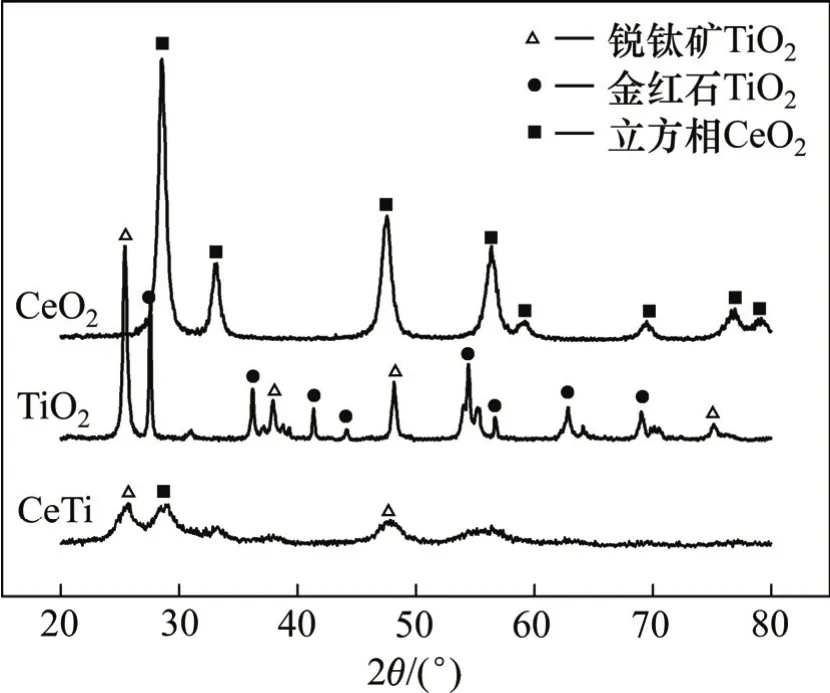
图3 催化剂XRD谱Fig. 3 XRD pattern of catalyst
采用Gaussian方程拟合了Ti 2p,Ce 3d以及O 1s的XPS光谱,如图4所示。根据拟合结果,计算了CeTi催化剂表面3种元素的原子数分数,结果如表2所示。从图4可以看出:Ti 2p1/2和Ti 2p3/2的结合能分别为464.2 eV和458.5 eV,说明催化剂中Ti均以Ti4+存在。纯CeO2表面只观测到Ce4+的3d104f0电子状态的u/v,u″/v″,u′″/v′″ 双峰对,而在CeTi催化剂中出现了Ce3+的3d104f1电子状态的u′/v′双峰对,说明TiO2与CeO2的相互作用使得催化剂表面出现了Ce3+。Ce3+有利于催化剂表面吸附态氧含量的增加,有助于提高催化剂的催化活性[13]。在O 1s光谱中,结合能在527.3~531.5 eV的峰来源于表面晶格氧(O 1sA)。结合能在527.8~532.8 eV的峰是吸附态/弱结合态的氧(O 1sB)。更高结合能的峰归因于表面羟基及吸附的水中的氧[10]。CeTi催化剂表面的高氧浓度归因于Ce3+造成的催化剂表面产生的电荷不平衡、电子空穴以及不饱和的化学键[14]。

表2 催化剂比表面积及表面原子数分数xTable 2 Specific surface area and surface atomic concentration of catalysts
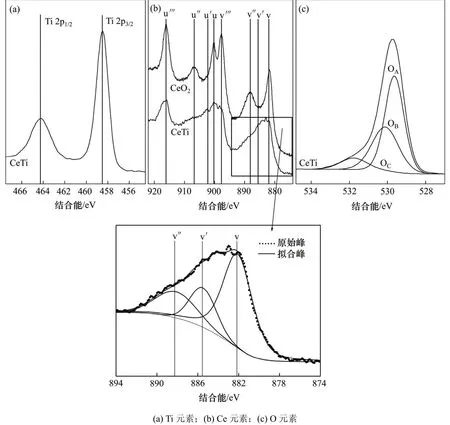
图4 催化剂中Ti,Ce,O元素的XPS光谱Fig. 4 XPS spectra of Ti, Ce, O of catalyst
2.2CeTi催化剂NH3-SCR性能
CeTi催化剂催化还原NO的实验结果如图5所示。由图5可知,纯TiO2几乎没有NO还原能力,在150~350 ℃温度范围内Ered低于5%,这与GOA等[10]的研究一致。催化剂为纯CeO2时,Ered随着温度的升高明显增大,但在整个温度考查范围内效率低于60%。 CeTi催化剂在空塔气速(GHSV)为27 000 h−1的条件下,脱硝效率不低于90%的温度窗口为200~350 ℃,在225~350 ℃内脱硝效率高达99%。CeTi催化剂具有较宽的温度窗口和优秀的低温SCR脱硝能力,有效克服了传统钒基SCR催化剂温度窗口较窄和仅在典型SCR温度(300~350 ℃)[15]内具有较高催化活性的缺点。在实验条件下可以认为TiO2对NO的还原过程是惰性的。因此,CeTi催化剂上NO的还原归因于表面活性组分CeO2,但其性能远远优于纯CeO2的还原性能,这说明TiO2与CeO2协同促进了催化剂的NO还原性能。
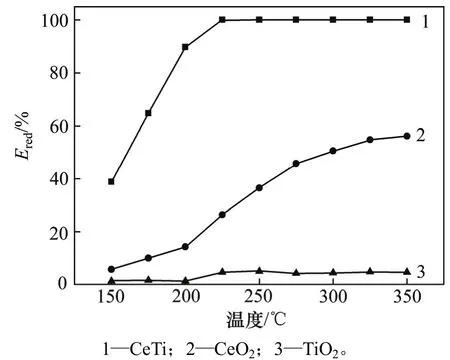
图5 不同温度下的脱硝效率(空塔气速为27 000 h−1)Fig. 5 NO conversion as a function of reaction temperatures when GHSV is 27 000 h−1
2.3CeTi催化剂的汞氧化性能
250 ℃催化剂上汞的氧化效率如图6所示。在250 ℃, 纯TiO2几乎没有汞氧化能力,催化剂为纯CeO2时,Eoxi低于40%,CeTi催化剂汞氧化效率可达84%。TiO2对汞的氧化是惰性的[6],CeTi催化剂良好的汞氧化性能归因于表面活性组分CeO2。以TiO2作为载体负载CeO2显著提高了CeO2的汞氧化活性,一方面是由于TiO2作为载体有效促进无定型CeO2分布在催化剂的表面,提高了活性组分的分散度,另一方面,由表2可知:溶胶−凝胶法制备的CeTi催化剂表面具有丰富的吸附态/弱结合态氧,x(OB)/x(OT)高达30.2%,远大于纯TiO2的x(OB)/x(OT) (9.0%)及纯CeO2的x(OB)/ x(OT) (12.6%),高吸附态/弱结合态氧含量促进了汞的氧化[13]。
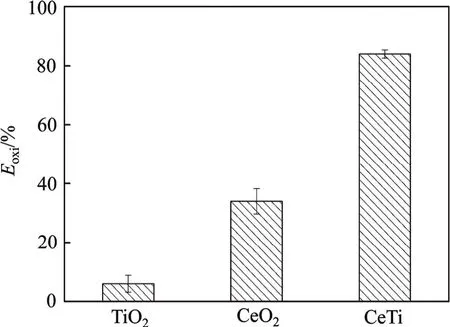
图6 250 ℃催化剂上汞的氧化效率Fig. 6 Mercury oxidation over catalyst at 250 ℃
2.4NH3和NO对催化剂汞氧化性能的影响
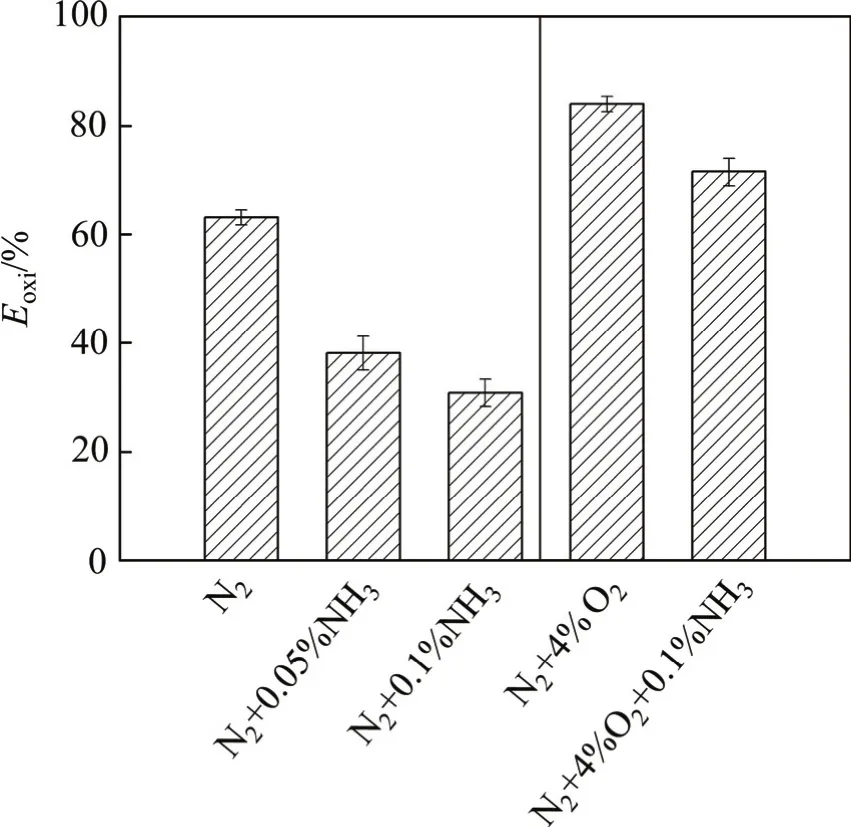
图7 NH3对汞氧化性能的影响Fig. 7 Effect of NH3on mercury oxidation
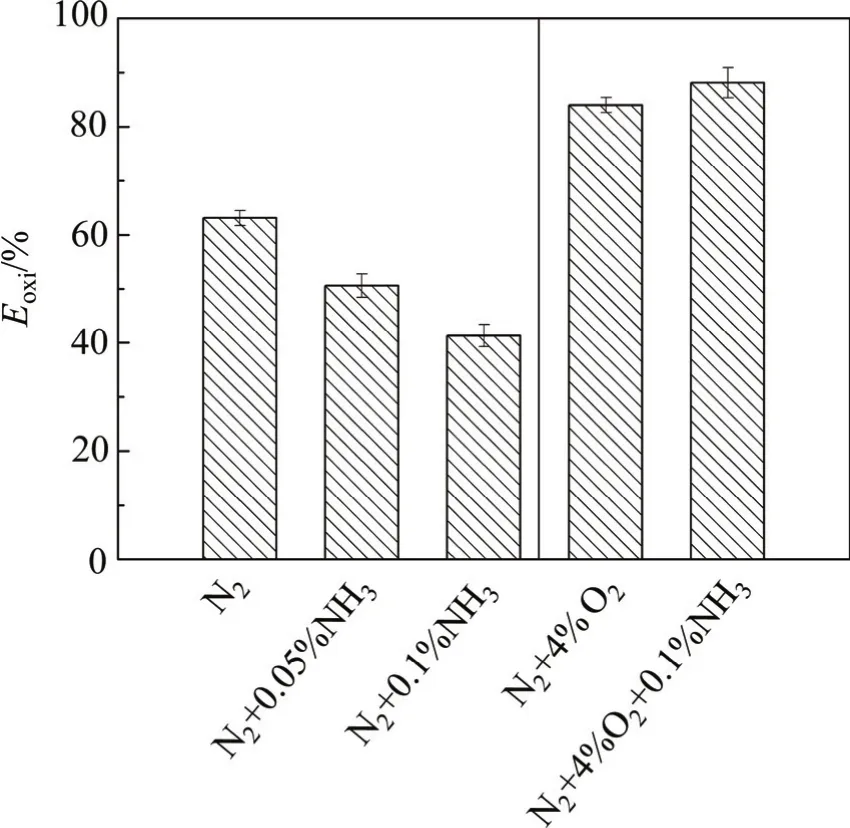
图8 NO对汞氧化性能的影响Fig. 8 Effect of NO on mercury oxidation
NH3与NO对催化剂汞氧化过程的影响如图7和图8所示。从图7可见:在无O2条件下,加入0.5× 10−3NH3后,Eoxi从63%降至38%,NH3降低了催化剂的汞氧化活性。LI等[16]研究了NH3对MnCeTi催化剂的汞氧化性能的影响,发现NH3与汞之间存在明显的竞争吸附,并且NH3能够消耗催化剂的表面活性氧。如果NH3的影响归因于竞争吸附导致的CeTi的汞的吸附性能的降低,而汞的吸附是CeTi催化剂上汞通过Langmuir-Hinshelwood机制被氧化的必要前提[17],那么增加NH3浓度必然导致Eoxi因汞的吸附速率的降低而降低。由图7还可知:进一步加大NH3质量分数至0.1%,Eoxi从38%降至30%。这表明NH3与汞的竞争吸附作用是其抑制CeTi催化剂的汞氧化活性的原因。在4% O2条件下,加入0.1% NH3(质量分数)后,Eoxi从84%降至72%,降幅(12%)远远小于无O2条件下的降幅(33%)。LI等[16]研究表明:NH3能够消耗催化剂表面活性氧从而抑制催化剂的汞氧化活性。在气相O2的作用下,NH3对CeTi汞氧化的影响显著降低,归因于气相O2补充了NH3消耗的催化剂表面活性氧。
从图8可知:在无O2条件下,加入0.05% NO(质量分数)后,Eoxi从63%降至51%,进一步加大NO浓度,Eoxi下降至41.3%。在有O2条件下,加入0.1% NO(质量分数)后,Eoxi为88%,相对于N2+O2条件,Eoxi从84%提高到88%,NO促进了CeTi催化剂的汞氧化性能。NO与单质汞之间的竞争吸附作用不明显,但NO能够微弱吸附于催化剂的表面[18],弱吸附态的NO占据一定量的表面活性位,同时消耗表面一定量的活性氧[19],从而抑制了无氧条件下的汞的催化氧化。但在有氧条件下,表面消耗的活性氧从载气中得到补充,同时有氧条件能够促进更多的NO生成NO2等具有汞氧化活性的物质[20]。有O2条件下加入0.1% NO(质量分数)后,在反应器出口检测到(21.3±2) μg/m3Hg2+,Hg2+不是以HgO形式存在,因为在无O2条件及N2+O2条件下均未检测到Hg2+,短时间实验生成的HgO均吸附在催化剂表面。反应器出口Hg2+的出现归因于NO在气相O2条件下使部分汞生成了Hg2(NO3)2和Hg2(NO2)2等物质[21]。有氧条件下NO促进CeTi催化剂的非均相氧化机理作用可能为:
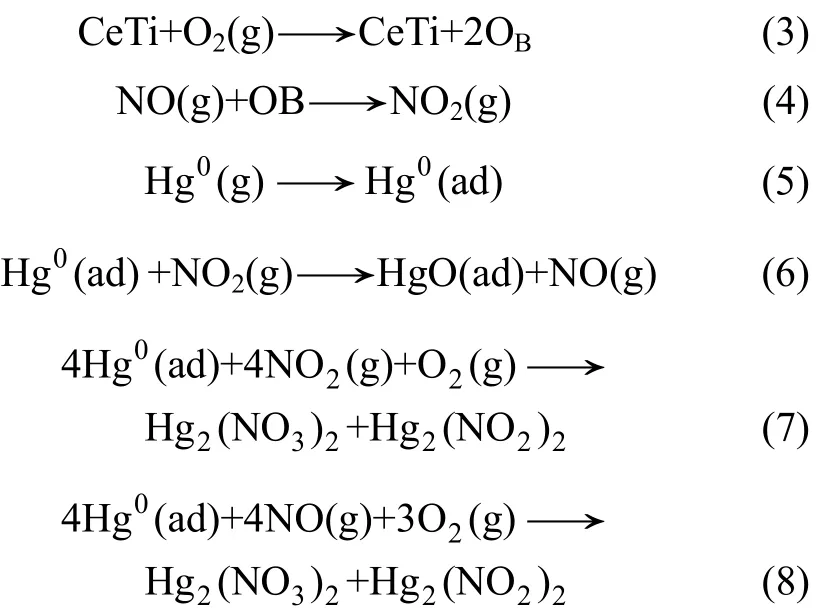
2.5NO还原与汞氧化过程的相互影响
CeTi作为一种SCR催化剂既可以促进汞的氧化又可以实现NO的还原,因此有必要考察CeTi催化剂上NO还原与汞氧化过程间的相互作用。首先在4% O2,0.1% NO,0.1% NH3,250 ℃条件下进行12 h脱硝实验,采用脱硝后的CeTi催化剂在4% O2,250 ℃条件下进行汞氧化实验。脱硝后的CeTi催化剂的汞的氧化性能如图9所示。由图9可知:达到稳定后,反应器出口汞质量浓度维持在40 μg/m3,Eoxi维持在83%左右。经历过脱硝过程的CeTi催化剂对汞的氧化能力与新鲜催化剂相当,12 h的脱硝反应对后续的汞氧化无不利影响。汞氧化后的CeTi催化剂的NO的还原性能如图10所示。从图10可知:12 h汞氧化实验后,催化剂的SCR脱硝性能也基本维持不变,说明催化剂表面因汞氧化过程积聚的微量HgO对NH3-SCR过程没有影响。在有氧条件下,气相O2有效补充NH3与NO氧化消耗的催化剂表面活性氧,SCR过程对CeTi催化剂的表面物化性质影响不大,因此,对后续的汞氧化没有影响。
2.6CeTi催化剂协同控制NO与汞
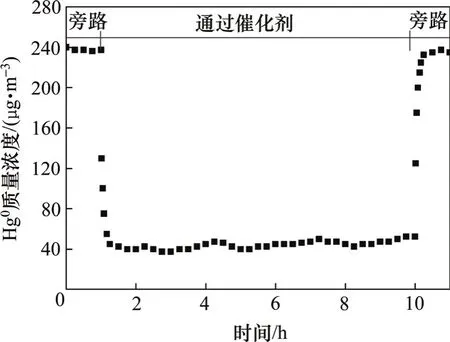
图9 脱硝后的CeTi催化剂的汞的氧化性能Fig. 9 Mercury oxidation over CeTi catalyst after denitration

图10 汞氧化后的CeTi催化剂的NO的还原性能Fig. 10 NO reduction over CeTi catalyst after mercury oxide
CeTi催化剂协同脱除NO与汞的性能如图11所示。在模拟烟气中同时添加SCR气体(NH3,NO)及汞时,在12 h的实验中,CeTi催化剂在实验条件下的协同NO还原效率与汞氧化效率分别稳定在95%和77%左右,且催化剂具有良好的化学反应稳定性。XU等[22]研究表明CeTi催化剂的NH3-SCR过程遵循Eley-Rideal机制,即吸附态NH3与气相中NO反应生成N2。由于CeTi对NH3的亲和力比汞对NH3的亲和力强,微量的汞及生成的HgO不影响NH3的吸附过程,因此气相汞对CeTi催化剂上的SCR过程没有影响。在有氧条件下,气相O2补充表面吸附态/弱结合态氧的含量,此外,NO能够促进汞的氧化,这缓解了NH3与汞竞争吸附对汞氧化过程的不利影响,因此,在NH3与NO同时存在时,Eoxi略有降低,但仍保持较高水平。本研究中的GHSV为27 000 h−1,远高于典型SCR反应器中的GHSV(2 000~4 000 h−1),降低GHSV有利于提高催化剂的协同控制性能。此外,烟气中HCl等组分有利于汞的氧化[3]。因此,利用溶胶−凝胶法合成的CeTi催化有望能够实现燃煤烟气中NO与汞的协同控制。

图11 CeTi催化剂协同脱除NO与汞的性能Fig. 11 Performance of simultaneous removal of NO and mercury over CeTi catalyst
3 结论
1) 溶胶−凝胶法合成的CeTi催化剂具有较高的比表面积、较高的CeO2分散度以及丰富的表面吸附态/弱结合态活性氧,对催化过程非常有利。
2) NH3与汞竞争吸附CeTi催化剂表面活性位,并消耗表面活性氧,不利于汞的氧化;在有O2条件下,气相O2补充催化剂表面消耗的活性氧,有效降低了NH3对汞氧化的抑制作用。
3) 在无O2条件下,NO可抑制CeTi催化剂的汞氧化活性;但在有O2条件下,由于气相O2再生了催化剂表面消耗的活性氧, 并促进NO生成具有汞氧化活性的物质,NO促进汞的氧化。
4) SCR脱硝及汞氧化过程的相互影响不明显。CeTi催化剂低温协同SCR脱硝及汞氧化效率均分别达95%和77%。应用CeTi催化剂有望实现低温条件下燃煤烟气中NO与汞的协同控制。
[1] 中国国家统计局. 中国统计年鉴[EB/OL]. [2013−10−30]. http://www.stats.gov.cn/tjsj/ndsj/2013/indexch.htm. National Bureau of Statistics of China. China statistical yearbook[EB/OL]. [2013−10−30]. http://www.stats.gov.cn/tjsj/ ndsj/2013/indexch.htm.
[2] International Energy Agency. World energy outlook[EB/OL]. [2010−10−30]. http://www.worldenergyoutlook.org/media/weo2010. pdf.
[3] 郑楚光. 洁净煤技术[M]. 武汉: 华中理工大学出版社, 1996: 78−82. ZHENG Chuguang. Clean coal technology[M]. Wuhan: Huazhong University of science and Technology Press, 1996: 78−82.
[4] CHENG Hefa, HU Yuanan. China needs to control mercury emissions from municipal solid waste (MSW) incineration[J]. Environmental Science & Technology, 2010, 44(21): 7994−7995.
[5] 李鹏, 张亚平, 肖睿, 等. 整体式 V2O5-WO3/TiO2-ZrO2催化剂用于 NH3选择性催化还原NOx[J]. 中南大学学报(自然科学版), 2013, 44(4): 1719−1726. LI Peng, ZHANG Yaping, XIAO Rui, et al. Selective catalytic reduction of NOxwith NH3over V2O5-WO3/TiO2-ZrO2monolith catalysts[J]. Journal of Central South University (Science and Technology), 2013, 44(4): 1719−1726.
[6] KAMATA H, UENO S, TOSHIYUKI N T A, et al. Mercury oxidation by hydrochloric acid over a VOx/TiO2catalyst[J]. Catalysis Communications, 2008, 9(14): 2441−2444.
[7] QI Gongshin, YANG-RALPH T. Low-temperature selective catalytic reduction of NO with NH3over iron and manganese oxides supported on titania[J]. Applied Catalysis B-Environmental, 2003, 44(3): 217-225.
[8] BENSON S A, LAUMB J D, CROCKER C R, et al. SCR catalyst performance in flue gases derived from subbituminous and lignite coals[J]. Fuel Processing Technology, 2005, 86(5): 577−613.
[9] XU Wenqing, YU Yunbo, ZHANG Changbin, et al. Selective catalytic reduction of NO by NH3over a Ce/TiO2catalyst[J]. Catalysis Communications, 2008, 9(6): 1453−1457.
[10] GAO Xiang, JIANG Ye, ZHONG Yi, et al. The activity and characterization of CeO2-TiO2catalysts prepared by the sol-gel method for selective catalytic reduction of NO with NH3[J]. Journal of Hazardous materials, 2010, 174(1/2/3): 734−739.
[11] LI Hailong, WU Chang-yu, LI Ying, et al. CeO2-TiO2catalysts for catalytic oxidation of elemental mercury in low-rank coal combustion flue gas[J]. Environmental Science & Technology, 2011, 45(17): 7394−7400.
[12] LI Hailong, WU Chang-yu, LI Ying, et al. Role of flue gas components in mercury oxidation over TiO2supported MnOx-CeO2mixed-oxide at low temperature[J]. Journal of Hazardous materials, 2012, 243: 117−123.
[13] YANG Shaoxia, ZHU Wanpeng, JIANG Zhanpeng, et al. The surface properties and the activities in catalytic wet air oxidation over CeO2-TiO2catalysts[J]. Applied Surface Science, 2006, 252(24): 8499−8505.
[14] HE Sheng, ZHOU Jinsong, ZHU Yanqun, et al. Mercury oxidation over a vanadia-based selective catalytic reduction catalyst[J]. Energy & Fuels, 2009, 23(1): 253−259.
[15] GALVEZ M E, LAZARO M J, MOLINER R. Novel activated carbon-based catalyst for the selective catalytic reduction of nitrogen oxide[J]. Catalysis Today, 2005, 102: 142−147.
[16] LI Hailong, WU Changyu, LI Ying, et al. Superior activity of MnOx-CeO2/TiO2catalyst for catalytic oxidation of elemental mercury at low flue gas temperatures[J]. Applied Catalysis B-Environmental, 2012, 111: 381−388.
[17] 李海龙, 张军营, WU Changyu, 等. 铈基催化剂催化氧化燃煤烟气中汞的实验及机理研究[J]. 工程热物理学报, 2012, 33(7): 1251−1254. LI Hailong, ZHANG Junying, WU Changyu, et al. Experimental and mechanism study on mercury catalytic oxidation over ceria based catalysts[J]. Journal of Engineering Thermophysics, 2012, 33(7): 1251−1254.
[18] QI Gongshin, YANG-RALPH T. Characterization and FTIR studies of MnOx-CeO2catalyst for low-temperature selective catalytic reduction of NO with NH3[J]. Journal of Physical Chemistry B, 2004, 108(40): 15738−15747.
[19] JIN Ruiben, LIU Yue, WU Zhongbiao, et al. Low-temperature selective catalytic reduction of NO with NH3over Mn-Ce oxides supported on TiO2and Al2O3: A comparative study[J]. Chemosphere, 2010, 78(9): 1160−1166.
[20] LI Ying, MURPHY P D, WU Changyu, et al. Development of silica/vanadia/titania catalysts for removal of elemental mercury from coal-combustion flue gas[J]. Environmental Science & Technology, 2008, 42(14): 5304−5309.
[21] ZHANG Anchao, ZHENG Wenwen, SONG Jun, et al. Cobalt manganese oxides modified titania catalysts for oxidation of elemental mercury at low flue gas temperature[J]. Chemical Engineering Journal, 2014, 236: 29-38.
[22] XU Wenqing, HE Hong, YU Yunbo. Deactivation of a Ce/TiO2catalyst by SO2in the selective catalytic reduction of NO by NH3[J]. Journal of Physical Chemistry C, 2009, 113(11): 4426−4432.
(编辑 赵俊)
Simultaneous removal of NOxand mercury over CeO2-TiO2catalyst at low flue gas temperature
LI Liqing1, WU Shaokang1, LI Hailong1, MA Weiwu1, YANG Jianping2, ZHAO Yongchun2, ZHANG Junying2
(1. School of Energy Science and Engineering, Central South University, Changsha 410083, China; 2. State Key Laboratory of Coal Combustion, Huazhong University of Science and Technology, Wuhan 430074, China)
Low-temperature selective catalytic reduction (SCR) of NOxwith NH3and mercury oxidation over a highly active CeO2-TiO2(CeTi) catalyst synthesized by sol-gel method was investigated in a fixed-bed system. The catalysts were characterized by BET surface area analysis, X-ray diffraction (XRD), X-ray photoelectron spectroscopy (XPS). The results show that CeTi catalyst has excellent surface properties with highly dispersed ceria oxide on surface, large specific surface area and plenty of surface oxygen. At 250 ℃, the mercury oxidation efficiency can reach more than 80% and NO reduction efficiency can reach 99%. In the absence of oxygen, NH3significantly decreases the activity of CeTi catalyst for mercury oxidation, while it has little influence with O2. NO limits mercury oxidation without oxygen, while with the participation of oxygen, NO enhances mercury oxidation. The interaction between mercury oxidation and NO reduction has little influence on cooperative control of NO and Hg0. The technology of low-temperature simultaneous removal of NO and Hg0for coal-fired power plants might be realized with the application of CeTi catalyst.
sol-gel; CeO2-TiO2; mercury; NO; low temperature
TK16
A
1672−7207(2016)03−1049−09
10.11817/j.issn.1672-7207.2016.03.044
2015−03−08;
2015−05−28
国家自然科学基金资助项目(51206192);湖南省环保科研项目(2013QNZT032) (Project(51206192) supported by the National Natural Science Foundation of China; Project(2013QNZT032) supported by the Environmental Research Foundation of Hunan Province)
李海龙,副教授,从事燃烧污染防治研究;E-mail: hailong_li@126.com
——李红,安明哲,苟梓希.CN 114180719A

