缺氧对肺癌细胞BMPR-1A的表达及其运动侵袭能力的影响
唐金明 王文祥★
缺氧对肺癌细胞BMPR-1A的表达及其运动侵袭能力的影响
唐金明王文祥★
目的 检测肺癌细胞A549中BMPR-1A在常氧和缺氧条件下的表达; 探讨两种不同培养条件下BMPR-1A的不同表达情况及对肺癌细胞运动侵袭能力的影响。方法 缺氧条件下培养人肺癌细胞A549,Western blot检测HIF-1α、BMPR-1A的表达情况;同时,划痕实验及Transwell实验检测在常氧和缺氧条件下由于BMPR-1A 的差异性表达对肺癌细胞运动侵袭能力的影响。结果 缺氧条件下刺激肺癌细胞24h后,HIF-1α蛋白表达明显上升,BMPR-1A蛋白表达明显下降; 划痕实验及Transwell 实验结果也显示肺癌细胞接受缺氧刺激后其运动侵袭能力显著增强。结论 缺氧增加肺癌细胞运动侵袭的能力,该作用机制可能与缺氧导致BMPR-1A的表达下降有关。
缺氧 肺癌 BMPR-1A 运动 侵袭
骨成型蛋白家族(BMPs)是转化生长因子(TGF)家族的成员之一,BMPs作为保守蛋白在动物及人类胚胎各系统的发育过程、肿瘤的发生发展中起重要作用[1]。BMPs作为一种分泌型蛋白,其家族受体分为Ⅰ型和Ⅱ型,Ⅰ型受体包括BMPR1A、BMPR1B、ACVR1A,Ⅱ型受体包括ACVRIIA、ACVRIIB、BMPR2,不同受体介导特异性的信号通路[2]。BMPR1A在胆囊癌、胰腺癌、胃癌等恶性肿瘤的发生发展中起重要作用,并且其表达水平受缺氧环境的调节[3-5];研究证明BMPR1A在肺癌的发生中起重要作用,但是其在肺癌的侵袭转移中的作用鲜有报道[6-7]。本研究检测常氧与缺氧条件下肺癌细胞中BMPR1A的差异表达情况,通过划痕及Transwell实验观察其差异表达与肺癌细胞的运动及侵袭能力的关系。
1 材料与方法
1.1材料 人肺癌细胞A549 购自湘雅学院细胞中心,BMPR1A抗体(ab38560),HIF-1α抗体(ab51608),β-actin抗体(ab8229)购自Abcam公司,乏氧培养箱购自Thermo公司,Transwell小室购自Corning 公司,Matrigel生物胶购自BD公司。
1.2实验方法 (1)细胞培养液:含10%胎牛血清的1640 培养液,常氧培养条件:37℃、20% 氧气、5%二氧化碳、75% 氮气;缺氧培养条件:37℃、1% 氧气、5%二氧化碳、94%氮气(乏氧培养箱提供缺氧细胞培养的条件),常氧和缺氧条件下分别同时培养人肺癌细胞A549 24h。(2)蛋白印迹法(Western blot):采用强裂解液提取总蛋白,BCA法测定蛋白浓度,总上样量为50μg,采用流程为:电泳(恒压100V,90min)、转膜(湿转,恒压120V,90min)、封闭(5%脱脂奶粉的TBST,常温2h)、孵育一抗(4℃,过夜)、洗膜(5min×3次)、孵育二抗(常温,2h)、洗膜(10min×3次)、ECL显色。(3)划痕试验:上述常氧及乏氧条件下培养细胞,重悬细胞,计数,六孔板内加入约5×105个细胞,过夜铺满。用20μl枪头划痕,用PBS洗细胞3次,去除划下的细胞,加入无血清培养基,分别放入常氧及乏氧培养箱培养。按0、12、24h取样,摄照,计算细胞爬行的距离。(4)Transwell 侵袭试验:常氧和缺氧条件下将A549培养24h,消化细胞,PBS洗2遍,无血清培养基重悬。调整细胞密度至1×105个/ ml。取细胞悬液200μl加入至已铺Matrigel胶的8μm孔径Transwell小室上室,将600μl含20%胎牛血清的1640培养基加入下室,分别于常氧和缺氧条件下培养24h后,取出小室,棉签小心擦去室内未转移细胞,4%多聚甲醛固定12min,结晶紫溶液染色15min,PBS 洗3 遍,显微镜下随机取5个视野,细胞计数。(5)Transwell 迁移试验:Transwell 小室不进行Matrigel胶包被,其余步骤同(4)。
1.3统计学方法 采用SPSS 17.0统计软件。计量资料以(±s)表示,组间比较采用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1Western blot检测缺氧对A549的MPR1A及HIF-1α蛋白表达的影响 Western blot结果显示,在A549缺氧24h培养后,HIF-1α蛋白的表达水平明显上升(P<0.05),相反,MPR1A蛋白的表达水平明显下降(P<0.05);见图1。
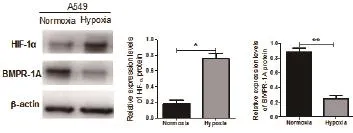
图1 常氧及乏氧条件培养下HIF-1α及MPR1A蛋白的表达水平(★P=0.0074,★★P=0.0060)
2.2划痕试验检测不同培养条件下细胞的运动能力 划痕实验检测常氧及乏氧细胞24h后划痕的宽度,以0h的宽度减24h的宽度作为爬行的距离,A549在24h乏氧培养条件下爬行的宽度大于常氧培养条件下爬行的宽度(P<0.05),见图2。

图2 常氧及乏氧条件下细胞迁徙运动的宽度(★P=0.0008)
2.3Transwell 侵袭试验检测不同培养条件下细胞迁徙能力 常氧及乏氧条件下细胞迁徙运动的能力(*P=0.0011),见图3(×400)。
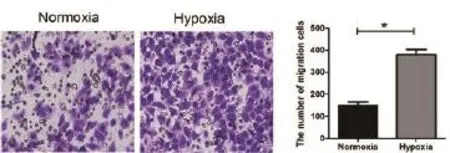
图3 Transwell 侵袭试验检测不同培养条件下细胞迁徙能力
2.4Transwell 迁移试验检测不同培养条件下细胞侵袭能力 常氧及乏氧条件下细胞迁徙运动的能力(*P=0.0006),见图4(×400)。
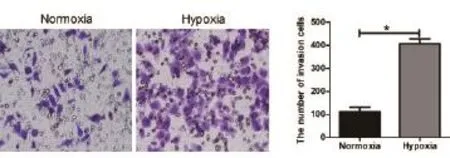
图4 Transwell 迁移试验检测不同培养条件下细胞侵袭能力
3 讨论
侵袭转移是导致非小细胞肺癌患者死亡的主要原因,而肿瘤周围微环境在肿瘤细胞的侵袭转移中扮演着重要角色[8]。肿瘤细胞周围的低氧环境是肿瘤细胞微环境的重要组成部分之一,其能通过调节肿瘤细胞的生长、凋亡、侵袭、转移及耐药等促进肿瘤的发生发展[9]。
骨形成蛋白受体1A是BMP家族受体之一,最早研究发现BMPR-1A通过与BMP家族蛋白结合,主要参与胚胎发育及骨形成,随后发现其调控肿瘤细胞的增殖、分化以及迁移。研究发现,降低BMPR-1A的表达可促进非小细胞肺癌的增殖及阻碍凋亡[6-7],缺氧环境中可下调胃癌细胞BMPR-1A的表达而促进细胞的侵袭转移[5],在前列腺癌中发现可介导肿瘤细胞的发生及侵袭与转移,并且其表达与转移程度及浸润深度成负相关[10]。但缺氧与肺癌细胞中的表达及其与肺癌细胞运动侵袭能力的关系仍未见报道。
本研究通过乏氧培养非小细胞肺癌A549,检测HIF-ɑ蛋白的表达验证成功构建乏氧细胞模型。HIF-1是1992年Semenza等在研究红细胞生成素(EPO)基因表达时发现的核转录因子,由HIF-1α及HIF-1β亚单位构成[11],HIF-1α只在缺氧细胞核中表达且与多种肿瘤发展密切相关,故可作为缺氧细胞模型构建成功的标志物[12]。Ei Bizri N等[13]报道,其在缺氧的血管壁中表达明显下调的,可促进肺动脉压力增高及其他变化。在肿瘤中,BMPR-1的表达与HIF-1α表达的关系不明确,本资料结果显示BMPR-1的表达水平随HIF-1α表达水平的升高而降低,具体机制需要进一步探讨。进一步观察缺氧条件下BMPR-1A低表达对肺癌细胞运动侵袭过程的影响,划痕实验及Transwell迁移实验证明缺氧条件下肺癌细胞的运动及迁移能力明显强于常氧条件下的肺癌细胞,同时,Transwell侵袭实验也证明缺氧培养下的肺癌细胞侵袭能力显著增强。
综上所述,缺氧条件下BMPR-1A的下降可能促进肺癌细胞的运动和侵袭。分析缺氧条件下BMPR-1A调节肺癌细胞运动及侵袭的分子机制,可作为肺癌侵袭转移的标志及靶向治疗的依据。缺氧作为肿瘤生长的微环境,受复杂的分子网络调节,缺氧导致肿瘤的侵袭和迁移能力增强不仅是BMPR-1A单一个分子所决定的,需要进一步研究阐明BMPR-1A在缺氧条件下促进肺癌细胞迁移侵袭过程中与其他因子的关系,为肺癌的防治提供进一步的理论依据。
[1]Brazil DP,Church RH,Surae S,et al. BMP signalling: agony and antagony in the family.Trends Cell Biol,2015,25(5):249-264.
[2]Hayashi M,Imamura T,Miyazono K,et al. BMP receptors and signal transduction. Nihon Rinsho,2005,63(Suppl 10):399-403.
[3]Xiong L, Deng X, Wen Y, et al. Association of BDNF and BMPR1A with clinicopathologic parameters in benign and malignant gallbladder lesions.World J Surg Oncol,2013,26(11):80.
[4]Voorneveld PW, Stache V, Jacobs RJ, et al. Reduced expression of bone morphogenetic protein receptor IA in pancreatic cancer is associated with a poor prognosis.Br J Cancer, 2013, 109(7): 1805-1812.
[5]王亚芳,魏彦玲,张宏博,等.缺氧对胃癌细胞BMPR-1A表达及其侵袭和迁移能力的影响.现代肿瘤医学,2014,22(3): 502-506.
[6]Langenfeld E,Hong CC,Lanke G,et al.Bone morphogenetic protein type I receptor antagonists decrease growth and induce cell death of lung cancer cell lines.PLoS One,2013,8(4):e61256.
[7]徐慧慧,齐艳丽,顿嵩,等.骨形成蛋白7通过激活Ⅰ型受体BMPR1A、BMPR1B抑制肺大细胞癌NCI-H460细胞的增殖.中国肺癌杂志,2010,13(7): 659-664.
[8]Yao Y,Wu Z,Zhou Q. Autoantibodies as the early diagnostic biomarkers for lung cancer. Zhong Guo Fei Ai Za Zhi,2010, 13(9): 903-907.
[9]Brustugun OT. Hypoxia as a cause of treatment failure in non-small cell carcinoma of the lung.Semin Radiat Oncol,2015,25(2):87-92.
[10]Kim IY,Lee DH,Ahn HJ,et al. Expression of bone morphogenetic protein receptors type-IA,-IB and -II correlates with tumor grade in human prostate cancer tissues.Cancer Res,2000,60(11):2840-2844.
[11]Semenza G.Signal transduction to hypoxia-inducible factor 1.Biochem Pharmacol,2002,64(5-6):993-998.
[12]Damert A, Machein M, Breier G, et al. Up-regulation of vascular endothelial growth factor expression in a rat glioma is conferred by two distinct hypoxia-driven mechanisms.Cancer Res, 1997, 57(17): 3860-3864.
[13]EI-Bizri N,Wang L,Merklinger SL,et al.Smooth muscle protein 22alpha-mediated patchy deletion of Bmpr1a impairs cardiac contractility but protects against pulmonary vascular remodeling. Circ Res, 2008,102(3):380-388.
Objective To explore the expression of BMPR-1A in the human lung cancer cells A549 under normoxia and hypoxia,and investigate the infl uence of the different expression of BMPR-1A under normoxia and hypoxia on the migration and invasion in human lung cancer cells. Methods The lung cancer cells A549 was cultured in normoxic condition and hypoxic condition,The protein levels of HIF-1αand BMPR-1A were determined by Western blot. Infl uence of different expression of BMPR-1A under normoxia and hypoxia on the migration and invasion of A549 was detected via using Wound-repair and Transwell. Results The results of Western blot showed that BMPR-1A was expressed down-regulated and HIF-1α was expressed up-regulated after A549 exposed to hypoxia for 24h; Wound-repair and Transwell assay showed that the migratory and invasive ability were enhanced when the lung cancer cells were exposed to hypoxia for 24h. Conclusions Hypoxia could enhance the migratory and invasive ability of lung cancer cells via down-regulating BMPR-1A.
Hypoxia Lung cancer BMPR-1A migration Invasion
410006湖南省肿瘤医院(中南大学湘雅医学院附属肿瘤医院)

