关节损伤对软骨蛋白酶基因表达影响的研究
薛建利 崔威
关节损伤对软骨蛋白酶基因表达影响的研究
薛建利 崔威
目的 本研究旨在探索膝关节损伤后特定的透明软骨退化酶,如基质金属蛋白酶 ( MMP )、蛋白聚糖酶 ( Agg ) 的基因表达是否增加。方法 试验纳入 138 例因关节组织如半月板、前交叉韧带 ( anterior cruciate ligament,ACL )、透明软骨损伤而行膝关节镜检查的患者,男 57 例,女 81 例,平均年龄 38.8 岁。检查前采集全血样本,检查时采集滑膜样本。利用 RT-PCR 和分光光度法处理样本。结果 患者中,有 56 例 ACL损伤,65 例内侧半月板损伤,5 例外侧半月板损伤,软骨损伤者根据 Outerbridge 标准进行分级。实验室检测显示,ACL 撕裂和基因表达 ( MMP1、MMP2、MMP8、MMP9、MMP13、MMP14、Agg1、Agg2、IL1、TNFα 和TIMP2,除外血浆 TIPM1 ) 显著相关:ACL 患者滑膜中基因表达水平较非 ACL 患者滑膜中的对应基因表达水平显著上调:MMP1 0.920±0.068 vs 0.794±0.061,MMP2 1.075±0.053 vs 0.668±0.035,MMP8 0.951±0.047 vs 0.766±0.045,MMP9 1.354±0.032 vs 0.947±0.042,MMP13 1.148±0.058 vs 0.991±0.058,MMP14 1.379±0.049vs 0.777±0.036,Agg1 1.309±0.071 vs 0.647±0.034,Agg2 1.043±0.072 vs 0.684±0.069,IL1 1.320±0.054 vs 0.857±0.049,TNFα 1.101±0.050 vs 0.802±0.039,TIMP1 1.197±0.060 vs 1.035±0.071,TIMP2 1.110±0.048vs 0.861±0.048 ( P 值均<0.05 )。除 TIMP1 外 ( 1.092±0.053 vs 1.081±0.033,P=0.32 ),ACL 患者血液中基因表达水平较非 ACL 患者血液中的对应基因表达水平显著上调:MMP1 1.163±0.030 vs 0.948±0.049,MMP2 0.918±0.056 vs 0.827±0.049,MMP8 1.172±0.029 vs 0.783±0.034,MMP9 1.304±0.059 vs 0.94±0.04,MMP131.155±0.060 vs 0.824±0.043,MMP14 1.095±0.058 vs 0.759±0.033,Agg1 1.270±0.077 vs 0.676±0.038,Agg21.244±0.037 vs 0.871±0.037,IL1 1.128±0.056 vs 0.912±0.045,TNFα 1.018±0.076 vs 0.724±0.047,TIMP11.092±0.053 vs 1.081±0.033,TIMP2 0.906±0.056 vs 0.875±0.049 ( P 值均<0.05 )。所有基因在血浆和滑膜中的表达具有相关性 ( Agg1:r=0.89,MMP1:r=0.88,MMP2:r=0.87,P<0.001 )。结论 ACL 损伤引起蛋白酶基因表达增加,而其它损伤造成的改变尚不确切。滑膜与血浆中的基因表达存在相关性。
骨关节炎,膝;透明软骨;金属内肽酶类;前交叉韧带;半月板,胫骨
骨关节炎 ( osteoarthritis,OA ) 是一种患病率随年龄显著增加的渐进性退行性关节病变,与患者年龄、体重、炎症、遗传等因素密切相关[1]。除常见病因外,其危险因素还包括体育运动和关节损伤病史。有研究表明[2],青年时期有关节损伤者,13.9%在 65 岁前发生骨关节炎,而对照组 ( 青年时期未发生关节损伤者 ) 仅 6%。
骨关节炎基本的病理变化是内外因素变化导致关节滑膜组织、软骨组织和软骨下骨异常代谢并释放多种蛋白酶[3],从而引发软骨基质中蛋白聚糖与胶原纤维网络的降解,最终导致进行性的骨与软骨破坏。而在降解过程中,蛋白聚糖的丢失是骨关节炎软骨早期退变,也最主要且最重要的病理变化。蛋白聚糖降解是一个蛋白水解过程,它的丢失破坏了软骨细胞外基质功能和结构的完整性,使软骨失去了抗负荷性能,最终导致不可逆性关节功能丧失。
骨关节炎与透明软骨分解代谢、再生的相互作用过程有关[4],受滑膜和软骨细胞分泌炎症因子的影响,如关节液中的 IL1、TNF-α 可刺激其它细胞因子分泌,进而影响损伤关节软骨的蛋白酶合成。有研究证实,对关节软骨起破坏作用的主要是两种金属内肽酶[5-6],包括蛋白聚糖酶 ( Agg ) 和基质金属蛋白酶 ( MMPs )。创伤后可检测到关节液中此两种酶水平改变,如:创伤后血肿会导致 MMP2 和 MMP9水平升高,关节创伤后 MMP1 水平升高,前交叉韧带 ( anterior cruciate ligament,ACL ) 损伤后 MMP2 水平升高[7],半月板退行性改变患者中观察到 MMP3、Agg1、Agg2 活性增强[8]。
既往研究多分析骨关节炎的损伤机制和关节液总体酶学水平,尚无对膝关节损伤后此类酶对应基因表达水平的相关研究。本试验致力于探索膝关节损伤是否改变特定蛋白酶 ( 如 MMP1、MMP2、MMP8、 MMP9、MMP13、MMP14、Agg1、Agg2 )、细胞因子( IL1 和 TNFα )、抑制因子 ( TIMP1 和 TIMP2 ) 的基因表达,以期从基因水平探索创伤后骨关节炎的发生机制。
资料与方法
一、纳入与排除标准
1.纳入标准:( 1 ) 在留取关节样本前 1 个月内未应用任何药物者;( 2 ) 1 年内无关节穿刺治疗及关节内用药史者。
2.排除标准:( 1 ) 有代谢性疾病史者;( 2 ) 有内分泌紊乱史者;( 3 ) 有风湿性疾病史者;( 4 ) 有结缔组织病史者;( 5 ) 有性激素避孕史者;( 6 ) 有糖皮质激素治疗史者;( 7 ) 既往有手术或骨折病史者;( 8 )吸烟、饮酒、药物成瘾史者。
二、一般资料
2013 年 6 月至 2015 年 6 月,在西安交大附属第二医院就诊的膝关节损伤患者共 138 例,男57 例,女 81 例,年龄 25~55 岁,平均 38.8 岁。病程为 1 天~1 个月,平均 7 天。均有明确的膝关节外伤史,临床表现为关节肿胀、疼痛、功能障碍、部分弹响等,所有病例均于损伤后 1 个月内经关节镜或手术证实。74 例行右膝关节手术,64 例行左膝关节手术,其中 29 例同时行 ACL 重建手术。本研究方案已获西安交通大学附属第二医院伦理委员会批准。
三、样本采集
检查前采集受试者外周血标本,从肘窝表浅静脉采集 2 ml 血液,收集至 5 ml BD VacutainerEDTA K2 管,20 min 内转存至 -20 ℃ 冰箱冷藏。所有患者行前外侧或前内侧膝关节镜检查,利用 4 mm 关节镜相机评估交叉韧带、半月板和关节软骨的损伤类型和损伤程度 ( Outerbridge 量表[9])。从近滑膜中点处或直接从损伤区域收集 ACL 周围滑膜碎片,标本立即放置于含 RNAlater的 1.5 cm3组织保存管中。处理后样本置于 4 ℃ 环境,隔日冷藏于 -20 ℃ 冰箱。
四、主要试剂与仪器
RNAlatermsolution,Trizol m( Invitrogen ) reagent,RT-PCR Kit ( Agilent Technologies)。PicodropTM分光光度计,RT-PCR 分析仪器 Stratagene Mx3005P ( Agilent Technologies )。
五、实验方法[10]
取上述组织、血液标本,按照试剂盒所述方法提取 RNA,利用分光光度计获得 RNA 浓度和纯度,获得的 RNA 溶液冷藏至 -80 ℃ 环境以备后用。利用RT-PCR 技术,首先经反转录酶的作用以 RNA 合成cDNA,再以 cDNA 为模板,扩增合成目的片段,内部参照为 GAPDH 基因,评估以下基因表达情况:蛋白酶 MMP1、MMP2、MMP8、MMP9、MMP13、MMP14、Agg1、Agg2,抑制因子 TIMP1 和 TIMP2,细胞因子 IL1 和 TNFα,根据分析仪器标准曲线计算各个样本中所检测指标的数值。对应的 mRNA 表达情况用 2-ΔΔCt 公式计算。
六、统计学处理
结 果
膝关节镜术中评估患者损伤类型:56 例 ACL 损伤,65 例内侧半月板 ( MM ) 损伤,11 例外侧半月板( LM ) 损伤。21 例 MM 合并 ACL 损伤,5 例 LM 合并 ACL 损伤。根据 Outerbridge 分级标准评估软骨面损伤程度,I 级 7 例,II 级 32 例,III 级 25 例,IV级 4 例,余 70 例未发现软骨面异常。软骨受损患者中,有 11 例 ACL 撕裂,其中 4 例伴发 MM 损伤。半月板损伤患者中有 30 例合并软骨面损伤。
如表 1 所示,与无 ACL 损伤者相比,ACL 损伤的患者中,除血 TIMP1 外,滑膜和血液中相关研究基因表达水平均有上调。ACL 患者滑膜中基因表达水平较非 ACL 患者滑膜中的对应基因表达水平显著上调:MMP1 0.920±0.068 vs 0.794±0.061,MMP2 1.075±0.053 vs 0.668±0.035,MMP8 0.951±0.047 vs 0.766±0.045,MMP9 1.354±0.032 vs 0.947±0.042,MMP13 1.148±0.058 vs 0.991±0.058,MMP141.379±0.049 vs 0.777±0.036,Agg1 1.309±0.071 vs 0.647±0.034,Agg2 1.043±0.072 vs 0.684±0.069,IL1 1.320±0.054 vs 0.857±0.049,TNFα 1.101±0.050 vs 0.802±0.039,TIMP1 1.197±0.060 vs 1.035±0.071,TIMP2 1.110±0.048 vs 0.861±0.048( P 值均<0.05 )。除 TIMP1 外 ( 1.092±0.053 vs 1.081±0.033,P=0.32 ),ACL 患者血液中基因表达水平较非 ACL 患者血液中的对应基因表达水平显著上调:MMP1 1.163±0.030 vs 0.948±0.049,MMP20.918±0.056 vs 0.827±0.049,MMP8 1.172±0.029 vs 0.783±0.034,MMP9 1.304±0.059 vs 0.94±0.04,MMP13 1.155±0.060 vs 0.824±0.043,MMP141.095±0.058 vs 0.759±0.033,Agg1 1.270±0.077 vs 0.676±0.038,Agg2 1.244±0.037 vs 0.871±0.037,IL1 1.128±0.056 vs 0.912±0.045,TNFα 1.018± 0.076 vs 0.724±0.047,TIMP1 1.092±0.053 vs 1.081± 0.033,TIMP2 0.906±0.056 vs 0.875±0.049 ( P<0.05 )。
与半月板正常的患者相比,MM 损伤的患者中,血 MMP9、Agg2 表达水平显著提高,而外周血 TIMP2和滑膜 MMP13 表达水平显著降低 ( P<0.05 )。LM 损伤的患者,外周血 MMP13、MMP14 基因表达水平显著提高,滑膜 MMP8 基因表达水平降低 ( P<0.05 )。
表1 ACL 与非 ACL 损伤者基因相对 GAPDH 表达水平 (±s )Tab.1 Gene expression level in the patients with or without ACL lesions compared with GAPDH (±s )

表1 ACL 与非 ACL 损伤者基因相对 GAPDH 表达水平 (±s )Tab.1 Gene expression level in the patients with or without ACL lesions compared with GAPDH (±s )
注:aACL 损伤者滑膜、外周血分别与非 ACL 损伤者比较,P<0.05Notice:aComparison of gene expression level in the synovium and peripheral blood of the patients with or without ACL lesions, P < 0.05
非 ACL 患者血液MMP1 0.920±0.068a 1.163±0.030a 0.794±0.061 0.948±0.049 MMP2 1.075±0.053a 0.918±0.056a 0.668±0.035 0.827±0.049 MMP8 0.951±0.047a 1.172±0.029a 0.766±0.045 0.783±0.034 MMP9 1.354±0.032a 1.304±0.059a 0.947±0.042 0.940±0.040 MMP13 1.148±0.058a 1.155±0.060a 0.991±0.058 0.824±0.043 MMP14 1.379±0.049a 1.095±0.058a 0.777±0.036 0.759±0.033 Agg1 1.309±0.071a 1.270±0.077a 0.647±0.034 0.676±0.038 Agg2 1.043±0.072a 1.244±0.037a 0.684±0.069 0.871±0.037 IL1 1.320±0.054a 1.128±0.056a 0.857±0.049 0.912±0.045 TNFα 1.101±0.050a 1.018±0.076a 0.802±0.039 0.724±0.047 TIMP1 1.197±0.060a 1.092±0.053 1.035±0.071 1.081±0.033 TIMP2 1.110±0.048a 0.906±0.056a 0.861±0.048 0.875±0.049基因类型 ACL 患者滑膜 ACL 患者外周血非 ACL 患者滑膜
与无关节面损伤的患者相比,关节面损伤的患者中,外周血、滑膜两种组织中仅 TIMP2 表达水平显著增加 ( P<0.05 )。外周血 MMP13、MMP14、TIMP1,滑膜细胞 MMP8、MMP14、TIMP1 的基因表达水平无显著改变,其余研究基因表达水平反而有所降低。
在 ACL 损伤的患者中进行亚组分析,比较单独ACL 损伤与 ACL 合并半月板或关节面损伤,合并损伤者滑膜 MMP1、MMP2、MMP13 基因表达水平更低,且在 ACL 合并关节面损伤的患者中最低;而滑膜 MMP8 和 MMP9 表达水平则显著增加 ( P<0.05 )。
本试验最后分析证明,研究的所有基因在滑膜与外周血中表达水平情况显著相关 ( 表 3 )。相关性最强的为 Agg1 ( r=0.89 )、MMP1 ( r=0.88 ) 和 MMP2 ( r=0.87 ),相关性最弱为 MMP8,差异有统计学意义。结果显示,本研究所有基因在滑膜和外周血中的表达水平变化具有一致性。
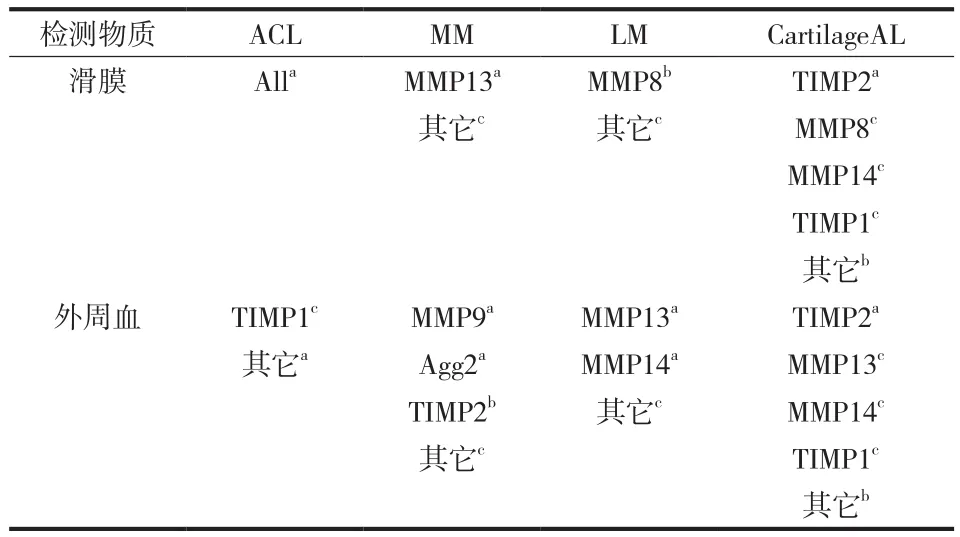
表2 不同膝关节损伤对基因表达水平的影响Tab.2 Gene expression changes in different knee injuries
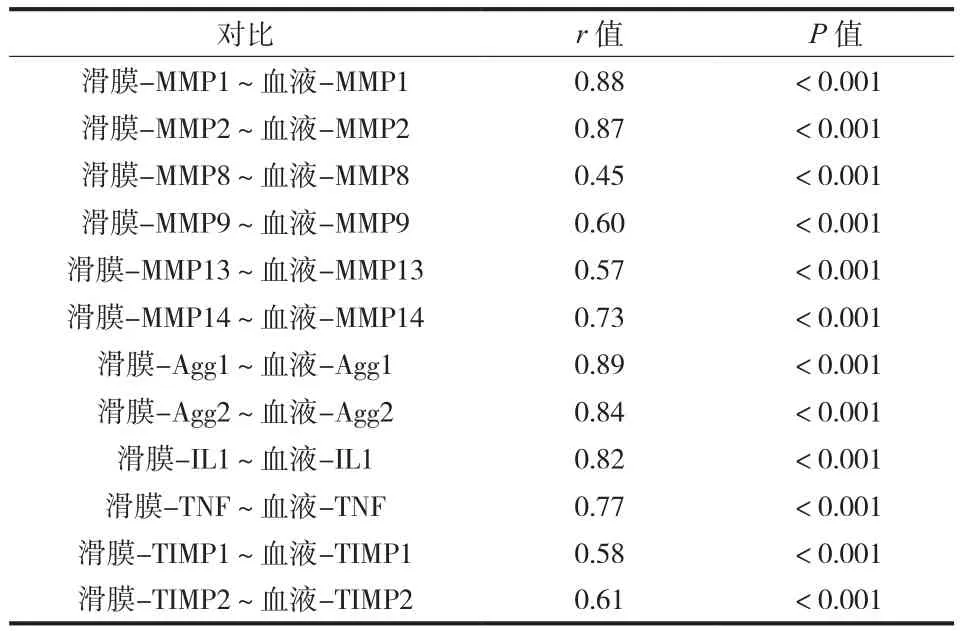
表3 滑膜、血液中研究基因表达水平相关性分析 ( P < 0.001 )Tab.3 Correlations between studied gene expression level in the synovial membrane and blood ( P < 0.001 )
讨 论
本试验结果显示,在 ACL 患者中,除血 TIMP1外,其它基因表达水平都有显著提高。而在 LM、MM 及软骨面损伤的患者中,细胞因子表达水平无显著改变,各金属内肽酶基因表达水平改变方向也不一致。故 ACL 损伤引起蛋白酶基因表达水平增加,而其它损伤造成的改变尚不确切。考虑到 ACL撕裂经常伴随其它关节内组织损伤,本试验也评估了合并损伤对基因表达水平的影响,发现合并损伤主要影响 MMP 表达水平,而对 Agg、细胞因子表达水平无明显改变。通过比较滑膜与外周血中基因的表达水平变化发现,滑膜与血浆中基因表达水平存在相关性。Monemdjou 等[11]认为 MMP1 和 MMP13是关节软骨退化的主要介质,Tchetverikov 等[12]也观察到关节创伤后 proMMP1 水平升高。Tajim 等[13]认为关节内血肿导致 MMP2 和 MMP9 水平升高。Higuchi 等[14]发现在 ACL 撕裂病例中,MMP1、IL6、TNFα、TIMP1 水平升高。这与我们的实验数据相符,从 ACL 损伤的患者数据来看,几乎所有基因表达水平都有显著提高。在半月板和软骨损伤患者中,本试验发现上述基因表达水平并无显著变化,TNFα 水平与软骨退行性标志物似乎并无关联。通过分析关节软骨损伤的影响,本试验发现与关节面受损者相比,大多数蛋白酶基因在关节软骨完好者表达水平更高。同样,El-Arman 等[15]也发现外周血和滑膜的酶水平存在正相关,阐述了骨关节炎局部标志物和全身标志物的相关性。
大多数研究分析的是关节液的总体酶学水平,但本试验着重研究了这些蛋白酶对应的基因表达水平。骨关节炎是一种缓慢进展的关节软骨退化性疾病,关节损伤可能发生在年轻的时候,但受伤病史若造成基因表达水平改变,破坏软骨的金属内肽酶表达水平增加,则可能对关节软骨造成持久的破坏。本试验仅在 ACL 损伤的患者中发现几乎所有破坏性酶对应基因表达水平提高,半月板、软骨面损伤造成的基因改变尚无定论。根据这些实验结果,笔者建议,今后的研究可延长随访时间,进一步分析基因表达水平增加对于骨关节炎的早期诊断意义。
[1] Neogi T, Zhang Y.Epidemiology of osteoarthritis.Rheum Dis Clin North Am, 2013, 39(1):1-19.
[2] Khanna V, Beaulé PE.Defining structural abnormalities of the hip joint at risk of degeneration.J Hip Preserv Surg, 2014, 1(1):12-20.
[3] Mort JS, Geng Y, Fisher WD, et al.Aggrecan heterogeneity in articular cartilage from patients with osteoarthritis.BMCMusculoskelet Disord, 2016, 17:89.
[4] Lee AS, Ellman MB, Yan D, et al.A current review of molecular mechanisms regarding osteoarthritis and pain.Gene.2013, 527(2):440-447.
[5] Zhongyi S, Sai Z, Chao L, et al.Effects of nuclear factor kappa B signaling pathway in human intervertebral disc degeneration.Spine, 2015, 40(4):224-232.
[6] Testa A, Leonardi R, Rusu MC.Role of cytokines and matrix metallo-proteinases in patients with temporo-mandibular joint internal derangements and/or osteoarthritis.Recent Patents On Biomarkers, 2013, 3(3)157-163.
[7] Tourville TW, Poynter ME, De Sarno MJ, et al.The relationship between synovial fluid ARGS, cytokines, MMPs & TIMPs following acute ACL injury.J Orthop Res, 2013, 33(12): 1796-1803.
[8] Stone AV, Loeser RF, Vanderman KS, et al.Pro-inflammatory stimulation of meniscus cells increases production of matrix metalloproteinases and additional catabolic factors involved in osteoarthritis pathogenesis.Osteoarthritis Cartilage, 2014, 22(2):264-274.
[9] Lasmar NP, Lasmar RC, Vieira RB, et al.Assessment of the reproducibility of the outerbridge and fsa classifications for chondral lesions of the knee.Rev Bras Ortop, 2011, 46(3):266-269.
[10] Ali SA, Alman B.RNA extraction from human articular cartilage by chondrocyte isolation.Anal Biochem, 2012, 429(1): 39-41.
[11] Monemdjou R, Fahmi H, Pelletier JP, et al.Metalloproteases in the pathogenesis of osteoarthritis: possible targets for treatment.Int J Adv Rheumatol, 2010, 8(3):103-110.
[12] Tchetverikov I, Lohmander LS, Verzijl N, et al.MMP protein and activity levels in synovial fluid from patients with joint injury, inflammatory arthritis, and osteoarthritis.Ann Rheum Dis, 2005, 64(5):694-698.
[13] Tajima T, Yoshida E, Yamashita A, et al.Hemoglobin stimulates the expression of matrix metalloproteinases, MMP-2 and MMP-9 by synovial cells: A possible cause of joint damage after intra-articular hemorrhage.J Orthop Res, 2005, 23(4): 891-898.
[14] Higuchi H, Shirakura K, Kimura M, et al.Changes in biochemical parameters after anterior cruciate ligament injury.Int Orthop, 2006, 30(1):43-47.
[15] El-Arman MM, El-Fayoumi G, El-Shal E, et al.Aggrecan and cartilage oligomeric matrix protein in serum and synovial fluid of patients with knee osteoarthritis.HSS J, 2010, 6(2):171-176.
( 本文编辑:裴艳宏 )
Research on the influence of joint injuries on gene expressions of articular cartilage proteases
XUE Jian-li, CUI Wei.
Department of Orthopedics, the second Affiliated Hospital of Xi’an Jiaotong University, Xi’an, Shanxi, 710004, PRC
Objective To explore whether injuries of the knee joint tissues will increase gene expressions of selected hyaline cartilage degenerating enzymes such as matrix metaloproteinases ( MMP ) and aggreacaneses ( Agg ).Methods A total of 138 patients with joint tissue lesions such as menisci, anterior cruciate ligament ( ACL ) and hyaline cartilage were admitted for knee arthroscopy.There were 81 females and 57 males with a mean age of 38.8 years.Full blood samples were collected preoperatively and synovium samples intraoperatively.Real time polymerase chain reaction ( PCR ) and spectrophotometric analysis were performed.Results ACL lesions were found in 56 patients, medial menisci ( MM ) lesions in 65 patients and lateral menisci ( LM ) lesions in 5 patients.Chondral lesions were estimated according to Outerbridge’s grading system.In laboratory tests, significant correlation was seen between ACL tears and gene expressions ( MMP1, MMP2, MMP8, MMP9, MMP13, MMP14, Agg1, Agg2, IL1, TNFα and TIMP2, except TIMP1 ) ( P < 0.05 ).The gene expression level in synovium of the patients with ACL lesions was significantly elevated compared with that of the patients without ACL lesions: MMP1 0.920 ± 0.068 vs 0.794 ± 0.061; MMP2 1.075 ± 0.053 vs 0.668 ± 0.035; MMP8 0.951 ± 0.047 vs 0.766 ± 0.045; MMP9 1.354 ± 0.032 vs 0.947 ± 0.042; MMP13 1.148 ± 0.058 vs 0.991 ± 0.058; MMP14 1.379 ± 0.049 vs 0.777 ± 0.036; Agg1 1.309 ± 0.071 vs 0.647 ± 0.034; Agg2 1.043 ± 0.072 vs 0.684 ± 0.069; IL1 1.320 ± 0.054 vs 0.857 ± 0.049; TNFα 1.101 ± 0.050 vs 0.802 ±0.039; TIMP1 1.197 ± 0.060 vs 1.035 ± 0.071; TIMP2 1.110 ± 0.048 vs 0.861 ± 0.048 ( P < 0.05 ).Except TIMP1( 1.092 ± 0.053 vs 1.081 ± 0.033, P = 0.32 ), the gene expression level in serum of the patients with ACL lesions was significantly elevated compared with that of the patients without ACL lesions: MMP1 1.163 ± 0.030 vs 0.948 ± 0.049; MMP2 0.918 ± 0.056 vs 0.827 ± 0.049; MMP8 1.172 ± 0.029 vs 0.783 ± 0.034; MMP9 1.304 ± 0.059 vs 0.94 ± 0.04; MMP13 1.155 ± 0.060 vs 0.824 ± 0.043; MMP14 1.095 ± 0.058 vs 0.759 ± 0.033; Agg1 1.270 ± 0.077 vs 0.676 ± 0.038; Agg2 1.244 ± 0.037 vs 0.871 ± 0.037; IL1 1.128 ± 0.056 vs 0.912 ± 0.045; TNFα 1.018 ± 0.076 vs 0.724 ± 0.047; TIMP1 1.092 ± 0.053 vs 1.081 ± 0.033; TIMP2 0.906 ± 0.056 vs 0.875 ± 0.049 ( P < 0.05 ).All of the gene expressions were correlated in the serum and synovium ( Agg1: r = 0.89, MMP1: r = 0.88, MMP2: r = 0.87, P < 0.001 ).Conclusions An ACL lesion provokes elevation in the gene expression of proteases, while the influence of other lesions remains elusive.Gene expression in the synovium is correlated with that in the peripheral blood.
Osteoarthritis, knee; Hyaline cartilage; Metalloendopeptidases; Anterior cruciate ligament; Menisci, tibial
10.3969/j.issn.2095-252X.2016.12.008
R684.7, Q344
710004 西安交通大学附属第二医院骨科 ( 薛建利 );712000 陕西省核工业 215 医院骨科 ( 崔威 )
崔威,Email: cuiwei 197502@126.com
2016-02-24 )

