超临界萃取制备亚麻籽油并用尿素包合提纯α-亚麻酸的工艺研究
张 楠 林 文 戴 琳 蒋璧蔚 程 月 王志祥
(中国药科大学制药工程教研室,南京 210009)
超临界萃取制备亚麻籽油并用尿素包合提纯α-亚麻酸的工艺研究
张 楠 林 文 戴 琳 蒋璧蔚 程 月 王志祥
(中国药科大学制药工程教研室,南京 210009)
联合超临界CO2萃取(SFE- CO2)与尿素包合法提纯亚麻籽中的α-亚麻酸。首先采用响应曲面法中的中心复合试验设计(CCD)对SFE- CO2萃取亚麻籽中α-亚麻酸的工艺条件进行优化,然后通过单因素试验确定尿素包合法的优选工艺。结果表明,SFE- CO2萃取的最佳工艺条件为萃取压力30 MPa、萃取温度35 ℃、萃取时间80 min,在此条件下α-亚麻酸得率可达13.26%。尿素包合法的优选工艺条件为结晶温度0 ℃、结晶时间3 h、脂肪酸∶尿素∶乙醇=1∶3∶12(m∶m∶V),经1次包合后产品纯度可达78.03%,得率为30.53%。
α-亚麻酸 超临界CO2萃取 响应曲面法 尿素包合 亚麻籽
α-亚麻酸为ω-3系多不饱和脂肪酸,在体内可代谢为DHA和EPA[1]。作为一种人体必需的脂肪酸,α-亚麻酸具有抗氧化、抗炎、预防心脑血管疾病、治疗糖尿病、保护视力及提高记忆力等多种生理作用[2-7],广泛用于医药、食品、化妆品等领域。目前α-亚麻酸尚不能人工合成,主要依靠从自然资源中分离获得。
α-亚麻酸主要存在于核桃、亚麻籽、紫苏籽等植物资源中,从中提纯α-亚麻酸的方法主要有尿素包合法、低温结晶法、分子蒸馏法和超临界CO2萃取法(SFE-CO2)等。尿素包合法主要依据长链脂肪酸的不饱和度进行分离,分离效果好,设备简单、操作方便,适合工业化生产。低温结晶法利用原料组分的溶解度差异进行分离,此法低温操作,可有效保护物质的稳定,但有机溶剂用量大,存在溶剂残留等安全隐患。分子蒸馏技术具有条件温和、无需溶剂等优点,但对设备要求较高,不适合工业生产。SFE-CO2法的得油率(35.3%)远高于传统的压榨法(25.5%),尤其对多不饱和脂肪酸的选择性较高[8-9],且油脂品质好,无溶剂残留,但此法仅适用于亚麻酸的初步提取,产品纯度不高。上述几种提纯方法各有优势,本研究利用各方法的优点,拟将SFE-CO2和尿素包合2种技术结合起来,用于亚麻籽中α-亚麻酸的提纯。
SFE- CO2可分离碳链长度差异较大的脂肪酸,却无法分离碳数相近的脂肪酸,而尿素包合法可将碳数相近、饱和度不同的游离脂肪酸分开。基于两者完全不同的分离机理,本研究将2种方法联用以分离不同类型的杂质,首先采用SFE-CO2技术在不添加有机溶剂的条件下萃取亚麻籽,得到多不饱和脂肪酸含量较高、油品较好的亚麻籽油,然后用尿素包合技术将亚麻籽油中的饱和脂肪酸和单不饱和脂肪酸结晶分离,进一步提高产品中α-亚麻酸的纯度。
1 材料与方法
1.1 材料与试剂
亚麻籽:深圳市瑞利来实业有限公司。
分析纯石油醚(沸程60~90 ℃)、苯、甲醇、氢氧化钾、氯化钠:南京化学试剂有限公司;CO2气体(纯度≥99.9%):南京天泽气体有限公司;硬脂酸甲酯、棕榈酸甲酯、油酸甲酯、亚油酸甲酯、α-亚麻酸甲酯:阿拉丁试剂有限公司。
1.2 仪器与设备
7071 SFE-CO2装置:美国AppLied Separation公司;GC-2010岛津气相色谱仪:日本岛津制作所;GZX-9070 MBE电热恒温鼓风干燥箱:上海博迅实业有限公司医疗设备厂;BT25S分析天平:北京赛多利斯仪器系统有限公司;JY1002电子天平:上海精密科学仪器有限公司;FW100高速万能粉碎机:天津市泰斯特仪器有限公司。
1.3 试验部分
1.3.1 试验流程
亚麻籽→粉碎→SFE-CO2→制备游离脂肪酸→尿素包合
将亚麻籽粉碎后用SFE- CO2得亚麻籽油,亚麻籽油中的脂肪酸均以甘油酯的形式存在,分子体积较大,无法进入尿素晶体。因此,在尿素包合之前需将脂肪酸甘油酯制成游离脂肪酸,再进行包合、分离、提纯。
1.3.2 试验方法
粉碎:取适量亚麻籽放入粉碎机中粉碎至无完整亚麻籽颗粒,过筛取40~60目粉末备用。
SFE- CO2:准确称取6g亚麻籽粉末装入萃取柱,待萃取温度达到设定值后,打开CO2进口阀,逐渐升压至设定的萃取压力,稳定后,打开出口阀,调节CO2流量至指定值,收集产品并开始计时。在单因素预试验的基础上,以萃取温度、萃取压力、萃取时间为自变量,以α-亚麻酸得率为响应值,采用响应面法中心复合旋转设计(CCD)试验方案,并用软件Design Expert 对试验结果进行分析优化,得出SFE- CO2亚麻籽中α-亚麻酸的最佳工艺参数。
混合游离脂肪酸的制备:天然α-亚麻酸均以甘油酯的形式存在,可利用皂化反应,将甘油酯在碱性条件下水解成甘油和α-亚麻酸盐,再加入适量酸便可将α-亚麻酸游离出来。具体操作为称取一定量超临界萃取所得的亚麻籽油,溶于1 mol/L氢氧化钠-乙醇溶液,于70 ℃搅拌回流1 h得皂化物,减压浓缩回收乙醇。加入适量的水使皂溶解,用10% HCl溶液调pH至2~3,加石油醚萃取3次,去水层,将有机层水洗至中性,加无水硫酸钠干燥,抽滤,用旋转蒸发器回收溶剂,得混合游离脂肪酸。
尿素包合:在混合游离脂肪酸中按一定比例加入尿素和乙醇,在70 ℃水浴中搅拌回流直至澄清,室温冷却后放入低温环境,冷冻结晶一段时间,抽滤,滤液真空浓缩回收乙醇,浓缩物加入适量蒸馏水转移到分液漏斗中,用10% HCl溶液调pH至2~3,加入适量的石油醚萃取3次,合并有机相,用蒸馏水反复冲洗,无水硫酸钠干燥,抽滤,滤液旋转蒸发回收溶剂,即得产物[10]。
对比试验(有机溶剂提取):称取15 g亚麻籽粉末放入250 mL圆底烧瓶中,加入70 mL石油醚,80 ℃水浴中回流搅拌6 h,抽滤,除溶剂,称重,即得有机溶剂提取的亚麻籽油。重复3次。
1.3.3 分析方法
油脂中甘油酯的衍生化:精密称取SFE- CO2得到的亚麻籽油80 mg左右,记录质量,放入20 mL具塞试管中,加入2 mL苯和石油醚(1:1)混合溶剂,震摇使油全部溶解,然后加入2 mL 0.4 mol/mL的氢氧化钾-甲醇溶液,室温反应30 min[11]。加入10 mL饱和氯化钠溶液,剧烈震摇,静置分层后,取上清液适当稀释,用GC测定样品中α-亚麻酸含量。
游离脂肪酸的衍生化:根据孙兰萍等[12]的描述方法进行改进。取尿素包合后的混合游离脂肪酸80 mg左右,放入20 mL具塞试管中,加入2 mL 0.4 mol/mL的氢氧化钾-甲醇溶液,室温反应30 min,再加入2 mL石油醚萃取,其他操作与上述油脂甲酯化操作同。
气相色谱条件:色谱柱:Rtx-Wax 毛细管柱(30 m×0.32 mm×0.25 μm);检测器:氢火焰检测器(FID);载气:氮气;氢气流速:40 mL/min;空气流速:400 mL/min;汽化室温度:240 ℃;柱温:起始温度190 ℃,保持14.5 min,然后以5 ℃/min升温到210 ℃,保持3 min;检测器温度:250 ℃;分流比:20∶1;进样量:1 μL。采用面积归一化法对α-亚麻酸进行定量。α-亚麻酸得率的计算公式如下:
α-亚麻酸得率=

式中:产品质量为经SFE-CO2得到的亚麻籽油的质量。
2 结果与讨论
在SFE-CO2的单因素预试验部分首先进行了夹带剂的选择,发现分别以乙醇、正己烷、乙酸乙酯、丙酮为夹带剂的萃取结果与不使用夹带剂无显著差异,因此在不使用夹带剂的情况下考察了装样量、萃取温度、萃取压力及萃取时间对萃取效果的影响,结果表明萃取温度、萃取压力和萃取时间对α-亚麻酸得率的影响较大,因此在进行响应曲面设计时,以α-亚麻酸得率为考察指标,仅考虑萃取温度、压力及时间对其的影响。
2.1 响应面试验设计
结合单因素试验结果,选择CO2流量为1.5 L/min,以萃取温度、萃取压力和萃取时间为考察因素,以α-亚麻酸得率为考察指标,进行CCD实验设计,各因素的水平编码见表1,试验方案及结果见表2。

表1 中心复合设计因素水平表
注:()内为实际操作值。

表2 中心复合设计试验方案及结果
经SFE-CO2得到的亚麻籽油中,α-亚麻酸含量基本稳定,α-亚麻酸得率的变化主要是受产品质量的影响。
利用Design Expert软件,对表2的试验数据进行多元回归拟合,获得α-亚麻酸得率对编码自变量萃取温度、萃取压力和萃取时间的回归方程为:
R=9.34-0.65A+1.59B+1.81C-0.43AB-0.50AC+1.05BC-0.41A2-1.19B2-0.68C2
回归模型的方差分析见表3,模型的P<0.000 1,表明该二次多元回归模型极其显著;失拟项P=0.093 4>0.05不显著,说明该模型未考虑到的因素对模型的影响不显著,可以用此模型对亚麻籽中α-亚麻酸的萃取效果进行分析和预测。
通过Design Expert软件求解回归方程,得出最佳萃取工艺条件为萃取温度35 ℃,压力30 MPa,时间80 min ,α-亚麻酸得率的预测值为13.08%。在预测的条件下进行3次平行试验,α-亚麻酸的平均得率为13.26%,与预测值相对误差为1.37%,表明采用响应面法优化得到的萃取工艺稳定可行。

表3 响应面回归模型方差分析
注:***为差异极显著(P<0.000 1);**为差异高度显著(P<0.01);*为差异显著(P<0.05)。
将SFE- CO2法萃取亚麻籽的最优条件下得到的亚麻籽油进行成分分析,并与传统溶剂提取法相比,结果见表4。与溶剂提取法相比,超临界萃取法的α-亚麻酸得率较低,但其产品中的α-亚麻酸含量较高(55.11% vs 50.35%),说明SFE-CO2法的对α-亚麻酸的选择性更高,这与Rabie等[8]和Pradhan等[9]的报道一致。同时,SFE-CO2法用时更短、不需夹带剂、无溶剂残留的风险,是一种优于传统溶剂萃取法的绿色环保的萃取技术。

表4 超临界萃取与有机溶剂法对比
2.2 尿素包合试验
取SFE-CO2法所得的亚麻籽油制备成游离脂肪酸,然后进行尿素包合试验,以进一步提高α-亚麻酸的的纯度。
2.2.1 游离脂肪酸尿素比(m/m)对尿素包合的影响
在尿素与无水乙醇比为1∶4(m/V),结晶温度0 ℃,包合18 h的条件下考察脂肪酸和尿素的比值对包合效果的影响,结果如图1所示。
由图1可知,随着尿素用量的增加,α-亚麻酸含量先升高后降低,游离脂肪酸尿素比在1∶3~4时,产物中α-亚麻酸含量较稳定。这是因为当尿素加入比例小时,其在乙醇溶液中形成的包合物框架较少,随着尿素比例增加,溶解在乙醇溶液中的尿素框架增多,更多的饱和脂肪酸和低不饱和脂肪酸被包合,形成稳定的包合物析出,从而提高了α-亚麻酸的含量。继续增加尿素用量,会使尿素在溶剂中溶解不充分,包合效果下降。α-亚麻酸得率随着尿素用量的增加而降低,主要是尿素结晶析出时,α-亚麻酸在其表面黏附造成损失,尿素用量越大,损失越多。因此综合考虑纯度与得率的问题,脂肪酸尿素比控制在1∶2~3左右为宜。

图1 脂肪酸与尿素比对α-亚麻酸纯度和得率的影响
2.2.2 尿素乙醇比(m/V)对尿素包合的影响
在脂肪酸与尿素比为1∶3(m/m),结晶温度0 ℃,包合18 h的条件下考察尿素和乙醇的比值对包合效果的影响,结果如图2所示。

图2 尿素与乙醇比对α-亚麻酸纯度和得率的影响
由图2可知,随着乙醇量的增加,α-亚麻酸纯度先增高,在m(尿素)∶V(乙醇)=1∶4时达到最高后下降,而收率逐渐增加。这是因为,当乙醇用量较少时,尿素无法充分溶解、溶液较稠,分子运动阻力增大,包合反应不充分,使α-亚麻酸纯度较低,且α-亚麻酸在尿素晶体表面黏附造成导致收率较低。随着乙醇增加,纯度有所提高,但达到6倍量后,纯度明显降低是因为,尿素在乙醇溶液中达不到饱和,部分饱和脂肪酸和单不饱和脂肪酸仍留在溶剂中,使得纯度降低,但收率提高。因此综合考虑纯度与得率,尿素:乙醇的值控制在1∶(4~5)较为适合。
2.2.3 包合温度对尿素包合的影响
在脂肪酸∶尿素∶乙醇=1∶3∶12(m∶m∶V),包合18 h的条件下考察包合温度对包合效果的影响,结果如图3所示。

图3 包合温度对α-亚麻酸纯度和收率的影响
如图3可知,α-亚麻酸纯度随温度降低而升高,0 ℃以下基本保持稳定,收率随温度的升高而升高。这是因为,包合为放热过程,温度降低,有利于尿素络合物形成,分离效果明显,α-亚麻酸纯度较高,当温度在0 ℃以上,尿素晶体形成较慢,且不稳定,使部分饱和脂肪酸和单不饱和脂肪酸无法被包合,包合结晶减少,使得纯度下降,收率提高。综合考虑纯度与收率,包合温度控制在-10~10 ℃较为适合。
2.2.4 包合时间对尿素包合的影响
在脂肪酸∶尿素∶乙醇=1∶3∶12(m∶m∶V),结晶温度0 ℃条件下考察包合时间对包合效果的影响,结果如图4所示。由图4可知,0~1 h内,α-亚麻酸含量显著提高;1~7 h内,α-亚麻酸含量基本趋于稳定;包合18 h,α-亚麻酸含量仅有小幅提高。这一现象说明,1~7 h内包合反应已比较充分,物系基本处于平衡状态,与大部分文献报道选择包合时间在12~18 h相比[13],大大缩短了包合结晶时间,而纯化效果与18 h的结果对比,并无明显偏低,因此综合考虑纯度、得率和生产效率,选择包合时间为1~3 h。

图4 包合时间对α-亚麻酸纯度和得率的影响
2.2.5 包合次数对尿素包合的影响
在脂肪酸∶尿素∶无水乙醇=1∶3∶12(m∶m∶V),结晶温度0 ℃包合3 h的条件下考察包合次数对包合效果的影响,结果如图5所示。由图5可知,经尿素2次包合纯化后,α-亚麻酸含量稍有提高,但得率大大下降。这是因为亚麻籽油中含有亚油酸,它的2个不饱和双键使分子具有一定的空间构型,不易被尿素包合。综合考虑纯度和得率,选择1次包合较合理。
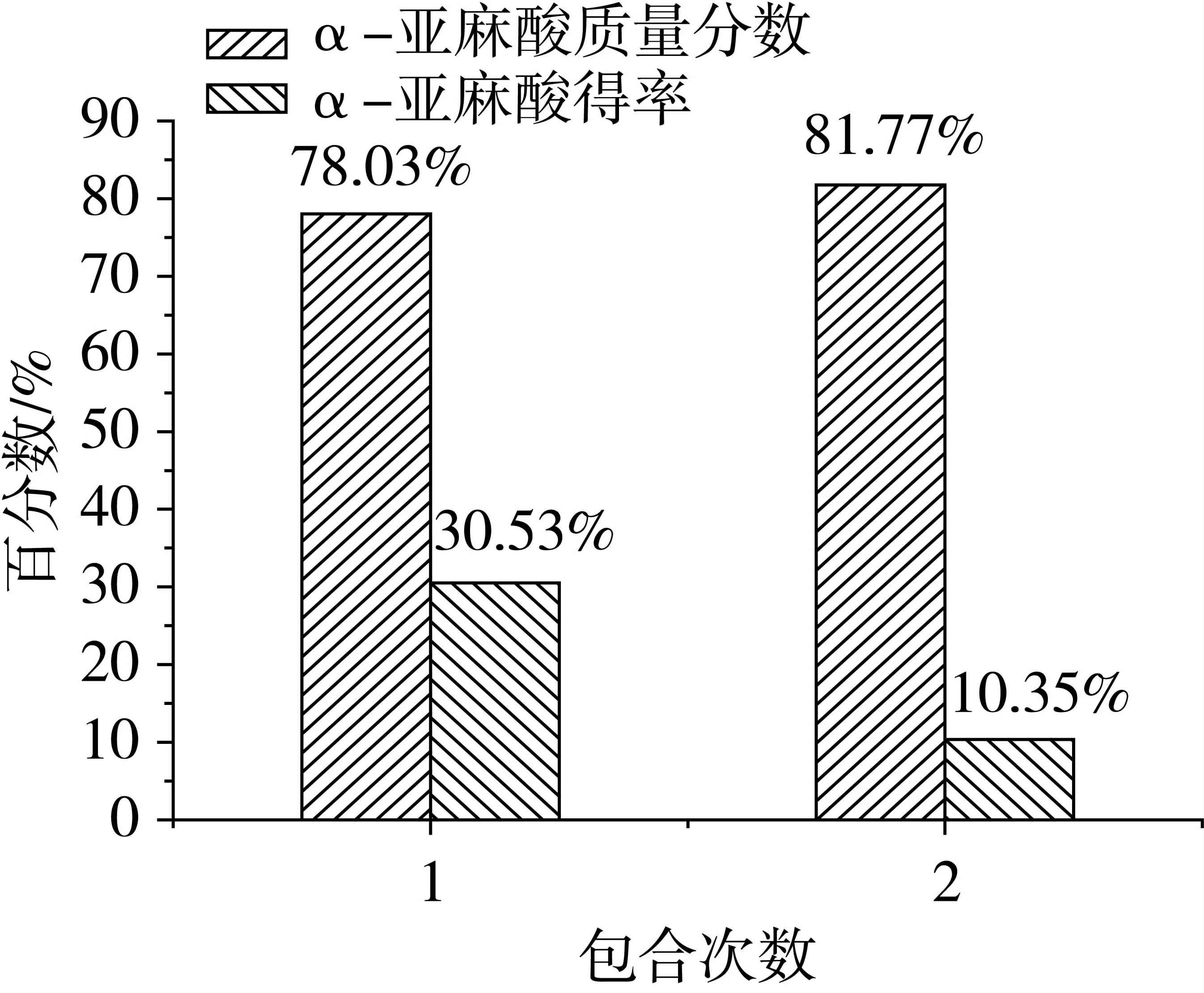
图5 包合次数对α-亚麻酸纯度和得率的影响
3 结论
3.1 SFE- CO2步骤最佳萃取条件为萃取压力30 MPa、温度35 ℃、时间80 min,此条件下α-亚麻酸得率可达13.26%,与响应曲面模型预测值相一致。
3.2 与溶剂提取法相比,SFE-CO2法所得的亚麻籽油中α-亚麻酸质量分数较高(55.11% vs 50.35%),说明SFE-CO2法的对α-亚麻酸的选择性高。
3.3 尿素包合步骤的较佳工艺条件为结晶温度0 ℃、结晶时间3 h、脂肪酸∶尿素∶乙醇=1∶3∶12(m∶m∶V),经1次包合,纯度可达78.03%,得率为30.53%。相比于文献报道的结晶时间为12~18 h,大大缩短了结晶时间,而纯化效果无显著差异[13]。
3.4 将2种提取分离技术联合使用,从亚麻籽中提取α-亚麻酸的工艺研究鲜有报道,研究结果可为提纯α-亚麻酸的工艺改进提供了一定的参考。
[1]Shark A H, Crawford M A, Reifen R. Update on alpha-linelic acid[J]. Nutrition Reviews, 2008, 66(6): 326-332
[2] Xie Nianlin, Zhang Wei, Li Jia et al. α - Linolenic acid intake attenuates myocardial ischemia/reperfusion injury through anti-inflammatory and anti-oxidative stress effects in diabetic but not normal rats [J] . Archives of Medical Research , 2011,42 (3):171-181
[3]Shen Junhui, Ma Qi, Shen Shengrong,et al. Effect of α-linolenic acid on streptozotocin-induced diabetic retinopathy indices in vivo [J]. Archives of Medical Research, 2013, 44(7): 514-520
[4]He Fuli, Daniel S Lupu, Mihai D Niculescu. Perinatal α-linolenic acid availability alters the expression of genes related to memory and to epigenetic machinery, and the Mecp2 DNA methylation in the whole brain of mouse offspring[J]. International Journal of Developmental Neuroscience, 2014,36:38-44
[5]Poudyal Hemant, Panchal Sunil K , Waanders Jennifer, et al. Lipid redistribution by α - linolenic acid-rich chia seed inhibits stearoyl-CoA desaturase-1 and induces cardiac and hepatic protection in diet-induced obese rats [J]. The Journal of Nutritional Biochemistry, 2012 , 23 ( 2 ) : 153-162
[6]Dirk Steinritz , Annette Schmidt, Thilo Simons, et al. Chlorambucil (nitrogen mustard) induced impairment of early vascular endothelial cell migration-effects of α-linolenic acid and N-acetylcysteine[J]. Chemico-Biological Interactions, 2014(5):15
[7]Maree T Brinkman, Margaret R Karagas, Michael Scott Zens, et al. Minerals and vitamins and the risk of bladder cancer : results from the New Hampshire Study [J] . Cancer Causes and Control , 2010, 21(4) : 609-619
[8]Khattab R Y, Zeitoun M A. Quality evaluation of flaxseed oil obtained by different extraction techniques[J]. LWT-Food Science and Technology, 2013, 53(1): 338-345
[9]Pradhan R C, Meda V, Rout P K, et al. Supercritical CO2extraction of fatty oil from flaxseed and comparison with screw press expression and solvent extraction processes[J]. Journal of Food Engineering, 2010, 98(4): 393-397
[10]吕秋楠,史高峰,陈学福等.尿素包合法纯化蚕蛹油中α-亚麻酸工艺研究[J].中国油脂,2009,34(8):32-35
[11]寇秀颖,于国萍. 脂肪和游离脂肪酸甲酯化方法的研究 [J].食品研究与开发 ,2005(4),26(2):46-47
[12]孙兰萍,许晖,马龙等.尿素包合法富集纯化杜仲籽油α-亚麻酸的工艺优化[J].食品工业科技,2013,34(11):218-222
[13]周瑞,王晓宇,李道明等. α-亚麻酸不同富集纯化方法的比较[J].中国油脂,2013,38(2):77-80.
Research on Supercritical Extraction Combined with Urea Adduction Fractionation Purify α-Linolenic Acid from Flaxseed
Zhang Nan Lin Wen Dai Lin Jiang Biwei Cheng Yue Wang Zhixiang
(China Pharmaceutical University, Pharmaceutical Engineering Teaching and Research Section, Nanjing 210009)
A-linolenic acid was extracted and purified from flaxseed by combining supercritical CO2extraction and urea adduction fractionation. First, central composite design (CCD) of response surface methodology (RSM) was applied to optimize process conditions of supercritical CO2extraction of α-linolenic from flaxseed, and then the single-factor experiments were applied to determine the process conditions of urea adduction fractionation. The results showed that the optimal supercritical CO2extraction conditions were pressure 30 MPa, temperature 35 ℃, time 80 min. Under which, α-linolenic acid yield reached to 13.26%. The optimal urea adduction fractionation conditions were temperature 0 ℃, time 3 h, fatty acid∶urea∶alcohol=1∶3∶12 (m∶m∶V), the content and yield of α-linolenic acid was up to 78.03% and 30.53% respectively by once clathration.
α-linolenic acid, supercritical CO2extraction, response surface methodology, urea adduction fractionation, flaxseed
TQ463
A
1003-0174(2016)02-0038-06
中央高校基本科研业务费专项基金(JKQZ2013003)
2014-07-03
张楠,女,1989年出生,硕士,制药分离工程
戴琳,男,1981年出生,硕士,讲师,高等制药分离工程

