甲壳类水产品中呋喃西林代谢物氨基脲的本底调查及来源分析
王鼎南,周凡,李诗言,徐卫国,王扬
(1.浙江省水产技术推广总站, 浙江 杭州 310023;2.嘉兴市水产技术推广站, 浙江 嘉兴 314050)
甲壳类水产品中呋喃西林代谢物氨基脲的本底调查及来源分析
王鼎南1*,周凡1,李诗言1,徐卫国2,王扬1
(1.浙江省水产技术推广总站, 浙江 杭州 310023;2.嘉兴市水产技术推广站, 浙江 嘉兴 314050)
通过对常见甲壳类水产品中呋喃西林代谢物氨基脲本底含量的调查及来源分析,为水产品质量安全监管提供依据。本研究运用液相色谱-串联质谱法,对常见的4种甲壳类水产品中本底氨基脲的含量进行测定。结果表明,在4种甲壳类水产品中,日本沼虾和罗氏沼虾中氨基脲检出率达100%,日本沼虾中氨基脲平均检出值为6.92 μg/kg,罗氏沼虾中氨基脲平均检出值为2.52 μg/kg,均超过现行残留限量,而凡纳滨对虾和中华绒螯蟹中的氨基脲含量较低。本研究的结果为甲壳类水产品中氨基脲残留限量的制定提供了数据支持。[中国渔业质量与标准,2016, 6(6):6-11]
甲壳类水产品;氨基脲;本底调查;来源分析;呋喃西林;日本沼虾;罗氏沼虾
呋喃西林(nitrofurazone, NFZ)是美国Eaton研究所在20世纪50年代开发的一种人工合成抗菌药,它能通过干扰细菌的糖代谢过程和氧化酶系统发挥抑菌或杀菌作用。因其具有杀菌能力强、抗菌谱广、价格低廉等特点而广泛应用于畜牧业[1],后又被引入水产养殖中。呋喃西林原药在动物体内代谢较快,半衰期仅为几个小时,导致原药本身在动物体内难以被检测[2]。而呋喃西林在动物体内的典型代谢物——氨基脲(semicarbazide, SEM),在食源性产品中的含量与呋喃西林在动物源中添加的量成线性正比,且能与蛋白结合生成稳定的残留物,因此美国、欧盟等国家以及中国均以氨基脲为呋喃西林药物代谢的标识物而进行检测和监控[3]。由于呋喃西林及其代谢物对人体具有致畸、致癌作用,而在动物源性食品中的残留可以通过食物链传递给人类,长期摄入会引起人体的各种疾病,因此美国、欧盟等国家已明文规定禁止在食品工业中使用该类药物,中国也将呋喃西林列为禁用药[4],并规定呋喃西林及其代谢物在动物源性食品中不得检出[5]。历年来,由于不同检测方法和仪器对于氨基脲的检出限存在差异,故农业部在下达监督抽查任务时,在《关于开展2016年国家产地水产品质量安全监督抽查工作的通知》(农渔发〔2016〕6号)中,将氨基脲的残留限量值定为1.0 μg/kg。
近些年来,在对浙江省水产品监督抽查过程中,
甲壳类水产品中检出氨基脲的情况较为普遍,而据养殖户反映,在养殖过程并未使用呋喃西林药物。目前,国内外均有文献指出氨基脲作为内源性物质存在于甲壳类水产品中。王群等[6]对硝基呋喃类在甲壳类动物中的代谢规律进行研究后,认为虽然氨基脲在甲壳类动物中的阳性检出率较高,但是是动物本身产生的,并不是违规用药的结果。Poucke等[7]通过研究发现,罗氏沼虾、凡纳滨对虾、斑节对虾挪威海鳌虾、锯缘青蟹和远海梭子蟹等甲壳中氨基脲本底含量为1.5~12.6 μg/kg,在肌肉中的含量低于0.5 μg/kg。McCracken等[8]在孟加拉国虾的研究中发现,孟加拉国虾的肌肉及外壳中含有氨基脲,且外壳中的氨基脲含量要高于肌肉。于慧娟等[9]对青虾、青蟹等多种甲壳类水产品中氨基脲的含量进行了系统性的测定,发现虾类样品中氨基脲含量在未检出~370.4 μg/kg之间,蟹类样品中氨基脲含量在未检出~87.5 μg/kg之间,且甲壳中含量最高,肌肉中含量最低。基于上述研究,本研究针对凡纳滨对虾(Penaeusvannamei)、罗氏沼虾(Macrobrachiumrosenbergiideman)、日本沼虾(Macrobrachiumnipponense)和中华绒螯蟹(Eriocheirsinensis)这4类甲壳类水产品进行了氨基脲的本底含量调查及来源分析,以期为甲壳类水产品中氨基脲残留限量的制定提供数据支持,并为水产品质量安全监督提供科学依据。
1 材料及方法
1.1 样品采集
综合考虑甲壳类水产品产量、居民日常食用习惯及市场消费情况等因素,本研究选择了4种常见的甲壳类水产品,包括凡纳滨对虾、罗氏沼虾、日本沼虾和中华绒螯蟹。为保证样品结果的真实性,从浙江省杭州、台州、温州、舟山等地市的超市、农贸市场和养殖场,随机抽取样品,每批次样品不少于500 g,共抽取凡纳滨对虾60批次(体长50~80 mm),罗氏沼虾20批次(体长50~100 mm),日本沼虾20批次(体长40~60 mm),中华绒螯蟹20批次(体重150~200 g)。样品采集方法依照SC/T 3016—2004《水产品抽样方法》规定执行,样品采集后,去除样品的甲壳,只保留肌肉部分,装入洁净的聚乙烯塑料袋中,在采集当天用冰箱运回实验室,存放于-20 ℃冷冻保存待用。
1.2 化学试剂
乙酸乙酯、二甲亚砜、甲醇、乙腈均为色谱纯(美国天地有限公司);2-硝基苯甲醛,纯度为99%(上海麦克林生化科技有限公司);磷酸氢二钾、盐酸为分析纯(国药集团化学试剂有限公司);氢氧化钠为优级纯(国药集团化学试剂有限公司)。
呋喃西林代谢物标准品,纯度99.5%(德国Dr.Ehrenstorfer公司);氘代呋喃西林代谢物标准品,纯度为99.9%(德国Dr.Ehrenstorfer公司)。
1.3 仪器设备
API4000Q-TRAP 三重四级杆质谱仪(美国AB公司),配备电喷雾离子源(ESI);1200液相色谱系统(美国Agilent公司);MILLI-Q A10超纯水系统(美国Millipore公司);Mettler Toledo PL203电子天平(瑞士Mettler公司);往返式水浴恒温摇床(上海智诚分析仪器制造有限公司)。
1.4 检测方法
1.4.1 样品预处理
依据农业部783号公告-1-2006《水产品中硝基呋喃类代谢物残留量的测定 液相色谱串联质谱法》对待测样品预处理:称取待测样品2.00 g(精确到0.01g)于50 mL离心管中,加入150 μL质量浓度为1 000 ng/mL内标溶液,再加入800 μL质量浓度为8 g/L 2-硝基苯甲醛溶液和20 mL浓度为0.2 mol/L 盐酸溶液,涡旋混合15秒,置于37 ℃往返式水浴恒温摇床上振荡16 h。取出样品后,加入300 μL质量浓度为103 g/L磷酸氢二钾溶液,再用质量浓度为40 g/L的氢氧化钠溶液将pH调节至7.0~7.5。再加入6 mL乙酸乙酯,涡旋混合15秒,5 000 r/min离心6 min,取上清液至10 mL离心管中,重复以上操作,合并上清液,在38 ℃水浴下氮气吹干,加入1.0 mL流动相(乙腈-0.2%乙酸水溶液,15 ∶85,V/V)和3 mL正己烷,涡旋混合15 s,3 000 r/min离心3 min,取下清液过0.22 μm有机滤膜到样品瓶中,供液相色谱串联质谱仪测定。后续实验中用于测定的虾壳样品,预处理方法同上述方法。
1.4.2 色谱-质谱联用条件
Agilent Eclipse XDB-C18色谱柱(2.1 mm×150 mm, 5 μm);柱温为35 ℃;进样量为20 μL;流动相:A为0.2%乙酸溶液,B为乙腈;梯度洗脱条件:0~1 min,30% A;1.1~3 min,80% A;3.1~6.5 min,95% A;6.6~12 min,30% A。
采用电喷雾离子源(ESI),正离子扫描,选择反应监测(SRM);电喷雾电压为5 500 V;去簇电压为55 V;碰撞室出口电压为25 V;气化温度为525 ℃。氨基脲和同位素内标物的母离子、子离子及碰撞能量见表1。
表1 氨基脲和同位素内标物的母离子和子离子及碰撞能量
Tab.1 Parent/Daughter ions and collision energy for semicarbazide and internal standard

化合物Compounds母离子Parention(m/z)子离子Daughterion(m/z)碰撞能量/eVCollisionenergySEM209.0166.0*11192.013SEM-13C-15N2212.0168.0*11
注:*示定量离子。
1.4.3 方法检出限和质量控制
为保证实验数据的准确性,本实验通过在阴性样品中加标的方式进行质量控制,标准曲线和质控样品与待测样品进行相同预处理。质控样品加标浓度为2.50 μg/kg,实际测定值为2.37 μg/kg,回收率为94.8%。经阴性样品加标确定实际方法检出限为0.25 μg/kg(S/N>3),定量限为0.50 μg/kg(S/N>10)。
1.5 来源分析
为证实氨基脲的来源,并分析氨基脲的含量是否与甲壳类生物的生长周期有关,本研究在嘉兴某固定养殖塘内养殖日本沼虾,在不使用任何药物养殖的前提下,从7月到12月,每月定期在该固定养殖塘内抽样:随机捕获10只日本沼虾,分离其肌肉和外壳,并将肌肉和外壳分别混合匀浆,制得该月的肌肉样本和外壳样本,然后再测定样本中的氨基脲含量。
1.6 数据统计及分析
数据整理汇总后,用Excel软件和SAS软件对相关参数进行计算。
2 结果与分析
2.1 检出率和平均值
由表2可见,本次调查的4种甲壳类水产品中,
所有日本沼虾和罗氏沼虾中都有检出氨基脲。日本沼虾中氨基脲含量的平均值为6.92 μg/kg,罗氏沼虾中氨基脲含量的平均值为2.52 μg/kg,均超过现行氨基脲残留限量(1.0 μg/kg)。51.7%凡纳滨对虾中有检出氨基脲,氨基脲含量的平均值为0.780 μg/kg,低于残留限量。80.0%中华绒螯蟹中有检出氨基脲,氨基脲含量的平均值为0.597 μg/kg,也低于残留限量。
2.2 检出值分布规律
本实验对各品种甲壳类水产品在不同检出值范围中的样本个数进行统计,并计算其占样本总数的百分比。4种甲壳类水产品中氨基脲检出值的分布情况见图1。
表2 不同品种甲壳类水产品中的氨基脲含量
Tab. 2 The content of semicarbazide in different kinds of shellfish
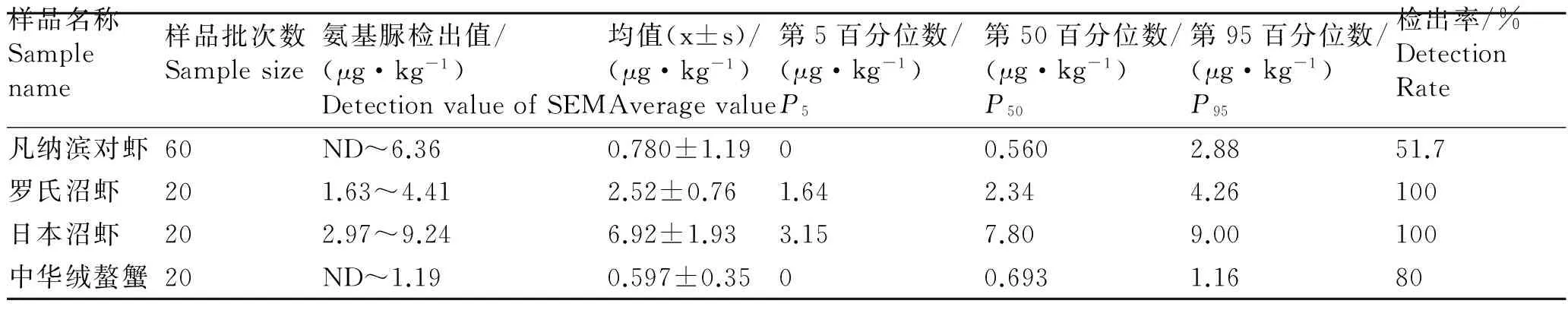
样品名称Samplename样品批次数Samplesize氨基脲检出值/(μg·kg-1)DetectionvalueofSEM均值(x±s)/(μg·kg-1)Averagevalue第5百分位数/(μg·kg-1)P5第50百分位数/(μg·kg-1)P50第95百分位数/(μg·kg-1)P95检出率/%DetectionRate凡纳滨对虾60ND~6.360.780±1.1900.5602.8851.7罗氏沼虾201.63~4.412.52±0.761.642.344.26100日本沼虾202.97~9.246.92±1.933.157.809.00100中华绒螯蟹20ND~1.190.597±0.3500.6931.1680
注:ND表示检出值小于0.5 μg/kg。
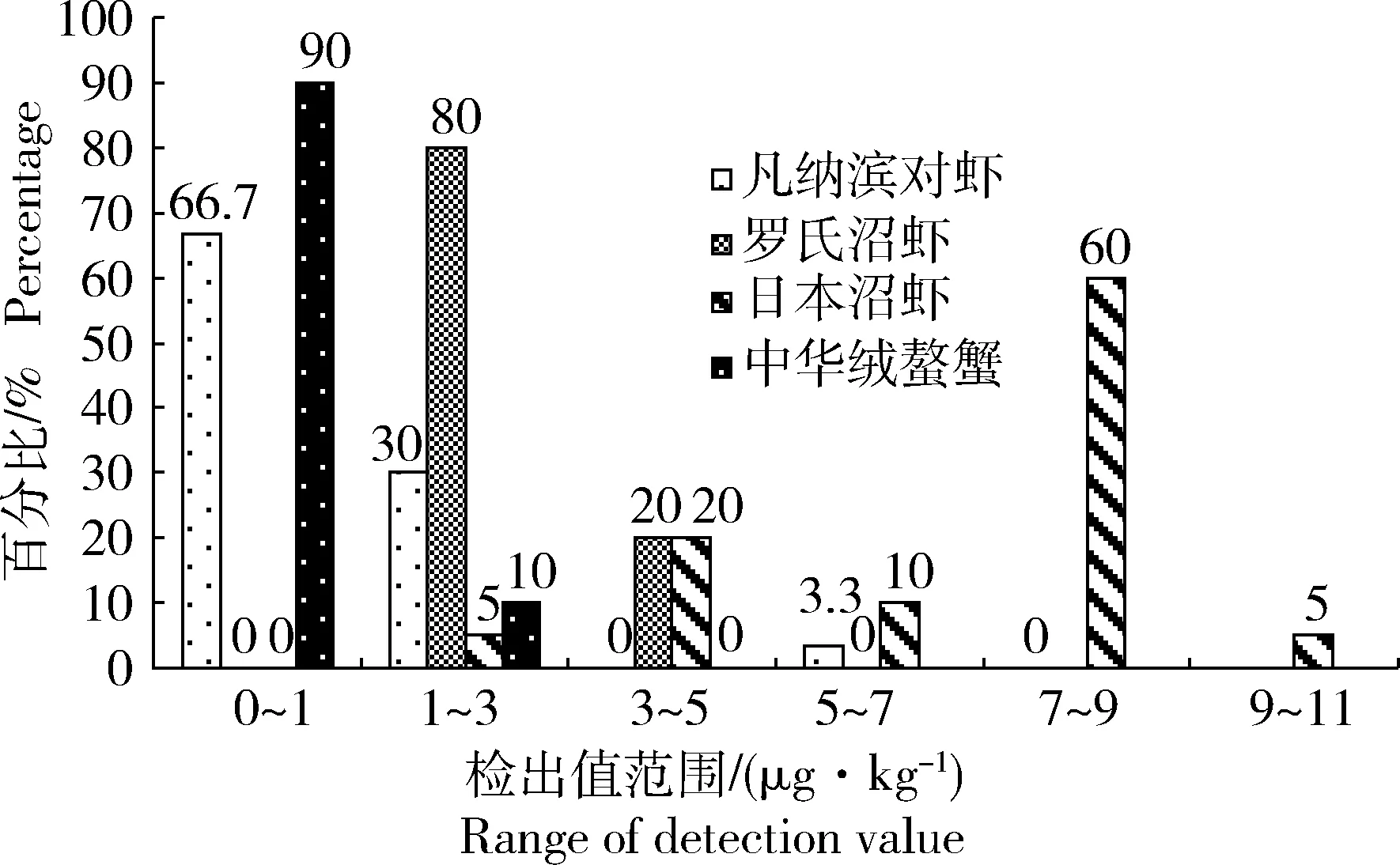
图1 氨基脲检出值分布情况Fig. 1 The distribution of the detection value of semicarbazide
由图1可见,凡纳滨对虾中氨基脲的检出值主要集中于0~1 μg/kg,其中未检出29批次,检出值在0.5~1 μg/kg的有11批次,共40批次,占样本总数的66.7%。另外检出值在1~3 μg/kg的有18批次,占样本总数的30%。经计算得95%置信区间为0.470~1.09 μg/kg。大部分凡纳滨对虾氨基脲检出值能符合现行残留限量。
罗氏沼虾中氨基脲的检出值主要集中于1~3 μg/kg,其中检出值在1~2 μg/kg有4批次,检出值在2~3 μg/kg有12批次,共16批次,占样本总数的80%。另有4批次样品检出值在3~5 μg/kg之间,占样本总数的20%。经计算得95%置信区间为2.17~2.80 μg/kg。罗氏沼虾中氨基脲的含量与现行残留限量不符。
日本沼虾中氨基脲的检出值主要集中于7~9 μg/kg,共有12批次样本,占样本总数的60%。经计算得95%置信区间为6.01~7.82 μg/kg。日本沼虾中氨基脲的含量也与现行残留限量不符。
中华绒螯蟹中氨基脲的检出值主要集中于0~1 μg/kg,其中未检出4批次,检出值在0.5~1 μg/kg的有14批次,共18批次,占样本总数的90%。经计算得95%置信区间为0.430~0.760 μg/kg,这与彭婕等[10]对中华绒螯蟹肌肉中氨基脲的含量分析结果基本一致,说明中华绒螯蟹中氨基脲的含量基本符合现行残留限量。
2.3 氨基脲来源分析
在对不同生长时期的日本沼虾肌肉和甲壳中的氨基脲含量进行测定后,进行数据整理,由表3可见,日本沼虾虾壳中氨基脲含量始终高于肌肉中的含量,可达到肌肉中含量的4.11~31.52倍,这与倪永付等[11]对微山湖小青虾各部分氨基脲含量的测定结果较一致,证实了肌肉中的氨基脲确实主要源自虾壳。但不同成长期的日本沼虾,虾壳与肌肉中的氨基脲含量并无规律可循。彭婕等[10]通过对中华绒螯蟹不同组织中氨基脲残留量的检测,发现旧甲壳与新长甲壳中氨基脲含量存在差异,考虑到甲壳类水产品存在周期性换壳的生长特征,本实验在取样时间上存在欠缺,未结合日本沼虾换壳期,故未能有效证明不同成长期日本沼虾虾壳与肌肉中氨基脲含量的关联。
表3 日本沼虾虾壳和肌肉中氨基脲的含量
Tab.3 The content of semicarbazide in shrimp shell and muscle ofMacrobrachiumnipponense
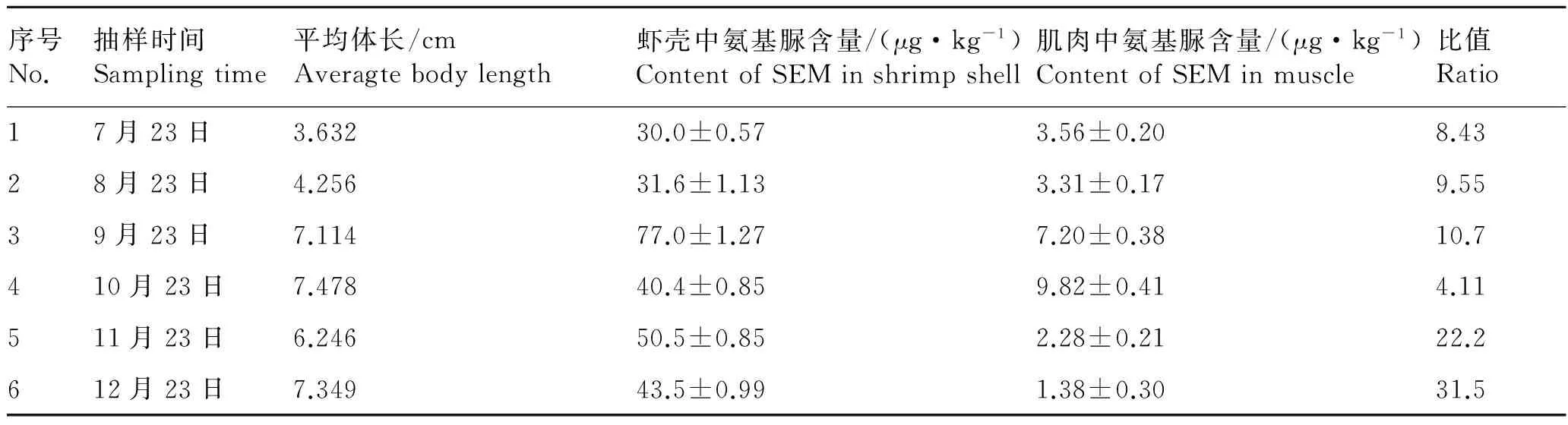
序号No.抽样时间Samplingtime平均体长/cmAveragtebodylength虾壳中氨基脲含量/(μg·kg-1)ContentofSEMinshrimpshell肌肉中氨基脲含量/(μg·kg-1)ContentofSEMinmuscle比值Ratio17月23日3.63230.0±0.573.56±0.208.4328月23日4.25631.6±1.133.31±0.179.5539月23日7.11477.0±1.277.20±0.3810.7410月23日7.47840.4±0.859.82±0.414.11511月23日6.24650.5±0.852.28±0.2122.2612月23日7.34943.5±0.991.38±0.3031.5
此外,本实验将上述实验中取得的6份日本沼虾肌肉用甲醇清洗后再测定其中氨基脲的含量,并与清洗前的氨基脲含量进行比较。由表4可见,日本沼虾的肌肉经过甲醇清洗后,其氨基脲含量明显降低,而一般情况下,氨基脲与蛋白质会形成牢固的结合物,需衍生化才能将其与蛋白质分离,这说明除了与蛋白质结合的“结合态”氨基脲外,肌肉中还存在部分“游离态”氨基脲,故推测“游离态”的氨基脲可能是在制样过程中,肌肉与虾壳分离不彻底而带入的。而对于“结合态”的氨基脲,Robert等[12]曾有研究,发现虾壳与肌肉之间存在一种分泌甲壳素的单细胞表皮层,而
表4 日本沼虾肌肉经甲醇清洗前后氨基脲的含量
Tab. 4 The content of semicarbazide in muscle before and after treatment
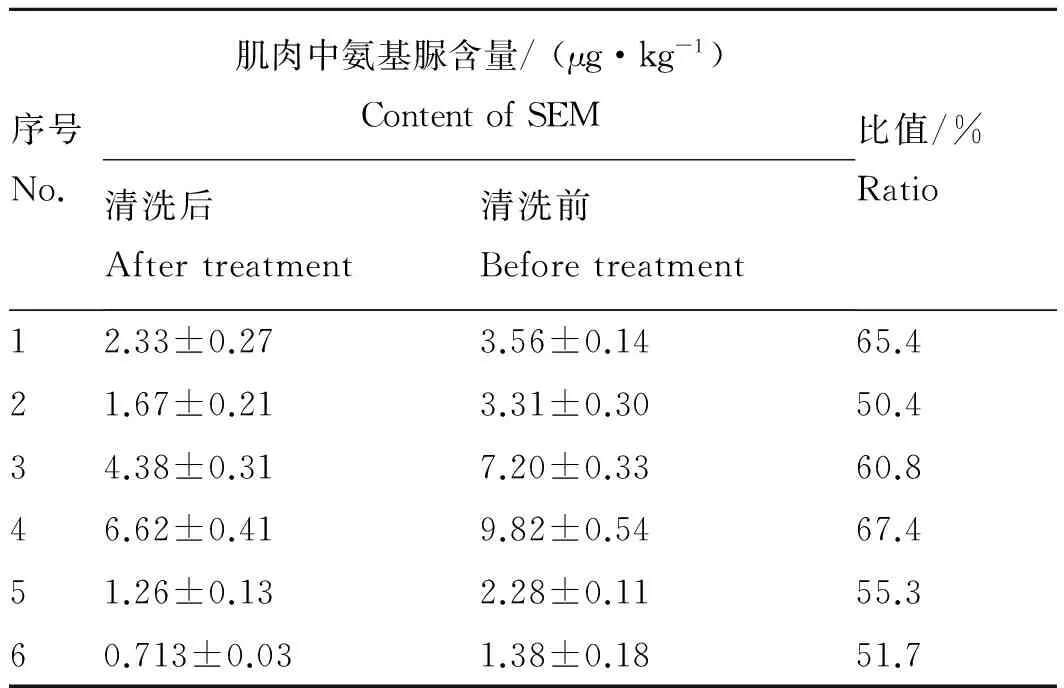
序号No.肌肉中氨基脲含量/(μg·kg-1)ContentofSEM清洗后Aftertreatment清洗前Beforetreatment比值/%Ratio12.33±0.273.56±0.1465.421.67±0.213.31±0.3050.434.38±0.317.20±0.3360.846.62±0.419.82±0.5467.451.26±0.132.28±0.1155.360.713±0.031.38±0.1851.7
与虾壳结合的表层肌肉中氨基脲的含量比内部肌肉高3倍以上,故推断虾肉中“结合态”的氨基脲可能来自于这层表皮层。
3 结论与讨论
根据上述研究,罗氏沼虾与日本沼虾中本底氨基脲的含量,与现行的氨基脲残留限量标准有明显的冲突,如果渔政部门继续按照现行残留限量进行判定,势必会存在假阳性的可能,这会对养殖户的积极性和权益等产生影响。据了解,日本已经不再对水产品中氨基脲的含量进行评价,中国农业部对于水产品苗种和无公害水产品中的氨基脲含量也不再做评价,而是仅作为调查。倘若对所有甲壳类水产品中的氨基脲含量不作评判,可能会导致呋喃西林药物在甲壳类水产品中出现滥用的状况。若想继续科学地对甲壳类水产品中呋喃西林代谢物进行监控,可以设想有以下3种途径:第一,掌握甲壳类水产品中内源性氨基脲的产生途径,区分内源性氨基脲和药源性氨基脲。周萍等[13]曾在对雄蜂蛹生长后期,外壳变硬并有氨基脲检出而推断氨基脲可能源自甲壳素。但彭婕等[10]在对中华绒螯蟹蟹壳和甲壳素中氨基脲含量测定后认为蟹壳中氨基脲的产生和甲壳素并没有关联。现有的研究只能推测氨基脲和甲壳有关,至于氨基脲的生成途径尚没有明确的定论,故途径一不可行。第二,通过追踪呋喃西林原药在动物体内代谢的其他代谢产物来判定是否用药。王建[14]曾对甲壳类水产品中氨基脲进行研究,提出通过追踪呋喃西林其他代谢产物,如5-硝基-2-糠醛,来建立监测呋喃西林的新方法,但未取得较好的成果。可见途径二尚不可行。第三,通过对甲壳类水产品中本底氨基脲的普查,根据不同品种修订现有氨基脲残留限量标准。将各个检测机构对甲壳类水产品本底氨基脲数据进行整理和汇总,进一步分析后即可获得不同品种甲壳类水产品本底氨基脲含量情况,这是目前最为可行的方案。
通过对4种甲壳类水产品本底氨基脲含量调查,4种甲壳类水产品中本底氨基脲含量存在较大差异,肌肉中氨基脲含量:日本沼虾>罗氏沼虾>凡纳滨对虾>河蟹(均为均值),肌肉中氨基脲检出率:日本沼虾=罗氏沼虾>河蟹>凡纳滨对虾。但由于样本数量较少,尚不能提出合理的建议限量值。虽然目前氨基脲在甲壳类水产品中仅作为调查项目,但对于肌肉中氨基脲检出值超过第95百分位(即P95,凡纳滨对虾为2.88 μg/kg,罗氏沼虾4.26 μg/kg,日本沼虾9.00 μg/kg,中华绒螯蟹1.16 μg/kg)的样品,仍然存在用药的可能性,渔政执法部门应予以重视。
此外,除了内源性氨基脲是导致甲壳类水产品中氨基脲超过残留限量的主要原因,一些外源性的氨基脲也同样可能导致氨基脲假阳性。袁涛等[15]发现次氯酸钠消毒剂使用后会残留在肉鸡皮肤中造成样品氨基脲阳性;杨曦等[16]发现用消毒水(主要成分为次氯酸钠) 浸泡罗非鱼肉片、虾仁能导致氨基脲检出;魏云计等[17]实验研究中发现在皮革加工过程用于洗皮的双氧水能导致皮制品中氨基脲检出,可见具有氧化性的次氯酸钠、双氧水在接触动物源性产品时能产生某种反应够产生氨基脲,具体途径有待研究。而李金强等[18]研究发现偶氮二甲酰胺(ADC)在高温热解时能够产生氨基脲,其主要途径为ADC与硫醇反应生成联二脲,联二脲则最终裂解为氨基脲[19]。而ADC通常被面粉改良剂,当甲壳类水产品经面粉包裹加热后,会导致氨基脲含量提高。因此,甲壳类水产品在生产和运输过程中应当避免与上述物质接触,以防其遭到外源性氨基脲污染。另外,考虑到甲壳类水产品其甲壳中可能存在的“游离态”氨基脲,故在甲壳类水产品的样品制备时应避免将碎壳混入肌肉中,从而确保检测结果的真实和准确性。
本次本底调查证实了甲壳类水产品中内源性氨基脲的存在,阐释了部分甲壳类水产品中氨基脲超过残留限量的可能原因,但由于样本数量的局限性,尚不能提出合理的建议限量值。限量标准的修订需要大量的数据支撑,本研究将进一步改进氨基脲本底调查方案,开展氨基脲来源分析研究,并希望更多检测机构能加入其中,提供更多有效数据,这对于水产行业的发展具有重要意义。政府相关部门也应当推进高效、低毒的替代药物的研发,从根源上杜绝呋喃西林药物的滥用。
[1] 祝伟霞, 刘亚, 梁炜,等. 动物性食品中硝基呋喃类药物残留检测研究进展[J]. 动物医学进展,2010,31(2):99-102.
[2] 蒋原, 丁涛, 徐锦忠,等. 硝基呋喃类药物在克氏螯虾组织中消除规律的研究[J]. 畜牧与兽药,2008,40(2):34-37.
[3] Leitner A, Zolner P, Lindner W. Determination of the metabolites of nitrofuran antibiotics in animal tissue by high-performance liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A, 2001, 939(1): 49-58.
[4] 中华人民共和国农业部. 中华人民共和国农业部公告第560号[S]. 北京:农业部, 2005.
[5] 中华人民共和国农业部. 中华人民共和国农业部公告第235号[S]. 北京:农业部, 2002.
[6] 王群, 吕海燕, 宋怿, 等. 硝基呋喃类在水产品及其养殖环境中的消解规律研究进展[J]. 中国渔业质量与标准, 2014, 4(6):16-20.
[7] Poucke C V, Detavernier C, Wille M, et al. Investigation into the possible natural occurence of semicarbazide inMacrobrachiumrosenbergiiprawns[J]. J Agric Food Chem, 2011, 59(5): 2107-2112.
[8] McCracken R, Hanna B, Ennis D, et al. The occurrence of senucarbazide in the meat and shell of Bangladeshi fresh-water shrimp[J]. Food chem, 2013, 136(3):1562-1567.
[9] 于慧娟, 李冰, 蔡友琼, 等. 液相色谱—串联质谱法测定甲壳类水产品中氨基脲的含量[J]. 分析化学, 2012,40(10),1530-1535.
[10] 彭婕, 甘金华, 陈建武, 等. 中华绒螯蟹中氨基脲的分布及产生机理分析[J]. 淡水渔业, 2015, 45(4):108-112.
[11] 倪永付, 朱莉萍, 王勇, 等. 微山湖小青虾各部分呋喃西林代谢物含量测定[J]. 食品与发酵科技, 2011, 48(1):86-88.
[12] Robert M C, Bob H, David E, et al. The occurrence of semicarbazide in the meat and shell of Bangladeshi fresh-water shrimp [J]. Food Chem, 2013, 136(3/4):1562-1567.
[13] 周萍, 胡福良, 章征天, 等. 雄蜂蛹中硝基呋喃类代谢物含量的测定及超标原因分析[J]. 中国蜂业, 2008,59(7):5-9.
[14] 王建. 甲壳类水产中呋喃西林及氨基脲的研究[D]. 杭州: 浙江工商大学, 2014:51-68.
[15] 袁涛, 田国华, 吴伟, 等. 次氯酸钠、酒精及穿串用竹签对鸡肉产品中呋喃西林代谢物检测结果的影响[J]. 安徽农业科学, 2011, 39(30):18733-18735.
[16] 杨曦, 李红光. 水产品在消毒水作用下产生呋喃西林代谢物的研究[J]. 食品工业科技, 2011, (4):158-159.
[17] 魏云计, 马卉, 冯民, 等. 皮制品中氨基脲的测定和来源分析[J]. 分析试验室, 2014, 33(增刊):70-72.
[18] 李金强, 郭海霞, 曹鹏, 等. 偶氮甲酰胺分解产生呋喃西林代谢物的相关性研究[J]. 化学计量分析, 2009, 18(6):34-36.
[19] Pereira A, Donato J, De Nucci G. Implications of the use of semicarbazide as a metabolic target of nitrofurazone contamination in coated products [J]. Food Addit Contam, 2004, 21(1):63-69.
Background value survey and source analysis of semicarbazide in shellfish
WANG Dingnan1*, ZHOU Fan1, LI Shiyan1, XU Weiguo2, WANG Yang1
(1. Zhejiang Fisheries Technical Extension Station, Hangzhou 310023, China; 2. Jiaxing Fisheries Technical Extension Station, Jiaxing 314050, China)
The aim of this study is to provide the basis for scientific supervision of quality and safety of aquatic products through the survey and source analysis of semicarbazide background value in shellfish. The content of semicarbazide background value in shellfish were determined by using high performance liquid chromatography-tandem mass spectrometry (LC-MS/MS). Among 4 kinds of shellfish, the detection rates ofMacrobrachiumnipponenseandMacrobrachiumrosenbergiidemanreached 100%. The average detection value of semicarbazide inMacrobrachiumnipponenseandMacrobrachiumrosenbergiidemanwere 6.92 and 2.52 μg/kg, respectively, both of which exceeded the current residue limits. The contents of semicarbazide inPenaeusvannameiandEriocheirsinensiswere relatively lower. The result of this survey provides data support for formulating the residue limits of semicarbazide in shellfish. [Chinese Fishery Quality and Standards, 2016, 6(6):6-11]
shellfish; semicarbazide; background value survey; source analysis;nitrofurazone;macrobrachiumnipponense;macrobrachiumrosenbergiideman
WANG Dingnan,skylineamd2012@163.com
2016-04-30;接收日期:2016-06-17
浙江省水产品质量安全技术支撑团队(QS20160132)
王鼎南(1989-),男,学士,助理工程师,研究方向为水产品中兽药残留检测,skylineamd2012@163.com
S932.5
A
2095-1833(2016)05-0006-06

