噻二唑硫醚席夫碱酪氨酸酶抑制活性研究
刘进兵,钟志坚,张宇,袁梦洁
(邵阳学院 生物与化学工程系,湖南 邵阳,422000)
噻二唑硫醚席夫碱酪氨酸酶抑制活性研究
刘进兵,钟志坚,张宇,袁梦洁
(邵阳学院 生物与化学工程系,湖南 邵阳,422000)
以二硫化碳和氨基硫脲为起始原料,缩合得到2-氨基-5-巯基-1,3,4噻二唑,再经硫醚化、缩合得到噻二唑硫醚席夫碱,目标化合物经核磁和质谱表征。对部分化合物进行了酪氨酸酶抑制活性考察,所测试的化合物都表现出一定的酪氨酸酶抑制活性,其中化合物8活性最好,强于阳性对照曲酸。优选化合物8进行了抑制机理探讨,结果表明其为不可逆抑制剂,同时对化合物8进行了分子对接研究。
噻二唑硫醚;席夫碱;酪氨酸酶抑制活性
酪氨酸酶是一种多酚氧化酶,两个铜离子活性中心与三个组氨酸残相连形成四面体结构[1,2]。酪氨酸酶是黑色素生物合成的关键酶,在动植黑色素合成过程中起着重要作用,与人的毛发、皮肤颜色密切相关,因此广泛存在于微生物和动植物[3,4]。酪氨酸酶在人体内过量表达会导致色素沉着性疾病,如雀斑、黄褐斑、老年斑等皮肤病,严重的会导致皮肤癌[5]。酪氨酸酶也和果蔬褐变有密切关系,酪氨酸酶抑制剂也可以用作食品保鲜剂[6]。同时酪氨酸酶与昆虫的蜕皮及伤口愈合,为开发生物杀虫剂指明方向[7]。由于酪氨酸酶抑制剂在医药、农业、食品工业、化妆品领域有着重要的用途,开发新型高效低毒的酪氨酸酶抑制剂并探讨其作用机制成为了科学界的研究热点。
杂环是一类具有生物活性多样性的物质,噻唑一类重要的含硫、氮杂环化合物,噻二唑是头孢唑啉、头孢西酮等头孢类药物的重要中间体。研究表明1,3,4-噻二唑类化合物是设计生物活性分子的重要先导化合物,具有抗肿瘤、抗菌、抗氧化、抗抑郁、抗菌消炎等生物活性[8,9]。本文以氨基硫脲和二硫化碳为起始原料合成2-氨基-5-巯基-1,3,4噻二唑,再经硫醚化、缩合得到噻二唑硫醚席夫碱,并考察了其酪氨酸酶抑制活性、抑制机理和抑制动力学特性,合成路线如下(图1):

1.R1= Bz; 2.R1= 烯丙基;
3.R1= Bz,R2= 4-羟基-3-甲氧基苯基;
4.R1= Bz,R2=5-溴-2-羟基苯基;
5.R1= Bz,R2= 2-甲氧基苯基;
6.5.R1= Bz,R2=5-氯-2-羟基苯基;
7.R1= 烯丙基,R2= 4-羟基-3-甲氧基苯基;
8.R1= 烯丙基,R2=2,4-二羟基苯基;
9.R1= 烯丙基,R2=5-氯-2-羟基苯基;
10.R1= 烯丙基,R2=5-溴-2-羟基苯基;
11.R1= 烯丙基,R2=3-氯苯基;
12.R1= 烯丙基,R2= 3-羟基苯基;
13.R1= 烯丙基,R2= 2-羟基苯基;
14.R1= 烯丙基,R2=4-羟基苯基.
图1 目标化合物的合成
Fig.1 Synthetic route of the target compounds
1 实验部分
1.1 试剂与仪器
醛、酮购置于上海达瑞试剂有限公司,酪氨酸酶、L-多巴,曲酸从Sigma-Aldrich公司购得,其他试剂及溶剂为市售分析纯,未进一步纯化。熔点仪为SGW®X-4(上海精密科学仪器有限公司),未校正;核磁共振仪为Bruker400or300型(德国Bruker公司);质谱仪为LCMS-2010A型(日本岛津);红外为VECTOR22型(德国Bruker公司);元素分析仪为Vario EL(德国Elementar公司)紫外分光光度计为UV-2100(北京莱伯泰科仪器有限公司)。
1.2 化合物合成
2-氨基-5-硫醚1,3,4噻二唑的合成按文献合成方法进行合成[8]。
Compound1.收率98.71%.淡黄色固体,熔点:156.5—159.1oC;1H NMR(DMSO-d6,500MHz)δ7.36-7.25(m,7H,NH2,ph-H),4.30(s,2H,CH2),;13C NMR(DMSO-d6,125MHz)δ170.3,149.9,137.4,129.5,129.0,127.9,38.9;MS(ESI):m/z(100%)224(M+)。
Compound 2.收率52.48%.淡黄色固体,熔点:112.3-112.8oC;1H NMR(DMSO-d6,500MHz)δ7.32(s,2H,NH2),5.91-5.84(m,1H,CH),5.16(dd,J=44.7,13.5Hz,2H),3.70(d,J=7.0Hz,2H,CH2);13C NMR(DMSO-d6,125MHz)δ170.4,149.8,133.9,119.1,37.8;MS(ESI):m/z(100%)174(M+)。
2-氨基-5-硫醚1,3,4噻二唑席夫碱的合成。
取5mmol 2-氨基-5-硫醚1,3,4噻二唑加入到25mL圆底烧瓶中,加入10mL无水乙醇,搅拌下加入不同取代基的芳香醛6mmol和催化量的TBAB,回流反应,用TLC跟踪反应进程,反应完毕后冷却至室温,有固体析出,抽滤,滤饼用无水乙醇洗三次,用无水乙醇重结晶。如冷却至室温后无固体析出,采用柱层析分离得产品。
Compound 3.收率49.89%,淡黄色固体,熔点:178.1—180.1oC;1H NMR(DMSO-d6,500MHz)δ10.33(s,1H,OH),8.72(s,1H,CH),7.58(s,1H,Ph-H),7.50-7.46(m,2H,Ph-H),7.37-7.28(m,4H,Ph-H),6.96(d,1H,J=8.2Hz,Ph-H),4.58(s,2H,CH2),3.86(s,3H,CH3);13C NMR(DMSO-d6,125MHz)δ174.8,169.0,162.3,153.2,148.7,136.9,129.6,129.1,128.2,126.5,116.1,111.5,55.9,37.5;MS(ESI):m/z(100%)358(M+)。
Compound 4.收率84.94%.淡黄色固体,熔点:146.0—148.7oC;1H NMR (CDCl3,500MHz) δ 11.80 (s,1H,OH),8.93 (s,1H,CH),7.56-7.52 (m,2H,Ph-H),7.43 (d,J=7.2Hz,1H,Ph-H),7.36-7.30 (m,3H,Ph-H),6.95 (d,J=8.8Hz,1H,Ph-H),4.56 (s,2H,CH2);13C NMR (CDCl3,125 MHz) δ 174.8,169.0,162.3,153.2,148.7,136.9,129.6,129.1,128.2,126.5,116.1,111.5,55.9,37.5;MS (ESI):m/z(100%)405 (M+)。
Compound 5.收率43.06%,淡黄色固体,熔点:95.9—97.3oC;1H NMR (DMSO-d6,500 MHz) δ 9.08 (s,1H,CH),8.59 (d,J=6.9Hz,1H,Ph-H),8.05 (d,J=7.6Hz,1H,Ph-H),7.65 (t,J=7.3Hz,1H,Ph-H),7.47 (d,J=7.4Hz,1H,Ph-H),7.42-7.25 (m,4H,Ph-H),7.10 (d,J=8.1Hz,1H,Ph-H),4.59 (s,2H,CH2),3.92(s,3H,CH3);13C NMR (DMSO-d6,125 MHz) δ 174.9,167.7,163.7,160.9,151.1,137.4,136.9,136.2,129.1,128.0,122.6,121.5,112.9,56.4,37.8;MS (ESI):m/z(100%) 342 (M+)。
Compound 6.收率49.92%.淡黄色固体,熔点:148.2—150.7oC;1H NMR (CDCl3,500 MHz) δ 11.79 (s,1H,OH),8.95 (s,1H,CH),7.44-7.30 (m,7H,Ph-H),7.00 (d,J=8.6Hz,1H,Ph-H),4.57 (s,2H,CH2);13C NMR (CDCl3,125 MHz) δ 170.4,166.7,164.8,160.2,135.6,132.6,132.3,129.3,128.9,128.1,124.6,119.4,118.9,38.4;MS (ESI):m/z(100%) 362 (M+)。
Compound 7.收率26.64%.淡黄色固体,熔点:65.5-67.4oC;1H NMR (CDCl3,500 MHz) δ 8.65 (s,1H,CH),7.66 (s,1H,Ph-H),7.34 (d,J=8.1Hz,1H,Ph-H),7.02 (d,J=8.1Hz,1H,Ph-H),6.01-5.97 (m,1H,CH),5.29 (dd,J=69.6,13.5Hz,2H),3.97 (s,3H,CH3),3.96 (d,J=7.0Hz,2H,CH2);13C NMR (CDCl3,125 MHz) δ 174.5,166.6,162.7,151.4,147.4,132.0,128.0,127.3,119.6,114.6,109.3,56.2,36.7;MS (ESI):m/z(100%) 308 (M+)。
Compound 8.收率47.83%.淡黄色固体,熔点:152.7-154.9oC;1H NMR (DMSO-d6,500 MHz) δ 11.53 (s,1H,OH),10.73 (s,1H,OH),8.93 (s,1H,CH),7.69 (d,J=8.7Hz,1H,Ph-H),6.46 (d,J=8.7Hz,1H,Ph-H),6.38 (s,1H,Ph-H),6.00-5.95 (m,1H,CH),5.28 (dd,J=76.8,13.5Hz,2H),3.96 (d,J=6.8Hz,2H,CH2);13C NMR (DMSO-d6,125 MHz) δ 174.1,167.1,165.5,163.4,162.0,134.0,133.1,120.0,112.6,109.8,102.8,36.7;MS (ESI):m/z(100%) 294 (M+)。
Compound 9.收率31.42%.淡黄色固体,熔点:125.9-127.5oC;1H NMR (CDCl3,500 MHz) δ 11.80 (s,1H,OH),8.97 (s,1H,CH),7.43 (s,1H,Ph-H),7.41 (d,J=8.7Hz,1H,Ph-H),7.01 (d,J=8.7Hz,1H,Ph-H),6.01-5.97 (m,1H,CH),5.31 (dd,J=68.7,13.5Hz,2H),3.97 (d,J=6.9Hz,2H,CH2);13C NMR (CDCl3,125 MHz) δ 170.7,166.7,164.8,160.3,135.5,132.6,131.8,124.6,119.9,119.4,118.9,36.6;MS (ESI):m/z(100%) 312 (M+)。
Compound 10.收率28.41%.淡黄色固体,熔点:104.7-105.9oC;1H NMR (CDCl3,500 MHz) δ 11.82 (s,1H,OH),8.96 (s,1H,CH),7.58 (s,1H,Ph-H),7.55 (d,J=8.8Hz,1H,Ph-H),6.96 (d,J=8.8Hz,1H,Ph-H),6.01-5.97 (m,1H,CH),5.31 (dd,J=68.7,13.5Hz,2H),3.97 (d,J=6.9Hz,2H,CH2);13C NMR (CDCl3,125 MHz) δ 170.7,166.6,164.8,160.7,138.3,135.7,131.8,119.9,119.6,111.4,36.6;MS (ESI):m/z(100%) 356 (M+)。
Compound 11.收率 6.72%.淡黄色固体,熔点:79.3-81.2oC;1H NMR (CDCl3,500 MHz) δ 8.84 (s,1H,CH),7.97 (s,1H,Ph-H),7.81 (d,J=7.6Hz,1H,Ph-H),7.54 (d,J=6.4Hz,1H,Ph-H),7.46-7.43 (m,1H,Ph-H),6.01-5.97 (m,1H,CH),5.37 (dd,J=68.7,13.5Hz,2H),3.98 (d,J=6.9Hz,2H,CH2);13C NMR (CDCl3,125 MHz) δ 168.7,165.0,153.8,139.7,134.6,131.9,130.3,129.5,126.7,119.8,119.4,36.6;MS (ESI):m/z(100%) 296 (M+)。
Compound 12.收率58.31%.淡黄色固体,熔点:156.2-158.1oC;1H NMR (DMSO-d6,500 MHz) δ 9.92 (s,1H,OH),8.84 (s,1H,CH),7.47 (s,1H,Ph-H),7.44 (d,J=7.6Hz,1H,Ph-H),7.39-7.33 (m,1H,Ph-H),7.07 (d,J=6.4Hz,1H,Ph-H),5.99-5.96 (m,1H,CH),5.37 (dd,J=68.7,13.5Hz,2H),3.99 (d,J=6.9Hz,2H,CH2);13C NMR (DMSO-d6,125 MHz) δ 193.6,174.3,170.0,163.5,158.5,136.2,130.7,122.3,121.5,120.0,115.6,36.6;MS (ESI):m/z(100%) 278 (M+)。
Compound 13.收率42.89%.淡黄色固体,熔点:102.2-103.4oC;1H NMR ((CDCl3,500 MHz) δ 11.82 (s,1H,OH),9.03 (s,1H,CH),7.50-7.45 (m,2H,Ph-H),7.04 (d,J=8.3Hz,1H,Ph-H),6.99 (d,J=7.4Hz,1H,Ph-H),6.03-5.97 (m,1H,CH),5.30 (dd,J=68.8,13.4Hz,2H),3.96 (d,J=6.9Hz,2H,CH2);13C NMR (CDCl3,125 MHz) δ 171.4,168.1,164.1,161.8,135.8,134.1,131.9,120.0,119.8,118.2,117.8,36.7;MS (ESI):m/z(100%) 278 (M+)。
Compound 14.收率 4.51%.淡黄色固体,熔点:96.9-100.5oC;1H NMR (DMSO-d6,500 MHz) δ 10.63 (s,1H,OH),8.76 (s,1H,CH),7.89 (d,J=8.5Hz,2H,Ph-H),6.94 (d,J=8.5Hz,2H,Ph-H),5.98-5.95 (m,1H,CH),5.28 (dd,J=77.1,13.5Hz,2H),3.96 (d,J=6.8Hz,2H,CH2);13C NMR (DMSO-d6,125 MHz) δ 175.0,169.0,163.4,162.3,133.2,133.1,126.2,119.9,116.6,36.6;MS (ESI):m/z(100%) 278 (M+)。
1.3 酪氨酸酶抑制活性测试
参照本课题组已经建立起的筛选方法[10]进行。
1.4 抑制机理研究
参照本课题组已经建立起的筛选方法[10]进行。
1.5 分子对接
参照文献[11]进行。
2 结果与讨论
2.1 目标化合物的合成
以二硫化碳和氨基硫脲为起始原料,无水乙醇做溶剂,在无水碳酸钠存在的情况下发生缩合的2-氨基-5-巯基1,3,4-噻二唑,通过改变反应温度得到反应体系在回流状态下收率最好,可以达到78%。将所得的2-氨基-5-巯基1,3,4-噻二唑分别于烯丙基溴及氯苄反应得到相应的硫醚化合物,其中和氯苄反应产物收率几乎是定量的,达到98.71%,然而和烯丙基溴反应的收率只有52.48%,说明氯苄反应活性更高。将所有相应的硫醚与不同的醛反应生成席夫碱,收率并不是很高,烯丙基取代的化合物收率偏低。
2.2 目标化合物的波谱分析
从核磁共振氢谱来看,苄基硫醚在δ 4.3处的单峰是苄基碳原子上的两个氢,烯丙基硫醚在δ 5.16处的dd峰为烯丙位碳原子上的两个氢原子,δ 5.91处多重峰为双键中间碳原子上的氢,在δ 3.70处双峰为双末端碳原子上的氢。形成席夫碱后原来醛基碳上氢原子位置发生变化,约在δ 8.50-9.00处。在核磁共振碳谱中,形成席夫碱后处于席夫碱上的碳原子约在δ 170左右。
2.3 化合物的酪氨酸酶抑制活性
为考察所合成的化合物对酪氨酸酶的抑制活性,采用本课题组已经建立起的筛选方法,以曲酸为阳性对照,对所合成的噻二唑硫醚席夫碱进行了酪氨酸酶抑制活性,其结果见表1。
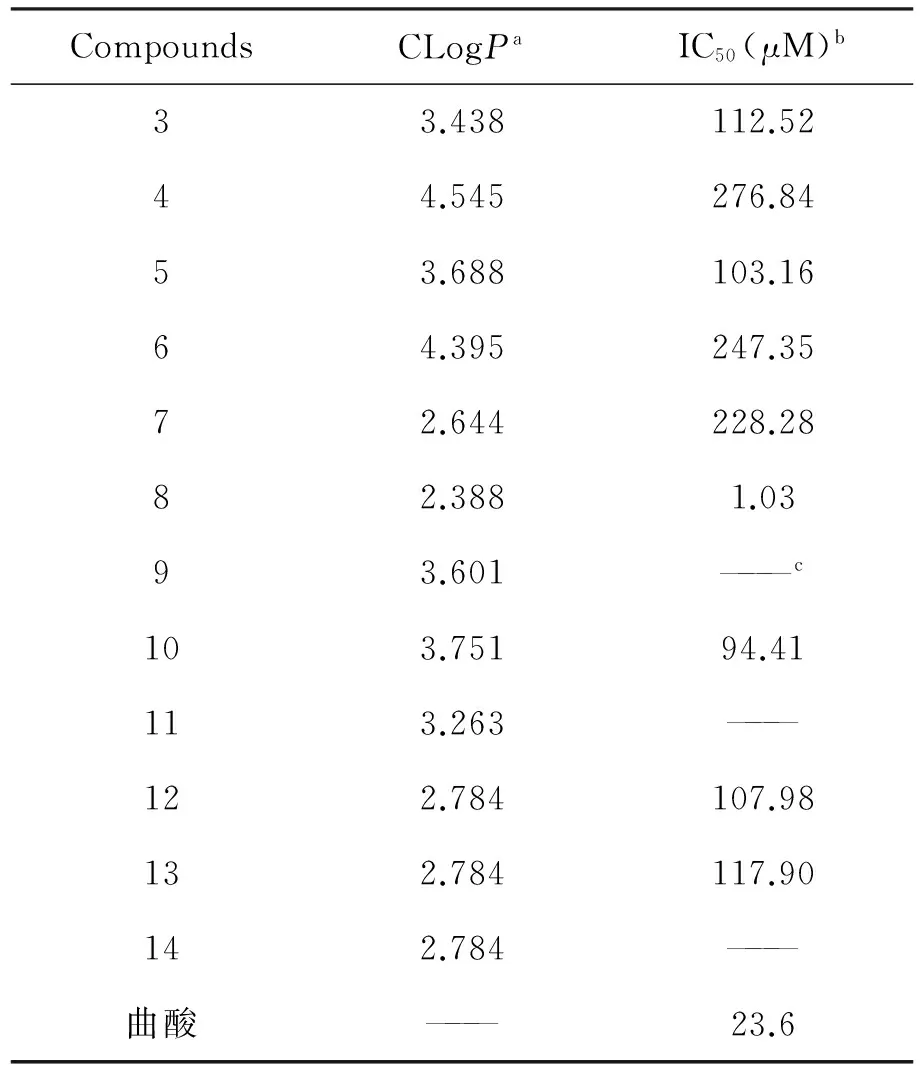
表1 目标化合物酪氨酸酶抑制活性
aLogP来源于 ChemBioDraw Ultra 12.0
b取三次实验平均值
c未测.
测试结果表明,目标化合物具有一定的酪氨酸酶抑制活性,其中化合物8抑制活性最强,其IC50为1.03μM,强于阳性对照曲酸,其结构特征是含有两个羟基。苄基硫醚类化合物酪氨酸酶抑制活性最强的是化合物5。对比苄基硫醚和烯丙基硫醚同种醛席夫碱的抑制活性,化合物3的抑制活性强于化合物7,而化合物10的抑制活性强于化合物4,这就说明该类化合物的酪氨酸酶抑制活性不仅与形成硫醚的基团有关,还与形成席夫碱的芳香醛上取代基的种类有关。从化合物12,13的活性数据可知,羟基在苯环上的位置可能对抑制活性有影响。
为了探讨这类化合物的抑制机理,优选化合物8进行抑制机理探讨,如图2所示,以酶的浓度为横坐标,V为纵坐标作图得到一组平行线,因此化合物8对酪氨酸酶的抑制作用是不可逆的。
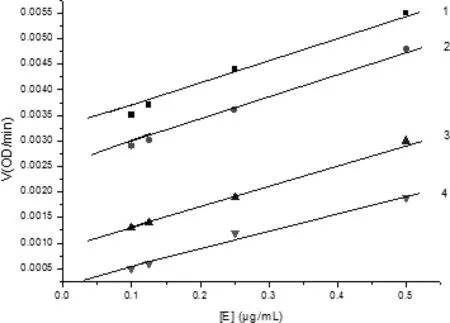
图2 化合物8对酪氨酸酶的抑制机理化合物8对应直线1-4的浓度为0,0.5,1,1.25μMFig.2 The effect of concentrations of tyrosinase on its activity for the catalysis of L-DOPA at different concentration of compound 8.The concentrations of compound 8 for curves 1-4 are 0,0.5,1 and 1.25μmol/L,respectively.

A.分子对接三维图

B.分子对接二维图图3 分子对接图Fig.3 The docking simulation between tyrosinase and inhibitor compound 8.
化合物8活性最好,选择这个化合物与酪氨酸酶进行分子对接,对接结果如图3所示。通过对接结果发现,化合物8与酪氨酸酶受体结合的总能量是-80.38 kcal/mol,这就说明化合物8能够与酪氨酸酶形成稳定的络合物。化合物8与酪氨酸酶可能发生相互作用的活性位点如图3所示。苯环上的两个酚羟基可以分别和GLU359,ILE13形成比较牢固氢键,其键长分别为2.85Å和2.98Å,噻二唑环上硫原子可以与LYS345形成氢键,其键长为2.56Å。烯丙基的碳碳双键能够与TRP350形成π-π叠加。
3 结论
将1,3,4-噻二唑和席夫碱拼接到一个分子中,考察其酪氨酸酶抑制活性,初步讨论了构效关系,化合物8的IC50值为1.03μM,强于阳性对照曲酸,为该类化合物中活性最强的,并对该化合物进行了抑制机理探讨,结果表明其为不可逆抑制剂。同时对化合物8进行了分子对接研究,发现羟基在抑制酪氨酸酶的过程中起着重要作用。
[1]MICHAEL R L S,CHRISTOPHER A R,PATRICK A R.Mechanistic studies of the inactivation of tyrosinase by resorcinol [J].Bioorg Med Chem,2013,21(5):1166-1173.
[2]LI Y C,WANG Y,JIANG H B,et al.Crystal structure of Manduca sexta prophenoloxidase provides insights into the mechanism of type 3 copper enzymes [J].P Natl Acad Sci USA,2009,106(40):17002-17006.
[3]CHEN Q X,LIU X D,HUANG H.Inactivation kinetics of mushroom tyrosinase in the dimethyl sulfoxide solution[J].Biochemistry (Mosc),2003,68(6):644-649.
[4]DONG X,ZHU Q,DAI Y,et al.Encapsulation artocarpanone and ascorbic acid in O/W microemulsions:Preparation,characterization,and antibrowning effects in apple juice[J].Food Chem.2016,192:1033-1040.
[5]TAN X,SONG Y H,PARK C,et al.Highly potent tyrosinase inhibitor,neorauflavane from Campylotropis hirtella and inhibitory mechanism with molecular docking[J].Bioorg Med Chem,2016,24(2):153-159.
[6]ARTÉS F,CASTANER M,GIE M I.Revisión:EI pardeamiento enzimático en frutasy hortalizas mínimamente procesadas Review:Enzymatic browning in minimally processed fruit and vegetables [J].Food Sci Technol Int,1998,4:377-380.
[7]ORTIZ-URQUIZA A,KEYHANI N O.Action on the surface:Entomopathogenic fungi versus the insect cuticle [J].Insects,2013,4(3):357-374.
[8]YANG S-J,LEE S-H,KWAK H-J,et al.Regioselective Synthesis of 2Amino-Substituted 1,3,4-Oxadiazole and 1,3,4-Thiadiazole Derivatives via Reagent-Based Cyclization of Thiosemicarbazide Intermediate [J].J Org Chem,2013,78(2):438-444.
[9]FARGHALY T A,ABDALLAH M A,MASARET G S,et al.New and efficient approach for synthesis of novel bioactive [1,3,4]thiadiazoles incorporated with 1,3-thiazole moiety [J].Eur J Med Chem,2015,97:320-333.
[10]LIU J B,YI W,WAN Y Q,et al.1-(1-Arylethylidene)- thiosemicarbazide derivatives:A new class of tyrosinase inhibitors [J].Bioorg Med Chem,2008,16(3):1096-1102.
[11]Tang J Y,LIU J B,WU F Y.Molecular docking studies and biological evaluation of 1,3,4-thiadiazole derivatives bearing Schiff base moieties as tyrosinase inhibitors [J].Bioorg Chem,2016,12:29-36.
Biological evaluation of 1,3,4-thiadiazole sulfide derivatives bearing Schiff base moieties as tyrosinase inhibitors
LIU Jinbing,ZHONG Zhijian,ZHANG Yu,YUAN Mengjie
(Department of Biology and Chemical Engineering,Shaoyang University, Shaoyang 422000,China)
1,3,4-thiadiazole sulfide derivatives bearing Schiff base moieties were designed,synthesized,and their tyrosinase inhibitory activities were evaluated.Some compounds displayed potent tyrosinase inhibitory activities,especially,compound 8 showed more potent inhibitory effect than the other compounds with the IC50value of 1.03μM.The structure-activity relationships (SARs) were preliminarily discussed.Docking study also was carried out in the paper.The inhibition mechanisms study demonstrated that the inhibitory effects of compound 8 on the tyrosinase were irreversible.
thiadiazole sulfide derivatives;schiff base;tyrosinase inhibitory activities.
1672-7010(2016)04-0093-07
2016-09-16
湖南省教育厅重点项目(15A172);邵阳学院大学生研究性学习和创新性实验计划项目
刘进兵(1974-),男,湖南邵阳人,副教授,博士,从事药物合成研究,E-mail:syuliujb@163.com
O0621.3
A

