过表达截形苜蓿液泡膜H+-PPase基因促进拟南芥的生长和根围酸化
王建武,相微微
(榆林学院生命科学学院,陕西榆林719000)
过表达截形苜蓿液泡膜H+-PPase基因促进拟南芥的生长和根围酸化
王建武,相微微
(榆林学院生命科学学院,陕西榆林719000)
在前期研究工作中,中国科学研究院西北高原生物研究所分子实验室已从豆科模式植物截形苜蓿(Medicago truncatula)中克隆到一种液泡膜焦磷酸酶(V-H+-PPase)基因MtVP1,并进行了序列分析。在前期工作的基础上,构建植物表达载体pBI121-MtVP1,把MtVP1基因转入到拟南芥中,观察转基因拟南芥的表型变化。结果表明,过表达MtVP1能使转基因株系的根系更发达,主根数增多1~2条,地上部生物量增大,并且促进了转基因株系的根围酸化能力;但幼苗耐盐性试验表明,转基因株系与对照没有明显差异。
液泡膜H+-PPase;根发育;根围酸化;耐盐性
液泡膜焦磷酸酶(H+-PPase)作为一种质子泵,能水解PPi产生两分子的Pi,并利用水解产生的能量酸化液泡。目前普遍认为,液泡膜H+-PPase主要在幼嫩和生长旺盛的组织中发挥功能,这些组织中由于ATP积累量减少,使得液泡膜H+-ATPase的活性降低[1-2]。对拟南芥液泡膜H+-PPase基因AVP1研究表明,AVP1主要定位到液泡膜上[3-4],此外还能定位到质膜上[5-6]。过表达AVP1能导致拟南芥质膜H+-ATPase丰度和活性发生变化[5,7-8]。过表达AVP1拟南芥株系的质膜H+-ATPase的丰度增大,导致了转基因拟南芥的质外体酸化,上述酸化作用的直接结果是加速了植物生长素的极性运输,由此导致转基因株系侧根增多,有机酸分泌增多,磷活化作用增强[4,7]。不管是在正常生长条件还是低磷生长条件下,过表达AVP1拟南芥和水稻株系表现出根系和地上部分更发达。过表达AVP1拟南芥株系表现出抗旱性和耐盐性增强[9]。过表达AVP1D(AVP1的功能增强突变体,其氨基酸序列的第229位由E突变成D)番茄株系的PPi水解活性和质子跨膜转运活性得到增强[10-11],然而在正常生长条件下,与对照相比,转基因株系的地上部分和果实大小没有明显差异[7];温室条件下,过表达AVP1D番茄植株表现出地上部分和根系生物量增大,在低磷生长条件下,果实产量也显著增大,而在正常生长条件下,根系生物量仅稍微增大。大田试验中,过表达AVP1D番茄植株的果实鲜质量仅比对照稍微高些,然而转基因株系的单株成熟果实数量显著高于对照植株(约高25%),这一结果与Mohammed等[12]报道的类型I液泡膜H+-PPase基因在果实发育中的功能相一致。与对照相比,过表达AVP1D番茄植株表现出更强的生长素转运活性和根围酸化能力,而且在缺磷条件下,转基因植株表现出更高的从叶(源)到果实(库)的磷转运活性。此外,在所有试验条件下,过表达类型I液泡膜H+-PPase基因均能显著提高转基因植株的移栽成活率[13]。
在前期研究工作中,中科院西北高原生物研究所分子实验室已从豆科模式植物截形苜蓿(Medicago truncatula)中克隆到一种液泡膜焦磷酸酶(V-H+-PPase)基因MtVP1[14]。目前,尚未见用反向遗传学手段研究豆科植物类型I液泡膜H+-PPase基因的报道。本试验在前期研究工作的基础上,构建植物表达载体pBI121-MtVP1,转化拟南芥,然后对转化子表型进行了相关分析,为研究类型I液泡膜H+-PPase基因的功能提供参考,也为截形苜蓿液泡膜焦磷酸酶基因MtVP1的应用打下基础。
1 材料和方法
1.1 材料
转截形苜蓿液泡膜焦磷酸酶基因MtVP1的拟南芥植株获得过程及鉴定参照文献[15],转GUS基因的对照植株由中国科学院西北高原生物研究所王海庆课题组保存。
1.2 方法
1.2.1 过表达MtVP1基因拟南芥幼苗的表型观察及耐盐性鉴定 拟南芥幼苗在1/2 MS固体培养基上萌发7d,然后转移到不含盐和含0.15mol/L NaCl的MS固体培养基上,培养21 d后,观察转基因幼苗在不加盐MS固体培养基上地上部分的形态和根的形态,测定幼苗地上部分鲜质量,计数主根数,并观察转基因幼苗生长在0.15 mol/L NaCl MS培养基上的表型。
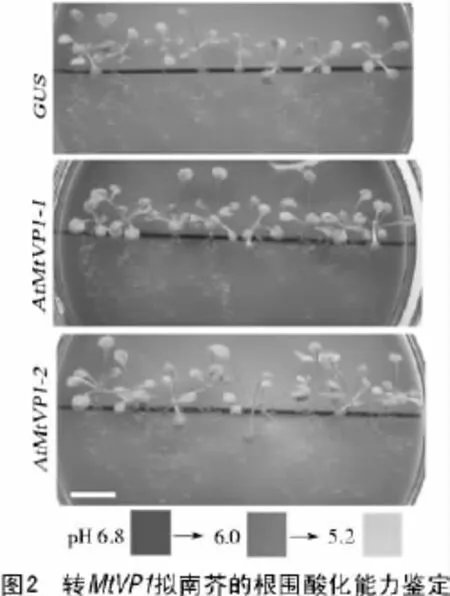
1.2.2 根围酸化分析 拟南芥幼苗在1/2 MS固体培养基上萌发7 d,然后转移到含有1 mmol/L MES和0.04 g/L溴甲酚紫(bromocresol purple)的MS固体培养基(pH值6.8)上,培养10d。配制3种pH值(6.8,6.0,5.2)的上述培养基,以其颜色作为参照,来确定拟南芥幼苗的根围酸化程度。
2 结果与分析
2.1 过表达MtVP1拟南芥幼苗的表型观察及耐盐性鉴定
不同植物来源的类型I液泡膜焦磷酸酶的氨基酸序列是高度相似的[3],表明截形苜蓿焦磷酸酶基因MtVP1转入拟南芥中后应该是有生理功能的。与转GUS基因的对照株系相比,过表达MtVP1的拟南芥表现出叶片面积增大且叶片数目增多(图1-a),地上部分的生物量增大,2个转基因株系(AtMtVP1-1和AtMtVP1-2)的平均地上部分鲜质量比对照分别增加了58%和81%(图1-b),2个转基因株系(AtMtVP1-1和AtMtVP1-2)的根系比对照要发达(图1-d),更为有意思的结果是2个转基因株系(AtMtVP1-1和AtMtVP1-2)的主根增多了,对照株系的主根都是1个,而转MtVP1株系在根茎结合的部位都长出了2~3条根(图1-f),这些根的粗细差不多,分不清主次,淡黄色,跟对照株系主根的颜色相近(图1-e),所以,过表达MtVP1促进了拟南芥主根的发育,使主根增多。然而幼苗耐盐试验结果(图1-c)表明,过表达MtVP1没有显著提高拟南芥的耐盐性,2个转基因株系(AtMtVP1-1和AtMtVP1-2)均不能在含0.15 mol/L NaCl的MS培养基上完成生活史。

2.2 根围酸化分析
已有文献表明,过表达拟南芥液泡膜焦磷酸酶基因AVP1能导致转基因株系的根系更为发达,并且导致根细胞的质外体中的pH值下降0.5个单位[4]。由于以上这2个原因会使转基因株系的根围酸化能力增强,为了验证截形苜蓿液泡膜焦磷酸酶基因MtVP1是否具有上述功能,进行了根围酸化分析。结果表明,2个转基因株系(AtMtVP1-1和AtMtVP1-2)的根能使根际培养基的颜色由紫变为淡黄色,而转GUS基因的对照株系仅能使培养基的颜色变成深绿色(图2),因此,过表达MtVP1也能增强拟南芥的根围酸化能力。
3 讨论
理论上,存在3种可用于减少植物细胞Na+过度积累造成伤害的策略:(1)确定质膜上转运Na+通道蛋白或转运蛋白后,降低这些蛋白的活性;(2)Na+区隔化,这依赖于植物体内有较大的液泡,且需要多种蛋白(酶)的配合,如位于液泡膜上的阳离子逆向转运蛋白、阴离子通道蛋白以及负责建立跨液泡膜电化学梯度的H+-ATPase或H+-PPase。然而,阳离子逆向转运蛋白如AtNHX1在一些对生长非常重要的细胞内(如根的分生组织)不表达。所以,这种提高植物耐盐性的策略存在一定的局限性。(3)Na+外排,如利用质膜上的阳离子逆向转运蛋白SOS1,把吸收到细胞内的Na+再排到植物体外[16-17]。(4)渗透调节物质的积累,如海藻糖[18]、脯氨酸[19],这些物质的积累可以提高转基因植株的耐盐性和抗旱性。本试验克隆得到的截形苜蓿液泡膜H+-PPase基因MtVP1转入到拟南芥后,转基因植株的幼苗没有表现出较强的耐盐性,可能跟AtNHX1在根的分生组织不表达以及细胞内的液泡较小有关。因此,植物的耐盐机制是1种由多基因参与调控的非常复杂的机制,在植物体内只过表达1种外源基因,有时不能到达预期效果。目前,有些实验室已在尝试选用组织特异性表达启动子或逆境诱导启动子以及把多个耐盐相关基因同时转入植物体内,得到了比转单一耐盐相关基因耐盐性更强的转基因株系。
液泡膜H+-PPase除了具有质子泵的作用外,还能控制植物生长素的运输。通过对拟南芥AVP1基因的深入研究表明,AVP1表达的变化能够影响质膜上的三磷酸腺苷酶(P-ATPase)和植物生长素外流介体(如PIN1)的分布和数量。过表达AVP1能够使具有调节器官形成功能的生长素的外流变得更为容易,促进植物生长素的极性运输,进而促进器官开始形成时的细胞分裂,最终使植物的生物量均显著增大[4]。本试验得到的转基因拟南芥,与对照相比,地上部分生物量明显增大,主根数增多,整个根系也更发达,说明MtVP1也具有AVP1同样的功能,能够促进植物生长素的极性运输,进而影响生长素介导的器官发育。
[1]MaeshimaM.Vacuolar H(+)-pyrophosphatase[J].Biochimicaet BiophysicaActa,2000,1465:37-51.
[2]HeinonenJ.Biological roleof inorganic pyrophosphate[M].Norwell,MA:KluwerAcademic PublishersGroup,2001:1-28.
[3]Drozdowicz Y M,Rea P A.Vacuolar H+-pyrophosphatases:from evolutionary backwaters into mainstream[J].Trends in Plant Science,2001,6:206-211.
[4]Li J S,Yang H B,Peer W A,et al.Arabidopsis H+-PPase AVP1 regulates auxin-mediated organ development[J].Science,2005,310:121-125.
[5]Alexandersson E,Saalbach G,Larsson C,et al.Arabidopsis plasma membrane proteomics identifies components of transport,signal transductionandmembranetrafficking[J].PlantandCell Physiology,2004,45:1543-1556.
[6]Paez V J,PatronS A,Rodriguez L A,et al.Plasmamembranelocalization of the type I H+-PPase AVP1 in sieve element-companion cell complexes from Arabidopsis thaliana [J].Plant Science,2011,181:23-30.
[7]YangH B,KnappJ,KoiralaP,etal.Enhancedphosphorus nutrition in monocots and dicots over-expressing a phosphorus-responsive typeI H+-pyrophosphatase[J].PlantBiotechnology Journal,2007,5:735-745.
[8]Undurraga S,Santos P M,Paez V J,et al.Arabidopsis sodium dependent and independent phenotypes triggered by H+-PPase up-regulation are SOS1 dependent[J].Plant Science,2012,183:96-105.
[9]Gaxiola R A,Li J S,Undurraga S,et al.Drought-and salt-tolerant plants result from over-expression of the AVP1 H+-pump[J].Proceedings of the National Academy of Sciences,USA,2001,98:11444-11449.
[10]Park S,Li J S,Pittman J K,etal.Up-regulation of a H+-pyrophosphatase(H+-PPase)asa strategy toengineer drought-resistantcrop plants[J].Proceedingsof the National Academy of Sciences,USA,2005,102:18830-18835.
[11]Zhen R G,Kim E J,Rea P A.Acidic residues necessary for pyrophosphate-energized pumping and inhibition of the vacuolar H+-pyrophosphataseby N,N'-dicyclohexylcarbodiimide[J].Journal ofBiological Chemistry,1997,272(35):22340-22348.
[12]Mohammed S A,Nishio S,Takahashi H,et al.Role of vacuolar H+-inorganic pyrophosphatase in tomato fruit development[J]. Journal ofExperimental Botany,2012,63:5613-5621.
[13]Yang H B,Zhang X,Gaxiola R A,et al.Over-expression of the Arabidopsis proton-pyrophosphatase AVP1 enhances transplant survival,rootmass,and fruitdevelopment under limiting phosphorusconditions[J].Journal ofExperimental Botany,2014,65(12):3045-3053.
[14]王建武,沈裕虎,王沛,等.截形苜蓿液泡膜H+-PPase基因克隆与序列分析[J].西北植物学报,2009,29(3):435-442.
[15]Wang J W,Wang H Q,Xiang W W,et al.A Medicago truncatula H+-pyrophosphatase gene,MtVP1,improves sucrose accumulation and anthocyanin biosynthesis in potato(Solanum tuberosum L.)[J].Geneticsand Molecular Research,2014,13(2):3615-3626.
[16]Shi H Z,Lee B H,Wu S J,et al.Overexpression of a plasmamembrane Na+/H+antiportergene improvessalt tolerance in Arabidopsis thaliana[J].Nature,2003,21:81-85.
[17]权庚,张侠,尹海波,等.过量表达SaSOS1水稻的幼苗鉴定及生理特性分析[J].河南农业科学,2015,44(3):14-18.
[18]王亚,郭宝太,乔利仙,等.PyTPS转化花生对其后代耐盐性和品质性状的影响[J].华北农学报,2014,29(5):175-179.
[19]聂莉莉,张越,刘仲齐.苦菜耐盐机理初探[J].天津农业科学, 2008,14(6):34-36.
Improved Growth and Rhizosphere Acidification inArabidopsis Overexpressing Medicago truncatulaVacuolar H+-PPase Gene
WANG Jianwu,XIANG Weiwei
(CollegeofLifeSciences,YulinUniversity,Yulin719000,China)
In preliminary research work,a kind of vacuolar H+-PPase gene,named MtVP1,was cloned from the legume model plant Medicago truncatula,and characterized.On the basis of preliminary work,plant expression vector were constructed,then transferred MtVP1 intoArabidopsis and observed transgenic Arabidopsis phenotypic changes.The phenotype of transgenic Arabidopsis suggested that MtVP1 overexpression resulted in more robust root system,increased primary root number(1-2),increased biomass of shoot and enhanced rhizosphere acidification.However,seedling salt tolerance experiments showed that there was noobvious difference betweentransgenic linesandCK plants.
vacuolarH+-PPase;rootdevelopment;rhizosphereacidification;salttolerance
Q789
A
1002-2481(2016)07-0907-04
10.3969/j.issn.1002-2481.2016.07.04
2016-03-10
榆林学院博士科研启动基金项目(14GK39)
王建武(1983-),男,山东滕州人,讲师,主要从事植物分子生物学研究工作。相微微为通信作者。

