猪肉脂肪氧化酶在高压结合热处理过程中失活动力学模型
黄业传,李 凤,吴照民
猪肉脂肪氧化酶在高压结合热处理过程中失活动力学模型
黄业传,李 凤,吴照民
(西南科技大学生命科学与工程学院,四川 绵阳 621010)
为了解猪肉高压加工过程中脂肪氧化酶(lipoxygenase,LOX)活性的变化规律,以猪背最长肌为原料,经不同压力(200~700 MPa)、温度(20~60 ℃)结合处理后,研究LOX失活常数的变化规律,并分别用Arrhenius和Eyring方程为基础来建立LOX失活的动力学模型。结果表明,当处理温度不变时,失活常数随压力的增加而增加;同样,当处理压力不变时,失活常数随温度升高而增加。Arrhenius和Eyring方程分别适用于整个研究的温度区间和压力区间,分别以两者为基础可以建立LOX失活的动力学方程,两个方程的拟合程度均较高,决定系数分别达到0.989和0.965。因此在一定的处理温度(20~60 ℃)和压力(200~700 MPa)范围内,猪肉高压结合热处理过程中LOX活性的变化可以用以Arrhenius和Eyring方程为基础建立的数学模型进行预测。
猪肉;高压;热处理;脂肪氧化酶;动力学模型
脂肪氧化酶(lipoxygenase,LOX,EC 1.13.11.12)是一类含非血红素铁的酶,能专一催化多不饱和脂肪酸中具有顺,顺-1,4-戊二烯结构的脂肪酸,产生一系列脂肪酸氢过氧化物,这些氢过氧化物进一步分解会形成一些小分子化合物,如醇类、醛类、酮类等,部分小分子化合物会构成食品中的挥发性风味成分[1]。LOX广泛存在于各种植物、动物及微生物中,然而当前大多数研究都集中于植物特别是豆类中的LOX,对动物制品中的LOX研究较少且大都集中于LOX的分离纯化和部分特性研究[2-6]。LOX对动物制品的品质非常重要,一方面,其催化产生的一些小分子化合物对动物制品风味有重要贡献;另一方面,如果这些小分子化合物特别是醛类在产品中浓度超过一定限值后又会对动物制品风味产生负面作用[1],因此动物制品加工中如何调控LOX活性使其有利于产品风味是一个重要研究课题。
作为一种最新的食品加工技术,超高压技术现已广泛应用于食品加工中。相对于传统热处理杀菌技术,高压技术作为一种冷杀菌技术可以在杀菌的同时最大程度地保留食品的色、香、味、形;此外高压处理技术还能改善食品品质,如嫩度、凝胶特性等[7-9]。现在高压技术在肉制品中的应用主要与低温热处理(50~70 ℃)联合应用,因为一些耐压芽孢菌在常温进行处理时,高达1 000 MPa的压力仍不能使其完全失活,而高压结合一定温度的热处理则对这些芽孢菌有较好的杀灭效果。
肉制品高压加工必然会影响到其中LOX的活性,由于LOX对肉制品品质十分重要,因此很有必要研究肉中LOX在高压处理过程中的变化规律及LOX对高压加工肉制品品质的作用。虽然前期研究了LOX在高压促进肉中脂肪氧化过程中的初步作用[10],但仍不明白其中的真正机理,为探究LOX在高压加工肉制品中的真正作用,必须研究LOX在处理过程中的动力学变化规律。现在一些学者研究了大豆[11-14]、绿豆[15-17]、番茄[18-19]等植物产品中LOX在高压处理过程中的动力学变化规律,但肉制品在高压处理中LOX的动力学变化规律鲜见报道。因此,本研究以猪肉为材料,探究不同压力(200~700 MPa)、温度(20~60 ℃)处理后,样品规律中LOX的失活,并探索用Arrhenius和Eyring方程为基础来建立LOX失活动力学模型的可行性。
1 材料与方法
1.1 材料与试剂
白玉黑土猪,由四川绵阳天农生态食品开发有限公司提供,宰杀后取3 头猪的背最长肌,并去掉表面可见脂肪、筋膜和结缔组织,用绞肉机绞碎,并装入聚乙烯塑料袋中,每袋约20 g,真空包装后于-18 ℃冷藏待用。
亚油酸 美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
HPP.L2超高压处理设备 天津华泰森淼生物工程技术有限公司;FSH-2A匀浆机 上海梅香仪器有限公司;5804R台式高速冷冻离心机 德国Eppendorf公司;U-3900H分光光度计 日本Hitachi公司;JYS-A800绞肉机 山东九阳电器有限公司;L-128型氮吹仪 北京来亨科贸有限公司。
1.3 方法
1.3.1 样品处理
样品先在4 ℃条件下解冻24 h,然后放进高压设备的处理腔,按设定的温度(20~60 ℃)、压力(200~700 MPa)、时间(1~40 min)分别进行处理,高压处理以癸二酸二辛酯为压力传递介质。其中,每个温度和压力的组合做5 个时间点,具体每个处理的5 个时间点根据预备实验确定,比较剧烈的组合处理时间相对较短,反之时间较长,以使每个时间点处理后都能观察到明显的酶失活且又不完全失活以利于计算失活常数(如200 MPa、50 ℃的处理时间分别为1、2、3、4、5 min,而400 MPa、60 ℃的处理时间分别为20、25、30、35、40 min)。高压处理后,马上分析各处理样品的LOX酶活力。对照样为不经过压力处理的样品,其LOX活力计为100%。
1.3.2 样品中LOX的提取与活力测定
LOX的提取参照Jin Guofeng等[20]的方法。样品经不同处理后,称取约5 g,加入4 倍体积50 mmol/L pH 7.4磷酸钠缓冲溶液(含1 mmol/L二硫苏糖醇和1 mmol/L乙二胺四乙酸),于冰浴中15 000 r/min匀浆15 s,重复3 次。经4 层纱布过滤后,匀浆物在10 000×g、4 ℃条件下离心1 h,得到的上清液经滤纸过滤后即为LOX粗酶液。
亚油酸底物溶液的制备参照Gata等[21]的方法。将140 mg亚油酸溶解在5 mL脱氧重蒸水(含180 μL吐温20),用2 mol/L NaOH调整pH值至9.0,待亚油酸完全溶解后用脱氧重蒸水定容至50 mL,并于氮气环境下贮藏待用。
将2.9 mL 50 mmol/L、pH 5.5的柠檬酸缓冲溶液与0.2 mL亚油酸底物溶液于20 ℃条件下快速混合均匀,当其在234 nm波长处吸光度稳定后,加入0.1 mL酶溶液,迅速混合均匀后测定1 min内在234 nm波长处吸光度的增加量。1 个LOX酶活力单位(U)定义为每分子每克蛋白质中引起吸光度增加0.001的酶量。对照样中包括0.2 mL亚油酸底物溶液和3.0 mL柠檬酸缓冲溶液。
1.3.3 LOX失活动力学研究
根据预备实验和资料显示[14],在一定的温度和压力条件下,LOX失活速率常数K与高压处理时间t满足一阶反应动力学方程(1),对方程(1)进行积分得到方程(2)。

式中:t为高压处理时间/min;A、A0分别为高压处理时间为t和0时的样品酶活力/U;K为酶的失活速率常数/min-1。
因此,利用SPSS的线性回归程序,可从酶活力的自然对数ln(A/A0)与时间t的一次回归直线斜率得到某一特定处理压力和温度条件下的LOX失活速率常数K。
Eyring方程(3)和Arrhenius方程(4)经常分别用来评价压力和温度对反应速率常数K的影响,因此在本实验中也用来评定压力和温度对LOX失活常数的影响,具体影响程度用反应活化体积(Va)和反应活化能(Ea)来衡量。

式中:KrefT和KrefP分别为参考温度和参考压力条件下的失活速率常数/min-1;Va为反应活化体积/(cm3/mol);Ea为反应活化能/(kJ/mol);R为通用气体常数(8.314 J/(mol·K));T为温度/K;Tref为参考温度/K(本实验中参考温度设为40 ℃);P为处理压力/MPa;Pref为参考压力/MPa(本实验中参考压力设为450 MPa)。
同样,利用SPSS的线性回归程序,在各温度条件下,以lnK为因变量,(P-Pref)/RT为自变量作线性回归分析,所得斜率即为各温度条件下的Va,截距即为各温度条件下的lnKrefP;在各压力条件下,以lnK为因变量,(1/T-1/Tref)/R为自变量作线性回归分析,所得斜率即为各压力条件下的Ea,截距即为各压力条件下的lnKrefT。
1.4 数据统计分析
实验重复测定3 次,采用SPSS软件对数据进行处理,实验结果表示为±s。
2 结果与分析
2.1 LOX的失活常数

表1 猪肉中脂肪氧化酶不同处理压力和温度条件下的失活常数Table1 Inactivation rate constants of lipoxygenase in pork at different pressures and temperatures 10-2min-1
利用SPSS的线性回归程序(方程(2))测得不同处理压力和温度条件下的失活常数。由表1可知,在某一特定温度条件下,失活常数随处理压力的升高而增加,表明升高压力可以加速LOX的失活,这与一些报道中的结果是一致的[13-14]。同样,在某一特定压力条件下,失活常数随温度的升高而增加,表明温度的升高也可以加速LOX的失活。王韧[14]研究大豆中LOX的失活时,发现在特定压力条件下(550~650 MPa),LOX的失活常数在10~20 ℃出现最小值,表明大豆中LOX在此温度条件下具有最高压力稳定性,在此温度条件下,增加或降低温度都会加速LOX的失活。这与本研究的结论存在一定差异,可能与研究的温度范围有关,本实验只研究了常温(20℃)及以上的温度,而前述报道中均研究了20 ℃以下的温度,而他们得到的温度临界值也不超过20 ℃。本研究得到的猪肉中LOX失活常数总体上与一些研究者报道的豆类中LOX[13-15]的失活常数相当,说明猪肉和大豆中LOX在压力结合一定温度处理过程中稳定性相当。
2.2 压力对LOX失活常数的影响

表2 各温度条件下脂肪氧化酶失活的反应活化体积及参考压力条件下(450 MPa)的失活常数Table2 Activation volume and inactivation rate constants at referenced pressure (450 MPa) of lipoxygenase at different temperatures
如前所述,LOX的失活常数在某一特定温度条件下随压力的升高而增加,具体增加规律可用Eyring方程进行评价,利用SPSS的线性回归程序(方程(3))可以求得各温度条件下LOX的活化体积(Va)和参考压力下(450 MPa)失活常数的自然对数lnKrefP。由表2可知,各温度条件下活化体积均为负值,这也进一步说明在某一特定温度条件下失活常数是随压力的升高而增加的。活化体积的绝对值随温度的升高而增加,说明随着温度升高,压力对失活常数的影响程度也在增加,这与Wang Ren等[22]的研究结论有所差异,在其研究温度范围内(5~60 ℃),活化体积的绝对值先随温度的升高而增加,30 ℃时达最大值,然后逐渐减小。另外,本研究中得到的活化体积的绝对值要显著低于大豆中的[13-14],而比绿豆中的略高一些[15]。这些差异可能与不同食品中LOX性质、浓度的差异有关,也可能与LOX所处的体系环境不同有关。
2.3 温度对LOX失活常数的影响

表3 各压力条件下脂肪氧化酶失活的反应活化能及参考温度条件下(40 ℃)的失活常数Table3 Activation energy and inactivation rate constants at referenced temperature (40 ℃) of lipoxygenase at different pressures
由前面的研究可知,LOX的失活常数在某一特定压力条件下随温度的升高而增加,具体增加规律可用Arrhenius方程进行评价,利用SPSS的线性回归程序(方程(4))可以求得各压力条件下LOX的Ea和参考温度(40 ℃)条件下失活常数的自然对数lnKrefT,如表3所示。由表3可知,各压力条件下活化能均为正值,这也进一步说明在某一特定压力条件下失活常数是随温度的升高而增加的。从数值上看,活化能随压力的升高先增加,300 MPa时达到最大值,然后逐渐减小。说明300 MPa时,温度对失活常数的影响最为显著。本研究的结论与Indrawati等[15]研究绿豆时得到的结论一致,他们发现绿豆中LOX活化能也是随压力的升高先增加后减小。而王韧[14]研究大豆中LOX失活时发现在一定压力范围内(475~600 MPa),活化能随压力的升高而逐渐减小,与本研究结论略有不一致,这可能与其研究压力范围较窄有关。事实上,在本研究中若压力范围固定在450~600 MPa,活化能也随压力的升高而逐渐减小。另外,本研究中得到的LOX活化能大小与其他人研究大豆中LOX[13-14]时得到的数据一致,说明猪肉中和大豆中LOX的活化能值是大致相当的。
2.4 以Eyring方程为基础建立LOX失活的动力学模型

图1 活化体积随温度的变化Fig. 1 Effect of temperature on activation volume
从前面的研究可知,在整个研究的温度范围内,失活常数均随压力升高而增加,因此Eyring方程适用于整个压力区间。在Eyring方程中Va和lnKrefP均可表示为温度T的函数,根据表2的数据,LOX的Va随温度的变化趋势如图1所示。经曲线回归分析,发现用一次函数对其进行拟合精度较好,决定系数达0.981,因此用方程(5)表示Va随温度的变化。同样lnKrefP随温度的变化(图2)也可以用一次函数拟合(方程(6))。将方程(5)、(6)代入方程(3)得到方程(7),即是初步拟合的以Eyring方程为基础的LOX失活动力学模型。将表1数据代入方程(7)中,利用SPSS对方程(7)进行非线性回归分析,得到模型中各参数的估计值(表4),整个模型的决定系数为0.965。该模型得到的各处理条件下失活常数的预测值与实测值的关系如图3所示,可以看出该模型拟合程度较高,因此在一定的处理温度和压力范围内,可以用以Eyring方程为基础建立的LOX失活动力学模型来预测猪肉中LOX在不同处理条件下的失活常数。

图2 ln 2 lnKrefPrefP随温度的变化Fig. 2 Effect of temperature on lnKrefP

表4 猪肉中脂肪氧化酶高压失活数学模型参数估计值Table4 Estimated parameters of the mathematical models of pork lipoxygenase inactivation at high pressure

图3 模型预测(方程(7))和实验得到的K值对比Fig. 3 Comparison between experimentally determined and model (Eq.(7)) predicted K values
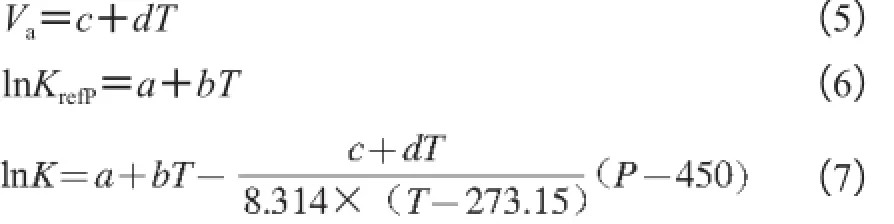
式中:a、b、c、d为模型参数;K为失活常数/min-1;P为处理压力/MPa;T为处理温度/℃;Va为活化体积/(cm3/mol);8.314为通用气体常数/(J/(mol·K));273.15为℃与K的转换常数;450为参考压力/MPa。
2.5 以Arrhenius方程为基础建立LOX失活的动力学模型
从前面的研究可知,在整个研究的压力范围内,失活常数均随温度升高而增加,因此Arrhenius方程适用于整个温度区间。在Arrhenius方程中Ea和lnKrefT均可表示为压力P的函数,根据表3中的数据,LOX的活化能随压力的变化趋势如图4所示,经过曲线回归分析,发现用三次函数对其进行拟合时精度高于比其他函数,决定系数为0.944,因此用方程(8)表示Ea随压力的变化。lnKrefT随压力的变化(图5)用一次函数拟合效果就很好,因此用方程(9)表示。将方程(8)、(9)代入方程(4)得到方程(10),即是初步拟合的以Arrhenius方程为基础的LOX失活动力学模型。将表1中的数据代入方程(10),利用SPSS对方程(10)进行非线性回归分析,得到模型中各参数的估计值,如表4所示,整个模型的决定系数为0.989,用该模型预测的各处理条件下的失活常数与实测的失活常数的关系如图6所示,同样可以看出,该模型的拟合程度也较好,因此在一定的处理温度和压力范围内,也可以用以Arrhenius方程为基础建立的LOX失活动力学模型来预测猪肉中LOX在不同处理条件下的失活常数。

式中:a、b、c、d、e、f为模型参数;K为失活常数/min-1;P为处理压力/MPa;T为处理温度/℃;Ea为活化能/(kJ/mol);8.314为通用气体常数/(J/(mol·K));313.15为参考温度/K。

图4 活化能随压力的变化Fig. 4 Effect of pressure on activation energy
在王韧[14]和Ludikhuyze[23]等对大豆的研究,及Indrawati等[15]对绿豆的研究中,因Arrhenius不适用于整个温度区间,故以Eyring方程为基础建立了LOX失活的动力学方程。Weemaes等[24]研究鳄梨时以Arrhenius方程为基础建立了多酚氧化酶的失活动力学模型;而Katsaros等[25]研究猕猴桃中蛋白酶失活时,同时以Arrhenius和Eyring方程为基础建立了失活动力学模型。本实验第一次在研究LOX失活时同时使用Arrhenius和Eyring方程为基础来建立酶失活的动力学模型,也第一次研究了肉类中LOX在高压处理中失活的动力学模型。从研究结果来看,两个动力学方程均具有较高的决定系数,因此在研究的处理温度(20~60 ℃)和压力(200~700 MPa)范围内均能较好的预测猪肉高压结合热处理过程中LOX活性的变化;从两者的对比来看,方程10的预测效果略高于方程(9),可能是由于方程(10)采用了三次函数来进行拟合,拟合结果更为精确,而在对方程(9)中Va和T进行拟合时,一次函数效果虽然很好,但其决定系数略低于二次和三次函数,为了简化结果,最终采用了一次函数。

图5 ln 5 lnKrefTrefT随压力的变化Fig. 5 Effect of pressure on lnKrefT
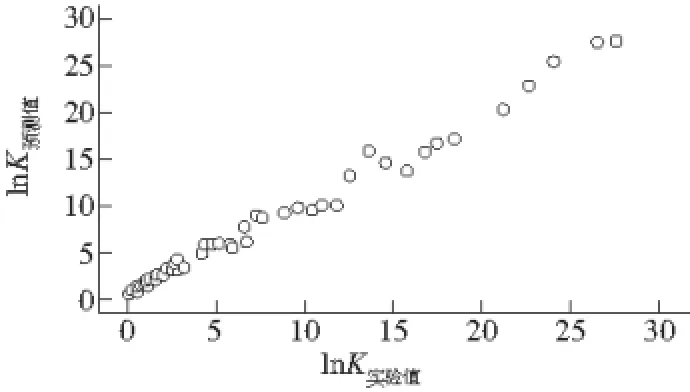
图6 模型预测(方程(10))和实验得到的K值的对比Fig. 6 Comparison between experimental determined and model (Eq.(10)) predicted K values
3 结 论
对猪肉进行高压处理过程中,当处理温度不变时,猪肉中脂肪氧化酶失活常数随压力(200~700 MPa)的增加而增加;同样,当处理压力不变时,失活常数随温度(20~60 ℃)的升高而增加。
各温度条件下脂肪氧化酶的活化体积均为负数,且其绝对值随温度的升高而增加,说明随着温度的升高,压力对失活常数的影响程度也在增加;各压力条件下脂肪氧化酶的活化能均为正值,其数值先随压力的升高而增加,300 MPa后随压力的升高而减小,说明300 MPa时,温度对失活常数的影响程度比其他压力条件下都要显著。
Arrhenius和Eyring方程分别适用于整个研究的温度区间和压力区间,分别以两者为基础可以建立脂肪氧化酶失活的动力学模型;两个动力学模型的决定系数分别达0.989和0.965,均在研究的处理温度(20~60 ℃)和压力(200~700 MPa)范围内能较好的预测猪肉高压结合热处理过程中脂肪氧化酶活性的变化。
[1] SHAHIDI F. 肉制品与水产品的风味[M]. 李洁, 朱国斌, 译. 2版.北京: 中国轻工业出版社, 2001: 5-69.
[2] FU Xiangjin, XU Shiying, WANG Zhang. Kinetics of lipid oxidation and off-odor formation in silver carp mince: the effect of lipoxygenase and hemoglobin[J]. Food Research International, 2009, 42(1): 85-90. DOI:10.1016/j.foodres.2008.09.004.
[3] 何立超, 赵见营, 田甜, 等. 樱桃谷鸭胸肉脂肪氧合酶的分离纯化及其酶学特性研究[J]. 食品科学, 2013, 34(7): 166-170.
[4] GERMAN J B, CREVELING R K. Identification and characterization of a 15-lipoxygenase from fish gills[J]. Journal of Agricultural and Food Chemistry, 1990, 38(12): 2144-2147. DOI:10.1021/jf00102a009.
[5] SAEED S, HOWELL N K. 12-Lipoxygenase activity in the muscle tissue of Atlantic mackerel (Scomber scombrus) and its prevention by antioxidants[J]. Journal of the Science of Food and Agriculture, 2001, 81(8): 745-750. DOI:10.1002/jsfa.878.
[6] 王卫东, 杨万根, 付湘晋. 白鲢鱼肌肉脂肪氧合酶的分离纯化与鉴定[J]. 食品科学, 2010, 31(23): 157-159.
[7] 马汉军. 高压和热结合处理对僵直后牛肉品质的影响[D]. 南京:南京农业大学, 2004: XI .
[8] CHEFTEL J C, CULIOLI J. Effects of high pressure on meat: a review[J]. Meat Science, 1997, 46(3): 211-236. DOI:10.1016/S0309-1740(97)00017-X.
[9] TORRES J A, VELAZQUEZ G. Commercial opportunities and research challenges in the high pressure processing of foods[J]. Journal of Food Engineering, 2005, 67(1/2): 95-112. DOI:10.1016/ j.jfoodeng.2004.05.066.
[10] 黄业传, 李凤, 严成. 高压促进猪肉肌内脂肪氧化过程中脂肪氧化酶的作用[J]. 食品工业科技, 2015, 36(14): 147-151. DIO:10.13386/ j.issn1002-0306.2015.14.022.
[11] 曹玉敏, 曲明椿, 陈芳, 等. 高静压技术对豆浆中脂肪氧合酶的钝化效果及其动力学分析[J]. 中国食品学报, 2012, 12(5): 110-115. DIO:10.16429/j.1009-7848.2012.05.023.
[12] LUDIKHUYZE L, INDRAWATI O, van den BROECK I, et al. Effect of combined pressure and temperature on soybean lipoxygenase. 1. influence of extrinsic and intrinsic factors on isobaric-isothermal inactivation kinetics[J]. Journal of Agricultural and Food Chemistry, 1998, 46(10): 4074-4080. DOI:10.1021/jf980256c.
[13] INDRAWATI I, van LOEY A M, LUDIKHUYZE L R, et al. Soybean lipoxygenase inactivation by pressure at subzero and elevated temperatures[J]. Journal of Agricultural and Food Chemistry, 1999, 47(6): 2468-2474. DOI:10.1021/jf9811875.
[14] 王韧. 超高压对大豆脂肪氧合酶、营养抑制因子和蛋白性质的影响[D]. 无锡: 江南大学, 2008: 21-49.
[15] INDRAWATI I, van LOEY A M, LUDIKHUYZE L R, et al. Kinetics of pressure inactivation at subzero and elevated temperature of lipoxygenase in crude green bean (Phaseolus vulgaris L.) extract[J]. Biotechnology Progress, 2000, 16(1): 109-115. DIO:10.1021/ bp9901419.
[16] INDRAWATI I, van LOEY A M, LUDIKHUYZE L R, et al. Single, combined, or sequential action of pressure and temperature on lipoxygenase in green beans (Phaseolus vulgaris L.): a kinetic inactivation study[J]. Biotechnology Progress, 1999, 15(2): 273-277. DIO:10.1021/bp990007o.
[17] INDRAWATI I, LUDIKHUYZE L R, van LOEY A M, et al. Lipoxygenase inactivation in green beans (Phaseolus vulgaris L.) due to high pressure treatment at subzero and elevated temperature[J]. Journal of Agricultural and Food Chemistry, 2000, 48(5): 1850-1859. DOI:10.1021/jf990937n.
[18] MONICA A, SOVRANO S. Kinetics of thermal inactivation of tomato lipoxygenase[J]. Food Chemistry, 2006, 95(1): 131-137. DOI:10.1016/ j.foodchem.2004.12.026.
[19] RODRIGO D, JOLIE R, van LOEY A, et al. Thermal and high pressure stability of tomato lipoxygenase and hydroperoxide lyase[J]. Journal of Food Engineering, 2007, 79(2): 423-429. DOI:10.1016/ j.jfoodeng.2006.02.005.
[20] JIN Guofeng, ZHANG Jianhao, YU Xiang, et al. Lipolysis and lipid oxidation in bacon during curing and drying-ripening[J]. Food Chemistry, 2010, 123(2), 465-471. DOI:10.1016/ j.foodchem.2010.05.031.
[21] GATA J L, PINTO M C, MACIAS P. Lipoxygenase activity in pig muscle: purification and partial characterization[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2573-2577. DOI:10.1021/jf960149n.
[22] WANG Ren, ZHOU Xing, CHEN Zhengxing. High pressure inactivation of lipoxygenase in soy milk and crude soybean extract[J]. Food Chemistry, 2008, 106(2): 603-611. DOI:10.1016/ j.foodchem.2007.06.056.
[23] LUDIKHUYZE L, INDRAWATI I, van den BROECK I, et al. Effect of combined pressure and temperature on soybean lipoxygenase. 2. modeling inactivation kinetics under static and dynamic conditions[J]. Journal of Agricultural and Food Chemistry, 1998, 46(10): 4081-4086. DOI:10.1021/jf9802575.
[24] WEEMAES C A, LUDIKHUYZE L R, van den BROECK I, et al. Kinetics of combined pressure-temperature inactivation of avocado polyphenoloxidase[J]. Biotechnology and Bioengineering, 1998, 60(3): 292-300. DOI:10.1002/(SICI)1097-0290(19981105)60:3<292::AIDBIT4>3.0.CO;2-C.
[25] KATSAROS G I, KATAPODIS P, TAOUKIS P S. Modeling the effect of temperature and high hydrostatic pressure on the proteolytic activity of kiwi fruit juice[J]. Journal of Food Engineering, 2009, 94(1): 40-45. DOI:10.1016/j.jfoodeng.2009.02.026.
Modeling the Effect of Combined Thermal and High Pressure Treatment on Inactivation of Lipoxygenase in Pork
HUANG Yechuan, LI Feng, WU Zhaomin
(College of Life Science and Engineering, Southwest University of Science and Technology, Mianyang 621010, China)
This study aimed to investigate the effect of high pressure processing on lipoxygenase (LOX) activity in pork. Pork Longissimus dorsi muscles were treated in the pressure range of 200-700 MPa and in the temperature range of 20-60 ℃. Changes in LOX inactivation rate constants were studied, and kinetic models of LOX inactivation based on Arrhenius and Eyring equation were established, respectively. The results showed that the inactivation rate constants increased with increasing pressure in the studied temperature range, and increased with increasing temperature in the studied pressure range. The Arrhenius and Eyring equations were suitable for the whole temperature and pressure ranges, respectively. Both the Arrhenius and Eyring kinetic models had a good f tting degree with high R2values (0.989 and 0.965, respectively). Thus, the regression models could well predict changes in LOX activity in pork during combined thermal and high pressure processing in a certain range of pressure and temperature.
pork; high pressure; thermal treatment; lipoxygenase; kinetic model
10.7506/spkx1002-6630-201702006
TS251.1
A
1002-6630(2017)02-0034-06
黄业传, 李凤, 吴照民. 猪肉脂肪氧化酶在高压结合热处理过程中失活动力学模型[J]. 食品科学, 2017, 38(2): 34-39. DOI:10.7506/spkx1002-6630-201702006. http://www.spkx.net.cn
HUANG Yechuan, LI Feng, WU Zhaomin. Modeling the effect of combined thermal and high pressure treatment on inactivation of lipoxygenase in pork[J]. Food Science, 2017, 38(2): 34-39. (in Chinese with English abstract)
10.7506/ spkx1002-6630-201702006. http://www.spkx.net.cn
2016-03-18
国家自然科学基金面上项目(31271892);四川省生物质资源利用与改性工程技术研究中心科研创新团队建设基金项目(14tdgc03)
黄业传(1975—),男,副教授,博士,研究方向为肉制品加工与食品酶技术。E-mail:55238861@qq.com

