转录因子OsEIL2正调控水稻对纹枯病的抗性
石彦龙, 徐国娟, 王旭丽, 王国梁
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
转录因子OsEIL2正调控水稻对纹枯病的抗性
石彦龙, 徐国娟, 王旭丽*, 王国梁*
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
纹枯病(sheath blight)是水稻三大病害之一,对水稻产量和品质造成严重影响。基因芯片数据分析发现,水稻受到纹枯病菌侵染时,与拟南芥EIN3同源的基因OsEIL2表达量显著升高,预示OsEIL2与水稻对纹枯病的抗性反应相关。利用农杆菌介导的方法,构建了OsEIL2-RNAi植株,实时荧光定量RT-PCR分析表明,该基因被特异性沉默,接种结果显示,OsEIL2沉默后,水稻对纹枯病菌感病性增强。通过水稻原生质体和烟草亚细胞定位分析,发现该基因定位于细胞核,酵母单杂交结果表明,该基因具有转录激活活性。在OsEIL2-RNAi植株中,乙烯合成关键酶的编码基因OsACO1表达量下降。综上,OsEIL2是一个与拟南芥EIN3蛋白同源的转录因子,能正调控水稻对纹枯病的抗性。
水稻; 纹枯病; 抗病; OsEIL2; 转录因子
水稻是全球种植最普遍的农作物之一,超过半数的人口以稻米为主食[1]。各种病虫害的发生是造成水稻产量损失的主要因素,如,由立枯丝核菌Rhizoctoniasolani引起的水稻纹枯病(rice sheath blight)。该病是水稻世界性病害,一般发生时可造成减产10%~30%,严重时可达50%[2]。由于水稻对纹枯病的抗性属于典型的数量性状,迄今未发现免疫或高抗种质,抗病育种一直进展缓慢,加之近年来矮化育种及高肥密植栽培技术的采用,由纹枯病造成的危害逐渐加重,在我国南方部分稻区已被认为是水稻第一大病害。水稻纹枯病菌是一种死体营养型病原真菌,现有研究表明,植物对该类病菌的防卫反应通常涉及乙烯(ethylene,ET)、 茉莉酸(jasmonic acid,JA)两种植物激素信号通路[3]。Helliwell等[4]将乙烯合成途径中的一个关键酶1-氨基环丙烷-1羧酸合成酶(1-aminocyclopropane-1-carboxylic acid synthase,OsACS2)的编码基因在水稻中过表达后,内源乙烯含量明显升高,转基因植株对纹枯病的抗性显著增强,表明乙烯参与水稻对纹枯病的抗性。
乙烯是一种内源植物气体激素,在植物生长发育及对生物和非生物胁迫响应等许多方面起着重要作用[5-6]。通过遗传学方法,现已鉴定出了拟南芥中乙烯信号传导途径中的重要基因,初步描绘出了一条近似线性的乙烯信号传导途径。当乙烯不存在时,乙烯受体蛋白可结合并激活CTR1(constitutive triple response 1),从而抑制下游转录因子EIN2(ethylene insensitive 2)和EIN3/EIL(ethylene insensitive 3/EIN3-like),使其处于非激活状态;受体蛋白一旦结合乙烯,则阻止其与CTR1的结合及其激酶活性的激活,下游反应也不再受抑制,EIN2进而激活EIN3/EIL,触发转录级联反应,建立乙烯响应[7-9]。
目前,EIN3/EILs被认为是乙烯、茉莉酸和水杨酸(salicylic acid, SA)信号通路交汇的节点,并通过这些信号通路参与植物防卫反应[10-12],促进植物选择合适的防御策略应对不同生活类型的病原菌[13-15]。因此推测水稻中EIN3/EILs蛋白在抗病反应中具有重要作用,通过同源克隆的方法,在水稻中发现了6个EIN3/EIL蛋白[16]。Yang等[17]发现,OsEIL1和OsEIL2沉默后,水稻对盐胁迫耐受性增强,但EIN3/EILs家族在水稻对纹枯病抗性中的作用还未见报道。本研究通过基因芯片技术,发现水稻受到纹枯菌侵染时,与拟南芥EIN3同源的转录因子OsEIL2的编码基因表达量显著升高。OsEIL2的表达定位于细胞核内,在酵母中表现出很强的转录激活活性,该基因沉默后,乙烯合成途径中的一个关键酶1-氨基环丙烷-1-羧酸氧化酶(1-aminocyclopropane-1-carboxylic acid oxidase1, OsACO1)的编码基因表达量显著降低,水稻对纹枯病菌感病性显著增强。对该基因的研究,将有助于水稻中乙烯信号通路的解析及乙烯参与抗病的分子机制的研究,可为培育持久广谱抗病水稻新品种提供新思路。
1 材料和方法
1.1 材料和试剂
水稻品种‘日本晴’及纹枯菌YN-7菌系为本实验室保存,转化用水稻品种‘泰粳394’(TG394)为扬州大学左示敏老师惠赠;载体pENTR、pDBL03为浙江省农业科学院瞿绍洪老师惠赠,pCaMV35S:mVenus载体由北京农林科学院农业生物技术研究中心姚磊博士馈赠,pDBLeu载体为本实验室保存;Gateway LR Clonase II Enzyme Mix试剂盒购自Invitrogen公司,各种限制性内切酶及T4 DNA连接酶购自Fermentas公司,其他试剂为国产分析纯。引物合成及测序由北京华大基因公司完成。
1.2 试验方法
1.2.1 纹枯菌的接种及病情调查
参照王子斌等[18]和徐国娟等[19]的方法,并略作改动。即从马铃薯葡萄糖琼脂培养基(Becton Dickinson and Company公司)上用打孔器打取菌饼,将菌饼菌丝面紧贴水稻茎基部进行接种。接种7 d后调查每株幼苗的相对病级。相对病级=(病斑攀升高度/植株地上部高度)×9,通过DPS 3.01对各品种的相对病级进行方差分析,并用最小显著差异法(LSD法) 进行品种间病级的多重比较。
1.2.2 RNA提取、反转录及qRT-PCR分析
按照产品使用说明,用TRIzol(Invitrogen)从水稻叶片中提取总RNA,用DNaseI(全式金)去除RNA中的DNA,然后取2 μg RNA用M-MLV(Promega)反转录酶合成第一链cDNA。
在进行qRT-PCR前,先将cDNA稀释20倍,然后用BIO-RAD iQ2实时荧光定量PCR仪进行定量检测,20 μL反应体系包括:稀释后的cDNA 5 μL, SYBR Premix ExTaq(TaKaRa)10 μL,正反引物各1 μL,以及超纯水 3 μL。程序如下:95℃预变性30 s;95℃变性15 s,55℃退火30 s,72℃延伸30 s,48个循环;然后建立熔解曲线,55℃保持30 s,每30 s升温0.5℃,递增到95℃,共进行81个循环。每个样品3次重复,以Actin或Ubiquitin(表1)做内参,用2-ΔCt法取3次重复的平均值,用GraphPad Prism 5.01作图并进行方差分析和多重比较。
1.2.3 OsEIL2分离及克隆
按照上述方法获得‘日本晴’cDNA,根据MSU(http:∥rice.plantbiology.msu.edu/)数据库中的注释,设计特异性引物:OsEIL2-F和OsEIL2-R(表1),然后通过高保真聚合酶Fast-pfu(全式金)和RT-PCR获得OsEIL2 (LOC_Os07g48630)的全长编码序列,最后按照产品说明书将其连接至pEASY-Blunt(全式金)平末端载体上,将获得的pEASY-Blunt-OsEIL2载体用M13-F/R引物测序,检测是否有突变。
1.2.4 载体构建
OsEIL2-RNAi载体的构建采用Gateway技术,先用特异性引物OsEIL2-Ri-F和OsEIL2-Ri-R(表1)扩增出OsEIL2编码序列起始密码子后的939~1 239 bp区段,酶切连接至入门载体pENTR,测序正确后,利用Gateway LR Clonase II Enzyme Mix试剂盒与pBDL03进行重组反应构建得到OsEIL2-RNAi载体。
为了确定OsEIL2的亚细胞定位,将1.2.3中获得的OsEIL2编码序列全长,通过XbaI和XhoI位点连接到黄色荧光蛋白mVenus的氨基端编码序列前,获得花椰菜花叶病毒(CaMV)35S启动子调控的载体pCaMV35S:OsEIL2-mVenus。
为了验证OsEIL2蛋白的转录激活功能,用特异性引物:pDBLeu-OsEIL2-F和pDBLeu-OsEIL2-R(表1),以pEASY-Blunt-OsEIL2为模板进行PCR扩增,然后用酶切和T4 DNA连接酶连接的方法融合到pDBLeu载体的GAL4 DNA结合域读码框后,获得pDBLeu-OsEIL2载体。
表1 文中所用引物列表
Table 1 Primers used in this study
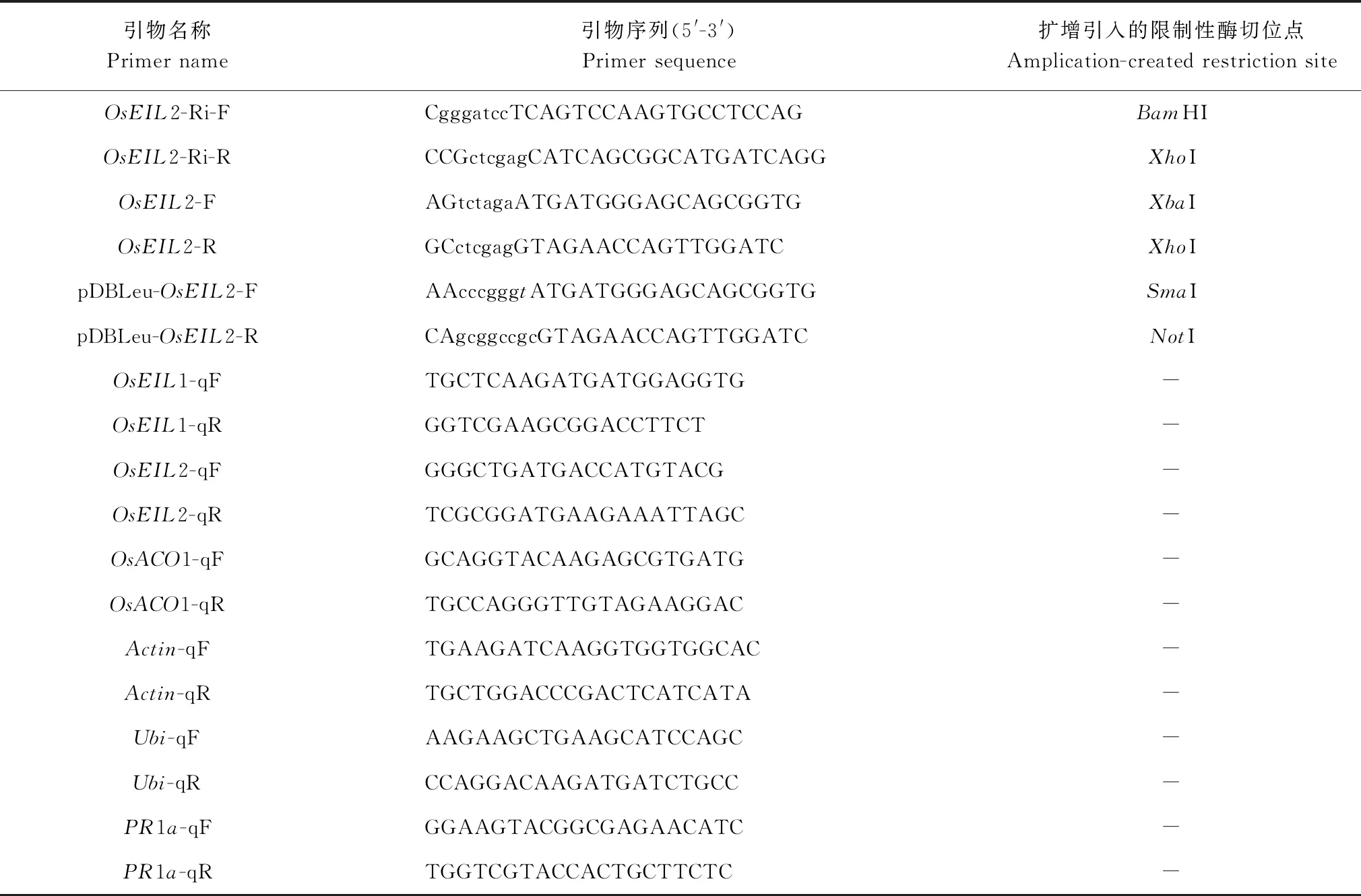
引物名称Primername引物序列(5'-3')Primersequence扩增引入的限制性酶切位点Amplication-createdrestrictionsiteOsEIL2-Ri-FCgggatccTCAGTCCAAGTGCCTCCAGBamHIOsEIL2-Ri-RCCGctcgagCATCAGCGGCATGATCAGGXhoIOsEIL2-FAGtctagaATGATGGGAGCAGCGGTGXbaIOsEIL2-RGCctcgagGTAGAACCAGTTGGATCXhoIpDBLeu-OsEIL2-FAAcccgggtATGATGGGAGCAGCGGTGSmaIpDBLeu-OsEIL2-RCAgcggccgcGTAGAACCAGTTGGATCNotIOsEIL1-qFTGCTCAAGATGATGGAGGTG-OsEIL1-qRGGTCGAAGCGGACCTTCT-OsEIL2-qFGGGCTGATGACCATGTACG-OsEIL2-qRTCGCGGATGAAGAAATTAGC-OsACO1-qFGCAGGTACAAGAGCGTGATG-OsACO1-qRTGCCAGGGTTGTAGAAGGAC-Actin-qFTGAAGATCAAGGTGGTGGCAC-Actin-qRTGCTGGACCCGACTCATCATA-Ubi-qFAAGAAGCTGAAGCATCCAGC-Ubi-qRCCAGGACAAGATGATCTGCC-PR1a-qFGGAAGTACGGCGAGAACATC-PR1a-qRTGGTCGTACCACTGCTTCTC-
1.2.5 水稻转化
水稻转化由北京大北农生物科技中心完成,以‘TG394’为受体材料,用农杆菌介导的转化方法将OsEIL2-RNAi载体转入水稻愈伤;从公司获得转基因植株,在廊坊温室种植、鉴定和繁种。
1.2.6 植物材料
水稻种子脱壳后,按照Park等[20]的方法进行表面消毒,然后均匀铺于1/2MS培养基上催芽,以保证起始长势一致。于光照培养箱中培养一周后,将水稻幼苗移栽于廊坊温室土壤中,一个月左右进行接种。
烟草Nicotianabenthamiana种子用同样的方法催芽后移栽到32穴穴盘中,在生长室中培养,4~6周后注射农杆菌。
1.2.7 农杆菌侵染烟草试验
在烟草中,按照Ning等[21]的方法,通过农杆菌介导的瞬时表达系统进行亚细胞定位。首先将pCaMV35S:OsEIL2-mVenus载体用电击转化法导入农杆菌EHA105中,然后挑选阳性菌株与P19分别在28℃摇床中220 r/min摇动培养,接着离心收集农杆菌菌体,将两者A600分别调整为1.5和1.0后1∶1混合,黑暗处静置3 h后,选择生长状态一致的烟草叶片进行注射。
3 d后,用蔡司LSM780倒置激光共聚焦扫描显微镜进行观察。DAPI染色时,在观察前将其注入烟草叶片,DAPI和mVenus分别用405 nm和514 nm激光激发,发射光检测波长分别为410~503 nm和519~621 nm,物镜为40×、数值孔径为1.3的油镜。
1.2.8 水稻原生质体的制备与转化
水稻原生质体的制备及亚细胞定位的方法参见Zhang等[22]的方法进行。将10~12 d左右的水稻黄化苗的茎秆部分切成0.5 mm左右大小,然后在酶解液(1.0%纤维素酶RS,0.5%离析酶R-10,0.6 mol/L甘露醇,10 mmol/L MES,pH 5.7,10 mmol/L CaCl2和0.1% BSA)中酶解5~7 h;酶解结束,用40 μm尼龙筛过滤获得滤液,离心收集其中的原生质体,用PEG介导的转化方法,将目的质粒和对照质粒分别转化到获得的原生质体中,培养16~36 h后,通过激光共聚焦扫描显微镜观察。DAPI染色时,将DAPI与转化的原生质体混匀,使DAPI终浓度为20 μg/mL,放置5 min左右观察,拍照方法同上。
1.2.9 酵母转录激活活性分析
按照酵母转化试剂盒(Alkali Cation Yeast Transformation Kit,MP Biomedicals)说明书,将目标质粒pDBLeu-OsEIL2和对照质粒pDBLeu分别转入酵母菌株Mav203;30℃生长3 d左右,挑选单个阳性转化子,30℃摇床220 r/min条件下摇动培养,然后用无菌蒸馏水稀释,获得1、10-1、10-2、10-34个浓度梯度,每个浓度各吸取6 μL分别在含有0 mmol/L和70 mmol/L 3-AT(Sigma)的亮氨酸和组氨酸缺陷型培养基SD/-Leu-His平板上培养,根据其生长情况分析其转录活性。
2 结果与分析
2.1 OsEIL2克隆与序列分析
根据基因芯片数据,发现LOC_Os07g48630在接种纹枯菌后表达量显著上调。通过基因登录号在Rice Genome Annotation Project网站(http:∥rice.plantbiology.msu.edu/Analyses_Search_locus.shtml)搜索该基因,发现其位于7号染色体上,具有2个剪接变体,但只有非编码区序列不同,因此编码相同的氨基酸,编码区核苷酸序列长1 782 bp,编码593个氨基酸,分子量65.1 kD,等电点5.213 4。根据Mao等[16]的研究,将该基因命名为OsEIL2,其编码的蛋白质与拟南芥EIN3同源,属于EIN3/EILs转录因子家族(图1),在乙烯信号传导通路中具有重要作用。通过RT-PCR方法,本研究克隆了OsEIL2的全长编码序列。
2.2 OsEIL2在OsEIL2-RNAi转基因水稻中的表达受到特异性抑制
由于该基因在抗病反应中表达量上调,为研究其功能,便选取OsEILs家族中不太保守的位于OsEIL2 3′端的300个碱基对,构建OsEIL2-RNAi载体。由于OsEIL1和OsEIL2的相似性最高(图1a),因此为了进一步确定基因沉默的特异性,通过实时荧光定量RT-PCR分别检测两者在OsEIL2-RNAi水稻和野生型‘TG394’中的表达量。如图2a所示,与‘TG394’相比,OsEIL2在6号株系中的表达显著下调,而在2、21、22、25号株系中则极显著下调,而OsEIL1在各转基因植株中的表达与对照间无显著差异(图2b)。以上结果表明OsEIL2在其RNAi植株中的表达受到了特异性抑制。

图1 水稻OsEILs蛋白与拟南芥AtEIN3进化关系Fig.1 Phylogenetic relationship of rice OsEILs and Arabidopsis EIN3

图2 转基因水稻中OsEIL2的表达受到特异性抑制Fig.2 The expression of OsEIL2 is specifically suppressed in the transgenic rice
2.3 OsEIL2-RNAi转基因水稻对纹枯病的感病性增强
本研究选择表达量显著下调的OsEIL2-RNAi株系做了进一步的抗病性检测,鉴定结果表明(表2),抗病对照‘YSBR1’与感病对照 ‘Lemont’间差异达极显著水平,说明鉴定试验可靠。OsEIL2-RNAi株系比野生型均更加感病(图3),平均病情指数比野生型高1.5以上,在0.01显著水平上,OsEIL2-RNAi转基因植株病情指数与野生型间均存在显著差异。以上结果表明OsEIL2在水稻对纹枯病的抗性中起着正调控作用。

图3 OsEIL2-RNAi转基因水稻接种纹枯病菌表型Fig.3 Phenotype of OsEIL2-RNAi transgenic events inoculated with Rhizoctonia solani
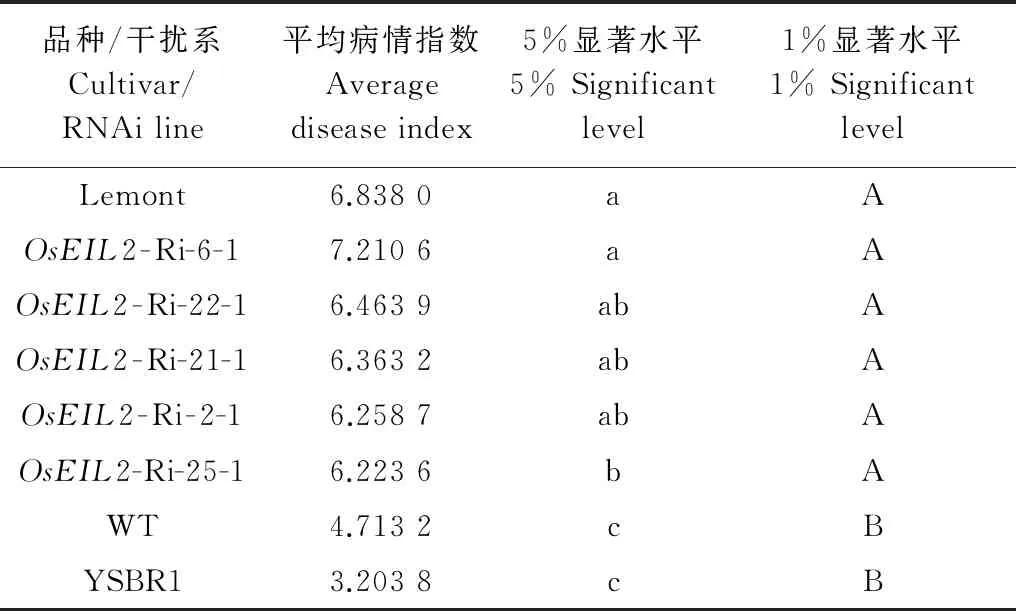
品种/干扰系Cultivar/RNAiline平均病情指数Averagediseaseindex5%显著水平5%Significantlevel1%显著水平1%SignificantlevelLemont6.8380aAOsEIL2-Ri-6-17.2106aAOsEIL2-Ri-22-16.4639abAOsEIL2-Ri-21-16.3632abAOsEIL2-Ri-2-16.2587abAOsEIL2-Ri-25-16.2236bAWT4.7132cBYSBR13.2038cB
1) WT表示野生型植株,‘Lemont’和‘YSBR1’分别为高感和抗病对照;平均病情指数为15个生物学重复的平均值,方差分析和多重比较通过DPS 3.01完成,小写字母不同代表差异显著(P<0.05),大写字母不同表示差异极显著(P<0.01)。 WT: Wild type. ‘Lemont’ is a highly susceptible variety; ‘YSBR1’ is a resistant variety; average disease scores are the means of 15 biological replicates; analyses of variety and multiple comparison test are completed using DPS 3.01 and different lowercase letters represent significant differences (P<0.05) while different capital letters represent highly significant differences (P<0.01).
2.4 OsEIL2定位于水稻和烟草细胞核
蛋白序列分析表明,OsEIL2包含一个核定位信号,预示其可能定位于细胞核。本研究分别采用水稻原生质体系统和烟草瞬时表达系统对其亚细胞定位进行研究。激光共聚焦扫描显微镜照片(图4)显示,OsEIL2-mVenus融合蛋白的荧光特异性地出现在转染化细胞的细胞核部位,且能与细胞核指示剂DAPI的蓝色荧光很好地叠加,而空白载体对照的黄色荧光(为便于与DAPI叠加,此处用绿色代表其荧光信号)则出现在细胞的各个部位,表明OsEIL2特异性地在水稻原生质体和烟草叶肉细胞的细胞核中表达。
2.5 OsEIL2在酵母中具有转录激活功能
为了检测OsEIL2是否具有转录活性,进行了酵母单杂交试验。由于酵母Mav203本身有一定的组氨酸本底表达,所以转化pDBLeu-OsEIL2载体和对照空载体的酵母在选择培养基(selective dropout-leucine-histidine,SD-L-H)上都能正常生长(图5a)。但是,当在SD-L-H培养基中加入组氨酸合成酶竞争性抑制剂3-氨基-1,2,4-三唑(3-amino-1, 2,4-triazole, 3-AT)后,只有转化pDBLeu-OsEIL2载体的酵母生长正常,而转化pDBLeu空载体的酵母不生长(图5b),表明OsEIL2具有激活报告基因表达的功能,即具有转录激活功能。
2.6 OsACO1在OsEIL2-RNAi植株中的表达受抑制
植物的抗病反应常常与SA和ET/ JA之间的协同或拮抗有关,为了进一步探究OsEIL2介导的对纹枯病的抗性机制,我们通过qRT-PCR的方法,检测了在OsEIL2-RNAi植株中,PR1a、OsACO1等植物激素标记基因的表达情况。结果表明,OsEIL2沉默后,一个乙烯合成关键酶的编码基因OsACO1表达量显著下调(图6a),而SA通路的相关基因的表达无明显变化(图6b)。
3 讨论
水稻全基因组测序的完成、生物信息学和转基因技术的飞速发展为水稻基因的研究提供了极大的便利。本研究基于基因芯片数据,对接种纹枯菌后差异表达的基因进行筛选,发现OsEIL2的表达受纹枯菌的诱导,OsEIL2蛋白与拟南芥EIN3转录因子同源,预测发现该蛋白包含一个核定位信号,通过水稻原生质体和烟草叶肉细胞证实其定位于细胞核,并具有转录激活的特性,进一步接种发现OsEIL2正调控水稻对纹枯病的抗性。

图4 OsEIL2在水稻原生质体和本生烟中的亚细胞定位Fig.4 Subcellular localization of OsEIL2 in rice protoplast and Nicotiana benthamiana

图5 酵母中OsEIL2转录活性分析Fig.5 Transactivation analysis of OsEIL2 protein in yeast
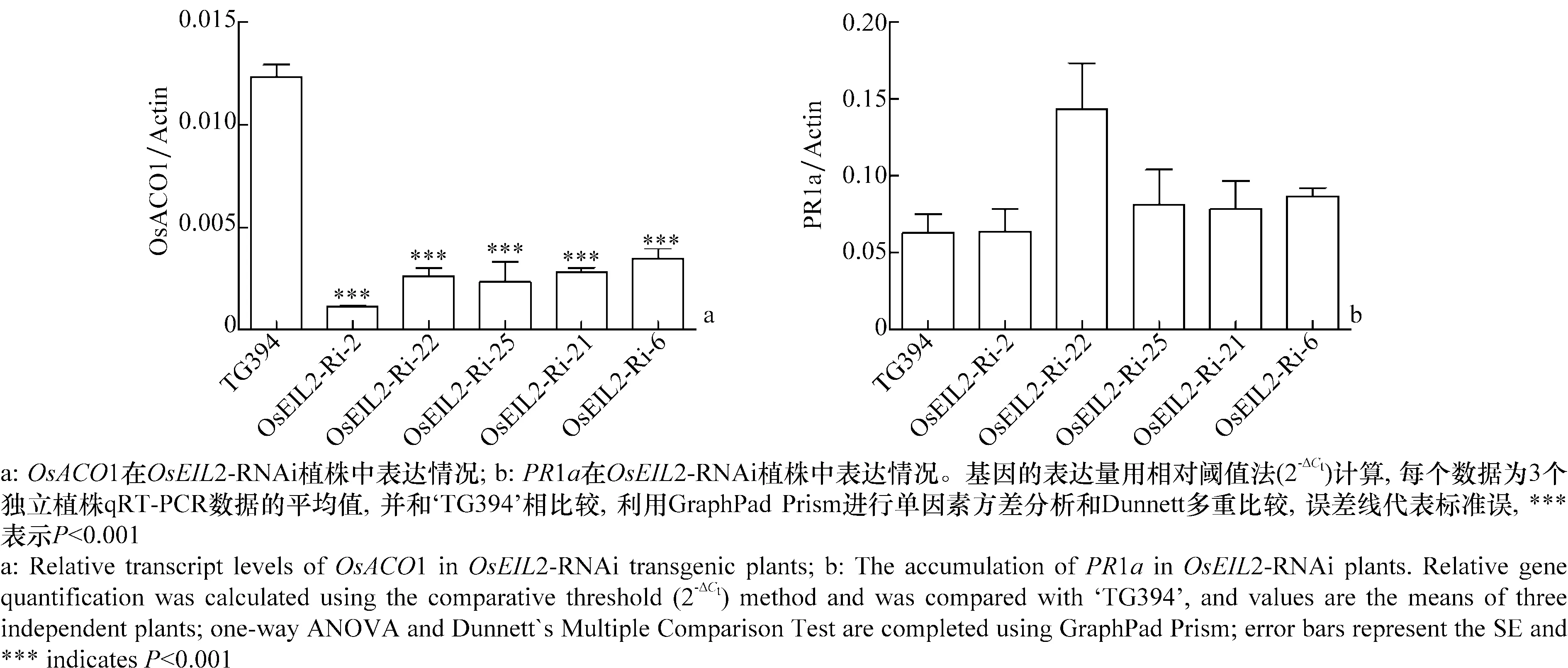
图6 OsACO1和PR1a在OsEIL2-RNAi 植株中的表达情况Fig.6 The expression of OsACO1 and PR1a in OsEIL2-RNAi transgenic lines
Mao等[16]的研究表明,在OsEIL1超表达水稻中OsACO1的表达上调,与其结果相一致,在OsEIL2-RNAi植株中,乙烯合成基因OsACO1(图6)的表达显著下调,然而这个结果与Jun等[23]的结果相矛盾,他们发现在OsEIN2沉默植株中的OsACO1的表达上升。OsACOs催化乙烯合成的最后一步反应,将ACC氧化成乙烯[24]。已经知道,在拟南芥中,EIN3等乙烯转录因子还受到负反馈调节机制的调控,乙烯处理能够上调 F-box蛋白EBF2的转录,而EBF2能识别、结合并介导EIN3的降解,从而使乙烯反应不至于过强[25-26],因此推测OsEIL2与OsACO1之间也存在某种反馈调节,具体机制需要进一步探索。
在双子叶植物中,已经证明ET和JA介导的抗病机制在植物防卫反应中具有重要作用,尤其是对死体营养型病原菌,而SA介导的系统获得性抗性通常对活体和半活体营养型病原菌有效[27-29]。纹枯菌是死体营养型病原菌[30],OsEIL2-RNAi植株中OsACO1的表达下降,推测内源乙烯的合成受到影响,导致更加感病,而SA通路相关基因无明显变化,这与之前的研究相一致,进一步说明针对不同类型的病原菌单子叶和双子叶植物可能有相同的抗病响应机制。Helliwell等[4]通过转基因技术将内源乙烯合成量增加后,水稻对纹枯病抗性增强,这从反面印证了本研究的结果,但其发现PR基因表达的升高是对纹枯病抗性增强的原因之一,而本研究则未发现PR基因表达的降低。这些矛盾的结果,使全面研究乙烯合成、乙烯信号传导和其他因子在OsEIL2介导的水稻抗病反应中的作用变得十分必要。
综上,本研究发现OsEIL2蛋白可能通过参与调控乙烯信号传导途径并反馈乙烯合成途径影响乙烯激素的合成,进而调节水稻对纹枯病的抗性,该结果不仅为研究水稻中该类EIN3转录因子参与抗病的重要功能揭开序幕,而且可为揭示寄主植物对不同类型病原菌表现出不同抗病反应的分子机制提供重要的理论基础。
[1] Nguyen N V, Ferrero A.Meeting the challenges of global rice production [J]. Paddy and Water Environment, 2006, 4: 1-9.
[2] 张楷正, 李平, 李娜, 等. 水稻抗纹枯病种质资源、抗性遗传和育种研究进展[J]. 分子植物育种, 2006(5): 713-720.
[3] Bari R, Jones J D G.Role of plant hormones in plant defence responses [J]. Plant Molecular Biology, 2009, 69(4): 473-488.
[4] Helliwell E E, Wang Qin, Yang Yinong. Transgenic rice with inducible ethylene production exhibits broad-spectrum disease resistance to the fungal pathogensMagnaportheoryzaeandRhizoctoniasolani[J]. Plant Biotechnology Journal, 2013, 11(1): 33-42.
[5] Yang Shangfa, Hoffman N E.Ethylene biosynthesis and its regulation in higher plants [J]. Annual Review of Plant Physiology, 1984, 35(1): 155-189.
[6] Johnson P, Ecker J R.The ethylene gas signal transduction pathway: a molecular perspective[J]. Annual Review of Genetics, 1998, 32(4): 227-254.
[7] Alonso J M, Stepanova A N.The ethylene signaling pathway[J]. Science, 2004, 306(5701): 1513-1515.
[8] Guo Hongwei, Ecker J R.The ethylene signaling pathway: new insights [J]. Current Opinion in Plant Biology, 2004, 7(1): 40-49.
[9] Chen Yifeng, Etheridge N, Schaller G E.Ethylene signal transduction [J]. Annals of Botany, 2005, 95(6): 901-915.
[10]Anderson J P, Badruzsaufari E, Schenk P M, et al. Antagonistic interaction between abscisic acid and jasmonate-ethylene signaling pathways modulates defense gene expression and disease resistance inArabidopsis[J]. Plant Cell, 2004, 16(12):3460-3479.
[11]Wildermuth M C, Dewdney J, Wu Gang, et al. Isochorismate synthase is required to synthesize salicylic acid for plant defence[J]. Nature, 2001, 414(6863): 562-565.
[12]Chen Huamin, Li Xue, Chintamanani S, et al. Ethylene insensitive3 and ethylene insensitive3-like1 repress salicylic acid induction deficient2 expression to negatively regulate plant innate immunity inArabidopsis[J]. The Plant Cell, 2009, 21(8): 2527-2540.
[13]Pieterse C M J, Leon-Reyes A, van der Ent S, et al. Networking by small-molecule hormones in plant immunity [J]. Nature Chemical Biology, 2009, 5(5): 308-316.
[14]Verhage A, van Wees S C M, Pieterse C M J.Plant immunity: it’s the hormones talking, but what do they say?[J]. Plant Physiology, 2010, 154(2): 536-540.
[15]Adie B A, Pérez-Pérez J, Pérez-Pérez M M, et al. ABA is an essential signal for plant resistance to pathogens affecting JA biosynthesis and the activation of defenses inArabidopsis[J]. The Plant Cell, 2007, 19(5): 1665-1681.
[16]Mao Chuanzao, Wang Shaomin, Jia Qiaojun, et al.OsEIL1, a rice homolog of theArabidopsisEIN3 regulates the ethylene response as a positive component [J]. Plant Molecular Biology, 2006, 61: 141-152.
[17]Yang Chao, Ma Biao, He Sijie, et al.MAOHUZI6/ETHYLENEINSENSITIVE3-LIKE1 andETHYLENEINSENSITIVE3-LIKE2 regulate ethylene response of roots and coleoptiles and negatively affect salt tolerance in rice [J]. Plant Physiology, 2015, 169(1): 148-165.
[18]王子斌, 左示敏, 李刚, 等. 水稻抗纹枯病苗期快速鉴定技术研究[J]. 植物病理学报, 2009, 39(2): 174-182.
[19]徐国娟, 袁正杰, 左示敏, 等. 水稻苗期纹枯病抗性鉴定微室接种技术的改良[J]. 中国水稻科学, 2015, 29(1): 97-105.
[20]Park C H, Chen Songbiao, Shirsekar G, et al. TheMagnaportheoryzaeeffector AvrPiz-t targets the RING E3 ubiquitin ligase APIP6 to suppress pathogen-associated molecular pattern-triggered immunity in rice [J].The Plant Cell,2012,24(11):4748-4762.
[21]Ning Yuese, Xie Qi, Wang Guoliang. OsDIS1-mediated stress response pathway in rice[J]. Plant Signaling & Behavior, 2011, 6(11): 1684-1686.
[22]Zhang Yang, Su Jianbin, Duan Shan, et al. A highly efficient rice green tissue protoplast system for transient gene expression and studying light/chloroplast-related processes [J]. Plant Methods, 2011, 7(1): 30-44.
[23]Jun Sunghoon, Han Minjung, Lee Shinyoung, et al. OsEIN2 is a positive component in ethylene signaling in rice [J]. Plant & Cell Physiology, 2004, 45(3): 281-289.
[24]Wang K L, Li Hai, Ecker J R.Ethylene biosynthesis and signaling networks [J]. The Plant Cell, 2002, 14(S):131-151.
[25]Gagne J M, Smalle J, Gingerich D J, et al.ArabidopsisEIN3-binding F-box 1 and 2 form ubiquitin-protein ligases that repress ethylene action and promote growth by directing EIN3 degradation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(17): 6803-6808.
[26]Potuschak T, Lechner E, Parmentier Y, et al. EIN3-Dependent regulation of plant ethylene hormone signaling by twoArabidopsisF box proteins: EBF1 and EBF2 [J].Cell,2003,115(6):679-689.
[27]Penninckx I A M A, Thomma B P H J, Buchala A, et al. Concomitant activation of jasmonate and ethylene response pathways is required for induction of a plant defensin gene inArabidopsis[J]. The Plant Cell, 1998, 10(12): 2103-2113.
[28]Glazebrook J.Contrasting mechanisms of defense against biotrophic and necrotrophic pathogens [J]. Annual Review of Phytopathology, 2005, 43(1): 205-227.
[29]Thomma B P H J, Eggermont K, Penninckx I A M A, et al. Separate jasmonate-dependent and salicylate-dependent defense-response pathways inArabidopsisare essential for resistance to distinct microbial pathogens [J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(25): 15107-15111.
[30]Zhao Changjiang, Wang Airong, Shi Yujun, et al. Identification of defense-related genes in rice responding to challenge byRhizoctoniasolani[J]. Theoretical & Applied Genetics, 2008, 116(4): 501-516.
(责任编辑:田 喆)
Transcription factor OsEIL2 positively regulates rice resistance to sheath blight
Shi Yanlong, Xu Guojuan, Wang Xuli, Wang Guoliang
(StateKeyLaboratoryforBiologyofPlantDiseasesandInsectPests,InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
Sheath blight, caused byRhizoctoniasolani, is one of the three most destructive diseases in rice (Oryzasativa), which causes severe yield losses and bad quality under favorable disease conditions. Genechip data showed that the expression ofOsEIL2, a homolog of theArabidopsis(Arabidopsisthaliana)ETHYLENEINSENSITIVE3 (EIN3), was significantly induced in rice byR.solaniinfection, suggesting a possible involvement ofOsEIL2 in the defense againstR.solani. In this study, we generatedOsEIL2-RNAi transgenic events through agrobacteria-mediated transformation. Quantitative RT-PCR assays showed that the transcription ofOsEIL2 was specifically silenced in these transgenic events. Inoculation results showed that theOsEIL2 RNAi plants displayed more susceptibility toR.solani. Further, subcellular localization analyses revealed that OsEIL2 was localized in the nucleus of rice protoplasts and tobacco leaves. Yeast one-hybrid assays showed that OsEIL2 exhibited transcriptional activity. In addition, the transcripts ofOsACO1, a key gene for ethylene biosynthesis, was down-regulated in theOsEIL2-RNAi plants. Taken together, we conclude that OsEIL2, an ortholog ofArabidopsisEIN3, is a transcription factor and positive regulator of rice resistance toR.solani.
Oryzasativa; rice sheath blight; disease resistance; OsEIL2; transcription factor
2016-03-24
2016-05-03
国家自然科学基金(31671984);转基因生物新品种培育科技重大专项(2012ZX08009001);国家自然科学基金(31471737)
S435.111
A
10.3969/j.issn.0529-1542.2017.01.008
* 通信作者 E-mail: lilywang0313@163.com;wang.620@osu.edu

