苹果轮纹病菌对戊唑醇的敏感性及其抗性突变体的致病力
范 昆, 付 丽, 李晓军, 翟 浩, 刘 璐, 曲健禄*
(1. 山东省果树研究所,泰安 271000; 2. 山东省泰安市林业局,泰安 271000)
苹果轮纹病菌对戊唑醇的敏感性及其抗性突变体的致病力
范 昆1, 付 丽1, 李晓军1, 翟 浩1, 刘 璐2, 曲健禄1*
(1. 山东省果树研究所,泰安 271000; 2. 山东省泰安市林业局,泰安 271000)
为明确苹果轮纹病菌对戊唑醇的敏感性及其抗性突变体的致病力,采用菌丝生长速率法测定了130株苹果轮纹病菌菌株对戊唑醇的敏感性,采用药剂驯化和紫外线诱导的方式获得抗性突变体,并研究其生存适合度。结果表明,戊唑醇对130个菌株的EC50分布在0.051 6~1.925 4 μg/mL,均值为(0.799 6±0.039 1)μg/mL,表明苹果轮纹病菌开始出现敏感性下降的亚群体。供试苹果轮纹病菌菌株的抗性频率为71.54%,各省份均未出现高抗菌株。药剂驯化、紫外诱导共获得3株抗性倍数分别为58.82倍、41.60倍、38.19倍的高抗菌株。抗性突变体致病力、适合度指数与敏感菌株相比没有显著性差异。无药培养9代后,各抗性突变体EC50逐渐下降,所获抗性可能不能稳定遗传。表明苹果轮纹病菌对戊唑醇的抗性在田间自然选择压力下可能会逐渐降低。
苹果轮纹病菌; 戊唑醇; 敏感性; 突变体; 致病力
三唑类杀菌剂是20世纪70年代中后期开发的一类新型广谱杀菌剂,是杀菌剂发展史上里程碑式的创新,历经几十年的发展,在杀菌剂市场中的销售份额位列第一[1-2]。戊唑醇的作用机理是抑制真菌麦角甾醇中间体的氧化脱甲基反应,具有内吸、高效、广谱、安全等特点[3],对链格孢属Alternaria、疫霉属Phytophthora、黑星菌属Venturia、白粉菌属Erysiphe、镰刀菌属Fusarium、柄锈菌属Puccinia、喙孢属Rhynchosporium、尾孢属Cercospora、丛赤壳属Nectria、核腔菌属Pyrenophora、壳针孢菌属Septoria、灰葡萄孢属Botrytis引起的病害均有良好的防治效果[4-5]。该药20世纪90年代中期正式在中国苹果树上登记使用[6],对苹果轮纹病具有优良的防治效果[5],近年来一直是防治苹果轮纹病的首选药剂。
戊唑醇因其强选择性和作用位点专一性,使用中可能会导致病原菌产生抗药性。据报道葡萄灰霉病菌Botrytiscinerea[7]、大麦云纹病菌Rhynchosporiumsecalis[8]、开心果枝枯病菌Botryosphaeriadothidea[9]、桃褐腐病菌Moniliniafructicola[10]、禾谷镰刀菌Fusariumgraminearum[11]、红球丛赤壳菌Nectriahaematococca[12]等病原菌均对戊唑醇产生了不同程度的抗性。目前,尚未见到关于苹果轮纹病菌Botryosphaeriadothidea对戊唑醇产生抗性的报道,因此,本研究2013年采集了我国主要苹果产区苹果轮纹病菌,并测定了其对戊唑醇的敏感性,比较室内诱导的抗药性突变体与敏感菌株的适合度,以期预测该病原菌群体抗性发展趋势,为制定正确的防治策略及指导生产用药提供依据。
1 材料和方法
1.1 材料
1.1.1 供试菌株
2013年8-10月从我国主要苹果产区(山东省、河北省、陕西省、河南省、辽宁省、山西省)的果园内, 随机采集枝干轮纹病病瘤、病果 (每个病瘤、病果采自相距10 km以上的果园),分离、纯化、鉴定,共获得130个苹果轮纹病菌菌株,其中山东26株、河北22株、陕西21株、河南18株、辽宁23株、山西20株。
1.1.2 供试药剂
98%戊唑醇(tebuconazole)原药,江苏常隆化工有限公司生产。将其溶于丙酮,配制成1×104μg/mL的母液,放置于4℃冰箱中保存备用。
1.2 含药培养基的配制
将戊唑醇母液用体积分数为0.05%吐温-80溶液稀释,稀释液中丙酮的含量控制在0.1%以下。用微量移液器吸取1 mL不同浓度的药剂稀释液分别加入到49 mL冷却至50℃左右PDA培养基中,充分摇匀,配制成戊唑醇终浓度分别为2.0、1.0、0.5、0.25、0.125 μg/mL的含药培养基,以添加相同浓度吐温-80和丙酮溶液为空白对照。
1.3 苹果轮纹病菌对戊唑醇的抗性测定
采用菌丝生长率法[13]测定。在26℃下培养5 d 的PDA平板的菌落边缘打取d=7 mm 的菌饼,分别移到1.2制备的含药PDA平板上,26℃培养4 d,每处理(每菌株每浓度水平)重复4 次。用十字交叉法测定各处理的菌落生长直径,测定菌落径向线性生长量,确定药剂对菌落生长的抑制率,通过菌丝生长抑制率概率值和药剂浓度对数值之间的线性回归分析求出各药剂对菌株的有效抑制中浓度(EC50),并依据范昆等[14]建立的苹果轮纹病菌对戊唑醇的敏感基线,计算抗性倍数(Rf)和抗性频率。
试验数据均由Microsoft Excel 2013、SPSS数据处理工作平台进行统计分析。
抗性倍数(Rf)=供试菌株的EC50/敏感基线值,其中:Rf<2为敏感菌株;2≤Rf<5为低抗菌株;5≤Rf<10为中抗菌株;Rf≥10为高抗菌株[15]。
抗性频率(%)=抗性菌株/供试菌株数×100。
1.4 苹果轮纹病菌抗药性突变体的诱导
以山东泰山南天门未施用过戊唑醇的苹果树上分离的菌株TS1 (EC50=0.011 1 μg/mL)[14]作为野生相对敏感型菌株。将TS1菌株稳定培养后,接种到含1 μg/mL戊唑醇的PDA培养基上,26℃培养10~15 d后,选择生长相对较快的菌落再转移至含2 μg/mL戊唑醇的培养基上,以此类推逐渐增加戊唑醇的质量浓度。每选择3代测定EC50,比较菌株对戊唑醇的抗性变化,连续选择30代,每代筛选时每个菌株均接种30皿,每皿5个d=7 mm的菌饼。以亲本菌株为对照,计算抗药性突变体的抗性倍数。
抗性倍数=抗性突变体菌株的EC50/亲本菌株的EC50
1.4.2 紫外诱导
参照Bruin等[16]、叶滔等[17]的方法并加以改进。选择采自泰山南天门野生苹果树上的菌株TS2、TS3、TS7、TS9、TS11、TS12,26℃培养5 d后打取d=7 mm的菌饼,接入含2 μg/mL戊唑醇(经预试验,该浓度下供试菌株不能生长)的PDA培养基上,每个菌株50皿,每皿4个菌饼。开盖状态下,将菌落置于紫外灯(30 W、波长254 nm)下方垂直距离25 cm处分别照射30、45、75、110、140、180 s后立即置于黑暗条件下培养10 d(26℃),能正常生长的菌落为疑似抗性突变体。将该疑似抗性突变体转移到含2 μg/mL戊唑醇的PDA平板上继续活化培养7~10 d(黑暗),将能较好生长的抗药性突变体记为第1代,并测定EC50(戊唑醇浓度1、2、4、8、16、32 μg/mL),计算抗性倍数和突变频率。每处理平行测定4次,试验重复2次。
突变频率(%)=(出现突变的菌饼数/供试菌饼数)×100。
1.5 抗药性突变体的适合度测定
参照Tooley等[18]、Kadish等[19-20]和朱书生等[21]的方法进行适合度测定。比较药剂驯化、紫外诱变的抗药性菌株和敏感菌株接种苹果离体果实和田间枝条后的发病率、病斑面积(接菌后7 d)和病斑长度(接菌后10 d),并计算菌株的适合度指数。
综合适合度指数=发病率×病斑面积(病斑长度)。
1.5.1 离体果实接种
不管是什么建筑工程,都需要满足功能要求才能够开始施工建设,以保证建筑工程的适用性,保证建筑工程的功能均能够正常运行。
参照Johnson等[22]的接种方法略作调整。健康‘富士’果实用75%的乙醇表面消毒,灭菌水冲洗晾干后,在苹果上相对应的位置打2个孔(3 mm×3 mm)并接种d=3 mm的菌饼,接种后的苹果放入托盘中用保鲜膜保湿。以与菌饼相同大小的培养基接种伤口作为对照。每个菌株设5次重复,26℃下培养7 d,观察果实发病情况,测量病斑直径。
1.5.2 田间活体枝条接种
参照刘保友等[23]的方法,2014年5月在山东省曲阜市吴村果园,选取当年生‘富士’苹果树枝条进行接种试验。每菌株接种20个枝条,每个枝条接种1个7 mm的菌饼,以不接种菌饼处理为对照,10 d后调查发病率、病斑长度。
1.6 抗性突变体的遗传稳定性测定
将药剂驯化、紫外诱变的抗药性突变体在无药PDA培养基上、26℃下连续培养9代,测定第1、3、5、7、9 代突变体的EC50,计算抗性倍数,分析其抗药性能否稳定遗传。
2 结果与分析
2.1 苹果轮纹病菌对戊唑醇的敏感性
戊唑醇对130个菌株的EC50分布在0.051 6~1.925 4 μg/mL,最高值是最低值的37.31倍,EC50均值为(0.799 6±0.039 1)μg/mL。与范昆等[14]测定的苹果轮纹病菌对戊唑醇的敏感基线(0.254 1±0.015 1)μg/mL相比,抗性倍数整体提高3.15倍,虽然抗性倍数没有显著性变化,但通过SPSS 分析S-W法正态检验得知: W=0.932,P=0.000<0.05,偏度Skew=0.586,频次分布图呈负偏态(图1),对戊唑醇敏感性的频次分布不符合正态分布,这表明苹果轮纹病菌对戊唑醇的药剂敏感性开始出现分化,且出现敏感性降低的亚群体。

图1 2013年苹果轮纹病菌菌株对戊唑醇的敏感性频次分布图Fig.1 Frequency distribution of susceptibility of Botryosphaeria dothidea isolates to tebuconazole in 2013
2.2 2013年山东、河北、陕西、河南、辽宁、山西轮纹病菌对戊唑醇的敏感性测定
不同省份菌株对戊唑醇敏感性见表1。结果表明,不同省份菌株的敏感性存在一定的差异,其中河南省的平均EC50最高, 达0.934 9 μg/mL,平均抗性水平为1.17倍;其次为山东省、河北省、陕西省、山西省,EC50分别为0.928 1、0.832 0、0.774 8、0.701 4 μg/mL,平均抗性水平依次是1.16、1.04、0.97、0.88倍。辽宁省的EC50最低,为0.627 8 μg/mL,平均抗性水平为0.79倍。同一省份不同地区菌株的敏感性也存在较大的差异,以辽宁省为例,EC50的最低值是0.051 6 μg/mL,最大值则达1.621 7 μg/mL。
2.3 2013年山东、河北、陕西、河南、辽宁、山西苹果轮纹病菌对戊唑醇的抗性水平
不同省份苹果轮纹病菌对戊唑醇的抗性频率见表2。供试菌株的抗性频率高达71.54%, 但各省份均未出现高抗菌株,抗性倍数最高的菌株出现在山东省,抗性倍数为8.12倍,其他省份菌株抗性水平差异不明显,其中山西省、辽宁省抗性菌株频率很低,分别为65.00%、56.52%,出现的中抗性水平菌株频率最低,分别为10.00%、17.39%,与其EC50平均值(0.701 4、0.627 8 μg/mL)均较低相呼应。从抗性水平的分布来看,51.54%的菌株对戊唑醇的抗性水平在2~5倍之间,表明菌株对戊唑醇虽然产生抗性,但大部分菌株的抗性为低抗性水平。
表1 2013年不同地理来源苹果轮纹病菌对戊唑醇的敏感性1)
Table 1 Susceptibility ofBotryosphaeriadothideato tebuconazole from different regions in 2013

省份Province菌株数/株No.ofisolateEC50范围/μg·mL-1RangeofEC50valueEC50均值/μg·mL-1Mean±SD变异系数(CV)Coefficientofvariation平均抗性水平Meanresistancefactor山东Shandong260.2524~1.9254(0.9281±0.0921)aA0.50591.16河南Henan180.2846~1.6242(0.9349±0.1002)aA0.45451.17河北Hebei220.1069~1.6172(0.8320±0.0938)bB0.52891.04陕西Shaanxi210.1216~1.5216(0.7748±0.0974)cC0.57600.97辽宁Liaoning230.0516~1.6217(0.6278±0.0918)eE0.70150.79山西Shanxi200.1304~1.4309(0.7014±0.0906)dD0.57740.88平均Average--(0.7996±0.0391)cBC0.55791.00
1) 表中EC50均值为平均值±标准差。同列数据后标相同小写(大写)字母者表示经 Duncan’s 新复极差测验,在P=0.05 (P=0.01)水平上差异不显著。下同。 EC50are given as mean±SD. Data in a column followed by the same small (capital) letters are not significantly different atP=0.05 (P=0.01) by Duncan’s new multiple range test, respectively.The same below.
表2 2013年不同地理来源苹果轮纹病菌对戊唑醇的抗性频率
Table 2 Resistance frequency ofBotryosphaeriadothideato tebuconazole from different regions in 2013

省份Province抗性分布/%FrequencyofisolateswithdifferentresistancefactorsRf<22≤Rf<55≤Rf<10Rf≥10最高抗性倍数Thehighestresistanceratio抗性频率/%Frequencyofresistance山东Shandong23.0853.8523.08-8.1276.93河北Hebei22.7354.5422.73-6.8277.27山西Shanxi35.0055.0010.00-6.0465.00辽宁Liaoning43.4839.1317.39-6.8756.52陕西Shaanxi33.3338.1028.57-6.4266.67河南Henan11.1161.1127.78-6.8588.89总计Total28.4651.5420.00-8.1271.54
2.4 抗药性突变体的获得及抗性水平测定
2.4.1 药剂驯化诱导菌株的抗药性
敏感菌株TS1在含药培养基上连续培养至30代,EC50由0.011 1 μg/mL(F0)增加到0.652 9 μg/mL(F30),F30代菌株为F0代的58.82倍,形成了较高水平的抗性菌株。苹果轮纹病菌对戊唑醇抗性发展规律为(图2):F0~F9为抗性缓慢发展阶段,EC50由0.011 1 μg/mL增至0.073 4 μg/mL,抗性仅提高至F0的6.61倍;F9~F27为抗性快速发展阶段,其EC50由0.073 4 μg/mL增至0.616 2 μg/mL,抗性由6.61倍增至55.51倍;F27~F30抗性发展较为平缓,进入平台期,抗性倍数由55.51倍增至58.82倍,形成了对戊唑醇具有较高抗性水平的菌株。
2.4.2 紫外驯化诱导菌株的抗药性
采用紫外线对相对敏感菌株TS2、TS3、TS7、TS9、TS11、TS12进行不同时间照射处理,75 s为最佳紫外线照射时间,共获得15株疑似抗药性突变体,其中能在含2 μg/mL戊唑醇的培养基上正常稳定生长的为5株抗性突变体,整体抗性突变频率为0.417%,其亲本菌株分别为TS7、TS11,抗性突变频率分别为1.0%、1.5%。

图2 苹果轮纹病菌对戊唑醇的抗性发展规律Fig.2 Resistance development of Botryosphaeria dothidea to tebuconazole
测定抗性突变体对戊唑醇的敏感性,结果显示EC50分布在0.300 6~0.911 1 μg/mL之间,对戊唑醇的敏感性均显著下降(表3)。与敏感菌株相比,抗性突变体的抗性倍数在9.16~41.60之间,参照范昆[14]划定的苹果轮纹病菌对戊唑醇的抗性水平标准,UV-TS7-3、UV-TS7-4、UV-TS11-6、UV-TS11-10为高抗突变体,UV-TS11-2为中抗突变体。
表3 抗药性突变体及其亲本菌株对戊唑醇的敏感性及其抗性水平
Table 3 Susceptibility and resistance level of parental isolates and resistant mutants to tebuconazole

菌株Isolate毒力回归方程Regressionequation有效抑制中浓度/μg·mL-1EC50相关系数(r)Correlationcoefficient抗性倍数ResistanceratioTS7y=6.9869+1.1977x0.0219(0.0181~0.0266)0.99291.00UV-TS7-3y=5.8610+0.9372x0.8364(0.6091~1.0637)0.988938.19UV-TS7-4y=5.7868+0.9418x0.9111(0.6868~1.1354)0.989041.60TS11y=6.4841+1.0001x0.0328(0.0279~0.0386)0.99351.00UV-TS11-2y=5.5469+1.0476x0.3006(0.2526~0.3577)0.99359.16UV-TS11-6y=5.2126+1.1013x0.6412(0.5189~0.7923)0.989819.55UV-TS11-10y=5.0749+1.0217x0.8446(0.7160~0.9963)0.993825.75
2.5 抗药性突变体适合度的测定
2.5.1 药剂驯化抗药性突变体的适合度
以药剂驯化抗药性突变体(F12、F21、F30)及敏感菌株TS1分别接种苹果果实、枝条后,被接种的果实、枝条全部发病,且致病力未发生明显变化,抗药性突变体的适合度指数与敏感菌株相比没有显著性差异(表4),对病果、病枝条进行再分离均可得到Botryosphaeriadothidea。
表4 药剂驯化抗药性突变体适合度的测定
Table 4 Fitness parameters of resistant mutants by chemical screening

菌株Isolate离体果实接种Fruitinoculation发病率Diseaseincidence病斑直径/cmLesiondiameter综合适合度Fitnessparameter活体枝条接种Branchinoculation发病率Diseaseincidence病斑长度/cmLesionlength综合适合度FitnessparameterTS11.003.203.20aA1.004.504.50aAF121.003.403.40aA1.004.704.70aAF211.003.303.30aA1.004.404.40aAF301.003.203.20aA1.004.604.60aA
2.5.2 紫外诱导抗药性突变体的适合度
紫外诱导抗药性突变体(UV-TS7-3、UV-TS7-4、UV-TS11-2、UV-TS11-6、UV-TS11-10)及敏感菌株(TS7、TS11)分别接种苹果果实、枝条后,被接种的果实、枝条全部发病,且致病力未发生明显变化,病斑面积与敏感菌株差异不显著。离体果实法测定中,除UV-TS11-2外,其他抗性突变体的综合适合度指数均高于敏感菌株,活体枝条法测定的适合度也表现出类似的趋势,除UV-TS11-2外,其他抗性突变体的综合适合度指数均高于敏感菌株(图3)。
2.6 抗性突变体的遗传稳定性测定
将药剂驯化、紫外线诱导获得的8个抗戊唑醇突变体及其亲本菌株在无药PDA 培养基上继代培养9代后,各抗性突变体EC50均呈逐渐下降趋势(表5~6),表明所获得的抗性可能不能稳定遗传。其中,UV-TS7-3、UV-TS7-4的EC50降幅相对缓慢,在转接至第9代时相较于其亲本菌株抗性倍数仍很高,F12、F21、F30、UV-TS11-2、UV-TS11-6、UV-TS11-10的EC50降幅相对较大可能不能稳定遗传。
3 讨论
戊唑醇是高效、广谱、内吸、输导性、高选择性的C-14α-脱甲基化酶抑制剂(C-14α-demethylation inhibitors,DMIs)[24],作用机制是抑制病原真菌麦角甾醇的合成,导致真菌细胞膜结构破坏和细胞死亡,对多种重要作物病害具有良好的防治效果[3],现已成为果树、农作物、蔬菜等真菌病害化学防治的主要药剂之一[25-26]。
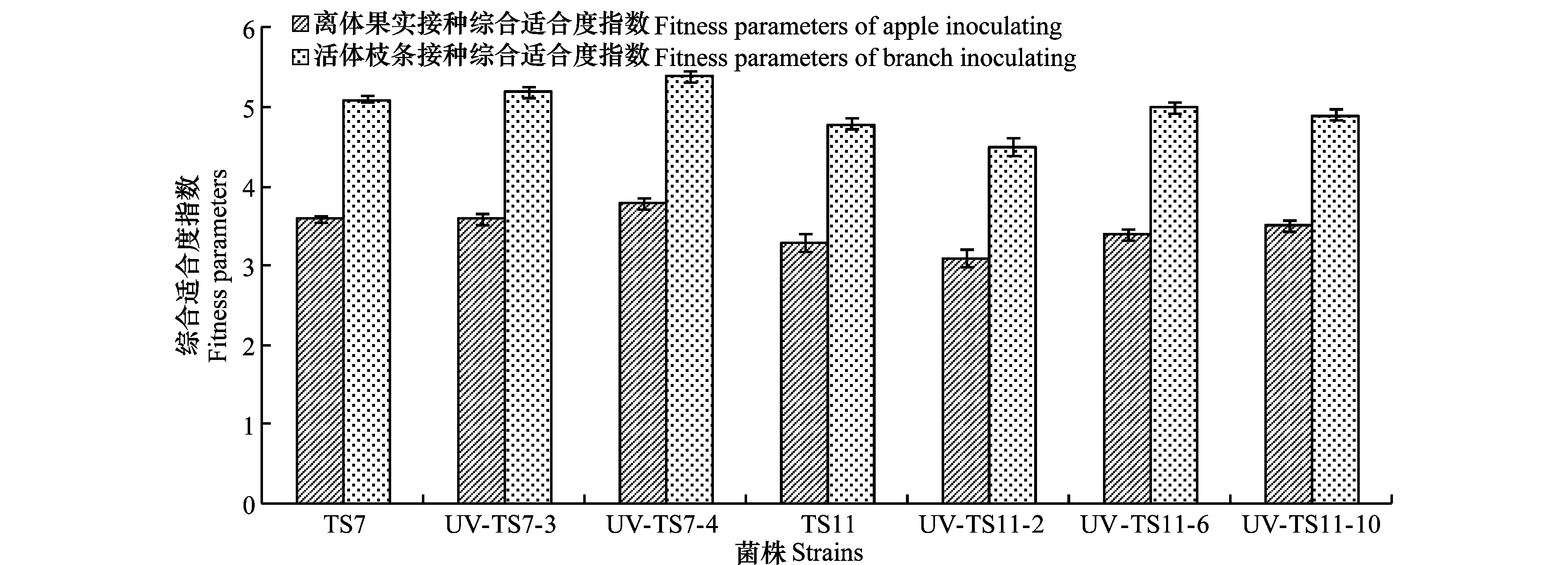
图3 紫外诱导抗药性突变体适合度的测定Fig.3 Fitness parameters of resistant mutants by UV irradiating
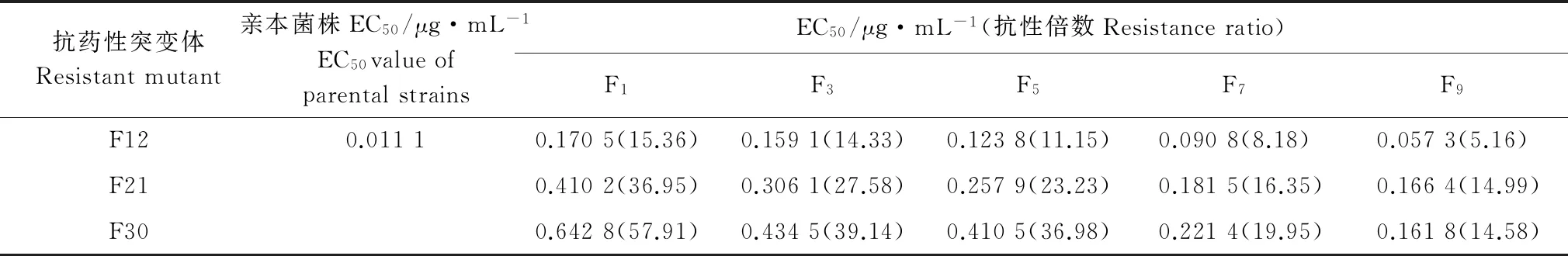
抗药性突变体Resistantmutant亲本菌株EC50/μg·mL-1EC50valueofparentalstrainsEC50/μg·mL-1(抗性倍数Resistanceratio)F1F3F5F7F9F120.01110.1705(15.36)0.1591(14.33)0.1238(11.15)0.0908(8.18)0.0573(5.16)F210.4102(36.95)0.3061(27.58)0.2579(23.23)0.1815(16.35)0.1664(14.99)F300.6428(57.91)0.4345(39.14)0.4105(36.98)0.2214(19.95)0.1618(14.58)
表6 紫外诱导抗药性突变体的抗性遗传稳定性
Table 6 Resistance genetic stability ofBotryosphaeriadothideamutants by UV irradiation to tebuconazole
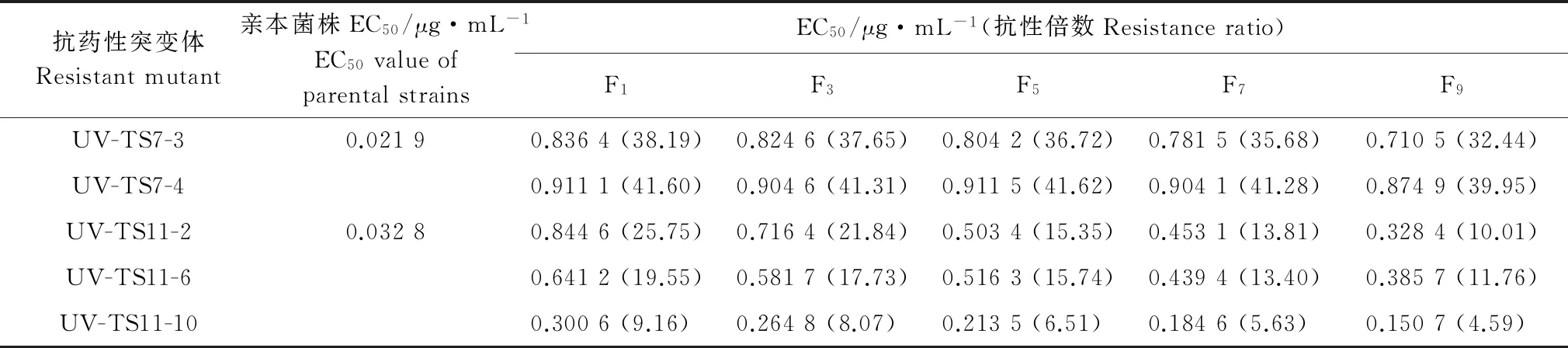
抗药性突变体Resistantmutant亲本菌株EC50/μg·mL-1EC50valueofparentalstrainsEC50/μg·mL-1(抗性倍数Resistanceratio)F1F3F5F7F9UV-TS7-30.02190.8364(38.19)0.8246(37.65)0.8042(36.72)0.7815(35.68)0.7105(32.44)UV-TS7-40.9111(41.60)0.9046(41.31)0.9115(41.62)0.9041(41.28)0.8749(39.95)UV-TS11-20.03280.8446(25.75)0.7164(21.84)0.5034(15.35)0.4531(13.81)0.3284(10.01)UV-TS11-60.6412(19.55)0.5817(17.73)0.5163(15.74)0.4394(13.40)0.3857(11.76)UV-TS11-100.3006(9.16)0.2648(8.07)0.2135(6.51)0.1846(5.63)0.1507(4.59)
本实验室从2007年起就我国苹果主产区轮纹病菌对戊唑醇的敏感性进行连续监测,2007年采集的51株菌株EC50平均值为(0.254 1±0.015 1)μg/mL,田间没有出现敏感性下降的亚群体[14]。2013年测定130个供试菌株的EC50均值为(0.799 6±0.039 1)mg/L,表明对戊唑醇的敏感性显著降低且敏感性开始出现分化,出现敏感性降低的亚群体,这是因为戊唑醇长期大面积使用导致病原菌对戊唑醇产生抗性,但整体抗性倍数比2007年仅提高3.15倍,抗性未出现显著性提高,田间也未监测到高抗性水平菌株,这可能与果园施药方式、药剂轮换使用、果实套袋及枝干对药剂吸收程度差等因素有关,同时与戊唑醇防治范围广泛密切相关。除苹果轮纹病外,戊唑醇对苹果斑点落叶病、炭疽病、褐斑病等苹果主要病害均有良好的防治效果,使用范围和次数越来越频繁,已经成为防治苹果病害的主要药剂,在DMIs类杀菌剂的选择压力下,田间病原菌都会相应提高自己的适应水平,于是敏感菌株的数量逐渐减少,抗性菌株的数量逐渐增多,而且这种情况会一直持续下去,直到抗性经常发生从而变成一种常态,药剂就失去了防控作用。本试验结果表明,供试菌株的抗性频率高达71.54%,从抗性水平的分布来看,20%的菌株对戊唑醇的抗性水平在5倍以上,属中抗药性水平,抗药性综合治理工作依然形势严峻。
20世纪70年代研究认为,真菌对DMIs类杀菌剂产生抗性受多基因控制,抗性突变体的适应性差,在自然界中难以形成抗性群体,因此认为病原菌对DMIs类杀菌剂在田间产生抗性的风险很低[27-28]。但近几十年来因为DMIs杀菌剂大量推广使用,目前如葡萄灰霉病菌Botrytiscinerea[7]、大麦云纹病菌Rhynchosporiumsecalis[8]、开心果枝枯病菌Botryosphaeriadothidea[9]、大麦白粉病菌Erysiphegraminis[29]、葡萄白粉病菌Uncinulanecator[30]、甜菜叶斑病菌Cercosporabeticola[31]、番茄叶霉病菌Fluviafulva[32]、草莓枯萎病菌Fusariumoxysporum[33]等病原菌均对DMIs杀菌剂产生了不同程度的抗药性。因此,定时监测苹果轮纹病菌对戊唑醇的抗药性对于今后田间抗药性监测和治理至关重要。
评价病原菌对杀菌剂的抗性风险,国内外一般采用药剂驯化、紫外诱导菌丝或孢子突变的方法获得抗性菌株[34-37]。经过36代连续戊唑醇药剂诱导,获得的抗性倍数为34.22倍的草莓枯萎病菌抗性菌株,与同类药剂具有较高水平的交互抗性,抗性遗传稳定[33];利用戊唑醇进行室内诱导,获得了抗性倍数达33.4 倍的禾谷丝核菌抗性菌株[24];Akallal等[12]室内诱导获得了红球丛赤壳菌的戊唑醇抗性菌株,与其他三唑类杀菌剂具有明显的交互抗性。本研究对苹果轮纹病菌进行药剂驯化和紫外诱导,获得抗性突变体的抗性倍数明显高于田间采集菌株,药剂驯化30代后获得抗性倍数达58.82倍的较高水平的抗性菌株;紫外诱导抗性突变频率较高,且能获得抗性倍数达41.60倍的较高水平的抗性菌株。继代培养9代后,各抗性突变体EC50均呈逐渐下降趋势,药剂驯化突变体均不能稳定遗传,部分紫外诱导抗性突变体抗药性能够稳定遗传;但所有抗性突变体的适合度与敏感菌株之间无显著性差异,由此说明,苹果轮纹病菌抗性突变体与敏感菌株之间具有相似的生存适合度,在田间产生抗性突变种群的风险很大,在以后的病害防治中,应注意药剂的轮换使用或药剂混配,以延缓田间苹果轮纹病菌抗药性的产生,但这一结论与田间菌株抗性发展缓慢不相符合,这可能与室内诱导抗性突变体、田间自然抗性突变体及敏感菌株在自然环境下群体生存时竞争力强弱有关,本课题组会对敏、抗菌株生存竞争力进行后续研究。
4 结论
2013年测定130个供试菌株的EC50均值为(0.799 6±0.039 1)mg/L,与2007年相比出现对戊唑醇敏感性降低的亚群体;供试菌株的抗性频率高达71.54%,20%的菌株对戊唑醇的抗性水平在5倍以上,属中抗药性水平,田间未监测到高抗性水平菌株。药剂驯化和紫外诱导获得的部分较高水平的菌株抗药性无法稳定遗传;抗性突变体的抗性倍数明显高于田间采集菌株,但适合度无显著性差异,在田间产生抗性突变种群的风险很大。
[1] 张一宾. 全球三唑类杀菌剂的市场、品种、特点及发展[J]. 中国农药, 2010(12): 11-13.
[2] 孙克. 全球十大杀菌剂的市场与展望[J]. 农药, 2013, 52(7): 469-475.
[3] 李富根, 吴新平, 刘乃炽.戊唑醇的作用特点及其应用概况[J]. 农药科学与管理, 2001, 22(3): 40-41.
[4] 林才华, 王开运, 顾春波, 等. 山东省草莓枯萎病菌对四种三唑类杀菌剂的敏感性检测[J]. 植物保护学报, 2009, 36(1): 55-60.
[5] 苏平, 周增强, 朱建兰, 等. 河南省苹果轮纹病菌对戊唑醇的敏感性检测[J]. 中国农学通报, 2010, 26(13): 312-318.
[6] 王英姿, 张伟, 刘保友, 等. 山东省苹果轮纹病菌对戊唑醇的抗药性及其地理分布[J]. 果树学报, 2010, 27(6): 961-964.
[7] Leroux P, Chapeland F, Desbrosses D, et al. Patterns of cross-resistance to fungicides inBotryotiniafuckeliana(Botrytiscinerea) isolates from French vineyards [J]. Crop Protection, 1999, 18(10): 687-697.
[8] Robbertse B, van der Rijst M, van Aarde I M R, et al. DMI sensitivity and cross-resistance patterns ofRhynchosporiumsecalisisolates from South Africa [J]. Crop Protection, 2001, 20(2): 97-102.
[9] Ma Zhonghua, Mougan D P, Felts D, et al. Sensitivity ofBotryosphaeriadothideafrom California pistachio to tebuconazole[J]. Crop Protection, 2002, 21(9): 829-835.
[10]Yoshimura M A, Luo Yong, Ma Zhonghua, et al. Sensitivity ofMoniliniafructicolafrom stone fruit to thiophanate-methyl, iprodione, and tebuconazole [J]. Plant Disease, 2004, 88: 373-378.
[11]Spolti P, Emerson M, Del Ponte E M, et al. Triazole sensitivity in a contemporary population ofFusariumgraminearumfrom New York wheat and competitiveness of a tebuconazole-resistant isolate [J]. Plant Disease, 2014, 98(5): 607-613.
[12]Akallal R, Debieu D, Lanen C, et al. Inheritance and mechanisms of resistance to tebuconazole, a sterol C14-demethylation inhibitor, inNectriahaematococca[J]. Pesticide Biochemistry and Physiology, 1998, 60(3): 147-166.
[13]翟明涛, 王开运, 许辉, 等. 抗氟吡菌胺辣椒疫霉菌株的诱导及其生物学特性的研究[J]. 植物病理学报, 2014, 44(1): 88-96.
[14]范昆,曲健禄,李林光,等.苹果轮纹病菌对戊唑醇的敏感基线及其室内抗药突变体研究[J]. 果树学报, 2013, 30(4): 650-656.
[15]FAO.Recommended methods for the detection and measurement of resistance of resistance of agricultural pests to pesticides [J].FAO Plant Protection Bulletin,1982,30(2): 30-36.
[16]Bruin G C A, Edgington L V.Induction of fungal resistance to metalaxyl by ultraviolet irradiation [J]. Phytopathology, 1982, 72(5): 1209-1212.
[17]叶滔, 马志强, 王文桥, 等. 禾谷镰孢菌对戊唑醇抗药性的诱导及抗性菌株特性研究[J]. 农药学学报, 2011, 13(3): 261-266.
[18]Tooley P W, Sweigard J A, Fry W E.Fitness and virulence ofPhytophthorainfestansisolates from sexual and asexual populations [J]. Phytopathology, 1986, 76(11): 1209-1212.
[19]Kadish D, Cohen Y.Fitness ofPhytophthorainfestansisolates from metalaxyl-sensitive and resistant populations [J]. Phytopathology, 1988, 78(7): 912-915.
[20]Kadish D, Cohen Y.Competition between metalaxyl-sensitive and metalaxyl-resistant isolatesPhytophthorainfestansin the absence of metalaxyl [J]. Plant Pathology, 1988, 37(4): 558-564.
[21]朱书生, 王岩, 刘鹏飞, 等. 黄瓜霜霉病菌抗氟吗啉菌株的适合度研究[J]. 植物病理学报, 2005, 35(6): 532-538.
[22]Johnson E M, Sutton T B, Hodges C S.Etiology of apple sooty blotch disease in North Carolina[J]. Phytopathology, 1997, 87(1): 88-95.
[23]刘保友, 张伟, 栾炳辉, 等. 苹果轮纹病菌对苯醚甲环唑和氟硅唑的敏感性及其交互抗性[J]. 植物病理学报, 2013, 43(5): 541-548.
[24]Hamamoto H, Hasegawa K, Nakaune R, et al. Tandem repeat of a transcriptional enhancer upstream of the sterol 14α-demethylase gene(CYP51) inPenicilliumdigitatum[J]. Applied and Environmental Microbiology, 2000, 66(8): 3421-3426.
[25]汪汉成, 周明国, 张艳军, 等. 戊唑醇对立枯丝核菌的抑制作用及在水稻上的应用[J]. 农药学学报, 2007, 9(4): 357-362.
[26]胡燕, 王怀训, 夏晓明, 等. 四地区小麦纹枯病菌对6种杀菌剂的抗性比较[J]. 植物保护学报, 2006, 33(4): 55-60.
[27]Fuchs A, Drandarevski C A.The likelihood of development of resistance to systemic fungicides which inhibit ergosterol biosynthesis [J]. Netherlands Journal of Plant Pathology, 1976, 82(2): 85-87.
[28]Köller W, Scheinpflug H.Fungal resistance to sterol biosynthesis inhibitors: a new challenge [J]. Plant Disease, 1987, 71(12): 1066-1074.
[30]Steva H, Clerjeau M.Cross resistance to sterol biosynthesis inhibitor fungicides in strains ofUncinulanecatorisolated in France and Portugal [J].Mededelingen van de Faculteit Landbouwwetenschappen, Rijksuniversiteit Gent, 1990, 42(3): 983-988.
[31]Karaoglanidis G S, Loannidis P M, Thanassouiopoulos C C.Reduced sensitivity ofCercosporabeticolaisolates to sterol-demethylation-inhbiting fungicides [J].Plant Pathology, 2000, 49(5): 567-572.
[32]张驰, 纪明山, 王英姿, 等. 番茄叶霉病菌对氟硅唑抗药性的初步研究[J].沈阳农业大学学报, 2003, 34(4): 255-258.
[33]顾春波, 姜莉莉, 王开运, 等. 抗戊唑醇草莓枯萎病菌ZY-W 的诱导及其生物学特性[J]. 中国农业科学, 2010, 43(14): 2897-2904.
[34]崔晓岚, 孟庆晓, 毕扬, 等. 辣椒疫霉对烯酰吗啉的敏感性基线及室内抗药突变体研究[J]. 植物病理学报, 2009, 39(6): 630-637.
[35]赵卫松, 韩秀英, 齐永志, 等. 辣椒疫霉对双炔酰菌胺的敏感性测定及其抗药突变体的生物学性状研究[J]. 农药学学报, 2011, 13(1): 21-27.
[36]Young D H, Spiewak S L, Slawecki R A.Laboratory studies to assess the risk of development of resistance to zoxamide [J]. Pest Management Science, 2001, 57(11): 1081-1087.
[37]Bi Yang, Cui Xiaolan, Lu Xiaohong, et al. Baseline sensitivity of natural population and resistance of mutants inPhytophthoracapsicito zoxamide [J]. Phytopathology,2011,101(9):1104-1111.
(责任编辑:杨明丽)
Susceptibility ofBotryosphaeriadothideato tebuconazole and virulence of its resistant mutants
Fan Kun1, Fu Li1, Li Xiaojun1, Zhai Hao1, Liu Lu2, Qu Jianlu1
(1.ShandongInstituteofPomology,Tai’an271000,China; 2.Tai’anCityForestryBureau,Tai’an271000,China)
130Botryosphaeriadothideaisolates were collected from major apple-produced regions to assess the susceptibility to tebuconazole by mycelium growth rate method and to test the virulence of resistance mutants. Resistant mutants were obtained by chemical screening and UV irradiation in the laboratory, and the fitness parameters of resistant and susceptible isolates were measured. The results showed that the EC50values of 130 isolates varied from 0.051 6-1.925 4 μg/mL with the mean of (0.799 6±0.039 1)μg/mL and low resistant subcolony has been discovered. The resistant ratio of tested isolates was 71.54% and high-resistant strains has not discovered in major apple-produced regions. The resistance level of three resistant mutants was high with the resistant ratio of 58.82, 41.60 and 38.19 times, respectively. The fitness and virulence of resistant mutants had no significant difference between resistant and susceptible isolates. The resistance ratio of mutants decreased gradually after 9 generations of subcultures in the absence of fungicides and the resistance could not inherit stably. The results indicated that the resistance ofB.dothideato tebuconazole could gradually decline when the field selection pressure became lower.
Botryosphaeriadothidea; tebuconazole; susceptibility; mutant; pathogenicity
2016-02-16
2016-04-26
山东省自然科学基金(ZR2013CQ040);国家现代农业产业技术体系(CARS-28);泰安市科技攻关项目(201540699);山东省农业科学院农业科技创新工程(CXGC2016B07);山东省农业科学院青年科研基金(2016YQN32);山东省果树研究所所长基金(2013ky02)
S482.2
A
10.3969/j.issn.0529-1542.2017.01.024
* 通信作者 E-mail:qujianlu@sina.com

