大型脑转移瘤伽玛刀剂量分割治疗进展
由语迪,王宏伟,张国荣
·综述·
大型脑转移瘤伽玛刀剂量分割治疗进展
由语迪,王宏伟,张国荣
伽玛刀立体定向放射外科(stereotactic radiosurgery,SRS)治疗颅内中小型转移瘤已被证明是一种安全、有效的治疗方法。然而,对于大型脑转移瘤,SRS治疗的预后及肿瘤控制率并不尽如人意。随着脑转移瘤发病率不断增加,探索一种针对大型脑转移瘤安全有效的治疗方法迫在眉睫。现代SRS治疗技术发展迅速,其概念和内涵正在发生着变化,从经典的单次大剂量发展到目前5次以内的聚焦照射均属SRS范畴。近年来以经典单次大剂量伽玛刀治疗为基础的伽玛刀剂量分割治疗(fractionated stereotactic radiosurgery,FSRS)在临床上的应用逐渐增多并受到关注。越来越多的研究表明在脑肿瘤治疗的过程中FSRS以其独特的优势发挥了重要作用,很多学者尝试着运用这种治疗手段治疗大型脑转移瘤并不断改进。现就大型脑转移瘤FSRS治疗进展作一综述。
脑转移瘤是最常见的颅内恶性肿瘤,其病情进展快,预后差,未经治疗患者生存期一般为1~3个月。因此最大程度提高肿瘤控制率,改善生活质量,延长生存期是脑转移瘤治疗的目标[1]。脑转移瘤在选择治疗方式时需要考虑患者自身情况、临床症状、肿瘤的病理性质及病灶的数目等多种因素。目前主要的治疗方式有手术外科切除、全脑放疗(WBRT)、化疗、立体定向放射外科、立体定向放射治疗、分子靶向治疗等,很多情况下要根据患者病情采取多种方法综合治疗。文献报道全脑放疗患者生存期4~6个月,手术加放射治疗的患者生存期可延长至10个月,近年来SRS治疗的广泛应用,使患者生存期进一步延长[2-3]。
1 伽玛刀治疗脑转移瘤
自1993年起,我国引进第一台leksell G型伽玛刀,自此开始了SRS治疗时代。头部伽玛刀治疗技术是运用伽玛射线,联合计算机及影像技术进行三维聚焦式精准大剂量照射。随着治疗例数及经验的不断累积,观察到其对颅内疾病尤其是脑转移瘤的疗效是惊人的,并且具有精准、微创、便捷、经济等优势,得到了广大患者的青睐。SRS技术对中小型脑转移瘤的疗效与预后得到业界学者的广泛认同,当然,其不足之处在于当肿瘤较大时,肿瘤的局部控制率会明显降低,并且增加了放射并发症的发生率[4],在一定程度上限制了伽玛刀技术的应用和发展。Vogelbaum等[5]报道当使用15 Gy的照射剂量时,直径在3~4 cm和小于2 cm的肿瘤的一年局部控制率分别为45%和85%,可见在同等的照射剂量下,较大的肿瘤局控率显著降低。因此要保证较高的肿瘤控制率,需要更大的照射剂量,但矛盾的是,大型肿瘤需要降低照射剂量,以保护正常组织,因此需要寻找针对大型脑转移瘤安全有效的治疗方法。
2 外科手术及全脑放疗治疗脑转移瘤
大型脑转移瘤一直被认为是伽玛刀治疗的相对禁忌证,因其所给的剂量受到了肿瘤体积的限制[6]。一般情况下,大型脑转移瘤的治疗应优先考虑外科手术切除,以尽快降低颅压,减轻肿瘤及水肿造成的神经压迫症状。但并不是所有的患者都能承受手术,这取决于患者的身体条件以及病灶的数目[7],大多数脑转移瘤患者因体质差病灶数目多并不适合开颅手术。全脑放疗一直是脑转移瘤的标准治疗方法,但放疗后神经认知功能下降是不可避免的[8],对于大型或不敏感转移瘤疗效差。一些研究表明,单独的SRS与WRBT相比,可提高肿瘤局部控制率同时避免远期的神经认知功能障碍,提高患者的生活质量[9-10]。临床上最为棘手的问题是针对不敏感肿瘤或较大肿瘤以及放疗后复发肿瘤。Eaton等[11]学者报道,利用FSRS治疗大型脑转移瘤患者47例,1年局部控制率,颅内无进展生存率和整体生存率分别为61%、55%和73%,而放射并发症发生率只有7%。单纯全脑放疗不能有效地控制肿瘤时,SRS局部补量也是一种不能忽略的治疗方式。适形调强放射治疗是另一种重要的局部治疗方法,其定位准确,按照肿瘤形态进行照射,既增加肿瘤的局部受量,又降低周围正常组织损伤。Assouline等[12]运用适形调强放疗治疗脑转移瘤,结果显示,调强组中位生存期为8.9个月,明显强于常规放疗组的4.0个月。在不具备SRS技术的条件下,可优先考虑适形调强放疗。然而,即使是调强放疗,其所达到的剂量较FSRS而言仍属于小剂量;并且调强放疗价格比较贵,治疗时间长,给患者造成的经济压力较大。
3 FSRS治疗颅内大型脑转移瘤
一般来说,伽玛刀治疗属于一次性治疗,但对于大型的脑转移瘤来说,这种一次性的大剂量照射很难完全摧毁肿瘤细胞,并且会造成脑水肿、脑坏死等严重的并发症,据此FSRS技术应运而生,其最大特点是将可以使肿瘤致死的单次伽玛刀照射剂量,分割成若干分进行重复照射[13],不但具有“刀”的特性,又利用了常规放疗“分”的形式,既提高了肿瘤控制率,又降低了放射不良反应的发生[14]。与传统放疗相比,FSRS技术具有剂量分布集中、剂量变化陡峭的特性,可在不增加周围正常脑组织的受量的情况下,大幅度增加肿瘤的局部受量。
大量的资料证实FSRS可提高大型脑转移瘤的控制率[1,15,17-18]。Kim等[15]比较分析了单次大剂量与剂量分割治疗颅内转移瘤,单次组中位生存时间为6个月,分割组为8个月(P=0.89);6个月和12个月的局部肿瘤控制率,单次组为81%和71%,分割组为97%和69%(P=0.31)。尽管分割组多用于瘤体较大、病情较重的患者,但其对肿瘤的控制率并不劣于单次组,且单次组较分割组产生的放射毒性更大。可见剂量分割比单次大剂量更适宜应用于瘤体较大和位于功能区的脑肿瘤。尹俊等[19]治疗30例脑干转移瘤时应用FSRS技术,获得较高的局部控制率和相对低的脑干并发症的发生率。薛松江等[20]报道了FSRS治疗大于3 cm脑转移瘤40例,中位生存期是17.8个月,1年、2年和3年总体生存率分别是55.3%、23.8%和15.9%。针对病灶对射线的敏感程度是否对分割治疗的结果产生影响,不同中心得出了不同的结果。有些资料显示对于较大的或不敏感的转移瘤,如肉瘤、黑色素瘤、肾癌等,采取伽玛刀剂量分割治疗预后效果会更好[21-22]。当然,Ahmed等[23]针对抗辐射与对辐射敏感的平均体积为6.18 cm3的病灶分别进行单次传统伽玛刀和伽玛刀剂量分割治疗,结果显示,对于大型脑转移瘤分割治疗优于传统的一次性治疗,而对于敏感与不敏感的肿瘤两者无显著的差异。亦有学者[24-25]认为对放疗不敏感的脑转移瘤伽玛刀剂量分割治疗疗效低于单次伽玛刀治疗,认为这可能与每次分割所用的剂量相关,当剂量上升到一定程度时,肿瘤是否敏感将不作为主要因素考虑?总之还需要大量的研究,对比单次与分割的治疗效果,规范FSRS治疗技术在脑转移瘤中的应用。
剂量分割照射符合了放射生物学理论的“4R[26]”特性,即再增值(reproduction)、再修复(repair)、再氧合(reoxygenation)、再分布(redistribution),以达到杀灭肿瘤,保护正常组织的目的。理论上讲,肿瘤体积越大、乏氧细胞越多,剂量应该越高;分割次数越多、总治疗时间越长,总剂量应该越高。具体的分割方式可以参考正常化总剂量(normalized total dose NTD2)和脑损伤发生率P(D,1)来决定。一般情况下NTD2应在60 Gy以下,P(D,1)应在3%~10%以下[23,26-27]。另外,在肿瘤中,乏氧细胞通过控制肿瘤的增值周期,增加了肿瘤对放射线的抵抗性并使之对瘤周组织更具有侵袭性,而其不断再氧化的特性使分割照射能更好地达到控制肿瘤的目的,相比较而言氧含量丰富的大型肿瘤较小肿瘤对放射更为敏感。而且相隔两次治疗的时间可使受到亚致死性损伤(sublethal cell injury)的正常组织得以修复,从而提高对放射线的耐受性。目前针对大型的脑转移瘤的具体治疗方案尚未确定,通常要考虑包括肿瘤的来源、体积、数量、位置和患者的总体情况等多种因素[22,28]。
伽玛刀剂量分割治疗过程与传统治疗过程基本相似[26],包括:安装固定立体定位框架,行头颅薄层MRI[29]或CT增强扫描定位,于伽玛刀治疗规划系统下进行治疗规划以及治疗计划的实施,其中头架的重复安装和位置的校准以及剂量的选择最为关键。各中心分割治疗方法不尽相同,我中心[19]治疗时通常分2~3次治疗,间隔6~8 h,中间不拆卸定位框架。这种治疗方式便捷,不需要重复定位,不会出现治疗误差。但患者头架固定在头部大时间较长,不适合于体质弱、病情重或需要分割次数更多的患者。胡泽勇等[13,26]研制了分割立体定位框架,方法是利用螺丝固定器,使得定位框架可重复安装。此方法的优点是无需重复扫描定位,患者也可得到充分的休息,适合于多次重复治疗。不足之处是可能出现一定误差或局部皮肤感染等。国内外还有学者采用了热塑面膜固定[16,30],在面膜及皮肤上作出对应标记,以方便进行重复照射。还有部分学者采用的是一种可重复使用的悬浮头架,在保证定位准确的同时,降低了患者对侵入式头架的心理抗拒[27]。为更好实现FSRS治疗,国内部分学者研制了适合伽玛刀分割治疗的立体定位头架,最新的瑞典伽玛刀也已经配置了剂量分割治疗牙托辅助定位系统。Cyber knife就是在这种理念下出现的新的立体定向放射外科治疗设备。
临床医生在实际工作中多根据患者的具体情况以及临床经验选择相应的剂量和分割次数。通常来讲提高肿瘤的放疗疗效有两种方式,一个是提高肿瘤的照射总剂量,一个是改变剂量分割方式提高生物剂量。我中心在治疗时的方案采用的是6~10 Gy/2~3 (单次剂量/次数)。研究表明当治疗方案为8 Gy/2,间隔8 h时,其产生的BED相当于普通放疗40 Gy的剂量并且未产生明显的毒副作用及放射性副反应[19]。Fahrig[31]等研究比较三种治疗方案,分别是5 Gy/6~7、10 Gy/4和7 Gy/5,结果表明在肿瘤直径大于3.0 cm时,应用10 Gy/4的治疗方案更好。Matsuyama等[32]将299例非小细胞肺癌脑转移患者共计573个病灶采用剂量分割治疗,根据生物有效剂量确定单次照射剂量及分割次数。结果显示,中位总生存率、局部无进展生存率和颅内无复发生存率分别为17.1%、14.9%和4.4%;6个月和12个月的总生存率、局部无进展生存率、颅内无复发生存率分别为78.5%和63.3%,74.3%和57.8%,41.0%和21.8%;其中有6例患者出现脑的放射性损伤。可见剂量分割治疗提高了治疗效果明显降低了不良反应发生率。Fokas等[33]报道了260例1~3个转移病灶患者分别运用SRS(平均剂量20 Gy)和两种不同分割形式的FSRS(7 Gy/5和10 Gy/4)进行治疗;结果显示三组中位生存期分别为8、7和10个月(P=0.575);1年局部肿瘤无进展生存率分别为73%、75%和71%。以上研究显示,虽然FSRS主要用于大型病灶、病变周围有重要结构和状态较差的患者,但其控制率与SRS相当,尤其是对于那些不适用于SRS的患者,FSRS的低毒性更加安全有效。随着FSRS的使用脑转移瘤患者的肿瘤控制率和生存期得以延长,患者的生存质量得到进一步改善。文献报道分割治疗的方案及效果见表1。
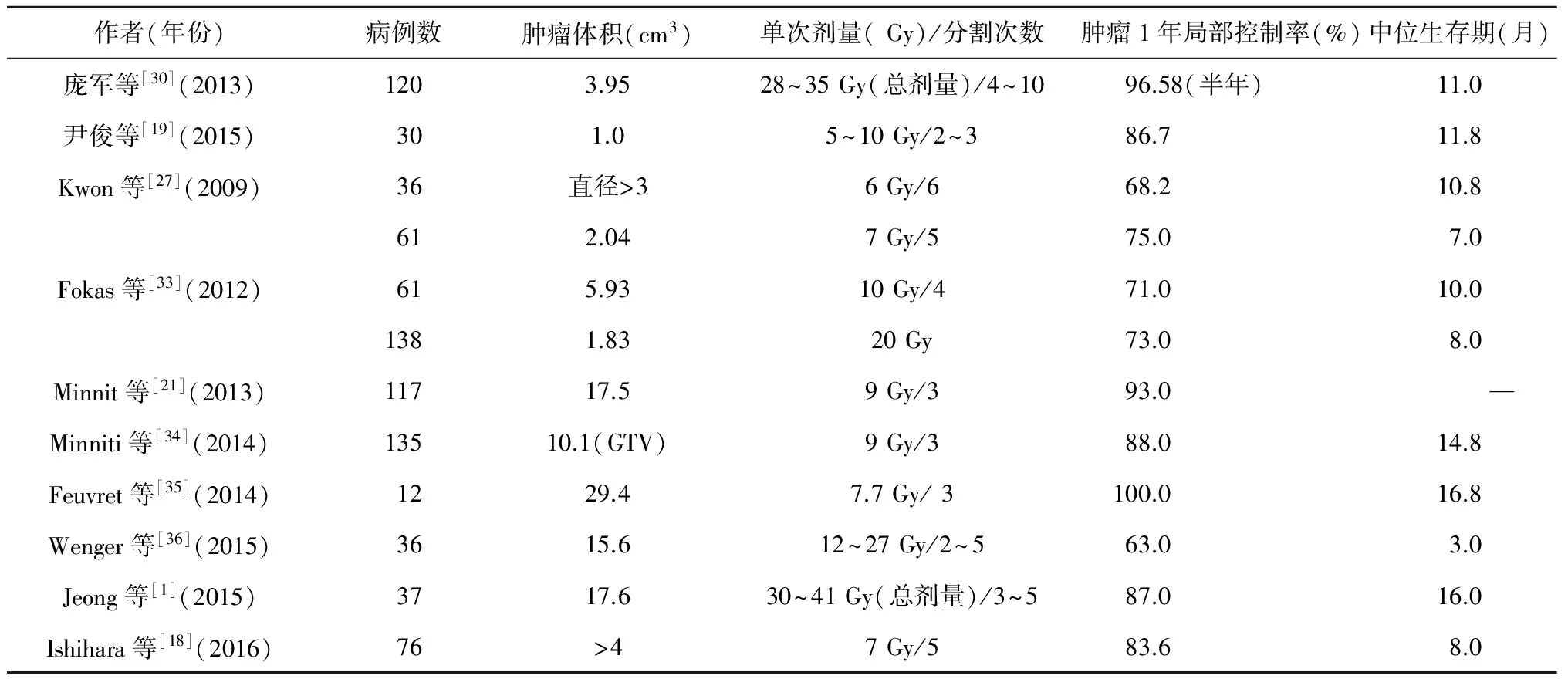
表1 分割治疗的方案及疗效
综上所述,FSRS治疗是在经典伽玛刀治疗的基础上结合分次放疗的治疗模式而衍生的治疗手段,通过降低单次治疗剂量,增加治疗次数,降低正常组织毒副作用,以达到在保证患者生存质量的同时提高肿瘤的局部控制率的目的。目前FSRS治疗的具体适应证、治疗程序、治疗方案等尚缺乏统一标准,需要大量的临床病例进行回顾性及前瞻性研究。
[1] Jeong WJ,Park JH,Lee EJ,etal.Efficacy and safety of fractionated stereotiactic radiosurgery for large brain metastases[J].Korean Neurosurgical Society,2015,58:217.
[2] Lee CC,Yen CP,Xu ZY,etal.Large intracranial metastatic tumors treated by gamma knife surgery:outcomes and prognostic factors[J].J Neurosurg,2014,120:52.
[3] 朱海伟,张金伟.颅内转移瘤的立体定向放射治疗进展[J].现代肿瘤医学,2013,21:1155.
[4] Blonigen BJ,Steinmetz RD,Levin L,etal.Irradiated volume as a predictor of brain radioecrosis after linear accelerator stereotactic radiosurgery[J].Int J Radiat Oncol Biol Phys,2010,77:996.
[5] Vogelbaum MA,Angelov L,Lee SY,etal.Local control of brain metastases by stereotactic radiosurgery in relation to dose to the tumor margin[J].J Neurosurg,2006,104:907.
[6] Minniti G,Clarke E,Lanzetta G,etal.Stereotactic radiosurgery for brain metastases:analysis of outcome and risk of brain radionecr-osis[J].Radiation Oncology,2011,6:48.
[7] Yoo H,Kim YZ,Nam BH,etal.Reduced local recurrence of a single brain metastasis through microscopic total resection clinical article[J].J Neurosurg,2009,110:730.
[8] Kaul D,Angelidis A,Budach V,etal.Prognostic indices in stereotactic radiotherapy of brain metastases of non-small cell lung cancer[J].Radiation Oncology,2015,10:1.
[9] Chang EL,Wefel JS,Hess KR,etal.Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation:a randomised controlled trial[J].Lancet Oncol,2009,10:1037.
[10] Giubilei C,Ingrosso G,D’andrea M,etal.Hypofractionated stereotactic radiotherapy in combination with whole brain radiotherapy for brain metastases[J].J Neurooncol,2009,91:207.
[11] Eaton BR,Gebhardt B,Prabhu R,etal.Hypofractionated radio-surgery for intact or resected brain metastases:defining the optimal dose and fractionation[J].Radiation Oncology,2013,8:253.
[12] Assouline A,Levy A,Chargari C,etal.Whole brain radiotherapy:Prognostic factors and results of a radiation boost delivered through a conventional linear accelerator[J].Radiotherapy Oncology,2011,99:214.
[13] 胡泽勇,夏廷毅,马宏伟,等.立体定向放射外科治疗的剂量学[J].空军总医院学报,2003,19:44.
[14] Ogura K,Mizowaki T,Ogura M,etal.Outcomes of hypofractionated stereotactic radiotherapy for metastatic brain tumors with high risk factors[J].Neuro Oncol,2012,19:425.
[15] Kim YJ,Cho KH,Kim JY,etal.Single-dose versus fractionated stereotactic radiotherapy for brain metastases[J].Int J Radiat Oncol Biol Phys,2011,81:483.
[16] Combs SE,Thimann C,Edler L,etal.Efficacy of fractionated stereotactic reirradiation in recurrent gliomas:long-term results in 172 patients treated in a single institution[J].J Clin Oncol,2005,23:8863.
[17] Scoccianti S,Magrini SM,Ricardi UA,etal.Patterns of care and survival in a retrospective analysis of 1059 patients with glioblastoma multiforme treated between 2002 and 2007:a multicenter study by the central nervous system study group of Airo (Italian association of radiation oncology)[J].Neurosurgery,2010,67:446.
[18] Ishihara T,Yamada K,Harada A,etal.Hypofractionated stereo-tactic radiotherapy for brain metastases from lung cancer evaluation of indications and predictors of local control[J].Strahlentherapie Onkologie,2016,192:386.
[19] 尹俊,张国荣,何占彪,等.脑干转移瘤的伽玛刀治疗[J].中华神经外科杂志,2015,31:1051.
[20] Jiang XS,Xiao JP,Zhang Y,etal.Hypofractionated stereotactic radiotherapy for brain metastases larger than three centimeters[J].Radiation Oncology,2012,7:1733.
[21] Minniti G,Esposito V,Clarke EA,etal.Multidose stereotactic radiosurgery (9 Gy x 3) of the postoperative resection cavity for treatment of large brain metastases[J].Int J Radiat Oncol Biol Phys,2013,86:623.
[22] Kim H,Jung TY,Kim IY,etal.The usefulness of stereotactic radiosurgery for radioresistant brain metastases[J].J Korean Neurosurg Soc,2013,54:107.
[23] Ahmed KA,Sarangkasiri S,Chinnaiyan PA,etal.Outcomes following hypofractionated stereotactic radiotherapy in the management of brain metastases[J].Am J Clin Oncology-Cancer Clinical Trials,2016,39:379.
[24] Oermann EK,Kress M,Todd JV,etal.The impact of radiosurgery fractionation and tumor radiobiology on the local control of brain metastases clinical article[J].J Neurosurg,2013,119:1131.
[25] Fokas E,Henzel M,Surber G,etal.Stereotactic radiosurgery and fractionated stereotactic radiotherapy:comparison of efficacy and toxicity in 260 patients with brain metastases[J].J Neurooncol,2012,109:91.
[26] 刘宗惠,杨卫忠.颅脑伽玛刀治疗学[M].北京:人民卫生出版社,2006:286.
[27] Kwon AK,Dibiase SJ,Wang B,etal.Hypofractionated stereotactic radiotherapy for the treatment of brain metastases[J].Cancer,2009,115:890.
[28] Kalkanis SN,Kondziolka D,Gaspar LE,etal.The role of surgical resection in the management of newly diagnosed brain metastases:a systematic review and evidence-based clinical practice guideline[J].J Neurooncol,2010,96:33.
[29] 王宏伟,窦长武,鞠海涛,等.MR薄层定位扫描与常规扫描检测脑转移瘤数量的对比研究[J].临床神经外科杂志,2014,11:252.
[30] 庞军,陈浩涛,陈燕,等.伽玛刀分次立体定向放疗治疗脑转移瘤的疗效及预后分析[J].肿瘤,2013,8:723.
[31] Fahtig A,Ganslandt O,Lambrecht U,etal.Hypofractionated stereotrctic radiotherapy for brain metastases-results from three different dose concepts[J].Cancer Radio,2010,14:625.
[32] Matsuyama TI,Kogo K,Oya N.Clinical outcomes of biological effective dose-based fractionated stereotactic radiation therapy formetastatic brain tumors from non-small cell lung cancer[J].Int J Radiat Oncol Biol Phys,2013,85:984.
[33] Fokas E,Henzel M,Surber G,etal.Stereotactic radiosurgery and fractionated stereotactic radiotherapy:comparison of efficacy and toxicity in 260 patients with brain metastases[J].J Neurooncol,2012,109:91.
[34] Minniti G,D’angelillo RM,Scaringi C,etal.Fractionated stereotactic radiosurgery for patients with brain metastases[J].Neuro Oncol,2014,117:295.
[35] Feuvret L,Vinchon S,Martin V,etal.Stereotactic radiotherapy for large solitary brain metastases[J].Cancer Radiotherapie,2014,18:97.
[36] Wegner RE,Leeman JE,Kabolizadeh P,etal.Fractionated stereotactic radiosurgery for large brain metastases[J].Am Clin Oncol,2015,38:135.
(收稿2016-07-12 修回2016-09-23)
10.3969/j.issn.1672-7770.2017.01.020
内蒙古自治区自然科学基金(2014MS0836,2015MS 08128)
010050 呼和浩特,内蒙古医科大学附属医院头部伽玛刀治疗中心
王宏伟
R739.41
A
1672-7770(2017)01-0072-04

