萝卜抽薹相关SRAP分子标记筛选与分析
刘哲+许园园+苏小俊


摘要:利用抽薹性状差异较大的晚抽薹萝卜品种L2和早抽薹萝卜品种E6配制杂交组合,构建F2群体。通过田间调查,选用极晚和极早抽薹单株分别构建晚抽池(BSA-1)和早抽池(BSA-2),用288对SRAP组合对两亲本进行PCR分析,共筛选出166对SRAP引物组合。通过2个基因池及基因池中各单株对筛选出的引物进行复筛,获得引物组合me3+em9,其在晚抽池中可扩增出多态性片段LB;对156株F2单株进行验证发现,LB与晚抽薹基因紧密连锁,其遗传距离为5.7 cM。
关键词:萝卜;晚抽薹;分子标记;遗传距离
中图分类号: Q943;S631.103文献标志码:
文章编号:1002-1302(2016)08-0074-03
抽薹开花是农业生产上的一个重要现象,不仅对植物生殖器官的形成起关键作用,而且关乎到植物的生物产量和产品品质。先期抽薹在十字花科作物栽培上是一个倍受关注的问题,不仅会降低十字花科作物的生物产量,而且会影响到产品的品质,晚抽薹是十字花科作物一個重要的育种目标[1]。生物技术的发展给作物遗传育种研究带来巨大变化,分子标记技术的应用是其中之一。分子标记具有位点丰富、多态性高、稳定可靠等特点,且检测不受时间和性状表达限制,可鉴别基因型的纯合或杂合。本研究利用与晚抽薹基因紧密连锁的分子标记可以方便准确识别不同晚抽薹基因的特点,通过群体分离分析法(BSA)筛选出与晚抽薹萝卜基因紧密连锁的分子标记,以实现分子标记辅助育种,减少萝卜选育过程中对表型性状的依赖,从而大大提高萝卜的育种效率。
1材料与方法
1.1材料
萝卜晚抽薹品种L2,为韩国白玉春萝卜第9代自交系;早抽薹品种E6,为短叶13萝卜第10代自交系,均由江苏省农业科学院蔬菜研究所提供。将晚抽薹与早抽薹亲本进行杂交再自交,形成F2分离世代群体共计156株单株。引物由上海英俊进行合成;dNTPs、TaqDNA聚合酶等分子生物学试剂,均购于TaKaRa公司。
1.2试验方法
1.2.1DNA提取与检测试验于2014年在江苏省农业科学院园艺研究所高效园艺作物遗传改良重点实验室进行,基因组DNA提取采用改良的CTAB法。采用DYY-Ⅲ-5型稳压稳流电泳仪,缓冲液为1.2%TAE,琼脂糖凝胶电泳检测,电泳时电压100 V(5 V/cm),时间为1 h。电泳结束,在 FR-200 紫外可见分析装置上检测、照相,记录结果。
1.2.2SRAP反应采用优化的SRAP反应体系,SRAP引物序列参考Li等信息[2-3]。PCR反应体系(10 μL)为:3.0 mmol/L MgCl2,0.2 mmol/L dNTPs,0.3 μmol/L上、下游引物,0.6 U TaqDNA聚合酶,20 ng模板DNA。PCR反应程序为94 ℃变性3 min;94 ℃ 60 s,35 ℃ 60 s,72 ℃ 90 s,5个循环;94 ℃ 60 s,50 ℃ 60 s,72 ℃ 90 s,33个循环;72 ℃延伸10 min。PCR产物采用8%非变性聚丙烯酰胺凝胶电泳,80 V预电泳30 min,160 V电泳2.5 h。凝胶中含有Arc ∶[KG-*3]Bis为29 ∶[KG-*3]1 6.65 mL,5×TBE 5 mL,TEMED 20 μL,10%AP 0.3 mL。1×TBE电泳缓冲液配方(1 L)为:0.054 g Tris,0027 5 g硼酸,0.25 mol/L EDTA 0.04 mL,pH值为8.0。电泳结束,采用0.5%冰醋酸、10%乙醇固定15~20 min,0.2% AgNO3溶液染色12~15 min;蒸馏水洗涤2次,于含1.5%NaOH、0.4%甲醛、0.002% Na2S2O3的显影液中显影,白炽灯箱下观察拍照。
1.2.3引物筛选利用萝卜晚抽薹品种代号L2和早抽薹品种E6的DNA为模板,从现有288对SRAP引物中筛选出双亲间存在多态性、条带清楚、易于识别、可以稳定扩增的引物;基于抽薹性状表现型,在F2群体中选取极早抽薹和极晚抽薹单株各10株,构建早抽池(BSA-1)及晚抽池(BSA-2),待幼苗长至5叶1心时提取DNA,等量混合;分别提取各单株基因组DNA,以早抽池、晚抽池及2个基因池中各单株 DNA 为模板,对筛选出的多态性引物进行再次筛选,寻找可能与目标基因连锁的标记;用获得的DNA标记对F2群体进行标记。PCR 产物在8%非变性聚丙烯酰胺凝胶中进行电泳。
1.3数据统计及连锁分析
用筛选到的具有多态性引物组合对待检测F2群体的DNA样品进行PCR扩增,统计有差异、易于识别的多态性条带,有带记为1,无带记为0。田间调查时,分别以1、0记录晚抽薹、早抽薹的植株;根据引物扩增结果,建立SRAP数据库;使用Joinmap 4.0分析分子标记,设最小LOD值为3.0,并用Kosambi函数将重组值转换成图距单位(cM)。
2结果与分析
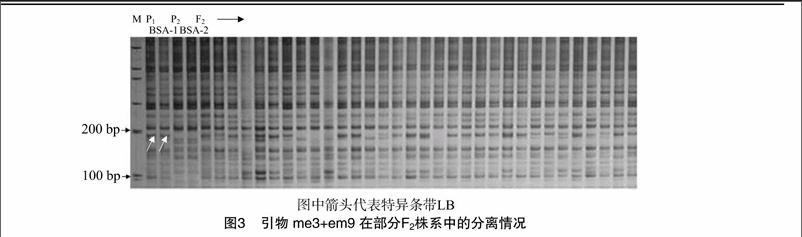
[FL(2K2]em9进一步验证,各标记在分离群体中并非表现为全有和全无的差别,有少数晚抽薹萝卜单株未能扩增出差异条带,同样也有少数早抽薹单株扩增产生差异条带。用Joinmap 4.0软件对分子标记进行分析得知,me3+em9与萝卜晚抽薹基因紧密连锁,其遗传距离为5.7 cM(图4)。
3结论与讨论
分子标记技术与其他分子生物学研究相比,具有简单快捷的优点。相关序列扩增多态性(SRAP)是Li等[2]发展的一种分子标记方法,具有简便、产率高、可显示大量的共显性标记、易从序列中得到分离条带等优点,已被广泛应用于图谱构建、比较基因组学、基因克隆和遗传多样性等研究[4-9]。Li等在对羽衣甘蓝×花椰菜的RI系构建遗传图谱时,用SRAP成功标记了芥子油脱饱和基因BoGLSALK,该基因在图谱Ll连锁群上距SRAPl33标记为1.4 cM[7]。另外,研究人员在中国白菜中发现了1个与雄性不育基因有关的SRAP标记,在油菜中筛选到1个与恢复基因连锁的SRAP标记,在芹菜中获得1个与病毒抗性基因紧密连锁的SRAP标记[10]。
抽薹性状属于数量性状遗传,易受环境条件的限制影响。目前,利用分子标记技术对抽薹性状的研究已有诸多报道。Ken等通过甘蓝和青花菜的F2群体RFLP连锁图,鉴定出控制从种植至现蕾天数的主效基因位于第2、第7连锁群上,从种植到现蕾的天数、现蕾到开花的天数这2个性状的许多标记位点密切相关。曹维荣等运用RAPD技术,采用混合分离群体法(BSA)对甘蓝迟抽蔓基因相连锁的分子标记进行研究,得到与甘蓝迟抽蔓基因相连锁的RAPD标记Nl-750,其连锁距离为7.9 cM[11]。卓祖闯等运用RAPD、SRAP、RSAP、SSR、SCAR技术,采用BSA法对大白菜晚抽蔓基因紧密连锁的分子标记进行研究,分别获得1个晚抽蔓基因紧密连锁的RAPD标记和RSAP标记,同时获得1个与早抽蔓基因连锁的SRAP标记[12]。
本研究中,从288对引物中筛选获得116对可以在双亲间稳定扩增出清晰条带、表现出多态性的引物组合,多态率为40.3%;将116对引物的PCR产物用8%非变性聚丙烯凝胶酰胺电泳构建图谱,共得到条带285条,其中多态性条带为66条,多态率为23.2%,每对引物扩增出的条带数量范围为0~40,多态性条带的数量范围为0~5,得到与萝卜晚抽薹基因紧密连锁的标记1个,其遗传距离为5.7 cM。这为以后的萝卜晚抽薹育种提供了理论基础。
参考文献:[HJ1.78mm]
[1]黄细松. 白菜开花时间相关基因的分子标记及春化相关基因的克隆和表达分析[D]. 杭州:浙江大学,2006.
[2]Li G,Quiros C F. Sequence-related amplified polymorhism(SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J]. Theoretical and Applied Genetics,2001,103(2):455-461.
[3]張波. 不结球白菜晚抽蔓分子标记及抽蓄性遗传分析[D]. 南京:南京农业大学,2007.
[4]刘雅辉,闫红飞,杨文香,等. 小麦抗叶锈病基因[WTBX][STBX]Lr19[WTBZ][STBZ]的SRAP标记[J]. 华北农学报,2007,22(4):193-196.
[5]陈晖,陈美霞,陶爱芬,等. 长果种黄麻SRAP标记遗传连锁图谱的构建及3个质量性状基因定位[J]. 中国农业科学,2011,44(12):2422-2430.
[6]Yeboah M X. A genetic linkage map of cucumber (Cucumis sativus L.) combining SRAP and ISSR markers[J]. African Journal of Biotechnology,2007(6):2784-2791.
[7]Li G,Gao M,Yang B,et al. Gene for gene alignment between the Brassica and Arabidopsis genomes by direct transcriptome mapping[J]. Theoretical and Applied Genetics,2003,107(1):168-180.
[8]Xu L,Wang L J,Gong Y Q,et al. Genetic linkage map construction and QTL mapping of cadmium accumulation in radish (Raphanus sativus L.)[J]. Theoretical and Applied Genetics,2012,125(4):659-670.
[9]张冬菊,李世超,吴鹏夫,等. 基于表型和SRAP标记的切花菊品种遗传多样性分析[J]. 园艺学报,2014,41(1):118-130.[ZK)]
[10]柳李旺,龚义勤,黄浩,等. 新型分子标记SRAP与TRAP及其应用[J]. 遗传,2004,26(5):777-781.
[11]曹维荣,王超. 甘蓝迟抽薹基因的RAPD标记[J]. 生物技术通报,2007(5):167-169.
[12]卓祖闯,万恩梅,张鲁刚,等. 大白菜抽薹性状的主基因+多基因遗传分析[J]. 西北植物学报,2009,29(5):923-928.

