麻醉药品和精神药品管制研究Ⅴ
——国内外麻醉药品和精神药品的管制制度比较研究
满春霞,邹武捷,杨淑苹,管晓东,3#,史录文,3(.北京大学药学院,北京 009;.北京大学基础医学院,北京 009;3.北京大学医药管理国际研究中心,北京 009)
麻醉药品和精神药品管制研究Ⅴ
——国内外麻醉药品和精神药品的管制制度比较研究
满春霞1*,邹武捷1,杨淑苹2,管晓东1,3#,史录文1,3(1.北京大学药学院,北京 100191;2.北京大学基础医学院,北京 100191;3.北京大学医药管理国际研究中心,北京 100191)
目的:为完善我国麻醉药品和精神药品(以下简称麻精药品)的管制工作提供建议。方法:从概念、分类、管制依据和管制机构等方面对国际组织、美国、英国和中国的麻精药品管制制度进行比较,并提出建议和参考。结果与结论:国际组织和美、英、中三国所指麻精药品均为纳入相关目录管制的品种,但美英还将兴奋剂、易制毒化学品等其他药品纳入管制目录;国际组织将麻精药品分为Ⅰ~Ⅳ4类,美国分为Ⅰ~Ⅴ5类,英国分为A、B、C 3类和临时类,中国分为麻醉药品和第一、二类精神药品;美、英、中三国的管制依据分别为《管制物质法案》《药品滥用法案》和《麻醉药品和精神药品管理条例》,主要管制机构分别为司法部下属的管制物质强制管理局、内政部下属的药品滥用咨询委员会、国家食品药品监督管理总局下设的特殊药品监管处,各国管制机构职能与协作单位也有所区别。基于我国麻精药品管制存在的问题,建议我国应完善法律法规体系,建立独立管制机构,延伸滥用监测网络,建立慢性非癌痛治疗原则。
对比;麻精药品;管制;监测网络;主动监测
近年来,我国药物滥用者数量持续增加,合成毒品滥用现象呈逐年增加趋势,与此同时,麻醉药品医用水平偏低,与发达国家相比存在较大差距[1-3]。因此,加强和改善麻醉药品和精神药品(以下简称麻精药品)的监管,控制药物滥用,提高患者生存质量刻不容缓。本系列研究通过纵向梳理国际组织、美国、英国和中国麻醉药品和精神药品(以下简称麻精药品)的管制历史和现状,从麻精药品的概念、分类、管制依据和机构4个方面对现行管制制度进行横向比较,并从发展历程的角度加以解释,以期为中国麻精药品管制工作提供参考。
1 中外麻精药品管制制度比较
1.1 麻精药品的概念
国际组织和美国、英国、中国的麻精药品概念的比较见表1[4-5]。
由表1可知,国际组织和美英中三国所指麻精药品均为纳入目录管制的品种。此外,美国管制物质和英国的管制药品不仅包括麻精药品,还包括兴奋剂、易制毒化学品等其他药品。而中国将麻精药品与兴奋剂、易制毒化学品等分开立法管制。这是因为对美英而言,管制物质和管制药品是管理学概念,凡是需要管制的就可以称为管制物质(药品),中国则是依据药理特性对各类特殊药品进行分类管制。

表1 麻精药品概念比较Tab 1 Comparison of narcotics and psychotropic substances concept
概念上的差异反映的是两种不同的管制思路:美英对需要实行管制的物质(药品)进行统一立法,不同类别的管制物质(药品)实行不同程度的管制措施。中国对需要管制的各类药品分开立法,形成相对独立的多个管制体系,管制措施也不尽相同,各种体系之间既有交叉又有区别。两种模式各有优劣,第一种模式立法结构单一,普适性强但缺少针对性;第二种模式针对性强,但体系间关系略显复杂。
1.2 麻精药品的分类
为方便管制、实施不同层次的管制措施,国际组织和各国均对麻精药品进行了分类,分类依据和管制级别比较见表2。

表2 麻精药品分类依据和管制级别比较Tab 2 Comparison of NPS classification basis and control level
国际组织和美国、英国对麻精药品的分类与相应的管制措施直接相关,不同类别的药品在生产、供应、使用和惩罚等环节都对应着不同的管制规定。例如,美国Ⅰ类特殊药品仅供研究所用,不能用作医疗用途,Ⅱ~Ⅴ类药品则可用于医疗用途,而Ⅲ~Ⅴ类药品的违法行为处罚力度比Ⅰ、Ⅱ类药品的处罚力度轻等[6]。这种分级别管制的模式可以使管制重点更加明晰,利于根据管制级别配置适当资源。
我国麻精药品分类简单,管制措施相对统一。尤其是麻醉药品和第一类精神药品,对于目录内品种,除部分按规定可在我国生产、供应、使用外,其他品种无论成瘾性和危害性程度如何,全部环节均实行统一严格的管制措施。
分类上的差异反映的是两种不同的管制理念。美国、英国及其代表的国际组织,强调个人权利,从方便患者使用的角度出发,对临床应用广泛、医疗价值高的管制物质(药品)实行较低的管制水平,基本能够满足患者需求。我国管制麻精药品的核心任务是在合理使用的前提下,严防流弊事件的发生,因此制定了一系列严格的管制措施,从生产到使用实行全程管制。
1.3 麻精药品的管制依据
早在20世纪70年代,美国和英国便以缔约《精神药品公约》为重要契机,完成了现行麻精药品管制的立法。我国立法工作起步较晚,直到1984年才开始药品法制化管制,2005年发布的《麻醉药品和精神药品管理条例》是当前麻精药品管制的主要依据。各国麻精药品管制依据比较见表3。
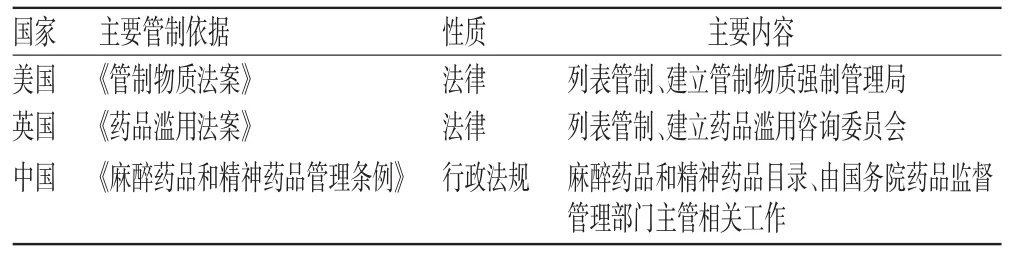
表3 各国麻精药品管制依据比较Tab 3 Comparison of NPS control basis
我国麻精药品管制法规层级较低,早期为部门行政规章,现为行政法规。相比之下,美国和英国的管制依据为法律,立法层级和法律效力均高于我国。这是因为在美国和英国,管制物质(药品)与普通药品分开管制,管制体系相对独立,在立法上也不受限制。中国的麻精药品在药品体系下管制,立法上受限于上位法《中华人民共和国药品管理法》的规定,因此,不仅是法律层级相对较低,在很多具体内容上也有一定局限性。
1.4 麻精药品的管制机构
管制机构是实施和执行政策法规的主体,其性质和管制行为对政策的贯彻执行有重要影响。
因为管制体系不同,三个国家在管制机构设置上也存在明显差异。美国管制物质强制管理局(DEA)的主要任务是执行与管制物质相关的法律法规、将参与贩毒活动的组织和主要成员移交至司法系统等。英国内政部的职责繁多,在管制药品方面,由其下属的药品滥用咨询委员会(ACMD)负责制订管制药品滥用的相关政策,另由严重有组织犯罪局(SOCA)负责打击毒品犯罪,由国家药品滥用治疗机构负责收集药品滥用者的相关信息。我国的麻精药品管制工作由国家食品药品监督管理总局(CFDA)下属的特殊药品监管处(简称特药处)负责,其职责包括拟定和监督实施麻精药品管制制度、行政审批、组织开展麻精药品滥用监测等,而国家卫生和计划生育委员会(简称卫计委)、农业部、公安部等其他部门也对不同的环节进行管制,详见表4。
通过对各国主管部门职能的比较发现,美国和英国的立法机构和执法机构相互分开:美国立法一般经由国会负责,DEA负责法案的具体执行;英国的立法部门内政部和执法机构SOCA也是各自独立的部门;我国的特药处几乎承担了立法和执法两项职能,而在资源配置方面与美国和英国相比都相距甚远,这将直接影响到管制效果。
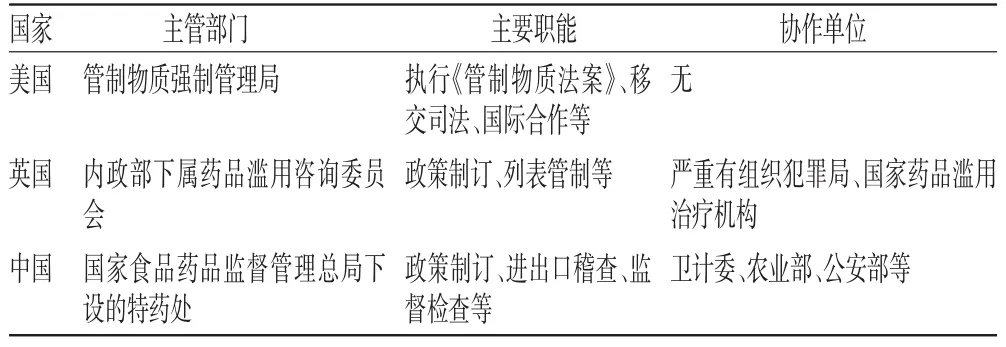
表4 各国麻精药品管制机构比较Tab 4 Comparison of NPS control organizations
2 我国麻精药品管制存在的问题
国际社会对麻精药品实施管制以来,至今已有百余年历史,而美国和英国对麻精药品的管制可以追溯到1887和1868年,历史更为久远。相比之下,我国自20世纪80年代后期发布《麻醉药品管理办法》和《精神药品管理办法》,至今也不过30年的发展历史。通过与国际组织和美英两国进行横向比较后发现,我国麻精药品管制和使用主要存在以下问题:(1)法规层级较低,配套措施不完善。长期以来,我国对麻精药品实行市场准入限制、总量控制、定点生产、定点经营等严格的经济性管制,而在相关法规及配套政策、措施方面的建设不足[7]。(2)CFDA、卫计委、农业部和公安部等多部门分散管制的模式使得职权分散,在麻精药品最为关键的数量控制上,无法确保销售和购入的记录一致,饱受诟病[8]。(3)特殊药品监控信息网络目前未能覆盖医疗机构,生产企业的麻精药品仅流入流通企业这一过程实现了全程监控,一旦流出流通企业,监控就进入死角[1,9]。(4)缺乏具体使用规范指南,临床治疗需求未能得到满足。世界卫生组织(WHO)将医疗用吗啡的消耗量作为衡量一个国家治疗癌痛水平的标准,并将吗啡人均年消耗量依>10 mg、1~10 mg、<1 mg分别划分为高、中、低3个档次。2010年以前我国吗啡人均年消耗量均在1 mg以下,处于低档水平;2011-2013年,吗啡人均年消耗量略高于1 mg,跻身中档水平,但与发达国家相比仍存在较大差距[8]。
3 讨论与建议
3.1 完善法律法规体系,分离立法执法职能
法律法规是麻精药品管制工作的基础,法理精确、内容全面、操作性强的法律能够确保管制工作的顺利进行。我国麻精药品管制依据从既往的部门规章提高到现在的行政法规,但与英美以法律作为管制依据相比,仍存在法律层级不高、相关配套措施建设不足、供应运输等环节存在管制漏洞等问题。因此,笔者建议提高麻精药品管制依据的法律层级和效力,完善配套措施,在立法时注意法条的可操作性,对不同管制环节进行细化,使麻精药品配套法律法规更加完备,相关部门执法时有法可依。
此外,CFDA独立承担了立法和执法的职能,不利于麻精药品管制工作的监督工作。建议参考美英两国的经验,由全国人民代表大会及其常务委员会制定相关法律,CFDA履行执法职能。
3.2 建立独立管制机构,实现管制主体单一化
目前,我国麻精药品各环节的管制由不同的部门分别承担,即原材料种植由CFDA和农业部共同负责,生产和经营由CFDA主管,医疗机构的使用环节则由卫计委进行管制,运输由交通部负责,打击违法犯罪和流失查处由公安部门管制。这种管制模式职权分散,影响政策的协调一致性。例如,涉及麻精药品流通链的生产、经营和医疗机构使用的3个主要环节分别由CFDA和卫计委负责,医疗机构凭借印鉴卡购买麻醉药品和第一类精神药品后,CFDA有权对药品生产、经营企业的销售行为和账目进行审查,但无法审查医疗机构的购买行为和账目,这就造成了CFDA无法对麻精药品从经营企业售出后的流向进行有效追踪,造成监控不利的局面,破坏了从供应链开始进行管制的连续性。
相比之下,美英两国麻精药品管制体系独立于普通药品管制体系,职能相对集中。以美国DEA为例,其运作独立、职责范围大,实现了科研、生产、销售、医疗使用、交通、进出口、打击犯罪和国际合作等几乎涉及“管制物质”所有方面的管制。因此本研究建议集中管制权限,建立一个相对独立的管制部门,对麻精药品种植、研发、生产、经营、使用等进行全面的管制,尤其是建议统一生产、经营和使用环节的管制工作,确保麻精药品流通链管制的连续性。
3.3 延伸麻精药品滥用监测网络,开展主动监测工作
我国药监部门于2007年9月基本建成全国特殊药品监控信息网络,实现了对麻精药品生产、购进、销售、存放及流向的实时监控[10]。但该系统并未覆盖到由卫生部门管辖的医疗机构使用环节,因此不能明确麻精药品是否全部流入医疗机构,也无法监控医疗机构麻精药品的使用情况。此外,我国麻精药品流行病学信息多通过卫生部门上报、吸毒登记制度和在特定的机构设立监测点等被动监测形式获得,信息来源十分有限。
从1970年起,一些药品滥用较为严重的国家,如美国和欧洲各国等,都先后建立了药品滥用监测体系,实现了对普通药品和“管制物质(药品)”生产、经营、使用等全环节的监测,同时,通过开展主动监测,对不同人群麻精药品滥用信息进行动态管制。以美国为例,美国国内由政府部门或研究所主导,开展全国范围或针对特定人群的主动监测或调查。如美国国家药物滥用研究所每2年开展一次针对大麻、致幻剂、可卡因、阿片类等药品的全国药品滥用家庭调查,对全国范围内12岁以上人群抽取八千至数万样本,以评估全国的药品滥用人数;密歇根大学社会研究所每年进行一次涉及全国范围内125~140所学校中、高年级学生的调查,以此估算各类管制物质的使用情况和动态变化等[11-12]。此外,美国自2012年在印第安纳州和俄亥俄州试点处方药监测计划,处方药发放者将处方信息收集并上传至处方药监测计划管理平台,供执法部门和处方权所有者查阅。这一计划极大地减少了处方药的滥用行为,使得其他30个州逐渐参与到计划管理中,现已基本将Ⅱ~Ⅴ类“管制物质”列入监测范围[11-12]。
因此,笔者建议将医疗机构纳入麻精药品管制信息化网络覆盖范围,实现流通链全环节的信息化管制;同时,借鉴英美发达国家经验,充分利用社会资源,与有关部门、研究机构密切配合开展麻精药品的主动监测,并通过建立全国联网的处方登记制度管制医疗机构麻精药品使用,保障麻精药品使用信息的准确和全面,以把握社会整体趋势。
3.4 建立鼓励慢性非癌痛治疗原则,按需使用麻精药品
随着我国经济水平的提高和医药卫生事业的发展,用于医疗使用目的的麻精药品的需求量也日益增加。尽管我国早在90年代就开始推行癌痛三阶梯治疗原则,但癌痛治疗中麻精药品的使用水平仍落后于国际平均水平,与实际治疗需求存在很大差距[7]。此外,我国社会更多关注癌症患者麻精药品是否滥用,缺乏指导慢性非癌疼痛患者用药的指南和政策支持。
而国际上,以美国为例,为满足疼痛治疗对麻醉药品的需求,DEA在2006年9月6日专门颁布了《控制药品疼痛治疗指南》。该指南强调虽然美国存在大量的药品滥用问题,但患者疼痛必须引起医疗机构和医师的重视[7]。同时明确了医师的权利和义务,鼓励医师积极应对患者的疼痛治疗,减轻向患者开具麻醉药品处方时过多的负担或担心。除此之外,美国还在《执业医师指导手册》中指出,对于临终患者的长期关怀项目等,可以通过处方复印件直接使用没有新处方不能再配置的Ⅱ类控制药品。同时,英美国家通过对“管制物质(药品)”临床使用价值的评估对“管制物质(药品)”进行分级管制,也保障了“管制物质(药品)”的临床合理应用[13]。
据WHO报道,相关医学知识受限、对麻醉药品滥用和成瘾依赖的恐惧以及缺乏有力的政策支持等均是导致麻精药品使用受限的原因[14]。因此笔者建议借鉴英国和美国分级管制的方法,根据对麻精药品临床价值和有害性的评估采取不同的管制方式和管制力度。同时,针对临床上较常使用的麻精药品,逐步推出和细化临床治疗技术指南,明确医师的权利和义务,指导麻精药品临床合理使用,积极鼓励癌痛和慢性非癌痛治疗,改变医师和患者对与麻精药品使用“谨小慎微”的观念,满足临床治疗需求。
4 结语
我国麻精药品管制市场与政策环境在不断优化,然而在管制依据级别、管制机构层级、资源配置、监控网络覆盖、临床需求满足程度等方面与英美两国仍存在较大差距。通过学习国外麻精药品管制的相关经验,针对缺点和不足作出适当的调整,不断完善我国的监管体系和控制方法,才能更好地提升麻精药品的管制水平,满足临床治疗需求。
[1] 王晓磊.麻醉药品和精神药品监管主体法律问题研究[D].天津:天津师范大学,2014.
[2] 国家食品药品监督管理总局,国家禁毒委员会办公室.国家药物滥用监测报告(2013年度)发布[EB/OL].[2016-05-30].http://ww.sda.gov.cn/WS01/CL0051/107039.html.
[3] 国家食品药品监督管理总局,国家禁毒委员会办公室.
2014年国家药物滥用监测年度报告发布[EB/OL].[2016-05-30].http://www.sda.gov.cn/WS01/CL0051/128740.html.
[4] UNODC.Single convention on narcotic drugs:1961[EB/ OL].[2016-05-30].http://www.unodc.org/documents/commissions/CND/Int_Drug_Control_Conventions/1961_ Schedules/ST-CND-1-Add1_C.pdf.
[5] UNODC.Convention on psychotropic substances:1971 [EB/OL].[2016-05-30].http://www.unodc.org/documents/ commissions/CND/Int_Drug_Control_Conventions/1971_ Schedules/ST-CND-1-Add2_C.pdf.
[6] 李翔,邵蓉.美国对特殊药品的管理[J].中国药物滥用防治杂志,2004,10(4):246-248.
[7] 吴迪.我国麻醉药品和精神药品管制中的问题[J].中国药物经济学,2008,11(2):57-60.
[8] 刘勇,吴晓明,顾建琴.我国麻醉药品监管发展问题及域外启示[J].中国新药杂志,2015,24(22):2540-2543、2554.
[9] 王生田,刘雪莹,吴迪.我国麻醉药品和精神药品政府管制中存在的问题及改革设想[J].中国药事,2008,22(11):939-941.
[10] 张东风.全国特殊药品监控信息网络初步建成[N].中国中医药报,2007-10-11(1).
[11] 卢熠.美国特殊管理药品滥用的监测与干预方式及其启示[J].中国药房,2012,23(21):1938-1940.
[12] 闫泉,邵蓉.美国麻精药品监管制度评价[J].现代商贸工业,2014,26(19):68-69.
[13] DEA.Dispensing controlled substances for the treatment of pain[EB/OL].[2016-06-03].http://www.deadiversion. usdoj.gov/fed_regs/notices/2006/fr09062.html.
[14] 陈鸣.中国麻醉药品管理历史沿革及医疗机构麻醉药品管理[J].中国医院药学杂志,2015,35(5):375-379.
(编辑:刘明伟)
Study on Narcotics and Psychotropic Substances Control(PartⅤ):Comparative Study on Domestic and Foreign Control System of Narcotics and Psychotropic Substances
MAN Chunxia1,ZOU Wujie1,YANG Shuping2,GUAN Xiaodong1,3,SHI Luwen1,3(1.College of Pharmacy,Peking University,Beijing 100191,China;2.School of Basic Medical Sciences,Peking University,Beijing 100191,China;3.International Research Center of Medicinal Administration,Peking University,Beijing 100191,China)
OBJECTIVE:To make proposals to improve narcotics and psychotropic substances(NPS)control in China.METHODS:NPS control system of international organizations,the United States,Britain and China were compared in terms of concept,classification,regulatory basis and agency,etc.The suggestions and reference were put forward.RESULTS&CONCLUSIONS:NPS of international organizations,the United States,Britain and China are drug types included in relevant categories,besides analeptics,precursor chemicals and other drugs are included in control catalogue by the United States and Britain.NPS are divided intoⅠ-Ⅳcategories by international organizations,Ⅰ-Ⅴcategories by the United States,A,B,C categories and temporary category by Britain,and narcotics,first and second class psychotropic substances by China.NPS control basis of the United States,Britain and China are Controlled Substances Act,Misuse of Drugs Act and Regulations on Narcotics and Psychotropic Drugs Control,respectively;major regulation organizations are Controlled Substances Enforcement Administration,Advisory Committee on Drug Abuse subordinated to Ministry of Interior,Special Drug Section under China Food and Drug Administration,respectively;there also are differences in the functions of control organization and cooperative units.Considering about the problems of NPS control in China,it is suggested to improve laws and regulations system,establish independent system,extend abuse surveillance network and encourage chronic non-cancer pain therapy.
Comparison;Narcotics and psychotropic substances;Control;Surveillance network;Active surveillance
R95
A
1001-0408(2017)01-0023-04
2016-06-14
2016-11-07)
*硕士研究生。研究方向:国家药物政策。电话:010-82805019。E-mail:manchx@163.com
#通信作者:讲师,博士。研究方向:药品公平可及与合理使用。电话:010-82801701-237。E-mail:guanxiaodong@bjmu.edu.cn
DOI10.6039/j.issn.1001-0408.2017.01.06

