饲料中添加肌肉生长抑制素抑制肽对海鲈生长性能、体组成、血清生化指标及肝脏与血清免疫指标的影响
李雅婷 田梦丽 谢换换 郭天宇 牛 津刘永坚 田丽霞
(中山大学生命科学学院水生经济动物研究所,广州 510275)
饲料中添加肌肉生长抑制素抑制肽对海鲈生长性能、体组成、血清生化指标及肝脏与血清免疫指标的影响
李雅婷 田梦丽 谢换换 郭天宇 牛 津∗刘永坚 田丽霞
(中山大学生命科学学院水生经济动物研究所,广州 510275)
本试验旨在研究饲料中添加肌肉生长抑制素抑制肽对海鲈生长性能、体组成、血清生化指标及肝脏与血清免疫指标的影响。以初始均重为(9.05±0.05)g的海鲈幼鱼为试验动物,暂养1周后,挑选规格一致的健康试验鱼480尾,随机分为4组,每组4个重复(水族箱),每个重复放养30尾鱼。4组试验鱼分别投喂肌肉生长抑制素抑制肽添加水平为0(对照)、0.25%、0.50%、0.75%的试验饲料135 d。结果显示:1)0.50%组的增重率(WGR)、特定生长率(SGR)和成活率(SR)均显著高于对照组(P<0.05),各添加组的饲料系数(FCR)均显著低于对照组(P<0.05),且以0.50%组的FCR最低;2)各添加组的背肌粗脂肪含量均显著低于对照组(P<0.05),0.50%组的背肌粗蛋白质含量显著高于对照组(P<0.05),全鱼的水分、粗蛋白质、粗脂肪、粗灰分和背肌的水分、粗灰分含量在各组之间没有显著差异(P>0.05);3)0.25%组的血清总蛋白(TP)、白蛋白(ALB)和总胆固醇(TC)含量显著低于其他各组(P<0.05),血清甘油三酯(TG)含量各组间不存在显著差异(P>0.05);4)0.50%和0.75%组的血清碱性磷酸酶(ALP)活性显著高于对照组(P<0.05),0.25%和0.50%组的肝脏溶菌酶(LZM)活性显著高于对照组(P<0.05),肝脏与血清的总抗氧化能力(T-AOC)和肝脏超氧化物歧化酶(SOD)活性各组间不存在显著差异(P>0.05)。综上所述,在饲料中添加肌肉生长抑制素抑制肽能够促进海鲈的生长并提高免疫能力,本试验条件下最适添加水平为0.50%。
肌肉生长抑制素抑制肽;海鲈;生长性能;血清生化指标;免疫指标
肌肉生长抑制素(myostatin,MSTN)是动物肌肉细胞生长调控中的一种负调控因子,即生长分化因子8(growth differentiation factor 8,GDF-8),属于转化生长因子 β(transforming growth factor β,TGF-β)家族成员。在鱼类中,MSTN分布广泛,其基因可在肌肉、脑、鳃、肠道、肾脏、性腺等处表达[1]。有研究报道,白鲈(Morone chrysops)的MSTN基因表达部位在肌肉中[2]。MSTN在肌肉生长的调节方面一直起负调节作用[3],鱼类MSTN的主要作用与哺乳动物类似。MSTN的调控机制是作为胞外信号分子与成肌细胞膜上的受体结合引起受体自身的磷酸化,启动细胞内一系列信号传导过程,作用于生肌决定因子(MyoD)靶基因的调控区,调节肌肉组成蛋白基因的表达[4-5]。研究表明,经基因敲除技术构建的MSTN基因突变纯合体小鼠的肌细胞表现出过度增生与肥大,且相比正常小鼠其肌肉量显著增加[3]。抑制成年鼠MSTN基因的表达能导致其肌肉量增加25%左右[6]。
长期以来人们一直认为蛋白质必须水解成游离的氨基酸后才能被利用,直到20世纪60年代Newey等才提出肽可以完整被吸收的证据[7]。小肽是由2个以上的氨基酸彼此以肽键相互连接的化合物,是一种具有多种生物学功能的肽。小肽相比氨基酸的吸收,具有速度快、耗能低、不易饱和且各种肽之间运转无竞争性与抑制性的特点[8],且有大量研究表明饲料中添加小肽能促进动物生长,改善饲料效率,提高动物的免疫力,并具有调节肉制品风味等特性。例如,Kotzamanis等[9]研究得出,在饲料中添加10%的小肽对欧洲鲈鱼(Dicentrarchus labrax)的生长起到最佳促进作用;于辉等[10]的研究成果表明,饲料中添加酪蛋白小肽能促进草鱼(Ctenopharyngodon idella)的生长及对饲料的利用。
MSTN是目前所知的最强的肌肉生长抑制因子,因此人们一直试图寻找MSTN的抑制物或相关技术来抑制MSTN功能的发挥。已有报道表明MSTN体外抑制物可降低其负向调节肌肉生长发育的作用,导致肌肉量的增加[11]。Whittemore等[12]给小鼠上注射MSTN抗体,结果发现小鼠肌肉量和体重增加。张宁宁等[13]首先制备 MSTN抗体,然后将获得的抗体显微注射到大口黑鲈(Micropterus salmoides)的受精卵卵黄区,结果显示具有促进仔鱼生长的作用。MSTN抑制肽(MSTN inhibitory peptides)是一种新型小肽,作用机理同MSTN抗体类似,能抑制MSTN的活性。本试验以海鲈作为试验动物,以肌肉生长抑制素抑制肽的添加水平为变量,探究饲料中添加不同水平MSTN抑制肽对海鲈生长性能、体组成、血清生化指标、肝脏和血清免疫指标的影响,旨在为海鲈配合饲料的基础研究和生产实践提供理论依据。
1 材料与方法
1.1 试验饲料
本试验配制了4种等氮等脂的试验饲料(粗蛋白质含量约为40.0%,粗脂肪含量约为6.5%),其组成及营养水平如表1所示,试验饲料中MSTN抑制肽[由共鳞实业(深圳)有限公司提供]的添加水平分别为0(对照)、0.25%、0.50%和0.75%。所有饲料原料先经粉碎,再过40目筛过滤,随后按表1中的比例准确称重并初步混合后,在商用饲料搅拌机中搅拌15 min,之后加入预先混匀的鱼油、豆油和卵磷脂,再搅拌 15 min,再加入大约40%的蒸馏水(体积/重量),继续搅拌15 min,用双螺杆挤条机(华南理工大学机械工程研究所制作)挤压成粒径分别为2.0和3.5 mm的颗粒饲料,经打磨后在空调房中抽干至水分含量在10%左右,而后用封口塑料袋分装,标记后储存于-20℃的冰柜中备用。
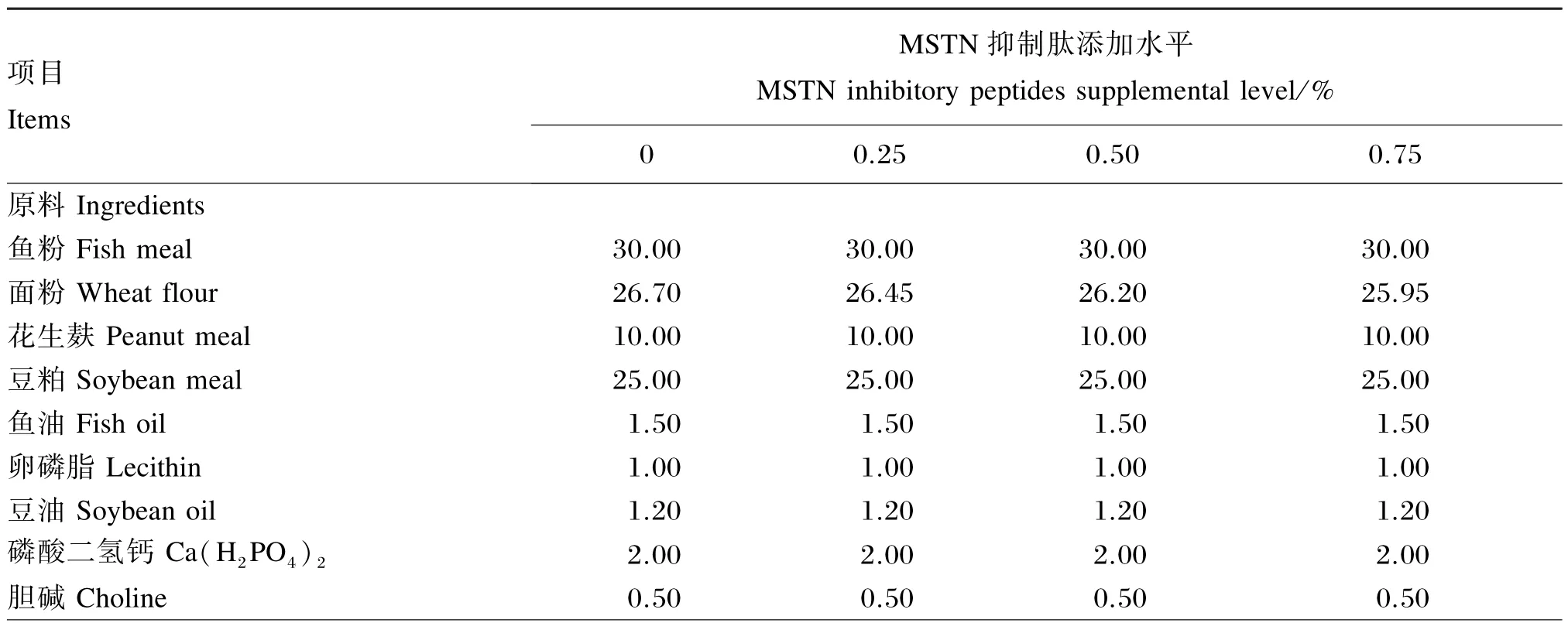
表1 试验饲料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(DM basis) %
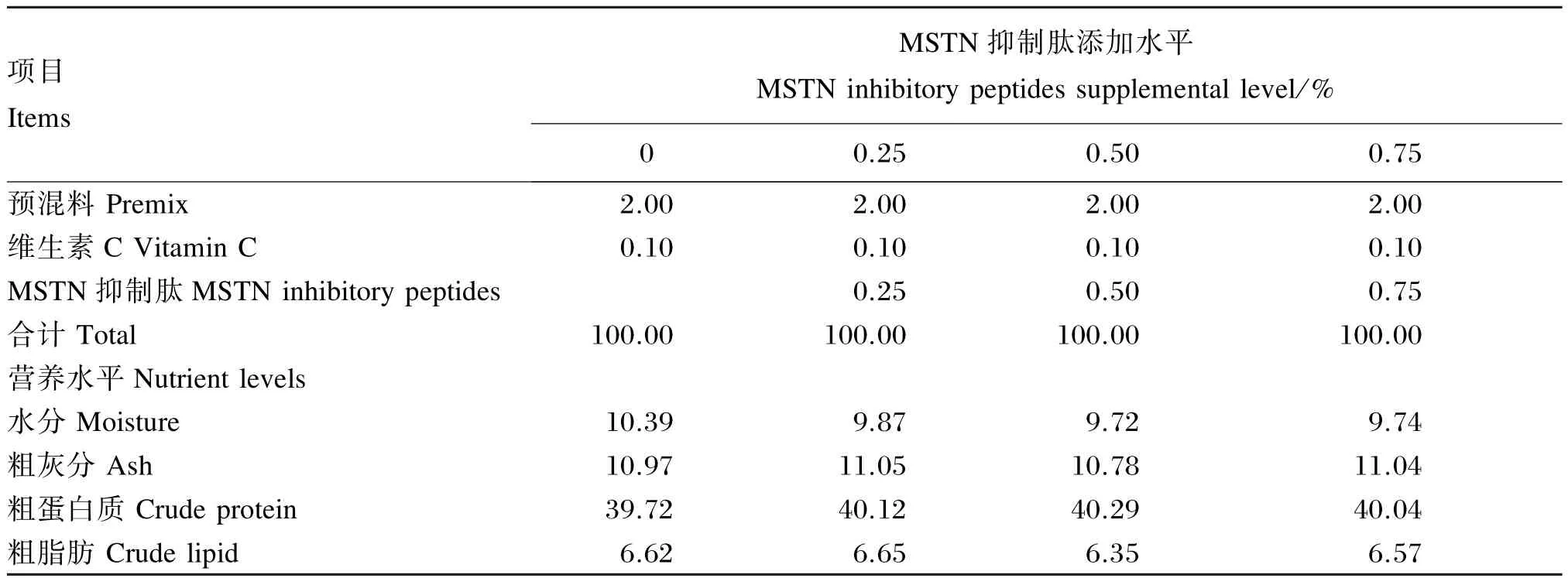
续表1
1.2 试验动物与饲养管理
养殖试验在珠海鱼虾营养研究基地进行。选取初始均重为(9.05±0.05)g的海鲈幼鱼为试验动物。在试验开始前将试验鱼置于1 000 L的水泥池中暂养1周,以便适应试验条件,暂养期间投喂商品饲料(广东君有饲料有限公司1号幼虾料,粗蛋白质含量≥41.0%,粗脂肪含量≥4.0%),暂养结束后开始正式试验。挑选规格一致的健康试验鱼480尾,养殖于16个250 L的水族箱中,内含200 L咸淡水,每箱放养30尾。每种试验饲料随机投喂给 4个水族箱,每天投喂 2次(分别为08:30和18:00),试验1~4周投喂粒径为2.0 mm的颗粒饲料,之后投喂粒径为3.5 mm的颗粒饲料。试验期间养殖系统微流水设置,初始投喂量按初始体重的6%计算,之后根据摄食情况及时调整投喂量,同时记录投喂量,每天清除残饵和粪便,残饵收集干燥称重。养殖周期为135 d。试验期间定期进行水质测定,水温为27~31℃,盐度为6‰~7‰,溶解氧浓度为6~7 mg/L,pH为7.0~7.4,硫酸物浓度为0~0.05 mg/L,亚硝酸氮浓度为0.05~0.10 mg/L,氨氮浓度为0.20~0.40 mg/L。
1.3 样品采集
养殖试验期间对鱼体的摄食情况、死亡情况以及对外界刺激的反应等进行记录。135 d的养殖期结束后,饥饿处理24 h,然后对每个水族箱中的试验鱼进行称重和记数,用于计算增重率(weight gain rate,WGR)、饲料系数(feed coefficient ratio,FCR)、成活率(survival rate,SR)和特定生长率(specific growth rate,SGR)。从每个水族箱中随机取2尾鱼作为全鱼样品。每箱再另取5尾鱼,测量体长和体重,用于肥满度(condition factor,CF)的计算;然后用经抗凝剂润洗过的2 mL注射器静脉窦抽取血液,静置 2 h后 4℃下4 000 r/min离心10 min后取上清液分装于1.5 mL离心管中,用于血清生化和免疫指标的测定;取血后进行解剖,分离出对应鱼体的内脏、肝脏和肠脂,称重记录用于脏体比(viscerosomatic index,VSI)、肝体比(hepatosomatic index,HSI)和脂体比(intraperitoneal fat ratio,IPF)的计算,并将肝脏样品保存于1.5 mL离心管中后迅速冻存于液氮中,用于肝脏免疫指标的测定;最后剥离背部肌肉,用于背肌组成的分析。
肝脏组织匀浆液的制备:取-80℃冰箱冻存的肝脏样品(0.2~0.4 g)于冰上解冻后,在冰冷的生理盐水中漂洗,除去血液,滤纸拭干,称重后放入10 mL离心管中,按照1∶9的比例加入0.86%冷生理盐水,用全自动样品快速研磨仪(JXFSTPRP-24,上海净信实业发展有限公司)匀浆后取出,置于离心机中4℃下2 500 r/min离心10 min,取上清液分装至1.5 mL的离心管中,保存于-80℃后用于肝脏免疫指标的测定。
1.4 指标测定
1.4.1 常规营养成分的测定
饲料、全鱼和背肌样品经105℃烘干至恒重,测定其水分含量,烘干后样品磨粉后进行粗蛋白质、粗脂肪、粗灰分含量的测定,测定方法分别为凯氏定氮法(1030-Auto-Analyzer,Tecator AB,Höganäs,瑞典),索氏抽提法(HT6,Tecator AB,Höganäs,瑞典)、马福炉550℃灼烧法。
1.4.2 血清生化指标以及肝脏与血清免疫指标的测定
血清样品送至中山大学附属第一医院,在日立7107A自动生化测定仪上进行总蛋白(TP)、白蛋白(ALB)、总胆固醇(TC)、甘油三酯(TG)含量及碱性磷酸酶(ALP)活性的测定。
血清总抗氧化能力(T-AOC)与肝脏T-AOC和超氧化物歧化酶(SOD)、溶菌酶(LZM)活性以及肝脏蛋白质含量均按照南京建成生物工程研究所提供的检测试剂盒进行测定。
1.5 计算公式

1.6 统计分析
试验结果以平均值±标准差表示。采用SPSS 21.0软件,先经单因素方差分析(one-way ANOVA),若有显著差异,再采用Duncan氏法进行组间的多重比较检验,P<0.05为显著性差异。
2 结 果
2.1 饲料中添加MSTN抑制肽对海鲈生长性能的影响
由表2可以看出,0.50%组的终末体重、增重率和特定生长率显著高于对照组和0.25%组(P<0.05),但与0.75%组没有显著差异(P>0.05),且0.50%组的增重率比对照组高出24.9%;0.50%组的成活率显著高于对照组和0.75%组(P<0.05),但与0.25%组没有显著差异(P>0.05);0.5%组的饲料系数显著低于其他各组(P<0.05);各形态学指标(肥满度、脏体比、肝体比和脂体比)在各组间均不存在显著性差异(P>0.05)。

表2 饲料中添加MSTN抑制肽对海鲈生长性能的影响Table 2 Effects of MSTN inhibitory peptides supplementation on growth performance of sea bass(Lateolabrax japonicas)
2.2 饲料中添加MSTN抑制肽对海鲈体组成的影响
由表3可以看出,全鱼的水分、粗蛋白质、粗脂肪和粗灰分的含量各组之间均无显著差异(P>0.05)。背肌水分和粗灰分含量各组之间无显著差异(P>0.05);0.50%组的背肌粗蛋白质含量显著高于其余各组(P<0.05),其余各组间无显著差异(P>0.05);添加MSTN抑制肽的3个组的背肌粗脂肪含量均显著低于未添加MSTN抑制肽的对照组(P<0.05)。
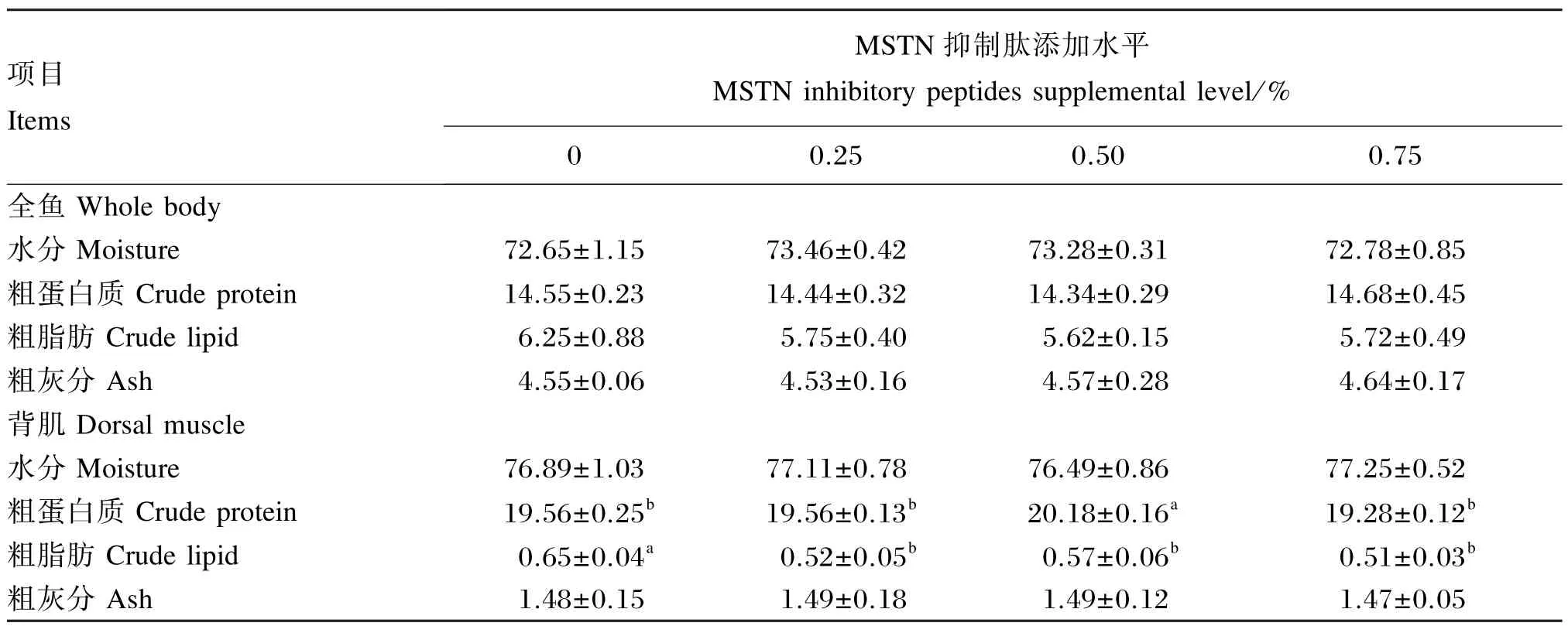
表3 饲料中添加MSTN抑制肽对海鲈体组成的影响(湿重基础)Table 3 Effects of MSTN inhibitory peptides supplementation on body composition of sea bass(Lateolabrax japonicas)(wet weight basis) %
2.3 饲料中添加MSTN抑制肽对海鲈血清生化指标的影响
由表4可以看出,0.25%组的血清总蛋白、白蛋白和总胆固醇的含量均显著低于其他各组(P< 0.05),其他各组间不存在显著差异(P>0.05);血清甘油三酯含量随MSTN抑制肽添加水平的增加呈下降趋势,但组间差异不显著(P>0.05)。

表4 饲料中添加MSTN抑制肽对海鲈血清生化指标的影响Table 4 Effects of MSTN inhibitory peptides supplementation on serum biochemical indices of sea bass(Lateolabrax japonicas)
2.4 饲料中添加MSTN抑制肽对海鲈肝脏与血清免疫指标的影响
由表4可以看出,肝脏与血清T-AOC、肝脏SOD活性在各组间均不存在显著差异(P>0.05);0.25%与0.50%组的肝脏溶菌酶活性显著高于对照组与0.75%组(P<0.05);血清碱性磷酸酶活性随着MSTN抑制肽添加水平的增加总体呈上升趋势,且0.50%和0.75%组显著高于对照组和0.25%组(P<0.05)。
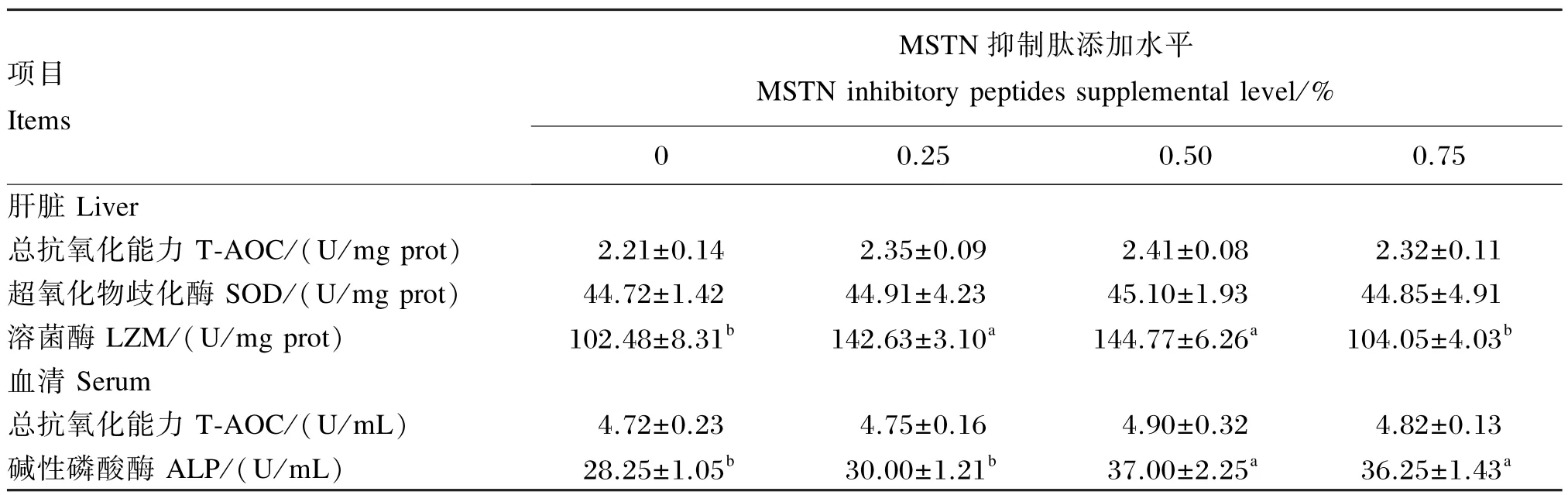
表5 饲料中添加MSTN抑制肽对海鲈肝脏与血清免疫指标的影响Table 5 Effects of MSTN inhibitory peptides supplementation on liver and serum immune indices of sea bass(Lateolabrax japonicas)
3 讨 论
3.1 饲料中添加MSTN抑制肽对海鲈生长性能的影响
本试验结果表明,添加0.50%MSTN抑制肽有利于海鲈的生长,并可提高成活率及降低饲料系数。查阅资料发现,关于MSTN抑制物在水产动物饲料中应用的研究基本没有,其研究主要集中在免疫中和方面,即利用免疫学原理,通过主动免疫或被动免疫有效中和体内的MSTN,灭活其生物学功能,进而达到促进肌肉生长发育的目的。研究表明,给小鼠[12]、大口黑鲈受精卵[13]、肉鸡卵黄[14]注射MSTN抗体后,可以使小鼠和肉鸡的骨骼肌的量增加,也可促进大口黑鲈仔鱼的生长。Tang等[15]给小鼠注射含MSTN的基因疫苗后发现,其肌肉的产量和力量显著提高。给杜氏肌营养不良(Duchenne muscular dystrophy)模型小鼠腹腔注射MSTN抗体3个月后,小鼠的体重、肌肉量、肌肉体积均增加,成年大鼠给予MSTN抗体后肌肉量增加[11]。还有其他方面的研究,比如在斑马鱼胚胎早期发育阶段对MSTN转录子的沉默促进了肌肉的生长发育,并导致肌肉的增生或肥大[16-17]。转基因小鼠过度表达显性负型MSTN,特异性结合活化素受体蛋白(ActR)ⅡB时,会出现肌肉量大幅增长的现象,相当于MSTN基因缺失型小鼠[18]。这些研究均表明 MSTN抑制物有助于机体生长及肌肉量的增加,与本试验添加0.5%MSTN抑制肽有助于鱼体生长的结果一致。同时,MSTN抑制肽是一种小肽,而大量的试验表明在饲料中添加小肽对水生动物的生长性能有明显的促进作用。例如:姜柯君[19]研究发现,饲料中添加0.75%和1.00%的小肽能显著提高星斑川鲽幼鱼(Platichthys stellatus)的增重率、摄食率和特定生长率;刘福星等[20]研究发现,在凡纳滨对虾(Litopenaeus vannamei)饲料中添加6%乐能小肽可提高对虾的生长速度、饲料转化率和成活率。就目前可参考的资料来看,MSTN抑制肽助力于海鲈生长和饲料吸收的原因可能有如下几点:首先,MSTN抑制肽作为一种小肽,具有吸收快、耗能少、载体不易饱和等特点,能够提高氨基酸的吸收速度,从而有效提高饲料蛋白质的利用率[21];其次,小肽可促进肠道蠕动,改善消化机能,促进动物的生长[22];最后,MSTN抑制肽在肌肉发育过程中抑制了MSTN功能的发挥,从而减少MSTN对成肌细胞的增生与分化的抑制作用,即降低了MSTN负向调节肌肉生长发育的作用,导致肌肉量的增加,促进生长[11]。本试验中,MSTN抑制肽添加水平为0.50%时,海鲈的生长性能表现最好,而高于该添加水平(如0.75%)对生长则并未表现出进一步促进的作用,但由于本试验只设置了3个梯度,目前的结果还不能表明MSTN抑制肽添加水平高于0.50%时不能进一步促进鱼体的生长甚至抑制其生长,建议在后续研究工作提高添加水平,以探讨更高剂量添加MSTN抑制肽对鱼体生长及饲料利用的影响。
3.2 饲料中添加MSTN抑制肽对海鲈体组成的影响
本试验结果表明,0.50%组的背肌粗蛋白质含量显著高于其他各组,所有添加MSTN抑制肽的组的背肌粗脂肪含量显著低于对照组,与岳志刚等[23]报道的MSTN基因缺失可导致动物肌肉增加和脂肪减少的结果一致。Lin等[24]证实敲除MSTN基因的9~10月龄小鼠比正常小鼠脂肪组织减少了20%。小肽在幼龄草鱼饲料中的应用研究亦有相似结果[10]。 姜柯君[19]研究结果显示,饲料中添加1.0%和1.5%小肽显著提高了星斑川鲽幼鱼背肌粗蛋白质含量,而背肌粗脂肪含量在不添加小肽的对照组含量最高。造成背肌粗蛋白质含量显著增多的原因与促进鱼体生长的原因一致。而引起背肌粗脂肪含量减少的原因,从以往的研究结果分析可能有以下4点:其一,小肽饲料添加剂提高了生物体蛋白质的合成,进而减少了氨基酸转化为脂肪的去向,从而有效减少脂肪在鱼体内的堆积;其二,MSTN的缺少可以抑制脂肪细胞的生长发育,同时促进脂质代谢[23];其三,增重率提高即增加肌肉量相当于增加静态能量消耗,静态能量消耗的增加使脂肪的生成量减少[25];其四,缺少MSTN的机体环境可能对前体脂肪细胞的形成或者脂肪细胞中甘油三酯的合成有影响[25]。
3.3 饲料中添加MSTN抑制肽对海鲈血清生化指标的影响
血清总蛋白含量反映了机体蛋白质代谢的水平,可用于衡量蛋白质和氨基酸的利用率[26]。血清白蛋白既是营养物质的载体,又是机体蛋白质的来源之一,可用于维持血液渗透压,提高能量和修补组织[27]。本试验中,0.25%组血清总蛋白和白蛋白的含量显著低于其他各组,与以往研究结果相反。已有研究指出,饲料中添加小肽可以促进星斑川鲽鱼血清蛋白质的合成,增加球蛋白的数量,提高机体免疫力[19]。而0.50%和0.75%组的血清白蛋白和总蛋白含量与对照组不存在显著差异,猜测本试验中的MSTN抑制肽添加水平还不足以显著增强海鲈血清蛋白质的合成,甚至较少量的MSTN抑制肽还会降低血清蛋白质的合成,具体原因还有待进一步研究。
总胆固醇和甘油三酯是机体脂肪堆积情况的反映指标[28]。本试验中,0.25%组血清总胆固醇含量显著低于其他各组。与姜柯君[19]的报道在星斑川鲽鱼中添加小肽的各试验组的血清总胆固醇含量低于对照组,以及Lin等[24]报道的MSTN基因敲除小鼠的血液胆固醇含量低于正常小鼠的结果相一致。其原因可能是MSTN抑制肽的添加促进了脂质代谢,从而降低血清中脂类物质的含量。添加MSTN抑制肽的各组的血清甘油三酯含量均低于对照组,但各添加组间不存在显著差异,猜测是本试验中的MSTN抑制肽添加水平还不足以显著降低海鲈血清甘油三酯的含量。
3.4 饲料中添加MSTN抑制肽对海鲈肝脏与血清免疫指标的影响
血液中的碱性磷酸酶活性是衡量磷元素是否充足的有效参考指标,血清中的碱性磷酸酶活性可以反映组织的钙、磷消化情况。当鱼类生长需要钙元素增多时,碱性磷酸酶可以催化骨组织释放钙元素满足机体需求。因此,碱性磷酸酶活性在一定程度内增长有助于鱼类生长和骨骼发育。在本试验中,添加MSTN抑制肽的各组的血清碱性磷酸酶活性皆高于对照组,以0.50%组的活性最高,此结果与生长结果相对应。
机体防御体系的总抗氧化能力的强弱与健康程度有非常密切的联系,其包括酶促抗氧化和非酶促抗氧化两大体系,前者依赖于机体中各种抗氧化酶(如过氧化氢酶、谷胱甘肽过氧化物酶等)发挥作用,后者主要依赖于金属蛋白质、氨基酸、维生素等发挥作用[29]。其中,超氧化物歧化酶是机体过氧化物酶系统的一种,可特异性地催化机体由于自身代谢或外界胁迫下做产生的一系列有毒的超氧化物,并将其转化为过氧化氢和氧,再由过氧化氢酶系统的其他成员转化过氧化氢为水和氧,从而保障机体正常的生理功能[30]。整个体系的防护氧化作用主要有3条途径:其一,通过消除活性氧与自由基以抑制脂质过度氧化;其二,分解过氧化物,阻断过氧化链;其三,除去具有催化作用的金属离子。本试验中,饲料添加MSTN抑制肽对肝脏总抗氧化能力、超氧化物歧化酶活性与血清总抗氧化能力均没有产生显著影响,说明MSTN抑制肽对海鲈的抗氧化能力的影响不显著。
溶菌酶是鱼类机体中巨噬细胞和嗜中性粒细胞产生的一种重要的非特异性免疫因子,在鱼体中起重要的防御作用。溶菌酶通过水解细菌细胞壁而致细菌死亡,且可以诱导调节其他免疫因子的合成分泌[31]。本试验中,饲料中添加0.25%与0.50%MSTN抑制肽时肝脏溶菌酶活性显著性高于对照组。一方面,溶菌酶活性升高后可进一步可诱导其他免疫因子,共同参与免疫防御,提高机体的免疫力[32];另一方面,MSTN抑制肽提高免疫活性可能是通过水解产生免疫活性肽(如免疫刺激肽和抗菌肽等),免疫活性肽最终参与鱼类机体内的免疫系统调节[33]。
4 结 论
综合上述结果,在本试验条件下,海鲈饲料中MSTN抑制肽的最适添加水平为0.50%。
[1]赵浩斌,彭扣,王玉凤,等.鱼类肌肉生长抑制素研究进展[J].水生生物学报,2006,30(2):227-231.
[2]RODGERS B D,WEBER G M,SULLIVAN C V,et al.Isolation and characterization of myostatin complementary deoxyribonucleic acid clones from two commercially important fish:Oreochromis mossambicusandMorone chrysops[J].Endocrinology,2001,142(4):1412-1418.
[3]MCPHERRON A C,LAWLER A M,LEE S J.Regulation of skeletal muscle mass in mice by a new TGF-β superfamily member[J].Nature,1997,387(6628):83-90.
[4]ZHU X Y,TOPOUZIS S,LIANG L F,et al.Myostatin signaling through Smad2,Smad3 and Smad4 is regulated by the inhibitory Smad7 by a negative feedback mechanism[J].Cytokine,2004,26(6):262-272.
[5]罗钧秋,陈代文.肌肉生长抑制素(MSTN)对肌肉调控的分子作用机制[J].黑龙江畜牧兽医,2007(7):36-38.
[6]WELLE S,BHATT K,PINKERT C A,et al.Muscle growth after postdevelopmental myostatin gene knockout[J].American Journal of Physiology:Endocrinology and Metabolism,2007,292(4):E985-E991.
[7]GILBERT E R,WONG E A,WEBB K E.Board-invited review:peptide absorption and utilization:implications for animal nutrition and health[J].Journal of Animal Science,2008,86(9):2135-2155.
[8]肖枫,辛莉,康怀彬.生物活性肽的功能及其在水产养殖中应用的研究进展[J].水产科学,2008,27(10):553-554.
[9]KOTZAMANIS Y P,GISBERT E,GATESOUPE F J,et al.Effects of different dietary levels of fish protein hydrolysates on growth,digestive enzymes,gut microbiota,and resistance toVibrio anguillarumin European sea bass(Dicentrarchus labrax)larvae[J].Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2007,147(1):205-214.
[10]于辉,冯健,刘栋辉,等.酪蛋白小肽对幼龄草鱼生长和饲料利用的影响[J].水生生物学报,2004,28(5):526-530.
[11]BOGDANOVICH S,KRAG T O B,BARTON E R,et al.Functional improvement of dystrophic muscle by myostatin blockade[J].Nature,2002,420(6914):418-421.
[12]WHITTEMORE L A,SONG K N,LI X P,et al.Inhibition of myostatin in adult mice increases skeletal muscle mass and strength[J].Biochemical and Biophysical Research Communications,2003,300(4):965-971.
[13]张宁宁,白俊杰,李胜杰,等.大口黑鲈肌肉生长抑制素多克隆抗体的制备及其对仔鱼生长影响[J].生物技术通报,2009(12):129-133.
[14]KIM Y S,BOBBILI N K,PAEK K S,et al.Production of a monoclonal anti-myostatin antibody and the effects of in ovo administration of the antibody on posthatch broiler growth and muscle mass[J].Poultry Science,2006,85(6):1062-1071.
[15]TANG L,YAN Z,WAN Y,et al.Myostatin DNA vaccine increases skeletal muscle mass and endurance in mice[J].Muscle&Nerve,2007,36(3):342-348.
[16]AMALI A A,LIN C J F,CHEN Y H,et al.Up-regulation of muscle-specific transcription factors during embryonic somitogenesis of zebrafish(Danio rerio)by knock-down of myostatin-1[J].Developmental Dynamics,2004,229(4):847-856.
[17]ACOSTA J,CARPIO Y,BORROTO I,et al.Myostatin gene silenced by RNAi show a zebrafish giant phenotype[J].Journal of Biotechnology,2005,119(4):324-331.
[18]LEE S J,MCPHERRON A C.Regulation of myostatin activity and muscle growth[J].Proceedings of the Na-tional Academy of Sciences of the United States of A-merica,2001,98(16):9306-9311.
[19]姜柯君.小肽对星斑川鲽(Platichthys stellatus)幼鱼生长、肌肉品质和生理生化指标的影响[D].硕士学位论文.上海:上海海洋大学,2013.
[20]刘福星,金志强,李新鄂.乐能小肽在南美白对虾饲料中的应用[J].中国饲料,2004(23):28-29.
[21]李清,肖调义,毛华明.生物活性肽在水产养殖中的研究进展[J].内陆水产,2004(11):39-41.
[22]CLARE D A,SWAISGOOD H E.Bioactive milk peptides:a prospectus[J].Journal of Dairy Science,2000,83(6):1187-1195.
[23]岳志刚,杨福合,邢秀梅,等.肌肉生长抑制素的研究新进展[J].黑龙江畜牧兽医,2010(6):31-33.
[24]LIN J,ARNOLD H B,DELLA-FERA M A,et al.Myostatin knockout in mice increases myogenesis and decreases adipogenesis[J].Biochemical and Biophysical Research Communications,2002,291(3):701-706.
[25]MCPHERRON A C,LEE S J.Suppression of body fat accumulation in myostatin-deficient mice[J].The Journal of Clinical Investigation,2002,109(5):595-601.
[26]钱云霞,陈惠群,孙江飞.饥饿对养殖鲈鱼血液生理生化指标的影响[J].中国水产科学,2002,9(2):133-137.
[27]ZHOU S,WANG G B,YANG Z B.Study on effect of plant small peptides on blood biochemical indexes and gut flora of suckling piglets[J].Chinese Journal of Animal Nutrition,2008,20(1):40-45.
[28]李富伟.肽的制备工艺及肽对肉鸡生长性能影响机理研究[D].博士学位论文.北京:中国农业科学院,2003.
[29]SHIELLS R,FALK G.Retinal on-bipolar cells contain a nitric oxide-sensitive guanylate cyclase[J].Neuroreport,1992,3(10):845-848.
[30]MCRAE M P.Vitamin C supplementation lowers serum low-density lipoprotein cholesterol and triglycerides:a meta-analysis of 13 randomized controlled trials[J].Journal of Chiropractic Medicine,2008,7(2):48-58.
[31]郑清梅,吴锐全,叶星.水生动物溶菌酶的研究进展[J].上海水产大学学报,2006,15(4):483-487.
[32]朱忠珂.玉米-豆粕日粮添加微生物酶对肉仔鸡生产性能、消化代谢及免疫功能的影响[D].硕士学位论文.杨凌:西北农林科技大学,2004.
[33]DAOUD R,DUBOIS V,BORS-DODITA L,et al.New antibacterial peptide derived from bovine hemoglobin[J].Peptides,2005,26(5):713-719.
Effects of Myostatin Inhibitory Peptides Supplementation on Growth Performance,Body Composition,Serum Biochemical Indices,Serum and Liver Immune Indices of Sea Bass(Lateolabrax japonicas)
LI Yating TIAN Mengli XIE Huanhuan GUO Tianyu NIU Jin∗LIU Yongjian TIAN Lixia
(Institute of Aquatic Economic Animals,School of Life Sciences,Sun Yat-Sen University,Guangzhou510275,China)
The study was conducted to investigate the effects of myostatin(MSTN)inhibitory peptides supplementation on growth performance,body composition,serum biochemical indices,serum and liver immune indices of sea bass(Lateolabrax japonicas).Using juvenile sea bass with the average initial body weight of(9.05±0.05)g as test animals,after one week feeding,a total of 480 healthy sea bass with the similar size were randomly divided into 4 groups with 4 replicates(aquariums)per group and 30 fish per replicate.The fish in those 4 groups were fed experimental diets supplemented with 0(control),0.25%,0.50%and 0.75% MSTN inhibitory peptides,respectively,and lasted for 135 days.The results showed as follows:1)the weight gain rate(WGR),specific growth rate(SGR)and survival rate(SR)of fish fed diet containing 0.50% MSTN inhibitory peptides were significantly higher than those of fish fed control diet(P<0.05),while the feed conversion ratio(FCR)of fish fed diets containing 0.25%,0.50%and 0.75%MSTN inhibitory peptides was significantly lower than that of fish fed control diet(P<0.05),and 0.50%group had the lowest FCR.2)No significant differences were found in the contents of whole body moisture,crude protein,crude lipid and ash among all groups(P>0.05),while dorsal muscle crude lipid content of fish fed diets containing 0.25%,0.50%and 0.75%MSTN inhibitory peptides was significantly lower than that of fish fed control diet(P<0.05),and dorsal muscle crude protein content of fish fed diet containing 0.50%MSTN inhibitory peptides was significantly higher than that of fish fed control diet(P<0.05).3)Serum total protein(TP),albumin(ALB)and total cholesterol(TC)contents of fish fed diet containing 0.25%MSTN inhibitory peptides were significantly lower than those of fish fed other diets(P<0.05).Yet,no significant difference was discovered in serum triglycerides(TG)content among all groups(P>0.05).4)Serum alkaline phosphatase(ALP)activity of fish fed diets containing 0.50%and 0.75%MSTN inhibitory peptides were significantly higher than that of fish fed control diet(P<0.05).Liver lysozyme(LZM)activity of fish fed diets containing 0.25%and 0.50%MSTN inhibitory peptides was significantly higher than that of fish fed control diet(P<0.05).No significant differences were found in liver total antioxidant capacity(T-AOC)and superoxide dismutase(SOD)activity among all groups(P>0.05).According to the above results,it is concluded that MSTN inhibitory peptides can effectively improve growth and immune capacity of sea bass.In addition,the suitable dietary MSTN inhibitory peptides supplemental level is 0.50%for sea bass under this experimental condition.[Chinese Journal of Animal Nutrition,2017,29(2):519-528]
MSTN inhibitory peptides;sea bass(Lateolabrax japonicas);growth performance;serum biochemical indices;immune indices
S963
A
1006-267X(2017)02-0519-10
10.3969/j.issn.1006-267x.2017.02.019
(责任编辑 菅景颖)
2016-07-26
海洋经济创新发展区域示范专项项目(GD2012-B01)
李雅婷(1992—),女,广西桂林人,硕士研究生,从事水生经济动物营养与饲料研究。E-mail:liyat2014@163.com
∗通信作者:牛 津,副教授,硕士生导师,E-mail:edls@mail.sysu.edu.cn
∗Corresponding author,associate professor,E-mail:edls@mail.sysu.edu.cn

