松针多糖对小鼠腹腔巨噬细胞免疫调节作用的研究
戴 艺徐明生上官新晨蒋 艳郑国栋王文君
(1.江西省天然产物与功能食品重点实验室,江西农业大学食品科学与工程学院,南昌 330045;2.江西工业贸易职业技术学院粮食工程系,南昌 330038)
松针多糖对小鼠腹腔巨噬细胞免疫调节作用的研究
戴 艺1,2徐明生1∗上官新晨1蒋 艳1郑国栋1王文君1
(1.江西省天然产物与功能食品重点实验室,江西农业大学食品科学与工程学院,南昌 330045;2.江西工业贸易职业技术学院粮食工程系,南昌 330038)
本试验旨在研究松针多糖对正常状态及脂多糖(LPS)刺激状态下小鼠腹腔巨噬细胞的免疫调节作用。试验采用不同浓度的松针多糖作用于正常的和经LPS刺激的小鼠腹腔巨噬细胞,设空白对照组(加入100 μL RPMI-1640培养基)、阳性对照组(加入100 μL终浓度为5 μg/mL的LPS)、松针多糖组(分别加入100 μL 25、50、100、200 μg/mL的松针多糖)和LPS+松针多糖组(加入与松针多糖组相同浓度的松针多糖和终浓度为5 μg/mL的LPS,液体终体积为200 μL)。噻唑蓝(MTT)比色法检测细胞活力,中性红吞噬试验检测巨噬细胞吞噬能力,Griess法检测一氧化氮(NO)的分泌量,酶联免疫吸附测定(ELISA)法检测巨噬细胞培养上清液中白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)的分泌量。结果表明:1)对空白对照组相比,各松针多糖组巨噬细胞相对增殖率均显著或极显著提高(P<0.05或P<0.01),50、100和200 μg/mL松针多糖组巨噬细胞中性红吞噬率显著或极显著提高(P<0.05或P<0.01),各 LPS+松针多糖组巨噬细胞中性红吞噬率均极显著提高(P<0.01),200 μg/mL松针多糖组巨噬细胞NO分泌量极显著提高(P<0.01),50、100和200 μg/mL松针多糖组巨噬细胞TNF-α和IL-1β分泌量显著或极显著提高(P<0.05或P<0.01),50、100和200 μg/mL松针多糖组巨噬细胞IL-10分泌量极显著降低(P<0.01)。2)与阳性对照组相比,各松针多糖组巨噬细胞相对增殖率均极显著降低(P<0.01),100和200 μg/mL LPS+松针多糖组巨噬细胞中性红吞噬率极显著升高(P<0.01),50、100和200 μg/mL LPS+松针多糖组巨噬细胞NO分泌量极显著提高(P<0.01),各LPS+松针多糖组巨噬细胞TNF-α分泌量显著或极显著提高(P<0.05或P<0.01),50、100和200 μg/mL LPS+松针多糖组巨噬细胞IL-1β分泌量显著或极显著提高(P<0.05或P<0.01),100和200 μg/mL LPS+松针多糖组巨噬细胞IL-10分泌量极显著降低(P<0.01)。由此可见,松针多糖通过发挥其促炎作用调节巨噬细胞的免疫功能,进而增强机体抗疾病的能力。
松针多糖;巨噬细胞;细胞因子;免疫调节
畜牧养殖业为了预防疾病,现如今大多在饲料中添加抗生素或兽药来提高畜禽对疾病的抵抗力,这也导致了药物残留,对食品安全和人类健康造成潜在危害。随着畜牧养殖业的发展以及人们对食品安全的日益重视,研制能增强机体免疫力、提高抗病力的绿色饲料添加剂成为当今研究的热点。植物多糖是从天然的植物中提取的一种生物活性物质,试验证明,许多植物多糖都具有促进免疫细胞功能、提高巨噬细胞活性等多种生物学功能,动物饲料中添加一定量的植物多糖能提高机体的免疫力、抗感染能力并改善其生产性能[1],是一种理想的绿色环保的添加剂。松针为松科裸子植物,是松树的针形叶,也是松树的药用代表成分,含丰富的营养物质和活性成分。松针多糖是从松针中提取的植物多糖,有降血糖[2]、降血脂[3]、抗氧化[4]等多种生理活性。 目前国内外对松针多糖的提取纯化及抗氧化有较多的研究[5-6],但对其免疫调节作用研究很少,吕梦云等[7]研究发现,松针多糖能提高肉鸡的免疫功能和生长性能。因此,本试验采用小鼠腹腔巨噬细胞为模型,考察松针多糖对正常状态及脂多糖(lipopolysaccharide,LPS)过度激活状态巨噬细胞的活性和免疫调节作用,为研究天然新型替代抗生素的饲料添加剂产品以及促进松针资源在动物生产中的应用提供理论依据。
1 材料与方法
1.1 试验设计
昆明(Km)小鼠,清洁级,4~6周龄,18~22 g,雌性,购于江西中医药大学实验动物中心。实验动物质量合格证号:JZDW No.2014-0183。参考Hammer等[8]的方法提取并培养小鼠腹腔巨噬细胞。向小鼠腹腔中注射2.9%巯基乙酸肉汤溶液,1 d后将小鼠脱臼处死,75%酒精浸泡5 min,把小鼠腹部朝上固定于板上,剪开小鼠腹部皮肤,暴露腹膜。无菌注射5 mL预冷RPMI-1640培养基[含10% 胎 牛 血 清 (fetalbovine serum,FBS)、100 U/mL的青霉素、100 μg/mL的链霉素],轻柔腹部5 min,吸出腹腔液,1 000 r/min离心5 min,弃上清,用RPMI-1640培养基重悬,计数,调整细胞至所需密度。将巨噬细胞悬液接种于96孔板中,每孔100 μL,置二氧化碳(CO2)培养箱中培养4 h至完全贴壁,吸弃上清,使用RPMI-1640培养基洗涤2次,去除未贴壁细胞,即得到纯化的腹腔巨噬细胞。巨噬细胞纯化后进行试验分组,共分4组,每组设置 3重复,具体分组如下。空白对照组:加入100 μL RPMI-1640培养基;阳性对照组:加入100 μL终浓度为5 μg/mL的LPS;松针多糖组:加 入 100 μL 不 同 浓 度 (25、50、100、 200 μg/mL)的松针多糖;LPS+松针多糖组:加入与松针多糖组相同浓度的松针多糖进行预孵6 h后,加入终浓度为5 μg/mL的LPS,液体终体积为200 μL。
1.2 试验材料
松针多糖,南京景竹医药科技有限公司,纯度90%;RPMI-1640培养基,美国Gibco公司;FBS:以色列 Biological Industries公司;青链霉素混合液、噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)、中性红、二甲基亚砜(dimethyl sulfoxide,DMSO),北京索莱宝公司;巯基乙酸肉汤、LPS,美国Sigma公司;一氧化氮(NO)试剂盒,江苏碧云天生物技术有限公司;白细胞介素-1β(interleukin 1 beta,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白细胞介素-10(interleukin 10,IL-10)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒,美国RayBiotech公司。Multiskan MK3酶标仪、3121型CO2培养箱,美国Thermo Electron公司;3110 SeriesⅡ超净工作台,新加坡Streamline Laboratory公司;低速离心机,上海安亭科学仪器厂;XD-202倒置生物显微镜,南京江南永新光学公司。
1.3 测定方法
1.3.1 松针多糖对小鼠腹腔巨噬细胞代谢活力的测定(MTT法)
细胞按5×105个/mL接种于96孔板,按1.1方法进行分组处理,37℃、5%CO2孵育24 h后每孔加入5 mg/mL的MTT 20 μL,继续培养4 h,弃上清,每孔加150 μL DMSO,轻轻振荡约10 min使其完全溶解,酶标仪570 nm波长下测其吸光度值。

1.3.2 松针多糖对小鼠腹腔巨噬细胞吞噬能力的测定(中性红法)
细胞按5×105个/mL接种于96孔板,按1.1方法进行分组处理,37℃、5%CO2孵育24 h后弃上清,每孔加1%中性红溶液100 μL,孵育30 min后用磷酸缓冲溶液(phosphate buffered saline,PBS)洗涤3次,每孔加200 μL细胞裂解液(等体积无水乙醇与乙酸混合液),4℃冰箱静置过夜,酶标仪540 nm波长下测其吸光度值。


1.3.3 松针多糖对小鼠腹腔巨噬细胞NO分泌量的测定(Greiss法)
细胞按2×106个/mL接种于96孔板中,按1.1方法进行分组处理,37℃、5%CO2孵育48 h后每孔取50 μL,按NO试剂盒操作。每孔分别加Greiss A和Greiss B试剂50 μL,酶标仪于540 nm处测定其吸光度值。根据亚硝酸钠(NaNO2)标准曲线换算为亚硝酸根离子(NO2-)浓度,间接反映NO分泌量。
1.3.4 松针多糖对小鼠腹腔巨噬细胞IL-10、TNF-α、IL-1β分泌量的测定
细胞按2×106个/mL接种于96孔板中,按1.1方法进行分组处理,37℃、5%CO2孵育48 h后收集上清液,1 000 r/min离心20 min,取上清。操作严格按照试剂盒说明书进行。具体步骤如下:每孔加入 100 μL测定稀释剂 RD1W;每孔加入100 μL标准品、样品或对照。室温孵育2 h;抽吸、洗涤4次;每孔加入200 μL复合溶液,室温孵育2 h;抽吸、洗涤4次;每孔加入200 μL底物溶液。避光,室温孵育20 min;每孔加入50 μL终止液,30 min内在450 nm处读数。
1.4 统计分析
采用DPS数据处理系统Duncan氏新复极差多重比较法进行数据统计分析。
2 结 果
2.1 松针多糖对小鼠腹腔巨噬细胞代谢活力的影响
从表1中可知,松针多糖对小鼠腹腔巨噬细胞代谢活力有增强作用,对空白照组相比,各松针多糖组巨噬细胞相对增殖率均显著或极显著提高(P<0.05或P<0.01),且50~200 μg/mL时呈剂量依赖性,但各松针多糖组巨噬细胞相对增殖率均极显著低于阳性对照组(P<0.01)。
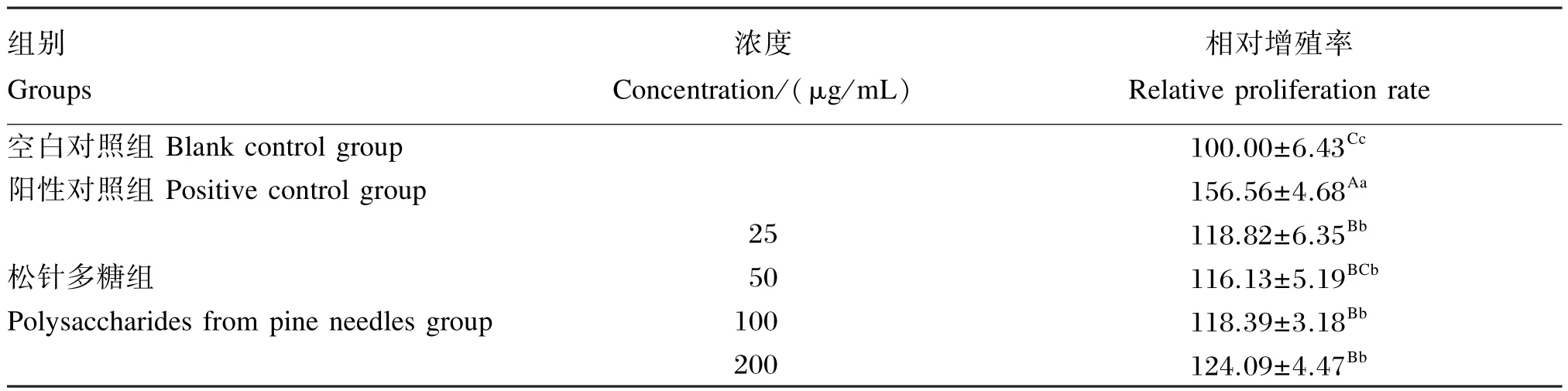
表1 松针多糖对小鼠腹腔巨噬细胞代谢活力的影响Table 1 Effects of polysaccharides from pine needles on metabolize viability of mouse peritoneal macrophages %
2.2 松针多糖对小鼠腹腔巨噬细胞吞噬能力的影响
从表2中可知,与空白对照组相比,50、100和200 μg/mL松针多糖组巨噬细胞中性红吞噬率显著或极显著增强(P<0.05或P<0.01),且呈剂量依赖性;LPS+松针多糖组巨噬细胞中性红吞噬率均极显著高于空白对照组(P<0.01),但与阳性对照组相比,100和200 μg/mL LPS+松针多糖组巨噬细胞中性红吞噬率极显著升高(P<0.01),200 μg/mL LPS+松针多糖组巨噬细胞中性红吞噬率最高。
2.3 松针多糖对小鼠腹腔巨噬细胞NO分泌量的影响
从表3中可知,与空白对照组相比,各松针多糖组均能提高巨噬细胞NO分泌量,且250 μg/mL松针多糖组极显著提高(P<0.01);与阳性对照组相比,50、100和200 μg/mL LPS+松针多糖组巨噬细胞NO分泌量极显著提高(P<0.01)。
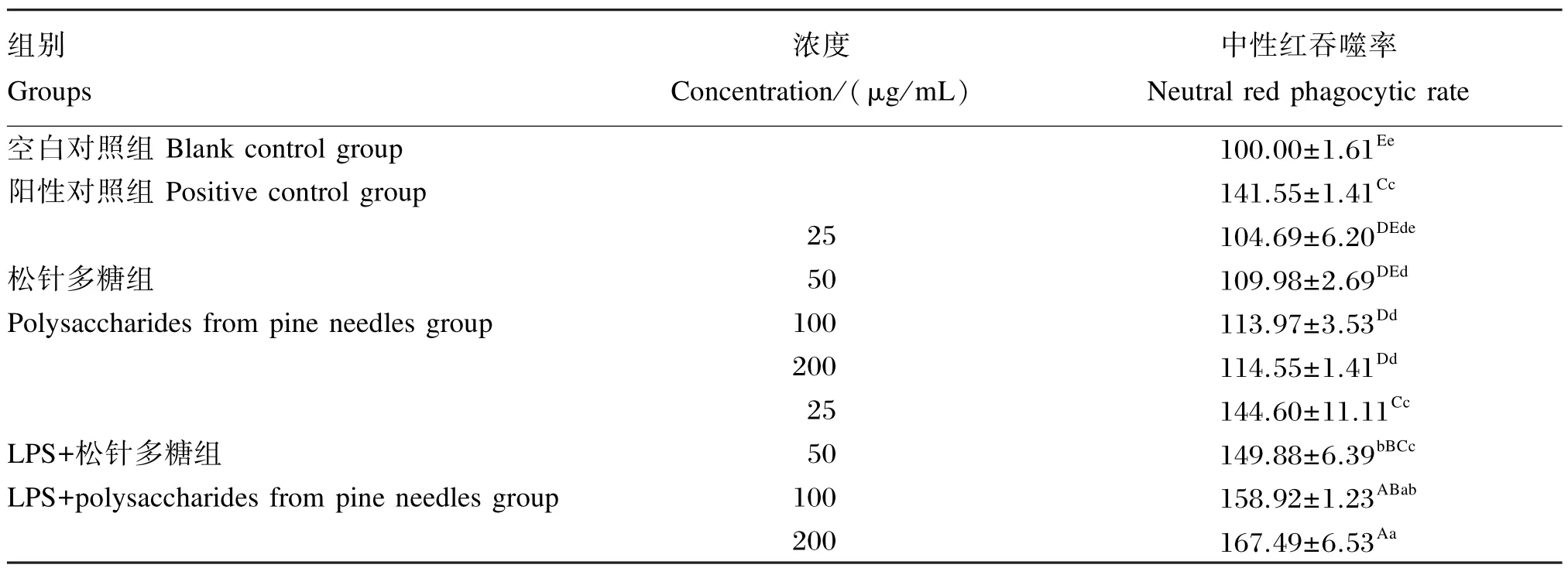
表2 松针多糖对小鼠腹腔巨噬细胞吞噬能力的影响Table 2 Effects of polysaccharides from pine needles on phagocytosis capacity of mouse peritoneal macrophages %
2.4 松针多糖对小鼠腹腔巨噬细胞IL-10、TNF-α、IL-1β分泌量的影响
从表4中可知,与空白对照组相比,50、100和200 μg/mL松针多糖组巨噬细胞TNF-α和IL-1β分泌量显著或极显著提高(P<0.05或P<0.01),且呈剂量依赖性;50、100和200 μg/mL松针多糖组巨噬细胞IL-10分泌量极显著降低(P<0.01),且呈剂量依赖性。与阳性对照组相比,25~200 μg/mL LPS+松针多糖组巨噬细胞TNF-α分泌量显著或极显著提高(P<0.05或P<0.01),且呈剂量依赖性;50、100和200 μg/mL LPS+松针多糖组巨噬细胞IL-1β分泌量显著或极显著提高(P<0.05或P<0.01);100和200 μg/mL LPS+松针多糖组巨噬细胞IL-10分泌量极显著降低(P<0.01)。
3 讨 论
炎症反应是一种重要的机体防御过程,涉及机体活动的许多环节,其中免疫细胞(巨噬细胞、中性粒细胞等)的激活是炎症反应的启动环节[9]。巨噬细胞广泛分布于体内,是一类重要的免疫细胞和炎症细胞,在炎症反应中起着重要的作用[10]。巨噬细胞是先天性细胞免疫的重要组成部分,有许多功能,包括对外来微生物(细菌、病毒、真菌和寄生虫)的防御和免疫,巨噬细胞具有一系列识别、吞噬、摧毁病原体的细胞表面受体、胞内介质和至关重要的分泌分子[11]。
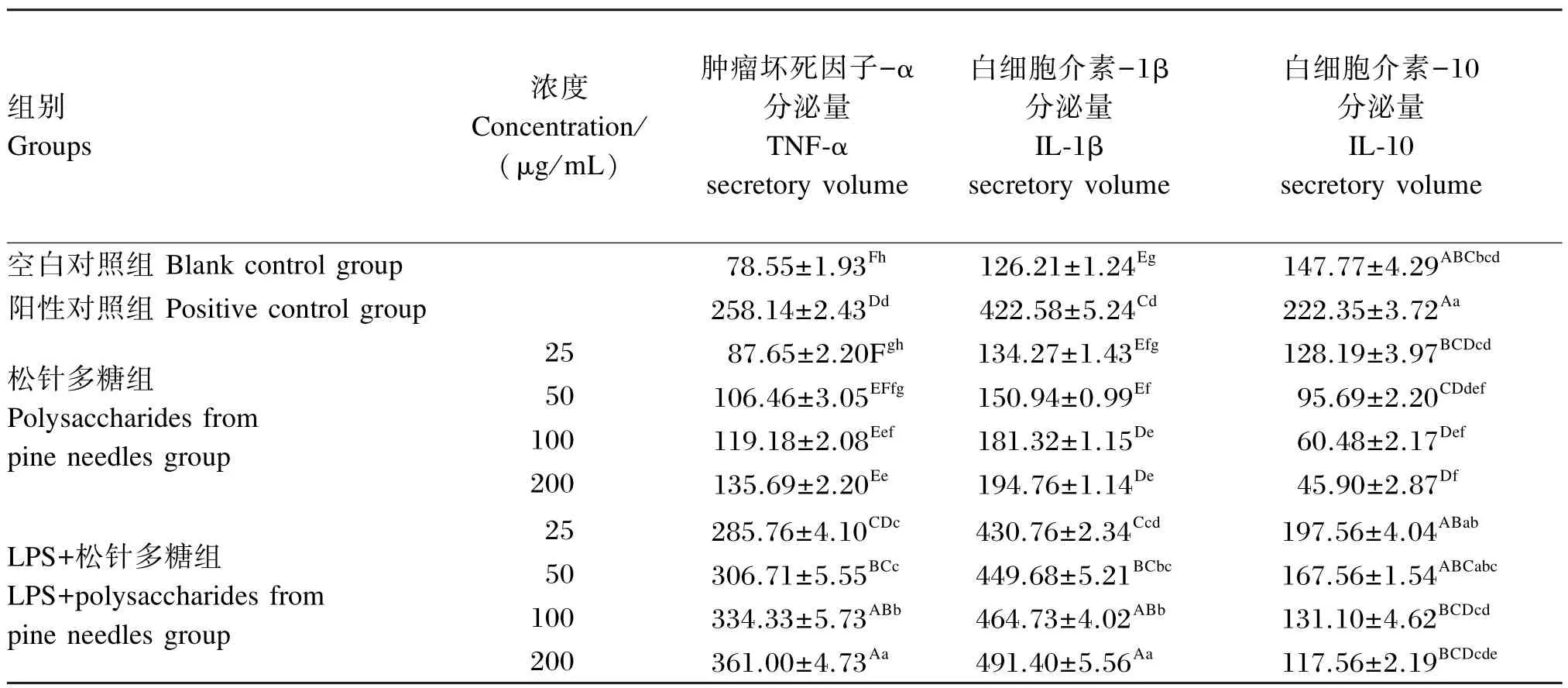
表4 松针多糖对小鼠腹腔巨噬细胞TNF-α、IL-1β和IL-10分泌量的影响Table 4 Effects of polysaccharides from pine needles on TNF-α,IL-1β and IL-10 secretory volume of mouse peritoneal macrophages pg/mL
MTT法是一种快速简便地检测细胞的增殖率和细胞毒性的方法。赵嘉惠等[12]研究表明,MTT法能准确反映出细胞的增殖能力。但小鼠腹腔巨噬细胞属于原代细胞,在体外几乎不增殖,而紫色结晶物的生成不仅与细胞数量有关,还与细胞活性呈正比[13],而颜晓静等[14]通过 MTT法证明了甘遂醋炙能增强小鼠淋巴细胞的代谢活力,增强淋巴细胞活性。故松针多糖能显著上调腹腔巨噬细胞代谢MTT的活力从而增强巨噬细胞的活性,发挥其促炎作用。
吞噬功能是巨噬细胞的十分重要功能之一,巨噬细胞通过吞噬侵入的病原体及体内衰老、畸变的细胞而提高机体的抗感染能力[15]。吞噬能力是衡量巨噬细胞活性的一个重要指标[16]。巨噬细胞对病原体等抗原性异物的识别是通过其表面模式识别受体直接识别某些病原体或其产物所共有的高度保守的特定分子结构免疫球蛋白G(immunoglobulin G,IgG)、Fc受体(Fc recepter)和补体受体识别IgG或补体结合的病原体。巨噬细胞和病原体等抗原性异物结合后,经过吞噬和吞饮作用将病原体等吸收进入细胞内成为吞噬体。在吞噬体内,可以通过氧依赖和氧非依赖的杀菌系统消灭病原体[17]。本试验结果显示,松针多糖能增强正常及LPS激活状态下小鼠腹腔巨噬细胞的吞噬能力,推测其可能是通过某个分子结构或生物学机制,促进巨噬细胞表面的模式识别受体和病原体或凋亡细胞表面的特定分子结构相结合,从而增强巨噬细胞的吞噬功能,提高动物机体抗疾病感染能力。
NO是一种多功能的介质,参与了大量的生理和病理过程,包括保护胃肠道、免疫细胞、单核细胞和巨噬细胞受到如病原体及微生物(如LPS、内源性细胞因子等)刺激时会表达诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)从而产生大量NO[18]。NO是巨噬细胞发挥吞噬作用的基本条件,随着NO分泌量的逐步升高,巨噬细胞吞噬能力也增强,抗疾病能力随之增强[19]。
TNF-α是一种由单核细胞、巨噬细胞和T细胞产生的细胞因子,是由病原体、木糖醇和相关物质诱导产生,在骨代谢和炎症性疾病中发挥重要作用。TNF-α在宿主防御中也起着重要的作用,它通过各种细胞包括负责细胞激活系统的单核吞噬细胞产生促炎活动,是一种炎症关键因子[20],可促进巨噬细胞表达IL-1β,从而增强巨噬细胞活性并扩大炎症反应。IL-1β是由活化的巨噬细胞和单核细胞产生的多功能细胞因子,它能与白细胞介素-1(IL-1)受体结合,并被认为是炎症中不可或缺的一种,它能促进其他许多的细胞因子[如白细胞介素-6(IL-6)、白细胞介素-8(IL-8)及TNF-α]的分泌[21],TNF-α及 IL-1β的浓度越高,巨噬细胞和体液免疫的功能越强,小鼠的抗病能力越强。IL-10是由巨噬细胞,淋巴细胞及其他细胞产生的一类抗炎性细胞因子,是与白细胞介素-12(IL-12)的产生和 Th1型免疫应答相关的抑制剂[22]。它参与免疫细胞、炎症细胞、肿瘤细胞等多种细胞的生物调节,在多种疾病中发挥重要作用[23],IL-10的大量分泌能抑制炎症的产生,从而使巨噬细胞发挥负向免疫调节作用。巨噬细胞的正向免疫调节作用主要靠其吞噬功能及分泌一些细胞因子(IL-1、IL-6及TNF-α)来实现的,而NO的生成能增强其吞噬能力[24]。本试验结果表明,在一定浓度范围内松针多糖能抑制巨噬细胞释放抑炎细胞因子IL-10,故松针多糖增强巨噬细胞的吞噬能力,促进其产生促炎细胞因子TNF-α、IL-1β及NO从而发挥其促炎作用。
王翔岩等[25]研究表明,植物多糖类化合物通过激活巨噬细胞吞噬能力,增加促炎细胞因子和NO等的分泌,从而增强其免疫调节作用。刘艳艳等[26]发现,黄芪多糖复方制剂可以显著提高胸腺、法氏囊指数,促进白细胞介素等细胞因子的分泌从而增强肉鸡的免疫力。Hashimoto等[27]也发现裂褶菌β-葡聚糖可促进NO的合成与分泌,均与本试验结果相符。单核-巨噬细胞可以吞噬病原体,杀伤、清除病毒和细菌等,也可以通过分泌细胞因子、趋化因子等介导和促进炎症反应,增强机体的抗疾病能力[28],故松针多糖能增强动物对疾病的抵抗力。
因此,本试验以小鼠腹腔巨噬细胞为模型,研究了松针多糖对巨噬细胞代谢活力、吞噬能力及产生NO、IL-1β、TNF-α、IL-10能力的影响。试验结果表明,不同浓度的松针多糖均能促进正常状态下小鼠腹腔巨噬细胞产生NO,当其浓度大于25 μg/mL时能增强巨噬细胞的吞噬能力,促进TNF-α和 IL-1β的分泌量。高浓度(100和200 μg/mL)的松针多糖能显著抑制 IL-10分泌量;不同浓度的松针多糖均能协同LPS释放大量TNF-α。当松针多糖浓度大于50 μg/mL时,LPS+松针多糖组能显著地增强巨噬细胞吞噬能力,促进巨噬细胞释放NO和促炎因子TNF-α、IL-1β,抑制IL-10的产生,并呈剂量依赖性。故松针多糖能发挥促炎作用而调节巨噬细胞的免疫功能。在通常状态下,通过对正常状态巨噬细胞的剌激增强巨噬细胞的促进炎性反应,提高机体的抗病能力,由此表明松针多糖对疾病有一定的预防作用。这为松针多糖在饲料添加剂中的进一步研究奠定了一定的理论基础。
4 结 论
松针多糖可抑制巨噬细胞产生抗炎细胞因子IL-10,并通过增强巨噬细胞的代谢活力、吞噬能力,增加NO和促炎细胞因子TNF-α和IL-1β的分泌量而增强机体的免疫力,从而提高机体抵抗疾病的能力。
[1]胡耀,欧阳克蕙.植物多糖在动物生产中的应用研究进展[J].饲料研究,2013(5):22-24.
[2]KIHO T,MORIMOTO H,KOBAYASHI T,et al.Effect of a Polysaccharide(TAP)from the fruiting bodies ofTremella aurantiaon glucose metabolism in mouse liver[J].Bioscience,Biotechnology,and Biochemistry,2000,64(2):417-419.
[3]HU S H,WANG J C,LIEN J L,et al.Antihyperglycemic effect of polysaccharide from fermented broth ofPleurotus citrinopileatus[J].Applied Microbiology and Biotechnology,2006,70(1):107-113.
[4]HONG Y K,WU H T,MA T,et al.Effects ofGlycyrrhizaglabra polysaccharides on immune and antioxidant activities in high-fat mice[J].International Journal of Biological Macromolecules,2009,45(1):61-64.
[5]许小向,洪艳平,胡捷敏,等.松针多糖微波提取工艺及抗氧化性研究[J].食品工业科技,2015,36(23):222-227.
[6]葛霞,王文君,欧阳克蕙,等.水提法提取雪松松针多糖[J].食品研究与开发,2010,31(7):20-23.
[7]吕梦云,胡耀,陈伟,等.松针多糖对肉鸡生产性能和免疫功能的影响[J].草业科学,2016,33(8):1633-1639.
[8]HAMMER MMAGES J,DIETRICH H,et al.Dual specificity phosphatase 1(DUSP1)regulates a subset of LPS-induced genes and protects mice from lethal endotoxin shock[J].The Journal of Experimental Medicine,2006,203(1):15-20.
[9]庞然,张淑玲,赵雷,等.草木犀正丁醇提取物对小鼠巨噬细胞促炎介质的影响[J].中国现代医学杂志,2009,19(19):2893-2896.
[10]余功旺,黄文浩,刘爱梅,等.小鼠腹腔巨噬细胞炎症模型的建立[J].广东药学院学报,2014,30(6):766-770.
[11]ZHANG L,WANG C C.Inflammatory response of macrophages in infection[J].Hepatobiliary&Pancreatic Diseases International,2014,13(2):138-152.
[12]赵嘉惠,张华屏,王春芳.MTT法在检测细胞增殖方面的探讨[J].山西医科大学学报,2007,38(3):262-263.
[13]易金娥,OBMINSKA-MRUKOWICZ B,杜金艳,等.桦木酸对巨噬细胞免疫功能和抗氧化作用的研究[J].营养学报,2010,32(3):281-285.
[14]颜晓静,李璘,李征军,等.甘遂醋炙前后对脾淋巴细胞活力和腹腔巨噬细胞释放NO的量效关系比较研究[J].中国药理学通报,2011,27(5):629-632.
[15]叶莎莎,曾耀英,尹乐乐.红景天苷对小鼠腹腔巨噬细胞体外增殖、凋亡、吞噬、ROS和NO产生的影响[J].细胞与分子免疫学杂志,2011,27(3):237-241.
[16]CHAUHAN A K,JAKHAR R,PAUL S,et al.Potentiation of macrophage activity by thymol through augmenting phagocytosis[J].International Immunopharmacology,2014,18(2):340-346.
[17]陈慰峰.医学免疫学[M].4版.北京:人民卫生出版社,2005:90-91.
[18]SUZUKI C,AOKI-YOSHIDA A,KIMOTO-NIRA H,et al.Effects of strains ofLactococcus lactison the production of nitric oxide and cytokines in murine macrophages[J].Inflammation,2014,37(5):1728-1737.
[19]张永红,官佳懿,崔德凤,等.绿原酸对小鼠不同组织巨噬细胞增殖、分泌及吞噬功能的影响[J].动物医学进展,2014,35(9):46-51.
[20]KITAURA H,KIMURA K,ISHIDA M,et al.Immunological reaction in TNF-α-mediated osteoclast formation and bone resorptionin vitroandin vivo[J].Clinical&Developmental Immunology,2013,2013:181849.
[21]LU M M,YANG W J,PENG Z Z,et al.Fluorofenidone inhibits macrophage IL-1β production by suppressing inflammasome activity[J].International Immunopharmacology,2015,27(1):148-153.
[22]RAHIM S S,KHAN N,BODDUPALLI C S,et al.Interleukin-10(IL-10)mediated suppression of IL-12 production in RAW 264.7 cells also involves c-rel transcription factor[J].Immunology,2005,114(3):313-321.
[23]刘红梅,李苏楠,吴婷婷,等.IL-21对LPS诱导的巨噬细胞中细胞因子IL-1β、IL-10、IL-12mRNA表达的影响[J].中国兽医学报,2014,34(10):1653-1656,1662.
[24]胡旭东,左建平.天然植物产物对巨噬细胞功能影响的研究进展[J].时珍国医国药,2007,18(9):2090-2092.
[25]王翔岩,齐云,蔡润兰,等.肉苁蓉多糖的巨噬细胞活化作用[J].中国药理学通报,2009,25(6):787-790.
[26]刘艳艳,秦光,李继昌.PHA复方制剂对鸡免疫功能及相关细胞因子的调节作用[J].东北农业大学学报,2011,42(6):95-100.
[27]HASHIMOTO T,OHNO N,ADACHI Y,et al.Enhanced production of inducible nitric oxide synthase by β-glucans in mice[J].Fems Immunology&Medical Microbiology,1997,19(2):131-135.
[28]马洪第,卢芳汀,陶艳艳,等.中药免疫调节作用的研究进展[J].临床肝胆病杂志,2011,27(5):462-466.
Immunoregulation Effects of Polysaccharides from Pine Needles on Mouse Peritoneal Macrophages
DAI Yi1,2XU Mingsheng1∗SHANGGUAN Xinchen1JIANG Yan1ZHENG Guodong1WANG Wenjun1
(1.Jiangxi Key Laboratory of Natural Products and Functional Food,College of Food Science and Engineering,Jiangxi Agricultural University,Nanchang330045,China;2.Jiangxi Vocational Technical College of Industry&Trade,Nanchang330038,China)
This experiment was conducted to explore the immunoregulation effects of polysaccharides from pine needles on normal and LPS stimulated mouse peritoneal macrophages.Different concentrations of polysaccharides from pine needles were used in normal and LPS stimulated mouse peritoneal macrophages.The blank control group was added 100 μL RPMI-1640 medium,the positive control group was added 100 μL LPS which the final concentration was 5 μg/mL,the polysaccharides from pine needles groups were added 100 μL of 25,50,100,200 μg/mL polysaccharides from pine needles,and the LPS+polysaccharides from pine needles groups were added the mixture of the same concentration as polysaccharides from pine needles groups and LPS solution which the final concentration was 5 μg/mL and the final volume of the liquid was 200 μL.The thiazolyl blue tetrazolium bromide(MTT)assay was used to tested the cell viability,and the macrophages phagocytic ability was tested by neutral red phagocytosis experiments,the secretory volume of nitrous oxide(NO)was measured by Griess reaction,the secretory volumes of interleukin-1β(IL-1β),tumor necrosis factor-α(TNF-α)and interleukin-10(IL-10)in culture supernatants were measured by enzyme-linked immunosorbent method(ELISA).The results showed that:1)compared with the blank control group,the relative proliferation rate of macrophages was significantly increased in all polysaccharides from pine needles groups(P<0.05 orP<0.01),the neutral red phagocytic rate of macrophages was significantly increased in 50,100 and 200 μg/mL polysaccharides from pine needles groups(P<0.05 orP<0.01),the neutral red phagocytic rate of macrophages was significantly increased in all LPS+polysaccharides from pine needles groups(P<0.01),the NO secretory volume of macrophages was significantly increased in 200 μg/mL polysaccharides from pine needles group(P<0.01),the TNF-α and IL-1β secretory volumes of macrophages were significantly increased in 50,100 and 200 μg/mL polysaccharides from pine needles groups(P<0.05 orP<0.01),the IL-10 secretory volume of macrophages was significantly decreased in 50,100 and 200 μg/mL polysaccharides from pine needles groups(P<0.01).2)Compared with the positive control group,the relative proliferation rate of macrophages was significantly decreased in all polysaccharides from pine needles groups(P<0.01),the neutral red phagocytic rate of macrophages was significantly increased in 100 and 200 LPS+polysaccharides from pine needles groups(P<0.01),the NO secretory volume of macrophages was significantly increased in 50,100 and 200 μg/mL LPS+polysaccharides from pine needles group(P<0.01),the TNF-α secretory volume of macrophages was significantly increased in all LPS+polysaccharides from pine needles groups(P<0.05 orP<0.01),the IL-1β secretory volume of macrophages was significantly increased in 50,100 and 200 μg/mL LPS+polysaccharides from pine needles groups(P<0.05 orP<0.01),the IL-10 secretory volume of macrophages was significantly decreased in 100 and 200 μg/mL LPS+polysaccharides from pine needles groups(P<0.01).It is concluded that polysaccharides from pine needles can play a role in proinflammatory,thereby regulate the immune function of macrophages,thus enhancing the ability of anti-disease.[Chinese Journal of Animal Nutrition,2017,29(2):670-677]
polysaccharides from pine needles;macrophages;cytokines;immuneoregulation
S811.3
A
1006-267X(2017)02-0670-08
10.3969/j.issn.1006-267x.2017.02.037
(责任编辑 武海龙)
2016-08-01
国家科技支撑计划(2013BAD10B04-3);江西省科技厅农业处重点项目(2016BBF60086)
戴 艺(1992—),女,江西南昌人,硕士研究生,从事天然产物提取与应用研究。E-mail:ivyjaydai@163.com
∗通信作者:徐明生,教授,硕士生导师,E-mail:xmsjy@sina.com
∗Corresponding author,professor,E-mail:xmsjy@sina.com

