植物乳杆菌对玉米秸秆和水稻秸秆体外发酵特性的影响
陈 亮任 傲∗李 斌周传社谭支良
(1.湖南农业大学动物科学技术学院,长沙 410128;2.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,农业部中南动物营养与饲料科学观测实验站,长沙 410125;3.西藏自治区农牧科学院畜牧兽医研究所,拉萨 850000;4.湖南畜禽安全生产协同创新中心,长沙 410128)
植物乳杆菌对玉米秸秆和水稻秸秆体外发酵特性的影响
陈 亮1,2任 傲1,2∗李 斌3周传社2,4∗∗谭支良2
(1.湖南农业大学动物科学技术学院,长沙 410128;2.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,农业部中南动物营养与饲料科学观测实验站,长沙 410125;3.西藏自治区农牧科学院畜牧兽医研究所,拉萨 850000;4.湖南畜禽安全生产协同创新中心,长沙 410128)
本试验旨在探讨植物乳杆菌(Lactobacillus plantarum)对玉米秸秆和水稻秸秆奶牛瘤胃体外发酵特性的影响。采用单因子随机区组试验设计,分别以玉米秸秆和水稻秸秆为发酵底物,分析不同添加水平[0(对照)、0.25×107、0.50×107和0.75×107CFU/mL]植物乳杆菌对发酵底物体外发酵产气量(1、2、4、6、12、24、36、48 h)、产气参数、干物质降解率(DMD)、中性洗涤纤维降解率(NDFD)、发酵液挥发性脂肪酸(VFA)、氨态氮(NH3-N)浓度及pH的影响。结果表明:添加植物乳杆菌能显著提高玉米秸秆发酵初期产气速率和产气量(1~24 h)(P<0.05),以添加0.75×107CFU/mL效果最为理想;添加植物乳杆菌能显著提高水稻秸秆体外发酵后期(36~48 h)产气量(P<0.05),而以添加0.25×107CFU/mL效果最为理想。随着植物乳杆菌添加水平的增加,2种底物体外发酵液NH3-N浓度均呈现显著的线性增加效应(P<0.05)。不同植物乳杆菌添加水平对2种底物体外发酵NDFD、DMD、发酵液VFA(乙酸、丙酸、异丁酸、丁酸和戊酸)浓度以及pH均无显著影响(P>0.05)。由试验结果推断,添加植物乳杆菌能促进玉米秸秆和水稻秸秆体外发酵及其氮代谢,同时对维持pH的稳定平衡具有积极作用,最佳添加水平分别为0.75×107和0.25×107CFU/mL。
植物乳杆菌;体外发酵;瘤胃;奶牛;玉米秸秆;水稻秸秆
随着人们对畜牧产品安全和环境保护意识的不断加强,微生态制剂作为一种绿色、安全、高效的饲料添加剂倍受关注,越来越多地应用于畜禽养殖中。目前,微生态制剂研究较多的菌种大致分为乳酸菌类、真菌及酵母菌类、芽孢杆菌类、光合细菌类[1],在反刍动物营养与饲料中,应用较广泛的是乳酸菌、酵母菌以及芽孢杆菌[2],而乳酸菌更多地被用于青贮饲料的发酵[3-5]。植物乳杆菌(Lactobacillus plantarum)作为乳酸菌的一种,目前普遍应用于对青贮饲料的发酵。Contreras-Govea等[6-7]利用植物乳杆菌对苜蓿和玉米植株进行青贮发酵,发现植物乳杆菌能显著促进青贮饲料中微生物生长;利用植物乳杆菌对青贮玉米进行发酵,结果表明,植物乳杆菌能促进发酵的进行和青贮玉米饲料的有氧稳定性[8-9],但也有学者研究报道植物乳杆菌对青贮玉米饲料发酵的有氧稳定性没有显著影响[10-11]。
目前,玉米秸秆和水稻秸秆是我国主要农业作物秸秆,在我国每年的作物秸秆总产量中占很大比例,而秸秆养畜对提高秸秆利用率具有重要意义。与牧草相比,玉米秸秆和水稻秸秆品质较低,秸秆饲料加工成为提高秸秆饲喂价值的重要手段,国内外专家对各种添加剂在秸秆养畜中的作用进行了大量研究,而对添加植物乳杆菌是否能提高玉米秸秆和水稻秸秆体外瘤胃发酵特性鲜有报道。
本试验利用体外发酵实时监测技术,以植物乳杆菌为试验菌株,以玉米秸秆和水稻秸秆为发酵底物,研究其对奶牛瘤胃体外发酵特性的影响,为进一步研究其在奶牛生产中的实际应用提供理论依据和技术支撑。
1 材料与方法
1.1 材料
1.1.1 试验菌株
植物乳杆菌,经真空冷冻干燥保存于安瓿管,购买于中国工业微生物菌种保藏中心,菌种号:22696。
1.1.2 MRS培养基
酪蛋白胨10.0 g、牛肉膏10.0 g、酵母粉5.0 g、葡萄糖5.0 g、乙酸钠5.0 g、柠檬酸二铵2.0 g、Tween 80 1.0 g、K2HPO42.0 g、MgSO4· 7H2O 0.2 g、MnSO4·H2O 0.05 g、CaCO320.0 g、琼脂15.0 g,用蒸馏水溶解定容至1.0 L,调整pH为6.8。
1.1.3 缓冲液
按照 Menke等[12]的方法配制瘤胃体外发酵厌氧缓冲液。
1.1.4 发酵底物
本试验采用玉米秸秆(湖南长沙科湘甜玉1号)与水稻秸秆(湖南浏阳湘125s)作为发酵底物。2种秸秆经65℃烘干24 h,粉碎过1 mm孔径筛后备用。底物粗纤维含量按照 GB/T 18868—2002方法测定;依照Hall等[13]的方法,使用Fibretherm FT12全自动纤维仪(Gerhardt Analytical Systems,德国)测定中性洗涤纤维(neutral detergent fiber,NDF)和酸性洗涤纤维(acid detergent fiber,ADF)含量;按照杨胜[14]确定的常规方法测定干物质(DM)、有机物(OM)、粗蛋白质(CP)、中性洗涤可溶物(NDS)含量。玉米秸秆和水稻秸秆主要营养成分含量见表1。

表1 玉米秸秆和水稻秸秆主要营养成分含量(干物质基础)Table 1 Main nutrient composition contents of maize stover and rice straw(DM basis)[15] %
1.1.5 试验动物及饲粮
本试验供体奶牛为健康状况良好、体重[(500±50)kg]相近的3头装有永久瘤胃瘘管的荷斯坦奶牛(Holstein cow),试验奶牛由湖南省长沙市望城县白若铺镇胜和奶牛养殖基地提供。试验期间,奶牛饲粮参照NRC(2001)标准配制。基础饲粮由粗料(水稻秸秆)和精料组成,饲粮精粗比为60∶40。基础饲粮营养成分水平测定方法与底物相同;利用电感耦合等离子体原子发射光谱法(ICP-AES)法测定钙(Ca)、磷(P)含量[16]。基础饲粮组成及营养水平见表2。
1.2 方法
1.2.1 试验设计
本试验采取单因子随机区组试验设计,植物乳杆菌(Lactobacillus plantarum)设置4个添加水平[0(对照)、0.25×107、0.50×107、0.75×107CFU/mL],每个添加水平设置12、24、48 h 3个采样时间点,每个采样时间点设置3个样品重复。

表2 基础饲粮组成及营养水平(干物质基础)Table 2 Composition and nutrient levels of the basal diet(DM basis)[15] %
1.2.2 菌株培养
将保存有菌株的安瓿管管口一端于酒精灯火焰上灼烧,然后滴1~2滴无菌水,轻轻敲打使其管口破碎,向安瓿管中加入0.5~1.0 mL已灭菌无琼脂液体MRS培养基,使固体菌株完全溶解后,利用无菌1 mL注射器转入到装有20 mL液体MRS培养基的50 mL锥形瓶中,37℃静止培养48 h后,进行连续传代培养,至第4代时,对其进行平板涂布计数。试验所需菌株浓度为1× 107CFU/mL时,培养瓶转移至4℃冰箱保存待用。菌株活化、传代以及平板计数过程均在无菌条件下进行。
1.2.3 体外发酵液配制
于晨饲前采集3头瘘管牛瘤胃食糜,用8层纱布过滤,滤液等体积混合后装入事先充满CO2并预热到39.5℃的保温瓶中,迅速带回实验室,与事先在39.5℃恒温水浴锅中预热的厌氧缓冲液混合(缓冲液∶瘤胃液=9∶1,体积比),并持续通入CO2。
1.2.4 体外培养
本试验中所用培养设备为自主研发体外发酵设备,由恒温摇床培养箱(6×6格)、电脑主机、显示器等硬件设备组成。其中恒温摇床培养箱每格为1个单元,体外发酵时,放置1个发酵瓶;每格均对应1个空气压力传感器与发酵瓶相连,空气压力传感器与电脑主机相连,实时监控发酵瓶内气压变化。称取(0.500 0±0.000 3)g发酵底物于发酵瓶中,按试验设计分别向发酵瓶中加入0、0.25、0.50、0.75 mL菌液。将上述准备好的发酵瓶置于39.5℃恒温培养箱中预热,向发酵瓶中通入CO2,随后加入 5 0 mL发酵液,并持续通入CO2,立即加上瓶塞瓶盖,并使用针头放气,使内外压强保持一致,然后迅速放回恒温培养箱,39.5℃恒温培养48 h。
1.2.5 体外发酵总产气量测定
分别于体外发酵中的 1 、2、4、6、12、24、36、48 h使用压力传感器(CYG130-12,昆山双桥传感器测控技术有限公司)测定发酵瓶内的气压,并按公式y=1.506x将气压换算成为室温标准气压下的气体体积。其中1.506为实测压强与体积之间的换算系数,x为实测压强,y为产气量。
利用Wang等[18]提出的LE模型对累积产气量数据进行拟合:
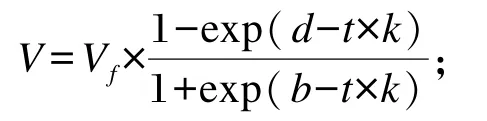
式中:V为t时间点底物的产气量(mL);Vf为理论最大产气量(mL);k为产气分率(%/h);b和d为曲线的形状指标,b>0表示曲线为 S 形,b<0则表示曲线非S形。下式同。
利用下列公式计算发酵初期产气速率(FRD0)(<12 h);
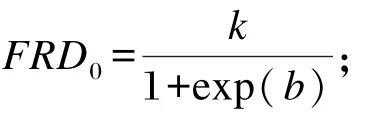
利用下列公式计算达1/2理论最大产气量的时间(t0.5)[19]。
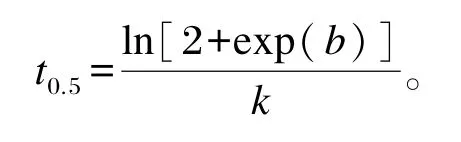
1.2.6 体外发酵干物质降解率(DMD)、中性洗涤纤维降解率(NDFD)及发酵液氨态氮(NH3-N)和挥发性脂肪酸(VFA)浓度、pH测定
分别于体外发酵12、24、48 h时取出发酵瓶,发酵液经400目尼龙布过滤,利用 pH计(REX PHS-3C,上海仪器设备厂)立即测定滤液pH;随后将滤液分装到离心管中,用于NH3-N、VFA浓度测定。按照冯宗慈等[20]改进的比色法测定NH3-N浓度;按照Vanzant等[21]提供的方法测定VFA浓度。将过滤后的残渣全部转移至石英坩埚中并用热蒸馏水反复冲洗,置于105℃烘箱中烘干8 h以测定剩余干物质含量,并计算其 DMD;测定过DMD后的残渣回收用样品袋密封保存,用于NDFD的测定[13]。
1.3 数据分析
试验数据采用SAS 8.2的MIXED过程统计,不同添加水平间的差异采用contrast语句进行比较。统计差异显著性定义为P<0.05。
2 结 果
2.1 植物乳杆菌不同添加水平对体外发酵产气量的影响
植物乳杆菌不同添加水平对玉米秸秆体外发酵产气量的影响如表3所示。当以玉米秸秆为发酵底物时,发酵前期(1、2和 4 h)添加 0.75× 107CFU/mL植物乳杆菌体外发酵产气量均显著高于对照组、0.25×107和0.50×107CFU/mL添加组(P<0.05),而后 3组之间差异不显著(P>0.05);发酵6 h时,添加0.75×107CFU/mL植物乳杆菌体外发酵产气量显著高于 0.50× 107CFU/mL添加组(P<0.05),而与对照组和0.25×107CFU/mL添加组没有显著差异(P>0.05);发酵12 h时,添加0.75×107CFU/mL植物乳杆菌体外发酵产气量均显著高于对照组、0.25× 107和0.50×107CFU/mL添加组(P<0.05),且0.50×107CFU/mL添加组亦显著高于对照组和0.25×107CFU/mL添加组(P<0.05),而后2组之间差异不显著(P>0.05);在发酵 24 h时,添加0.75×107和0.50×107CFU/mL植物乳杆菌体外发酵产气量均显著高于对照组和 0.25× 107CFU/mL添加组(P<0.05),而 0.75×107和0.50×107CFU/mL添加组之间、对照组和0.25× 107CFU/mL添加组之间均没有显著差异(P>0.05);而在发酵36和48 h时,各组之间体外发酵产气量均无显著差异(P>0.05)。由此可知,在以玉米秸秆为底物的体外发酵过程中,添加植物乳杆菌能显著促进体外发酵前期的进行,同时以植物乳杆菌添加量为0.75×107CFU/mL时,效果最强。
当以水稻秸秆为发酵底物时,在发酵1 h时,对照组体外发酵产气量均显著高于其他3组(P<0.05),且添加0.25×107CFU/mL植物乳杆菌时,显著高于0.75×107CFU/mL添加组(P<0.05),而与0.50×107CFU/mL添加组没有显著差异(P>0.05)。这可能由于植物乳杆菌在发酵刚开始存在一定适应性,一定程度上抑制了发酵初期的正常进行。在发酵 36和 48 h时,添加 0.25× 107CFU/mL植物乳杆菌时体外发酵产气量均显著高于对照组和0.75×107CFU/mL添加组(P<0.05),而与0.50×107CFU/mL添加组没有显著差异(P>0.05);且对照组、0.50×107和 0.75× 107CFU/mL添加组之间体外发酵产气量差异不显著(P>0.05)。
2.2 植物乳杆菌不同添加水平对体外发酵产气参数的影响
植物乳杆菌不同添加水平对玉米秸秆体外发酵产气参数的影响如表4所示。玉米秸秆理论最大产气量、发酵初期产气速率和达1/2理论最大产气量的时间各添加水平的平均值均显著高于水稻秸秆(P<0.05)。
当以玉米秸秆为底物时,添加 0.75× 107CFU/mL植物乳杆菌发酵初期产气速率显著高于对照组、0.25×107和0.50×107CFU/mL添加组(P<0.05),且0.50×107CFU/mL添加组发酵初期产气速率亦显著高于对照组(P<0.05),而与0.25×107CFU/mL添加组之间差异不显著(P>0.05),且0.25×107CFU/mL添加组与对照组之间差异亦不显著(P>0.05)。添加0.75×107CFU/mL植物乳杆菌体外达1/2理论最大产气量的时间显著低于对照组和0.25×107CFU/mL添加组(P<0.05),而与0.50×107CFU/mL添加组之间差异不显著(P>0.05);而0.50×107CFU/mL添加组与对照组、0.25×107CFU/mL添加组之间差异不显著(P>0.05)。不同添加水平植物乳杆菌对理论最大产气量均没有显著影响(P>0.05)。
当以水稻秸秆为发酵底物时,不同添加水平植物乳杆菌对理论最大产气量和达1/2理论最大产气量的时间均没有显著影响(P>0.05);添加0.75×107CFU/mL植物乳杆菌发酵初期产气速率显著高于对照组(P<0.05)。随着植物乳杆菌添加水平的增加,发酵初期产气速率呈显著的线性增加效应(P<0.05)。对发酵初期产气速率,发酵底物和植物乳杆菌添加水平之间呈显著的交互效应(P<0.05),而对理论最大产气量和达1/2理论最大产气量的时间则没有显著的交互效应(P>0.05)。
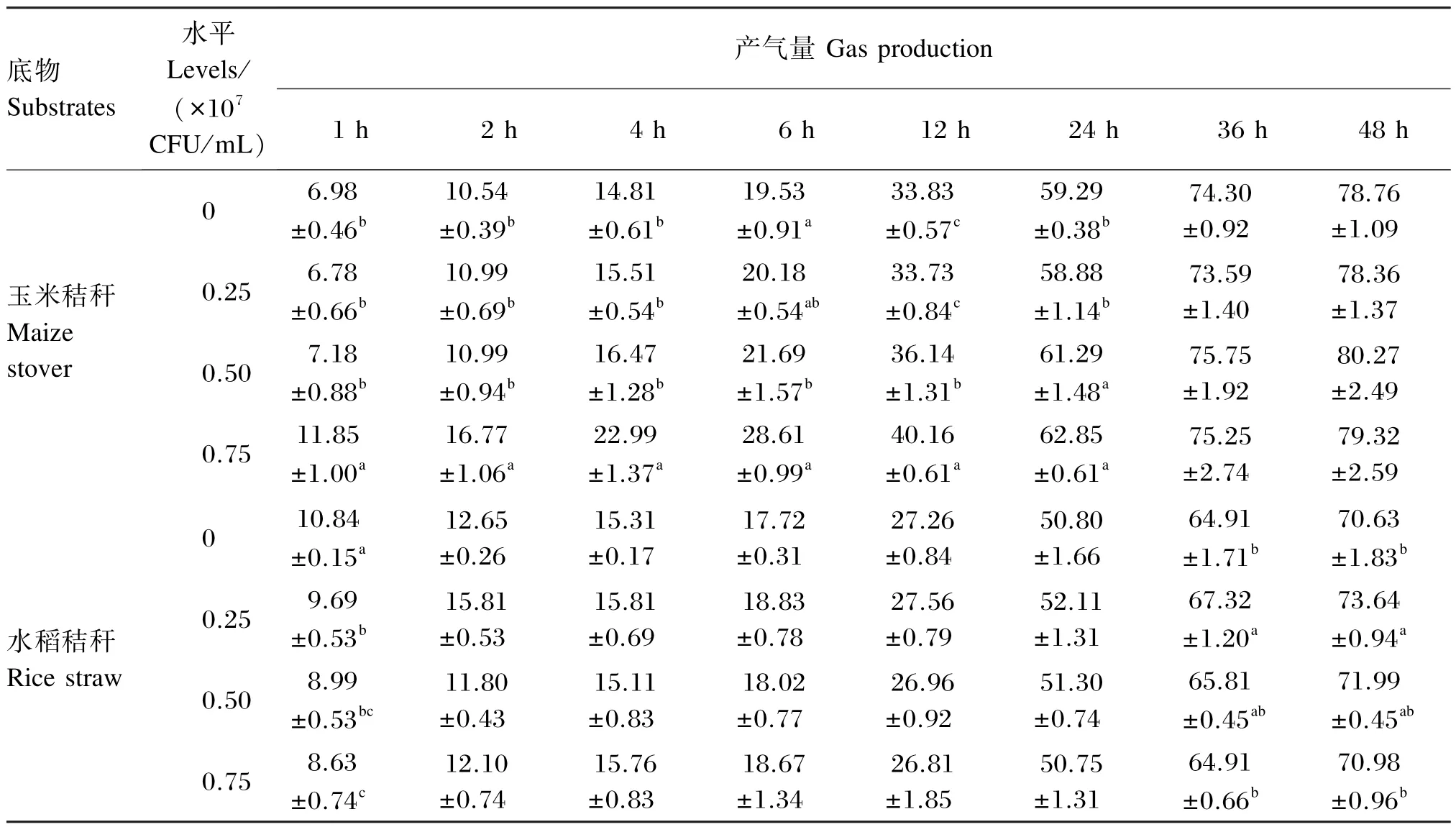
表3 植物乳杆菌不同添加水平对玉米秸秆和水稻秸秆体外发酵产气量的影响Table 3 Effects of different supplemental levels ofLactobacillus plantarumonin vitrofermentation gas production of maize stover and rice straw mL
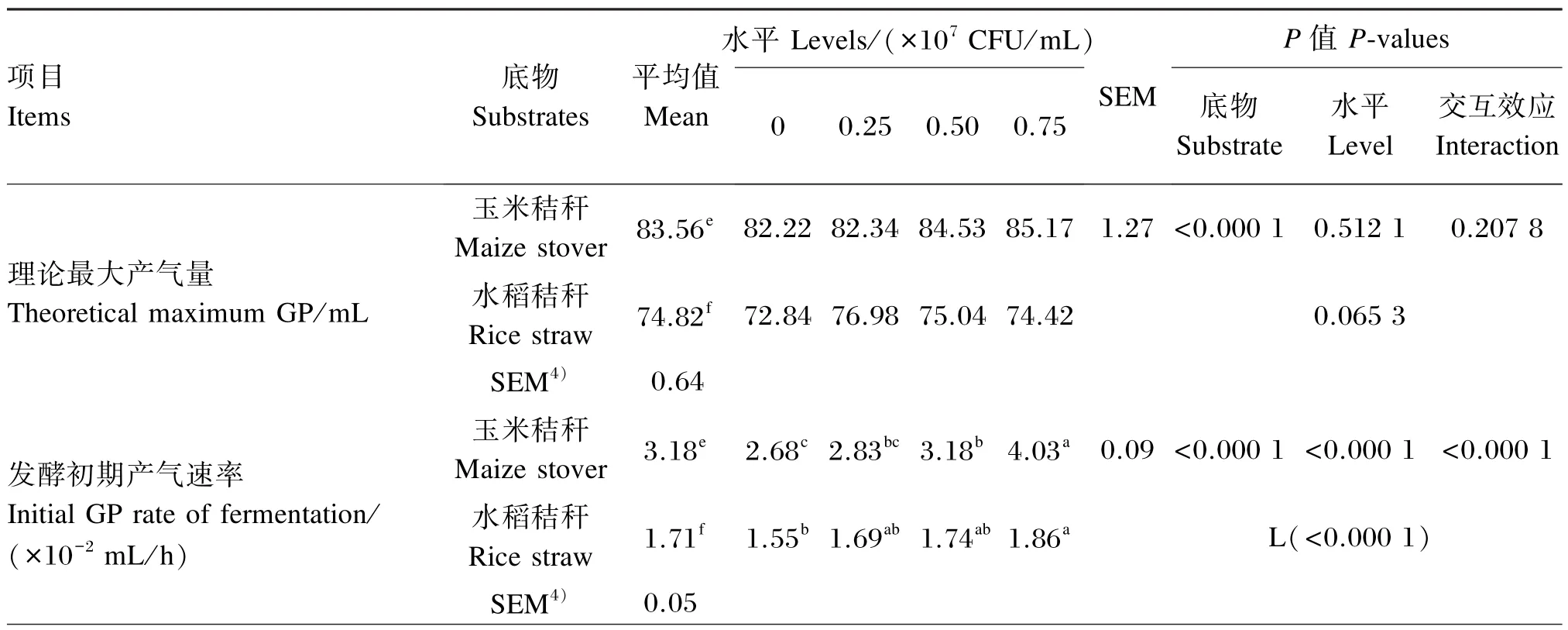
表4 植物乳杆菌不同添加水平对玉米秸秆和水稻秸秆体外发酵产气参数的影响Table 4 Effects of different supplemental levels ofLactobacillus plantarumonin vitrofermentation gas production parameters of maize stover and rice straw
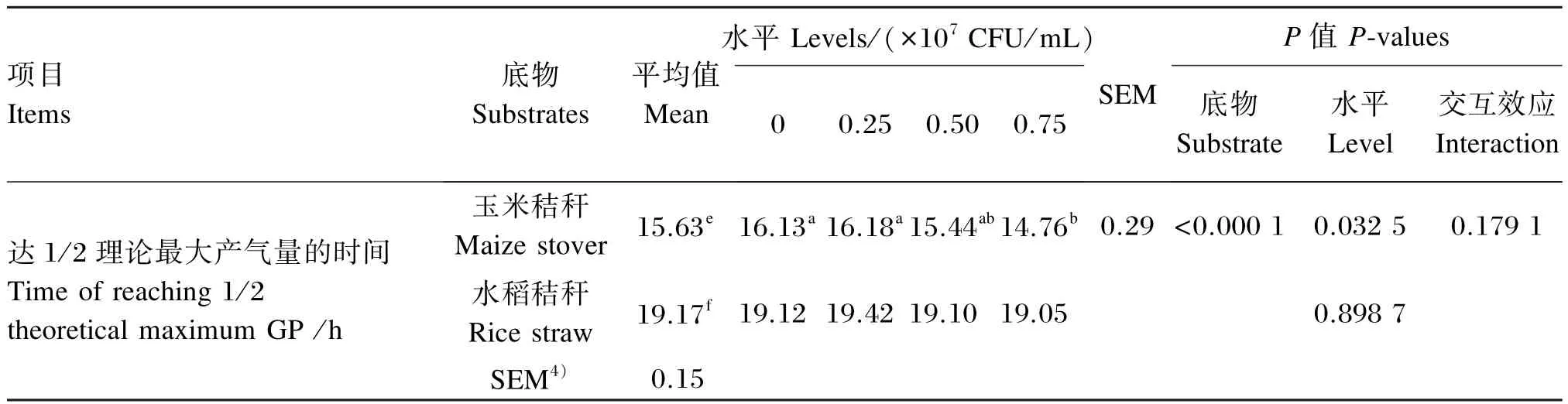
续表4
2.3 植物乳杆菌不同添加水平对体外发酵VFA浓度的影响
植物乳杆菌不同添加水平对玉米秸秆和水稻秸秆体外发酵VFA浓度的影响如表5所示。玉米秸秆为发酵底物时,体外发酵各VFA浓度和乙酸/丙酸各植物乳杆菌添加水平的平均值均显著高于水稻秸秆(P<0.05)。
植物乳杆菌不同添加水平对玉米秸秆和水稻秸秆体外发酵乙酸、丙酸、异丁酸、丁酸、戊酸和总VFA浓度及乙酸/丙酸均没有显著影响(P>0.05),且植物乳杆菌添加水平与发酵底物间的没有显著交互效应(P>0.05)。
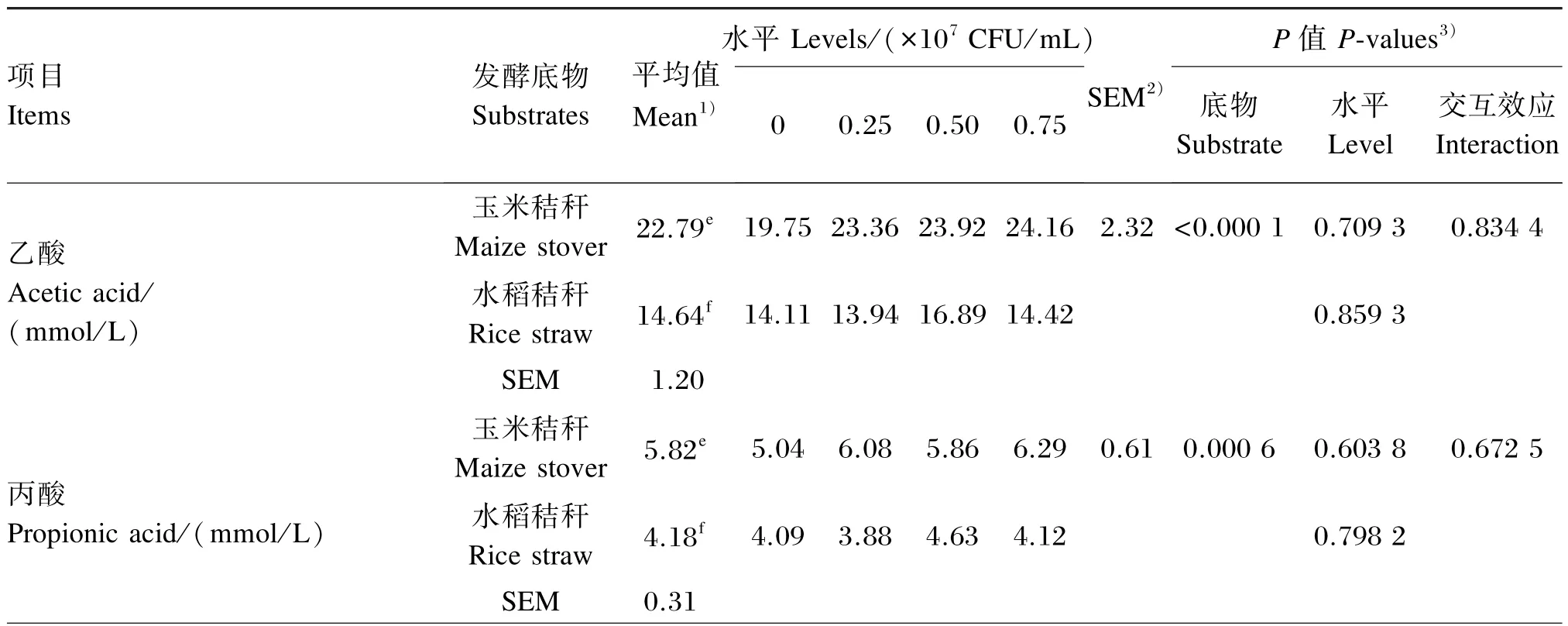
表5 植物乳杆菌不同添加水平对玉米秸秆和水稻秸秆体外发酵48 h VFA浓度的影响Table 5 Effects of different supplemental levels ofLactobacillus plantarumon VFA concentrations of 48 hin vitrofermentation of maize stover and rice straw
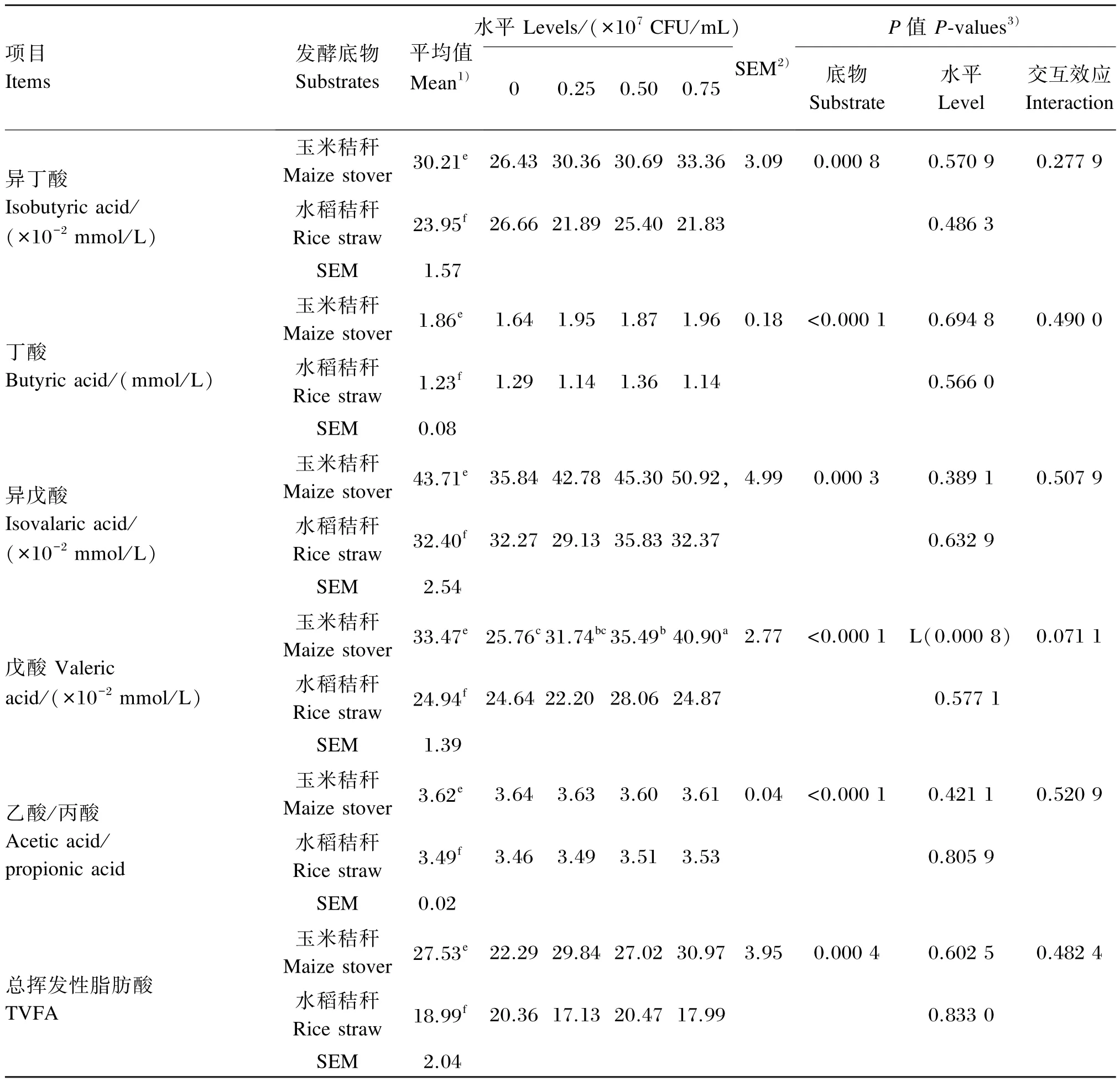
续表5
2.4 植物乳杆菌不同添加水平对体外发酵NDFD和DMD的影响
植物乳杆菌不同添加水平对玉米秸秆和水稻秸秆体外发酵NDFD和DMD的影响如表6所示。玉米秸秆和水稻秸秆不同植物乳杆菌添加水平的NDFD和DMD平均值均无显著差异(P>0.05)。植物乳杆菌不同添加水平对玉米秸秆和水稻秸秆两种发酵底物体外发酵NDFD和DMD亦没有显著影响(P>0.05),且对这2个指标,发酵底物和植物乳杆菌添加水平之间没有显著的交互效应(P>0.05)。
2.5 植物乳杆菌不同添加水平对体外发酵NH3-N浓度和pH的影响
植物乳杆菌不同添加水平对玉米秸秆和水稻秸秆体外发酵NH3-N浓度和pH的影响如表7所示。随着植物乳杆菌添加水平的增加,玉米秸秆和水稻秸秆体外发酵NH3-N浓度均呈显著的线性增加效应(P<0.05)。添加0.75×107CFU/mL植物乳杆菌玉米秸秆体外发酵NH3-N浓度显著高于对照组和0.25×107CFU/mL添加组(P<0.05),且0.50×107CFU/mL添加组亦极显著高于对照组(P<0.01),而与0.25×107CFU/mL添加组没有显著差异(P>0.05),且0.25×107CFU/mL添加组和对照组亦没有显著差异(P>0.05)。添加 0.75× 107CFU/mL植物乳杆菌水稻秸秆体外发酵NH3-N浓度显著高于对照组及 0.25×107和 0.50× 107CFU/mL添加组(P<0.05),而后3组之间没有显著差异(P>0.05)。发酵底物、植物乳杆菌添加水平以及两者之间的交互效应对体外发酵pH均没有显著影响(P>0.05)。

表6 植物乳杆菌不同添加水平对玉米秸秆和水稻秸秆体外发酵48 h NDFD和DMD的影响Table 6 Effects of different supplemental levels ofLactobacillus plantarumon NDFD and DMD of 48 hin vitrofermentation of maize stover and rice straw %
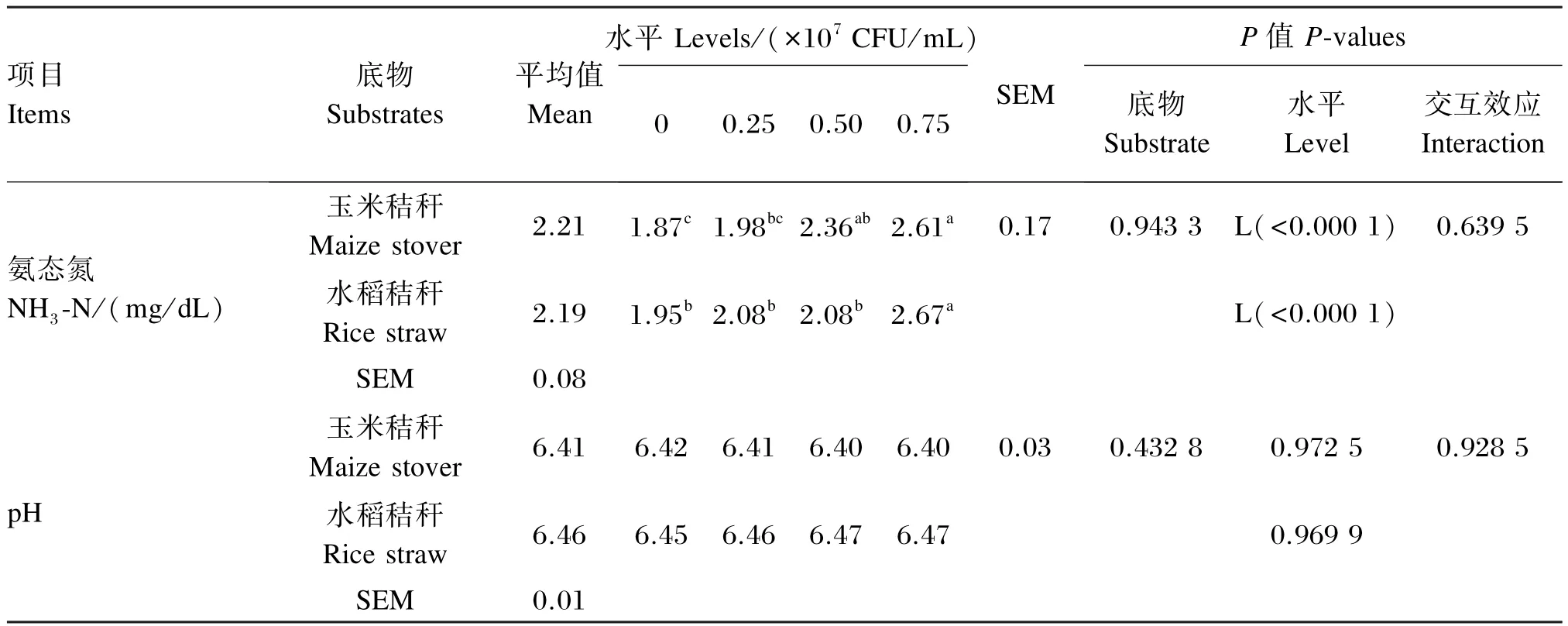
表7 植物乳杆菌不同添加水平对玉米秸秆和水稻秸秆体外发酵48 h NH3-N浓度和pH的影响Table 7 Effects of different supplemental levels ofLactobacillus plantarumon NH3-N concentration and pH of 48 hin vitrofermentation of maize stover and rice straw
3 讨 论
低添加水平的植物乳杆菌一定程度上可促进水稻秸秆中后期发酵的进行,而高添加水平的植物乳杆菌对水稻秸秆体外发酵的促进作用不明显。瘤胃内的气体主要来源于瘤胃微生物消耗可溶性碳水化合物和其他营养物质产生的低级脂肪酸、甲烷、氢气和二氧化碳等代谢产物。添加植物乳杆菌能促进玉米秸秆前期体外发酵,相反对水稻秸秆体外发酵中后期发酵促进作用则更加明显,这可能与玉米秸秆和水稻秸秆2种发酵底物植物细胞壁结构和养分释放规律的差异有关。
体外发酵产气量一定程度上可以反映出发酵底物为瘤胃微生物所利用的程度[22],同时利用产气量,能有效预测体内干物质的降解率以及代谢能[23]。 Muck等[24]研究报道,体外发酵过程中65%~70%产气量在发酵初期9~10 h内产生,而本试验中,玉米秸秆和水稻秸秆体外发酵达1/2理论最大产气量的时间分别约为15和19 h,即2种底物体外发酵产气量达到总产气量50%时所需时间分别约为15和19 h,明显高于Muck等[24]所报道的结论,可能是由于两者体外培养方式的不同而导致产气速率上存在差异。
Contreras-Govea等[6]利用植物乳杆菌接种青贮饲料进行体外发酵,研究结果证实VFA浓度也没有显著改变,这与本试验结果一致。通过青贮饲料接种微生物进行体外发酵,证明微生物能够影响体外发酵VFA浓度[22];同时体外瘤胃接种乳酸菌亦能够影响VFA的组成[25-26]。在本试验中,除戊酸外,添加不同水平植物乳杆菌对其他VFA浓度以及乙酸/丙酸并无显著影响,VFA浓度只在添加植物乳杆菌的不同底物间存在显著差异,可能由于发酵底物化学成分以及细胞比结构不同引起的。2种底物不同的有机物含量以及矿物质含量均会导致不同的发酵液VFA浓度[21-28],此外,2种秸秆不同的细胞壁结构,也可能是造成VFA浓度不同的原因。张元庆等[29]研究报道6种不同来源植物细胞壁发酵产生总VFA及其除丁酸外的其他VFA组分浓度均存在显著性差异。
通过对添加植物乳杆菌的青贮饲料进行体外发酵试验结果表明,与对照组相比,添加植物乳杆菌的青贮饲料NDFD和DMD均无显著差异[6];利用全株玉米做发酵底物进行体外发酵时,也得到类似结论[30],这与本试验结果一致。而利用植物乳杆菌发酵青贮饲料,结果表明该菌可提高体外DMD[4],二者之间的差异可能是由于发酵底物不同而造成的。此外,随着植物乳杆菌添加量的增加,玉米秸秆和水稻秸秆体外DMD亦不断增加,且体外产气量也随之增加;产气量与DMD之间存在高度正相关[31],此结论与本试验结果相符合。在本试验中,玉米秸秆体外平均DMD和NDFD均高于水稻秸秆,造成此种差异除化学组成存在差异外,微生物与底物的吸附能力以及底物的结构也可能是造成此种差异的原因之一。Fernando等[32]报道,细菌与底物的吸附能力是影响底物消化率的重要因子,徐俊等[33]研究报道,苜蓿茎被瘤胃微生物降解的速率及程度受其组织结构及组分影响,同时其指出微生物对植物组织的吸附方式的不一致性也可能是造成不同底物纤维降解率不同的原因之一。
随着体外发酵时间的延长,NH3-N浓度和产气量上升趋势一致,表明植物乳杆菌对体外瘤胃发酵氮代谢具有一定的影响。孟庆翔等[34]研究指出,体外发酵NH3-N浓度与体外产气量存在高度正相关(r>0.99)。Hu等[8]利用植物乳杆菌对干物质含量不同的青贮玉米秸秆进行体外发酵,结果表明植物乳杆菌能显著降低NH3-N浓度,这可能是由于发酵底物营养成分不同所致。瘤胃液pH常作为衡量瘤胃内营养物质发酵的重要生化指标之一,它的稳定直接影响着瘤胃内生态系统的多样性,并直观地反映动物体的健康状况[35]。本试验pH为6.40~6.47,属于反刍动物体内瘤胃液pH的正常范围[36],且随添加量增加,并无显著变化,这与体外发酵VFA浓度变化保持一致。但也有研究报道用植物乳杆菌发酵青贮饲料后,pH降到4以下[37],此结果可能是由于青贮饲料中含有大量微生物以及有机物所致。
4 结 论
①添加植物乳杆菌能显著提高玉米秸秆体外发酵初期的产气速率和产气量(1~24 h),以添加0.75×107CFU/mL效果最为理想。
②添加植物乳杆菌能显著提高水稻秸秆体外发酵后期(36~48 h)产气量,以添加 0.25× 107CFU/mL效果最为理想。
③ 随着植物乳杆菌添加水平的增加,玉米秸秆和水稻秸秆体外发酵NH3-N浓度均呈现显著的线性性增加效应,表明添加植物乳杆菌能促进2种底物体外发酵氮代谢,同时对维持pH的稳定平衡具有积极作用。
[1]陈亮,周传社,方俊,等.单菌株与多菌株微生态制剂在提高奶牛产奶性能上的应用[J].饲料工业,2013,34(4):11-15.
[2]CHEN L,ZHOU C S,LIU G,et al.Application of lactic acid bacteria,yeast andBacillusas feed additive in dairy cattle[J].Journal of Food,Agriculture&Envi-ronment,2013,11(2):626-629.
[3]JENSEN H,GRIMMER S,NATERSTAD K,et al.In vitrotesting of commercial and potential probiotic lactic acid bacteria[J].International Journal of Food Microbiology,2012,153(1/2):216-222.
[4]CAO Y,CAI Y,TAKAHASHI T,et al.Effect of lactic acid bacteria inoculant and beet pulp addition on fermentation characteristics andin vitroruminal digestion of vegetable residue silage[J].Journal of Dairy Science,2011,94(8):3902-3912.
[5]WEINBERG Z G,SHATZ O,CHEN Y,et al.Effect of lactic acid bacteria inoculants on in vitro digestibility of wheat and corn silages[J].Journal of Dairy Science,2007,90(10):4754-4762.
[6]CONTRERAS-GOVEA F E,MUCK R E,MERTENS D R,et al.Microbial inoculant effects on silage andin vitroruminal fermentation,and microbial biomass estimation for alfalfa,bmr corn,and corn silages[J].Animal Feed Science and Technology,2011,163(1):2-10.
[7]CONTRERAS-GOVEA F E,MUCK R E,BRODERICK G A,et al.Lactobacillus plantarumeffects on silage fermentation andin vitromicrobial yield[J].Animal Feed Science and Technology,2013,179(1/2/3/4):61-68.
[8]HU W,SCHMIDT R J,MCDONELL E E,et al.The effect ofLactobacillus buchneri40788 orLactobacillus plantarumMTD-1 on the fermentation and aerobic stability of corn silages ensiled at two dry matter contents[J].Journal of Dairy Science,2009,92(8):3907-3914.
[9]GUO X S,UNDERSANDER D J,COMBS D K.Effect ofLactobacillusinoculants and forage dry matter on the fermentation and aerobic stability of ensiled mixed-crop tall fescue and meadow fescue[J].Journal of Dairy Science,2013,96(3):1735-1744.
[10]LYNCH J P,O’KIELY P,WATERS S M,et al.Conservation characteristics of corn ears and stover ensiled with the addition ofLactobacillus plantarumMTD-1,Lactobacillus plantarum30114,or Lactobacillus buchneri 11A44[J].Journal of Dairy Science,2012,95(4):2070-2080.
[11]QUENROZ O C M,ARRIOLA K G,DANIEL J L P,et al.Effects of 8 chemical and bacterial additives on the quality of corn silage[J].Journal of Dairy Science,2013,96(9):5836-5843.
[12]MENKE K H,STEINGASS H.Estimation of the energetic feed value obtained from chemical analysis andin vitrogas production using rumen fluid[J].Animal Research and Development,1988,28(1):7-55.
[13]HALL M B,PELL A N,CHASE L E.Characteristics of neutraldetergent-soluble fiberfermentation by mixed ruminal microbes[J].Animal Feed Science and Technology,1998,70(1/2):23-39.
[14]杨胜.饲料分析及饲料质量检测技术[M].北京:北京农业大学出版社,1993.
[15]王祚,周传社,汤少勋,等.两种酵母对奶牛瘤胃体外发酵特性的影响[J].农业现代化研究,2014,35(2):218-224.
[16]冯三令,储瑞武,吴玲,等.ICP-AES法测定饲料中多种微量元素的方法研究[J].畜牧与饲料科学,2010,31(4):109-112.
[17]刘玉杰,李向林,何峰.基于饲养标准的家畜单位折算方法[J].草地学报,2009,17(4):500-504.
[18]WANG M,TANG S X,TAN Z L.Modelingin vitrogas production kinetics:derivation of Logistic-Exponential(LE) equations and comparison of models[J].Animal Feed Science and Technology,2011,165(3/4):137-150.
[19]WANG M,SUN X Z,TANG S X,et al.Deriving fractional rate of degradation of logistic-exponential(LE)model to evaluate earlyin vitrofermentation[J].Animal,2013,7(6):920-929.
[20]冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].畜牧与饲料科学,2010,31(6/7):37.
[21]VANZANT E S,COCHRAN R C.Performance and forage utilization by beef cattle receiving increasing amounts of alfalfa hay as a supplement to low-quality,tallgrass-prairie forage[J].Journal of Animal Science,1994,72(4):1059-1067.
[22]METZLER-ZEBELI B U,SCHERR C,SALLAKU E,et al.Evaluation of associative effects of total mixed ration for dairy cattle usingin vitrogas production and different rumen inocula[J].Journal of the Science of Food and Agriculture,2012,92(12):2479-2485.
[23]MENKE K H,RAAB L,SALEWSKI A,et al.The estimation of the digestibility and metabolizable energy content of ruminant feeding stuffs from the gas production when they are incubated with rumen liquor in vitro[J].The Journal of Agricultural Science,1979,93(1):217-222.
[24]MUCK R E,FILYA I,CONTRERAS-GOVEA F E.Inoculant effects on alfalfa silage:in vitrogas and volatile fatty acid production[J].Journal of Dairy Sci-ence,2007,90(11):5115-5125.
[25]WEINBERG Z G,MUCK R E,WEINER P J.The survival of silage inoculant lactic acid bacteria in rumen fluid[J].Journal of Applied Microbiology,2003,94(6):1066-1071.
[26]WEINBERG Z G,CHEN Y,GAMBURG M.The passage of lactic acid bacteria from silage into rumen fluid,in vitrostudies[J].Journal of Dairy Science,2004,87(10):3386-3397.
[27]郭冬生,彭小兰.反刍动物挥发性脂肪酸消化代谢规律刍议[J].畜牧与饲料科学,2005(1):1-3.
[28]李旺.瘤胃挥发性脂肪酸的作用及影响因素[J].中国畜牧杂志,2012,48(7):63-66.
[29]张元庆,魏吉安,孟庆翔.不同植物细胞壁的体外发酵特征及其对甲烷产生的贡献[J].畜牧兽医学报,2006,37(10):992-998.
[30]KUNG L,Jr.,CHEN J H,KRECK E M,et al.Effect of microbial inoculants on the nutritive value of corn silage for lactating dairy cows[J].Journal of Dairy Science,1993,76(12):3763-3770.
[31]BLÜMMEL M,STEINGAβ H,BECKER K.The relationship between,in vitrogas production,in vitromicrobial biomass yield and 15N incorporation and its implications for the prediction of voluntary feed intake of roughages[J].British Journal of Nutrition,1997,77(6):911-921.
[32]FERNANDO W M A D B,FLINT S,BRENNAN C S,et al.The influence of environmental factors on the adhesion of combinations of probiotics to rice fibre fractions[J].World Journal of Microbiology and Biotechnology,2012,28(6):2293-2302.
[33]徐俊,侯玉洁,赵国琦,等.瘤胃微生物对苜蓿茎降解特性及超微结构的影响[J].动物营养学报,2014,26(3):776-782.
[34]孟庆翔,张洪军,戎易,等.估测饲料蛋白质瘤胃降解率活体外新方法的研究[J].北京农业大学学报,1991,17(4):95-101.
[35]RUSSI J R,WALLACE R J,NEWBOLD C J.Influence of the pattern of peptide supply on microbial activity in the rumen simulating fermenter(RUSITEC)[J].British Journal of Nutrition,2002,88(1):73-80.
[36]冯仰廉.反刍动物营养学[M].北京:科学出版社,2004.
[37]HAGHPARVAR R,SHOJAIAN K,ROWGHANI E,et al.The effects ofLactobacillus plantarumon chemical composition,rumen degradability,in vitrogas production and energy content of whole-plant corn ensiled at different stages of maturity[J].Iranian Journal of Veterinary Research,2012,13(1):8-15.
Effects ofLactobacillus plantarumonin VitroRumen Fermentation Characteristics of Maize Straw and Rice Straw
CHEN Liang1,2REN Ao1,2∗LI Bin3ZHOU Chuanshe2,4∗∗TAN Zhiliang2
(1.College of Animal Science and Technology,Hunan Agricultural University,Changsha410128,China;2.Key Laboratory for Agri-Ecological Processes in Subtropical Region,Hunan Research Center of Livestock&Poultry Sciences,South Central Experimental Station of Animal Nutrition and Feed Science in Ministry of Agriculture,Institute of Subtropical Agriculture,Chinese Academy of Sciences,Changsha410125,China;3.Institute of Animal Science of Tibet Academy of Agricultural and Animal Husbandry Sciences,Lhasa850000,China;4.Hunan Co-Innovation Center of Animal Production Safety,Changsha410128,China)
The objective of this trial was to explore and the effects ofLactobacillus plantarumon the characteristics ofin vitroruminal fermentation of maize straw and rice straw in dairy cows.The trial was conducted as one-factor block experimental design,and four supplemental levels[0(control),0.25×107,0.50×107and 0.75×107CFU/mL]ofLactobacillus plantarumwere designed to analyze the influence onin vitrofermentation gas production(1,2,4,6,12,24,36 and 48 h),gas production parameters,dry matter degradability(DMD),neutral detergent fiber degradability(NDFD),and concentrations of volatile fatty acid(VFA)and ammonia nitrogen(NH3-N),as well as pH in fermentation fluid.The results showed that the supplementation ofLactobacillus plantarumcould significantly increase theoretical maximum gas production and gas production at 1 to 24 h of maize straw(P<0.05),and the optimum supplemental level was 0.75×107CFU/mL;the supplementation ofLactobacillus plantarumcould significantly increase gas production at 36 to 48 h(P<0.05),and the optimum supplemental level was 0.25×107CFU/mL.NH3-N concentration of two substrates of in vitro fermentation was enhanced linearly and significantly with the improvement of supplemental level ofLactobacillus plantarum(P<0.05).However,there were no significant differences on NDFD,DMD,and VFA(acetic acid,propionic acid,isobutyric acid,butyric acid and valeric acid)concentrations and pH of fermentation fluid with the change of supplemental levels ofLactobacillus plantarum(P>0.05).The results suggest that addingLactobacillus plantarumcan promote in vitro fermentation and nitrogen metabolism,and maintain pH balance of maize straw and rice straw,the optimal supplemental levels of which are 0.75×107and 0.25× 107CFU/mL,respectively.[Chinese Journal of Animal Nutrition,2017,29(2):678-689]
Lactobacillus plantarum;in vitrofermentation;rumen;dairy cows;maize straw;rice straw
S816.7;S823
A
1006-267X(2017)02-0678-12
10.3969/j.issn.1006-267x.2017.02.038
(责任编辑 王智航)
2016-08-22
娟姗牛生产性能与乳品质提升营养调控关键技术研究(西藏自治区财政专项);国家“十二五”科技支撑计划(2012BAD14B17);国家自然科学基金(31001024);中国科学院亚热带农业生态研究所青年人才领域项目(ISACX-LYQY-QN-1105)
陈 亮(1987—),男,安徽阜阳人,硕士,研究方向反刍动物营养学。E-mail:chenliang071110@163.com
∗同等贡献作者
∗∗通信作者:周传社,研究员,硕士生导师,E-mail:zcs@isa.ac.cn
∗Contributed equally
∗∗Corresponding author,professor,E-mail:zcs@isa.ac.cn

