体外血管内皮生长因子单克隆抗体对C6胶质瘤细胞增殖、侵袭和迁移力的影响
李俊,叶亮,王帆
体外血管内皮生长因子单克隆抗体对C6胶质瘤细胞增殖、侵袭和迁移力的影响
李俊,叶亮,王帆
目的:在体外观察血管内皮生长因子(VEGF)单克隆抗体对C6胶质瘤细胞增殖、侵袭和迁移力的影响。方法:采用氯化钴(CoCl2)模拟缺氧环境,予以0、0.1、1、10 μg/mL的VEGF抗体,对常氧或缺氧条件下对C6胶质瘤细胞进行处理。通过MTT实验检测细胞增殖,Transwell实验检测细胞的侵袭和迁移能力,Western blotting检测HIF-1α蛋白、FAK/Pyk2总蛋白及磷酸化FAK-Tyr397/Pyk2-Tyr402表达水平变化。结果:200 μmol/L CoCl2明显抑制C6细胞增殖(P<0.05),10 μg/mL VEGF抗体可明显抑制C6细胞增殖(P<0.05)。与常氧相比,缺氧可使C6细胞的迁移、侵袭能力增强(P<0.05)。常氧和缺氧下,VEGF抗体的干预均增强C6细胞的迁移、侵袭能力(P<0.05),且相对于常氧,缺氧可进一步增强VEGF抗体促C6细胞迁移、侵袭的作用(P<0.05)。CoCl2干预可增加C6细胞中HIF-1α的含量;在常氧和缺氧情况下,只有1 μg/mL VEGF抗体可降低FAK的总蛋白量(P<0.05);在缺氧情况下,VEGF抗体可明显增高Pyk2-Tyr402位点的磷酸化水平。结论:在缺氧情况下,VEGF抗体的干预可使Pyk2-Tyr402位点的磷酸化水平增高,引起C6细胞的侵袭迁移能力进一步增强。
胶质母细胞瘤;迁移;侵袭;缺氧;血管内皮生长因子
胶质瘤大约占颅脑肿瘤的70%以上,是最为常见的原发性神经系统恶性肿瘤,其中多形性胶质瘤母细胞瘤(glioblastoma multiforme,GBM)被认为是最恶性的胶质瘤(WHOⅣ级)[1,2]。针对新确诊的胶质瘤,目前主要采取以手术、放疗、化疗为主的综合治疗方案,但其预后不容乐观,确诊后平均生存期仅为14月[3,4],而且大部分肿瘤会复发,对于复发型胶质瘤目前仍未有统一的标准治疗方案。本研究采用化学方法建立胶质瘤细胞缺氧模型[5,6],观察血管内皮生长因子(vascular endothelial growth factor,VEGF)单克隆抗体对C6胶质瘤细胞增殖、侵袭和迁移等生物学行为的影响,并初步探讨缺氧环境下,VEGF抗体对胶质瘤细胞侵袭迁移能力改变的有关机制。
1 材料与方法
1.1 材料
1.1.1 细胞来源 大鼠C6胶质瘤细胞购于中国科学院上海生命科学研究院细胞资源中心。C6细胞在含有10%胎牛血清的DMEM培养基中培养,置于5%CO2、37℃的密闭培养箱内(培养箱相对湿度为95%),每2~3 d更换一次培养基。倒置显微镜下观察细胞形态,当细胞生长至70%~80%密度时,予以传代。
1.1.2 主要试剂 氯化钴(CoCl2)、丙烯酰胺/N、N-亚甲叉双丙烯酰胺(Arc/Bis)、四甲基乙二胺(TEMED)、十二烷基磺酸钠(SDS)、甘氨酸(Glycine)购于美国Sigma公司;Tween-20、β-巯基乙醇购于美国Amresco公司;二喹啉甲酸(BCA)蛋白测定试剂盒购于美国Pierce公司;FAK/p-FAK(Tyr397)抗体、Pyk2/p-Pyk2(Tyr402)抗体、VEGF单克隆抗体、β-actin抗体、HRP标记的二抗购于美国Santa Cruz公司;其余试剂均为国产分析纯。
1.2 方法
1.2.1 不同浓度CoCl2对C6细胞增殖的影响 取对数生长期的C6细胞,消化、吹打成单细胞悬液,计数后以每孔8×103个细胞接种于96孔培养板中,每孔100 μL,每组设置5个复孔,于37℃含有5%CO2的培养箱中培养;细胞生长至60%~70%时弃去原培养基,每孔加入含有不同浓度CoCl2的培养基200 μL,使CoCl2终浓度分别为0 μmol/L(0 μmol/L组)、50 μmol/L(50 μmol/L组)、100 μ mol/L(100 μ mol/L组)、200 μ mol/L(200 μmol/L组),调零孔加入与实验组等体积的培养基,其余边缘孔加入等体积PBS,继续培养;处理24 h后取出培养板,每孔加入MTT溶液(5 mg/mL)20 μL,于37℃温箱中孵育4 h,弃去孔内培养基,每孔加入200 μL二甲基亚砜(DMSO),将培养板放在水平摇床上震荡10 min,使结晶充分溶解;以空白孔调零,在酶联免疫检测仪检测490 nm波长处的每孔吸光度值(OD值),比较细胞活力改变。
1.2.2 不同浓度VEGF抗体对C6细胞增殖的影响 取对数生长期的C6细胞,消化、吹打成单细胞悬液,计数后以每孔8×103个细胞接种于96孔培养板中,每孔100 μL,每组设置3个复孔,于37℃含有5%CO2的培养箱中培养;细胞生长至60%~70%时弃去原培养基,每孔加入含有不同浓度VEGF抗体的常氧或缺氧培养基200 μL,使VEGF抗体终浓度分别为0 μg/mL(0 μg/mL组)、0.1 μg/mL(0.1 μg/mL组)、1 μg/mL(1 μg/mL组)、10 μ g/mL(10 μ g/mL组),缺氧条件培养基中含100 μmol/L CoCl2,常氧条件培养基则不含CoCl2,调零孔加入与实验组等体积的培养液,其余边缘孔加入等体积PBS,继续培养;处理24 h后取出培养板,每孔加入MTT溶液(5 mg/mL)20 μL,于37℃温箱中孵育4 h,弃去孔内培养液,每孔加入200 μL DMSO,将培养板放在水平摇床上震荡10 min,使结晶充分溶解;以空白孔调零,在酶联免疫检测仪检测490 nm波长处的每孔OD值,比较细胞活力改变。
1.2.3 Transwell体外迁移和侵袭实验 取对数生长期的C6细胞,消化、吹打成单细胞悬液,计数后以每孔1× 105个接种细胞于6孔培养板中,于37℃含有5%CO2的培养箱中常规培养;参照文献方法[7,8]进行体外迁移和侵袭实验,在倒置显微镜下观察,200×视野下任取5个不重复视野照相,并记数侵袭细胞数量。
1.2.4Western Blotting检测FAK、Pyk2总蛋白表达变化及其磷酸化水平的变化 按照试剂盒说明步骤制备蛋白样品,根据OD值和标准蛋白浓度在Excel中计算出直线回归方程,再根据蛋白样品OD值,用回归方程计算出样品蛋白浓度及上样量。按照试剂盒说明进行Western Blotting检测,photoshop CS 5和Image J软件处理分析图片。
1.3 统计学处理
统计分析及制图采用SPSS 17.0、Image J、photoshop CS 5、Excel 2003软件完成,方差分析、t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度的CoCl2对C6细胞增殖的影响
加入CoCl2后,50、100、200 μmol/L组的C6细胞的相对活性分别为(1.00±0.00)、(0.94±0.08)、(0.89±0.07)、(0.56±0.05)。50 μmol/L组和100 μmol/L组的C6细胞的相对活性与0 μmol/L组比较差异无统计学意义,200 μmol/L组的C6细胞的相对活性较0 μmol/L组差异有统计学意义(P<0.05),C6细胞出现明显的增殖抑制,表现为细胞变细,突起减少,粘附性下降。
2.2 不同浓度的CoCl2对C6细胞HIF-1α的影响
CoCl2可引起HIF-1α表达增高,而且100 μmol/L组的HIF-1α的增高更显著,见图1。
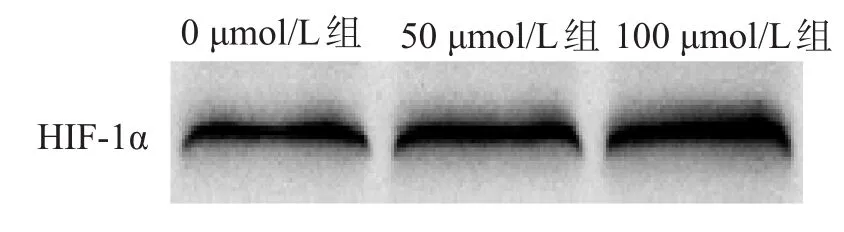
图1 Western blotting检测不同浓度CoCl2对C6细胞HIF-1α表达的影响
2.3 常氧/缺氧条件下VEGF抗体对C6细胞增殖的影响
给予VEGF抗体后,无论是在常氧还是缺氧条件下,0.1 μg/mL组和1 μg/mL组C6细胞的相对活性与0 μg/mL组相比差异均无统计学意义(P>0.05),10 μg/ mL组C6细胞的相对活性与0 μg/mL组相比差异均有统计学意义(P<0.05),细胞出现增殖抑制,见表1。
表1 常氧或缺氧情况下VEGF抗体对C6细胞增殖活性的影响(±s)
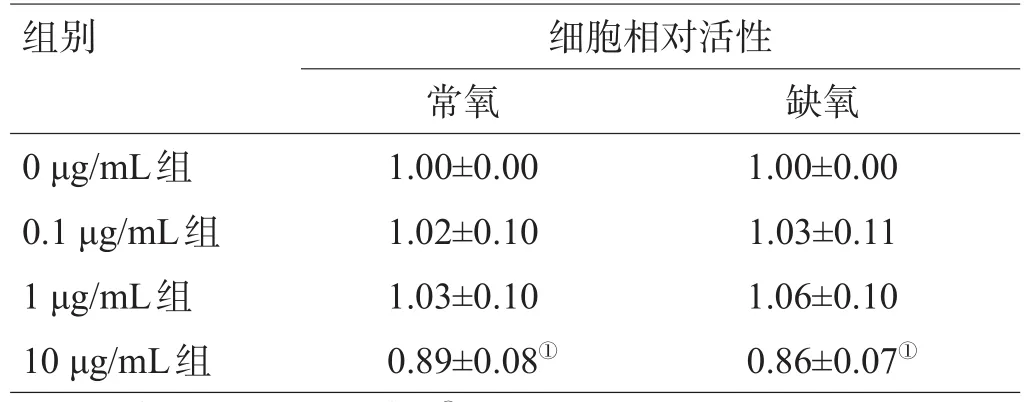
表1 常氧或缺氧情况下VEGF抗体对C6细胞增殖活性的影响(±s)
注:与0 μg/mL组比较,①P<0.05
组别0 μg/mL组0.1 μg/mL组1 μg/mL组10 μg/mL组细胞相对活性常氧1.00±0.00 1.02±0.10 1.03±0.10 0.89±0.08①缺氧1.00±0.00 1.03±0.11 1.06±0.10 0.86±0.07①
2.4 常氧/缺氧条件下VEGF抗体对C6细胞迁移的影响
常氧和缺氧时,VEGF抗体的干预使C6细胞的迁移能力明显增强,与0 μg/mL组相比差异均有统计学意义(P<0.05);0 μg/mL组缺氧情况下的C6细胞迁移能力更强,较常氧情况差异有统计学意义(P<0.05);0.1、1 μg/mL组缺氧情况下的C6细胞具有更强的迁移能力,差异有统计学意义(P<0.05),见图2、表2。
表2 常氧或缺氧情况下VEGF抗体对C6细胞迁移的影响(±s)
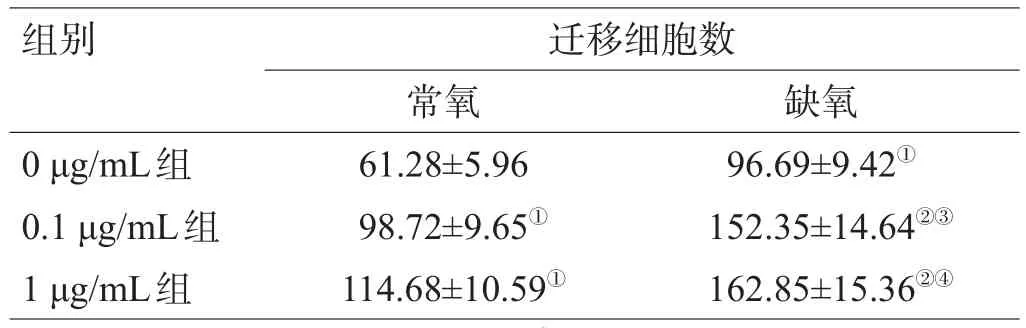
表2 常氧或缺氧情况下VEGF抗体对C6细胞迁移的影响(±s)
注:与0 μg/mL组常氧比较,①P<0.05;与0 μg/mL组缺氧比较,②P<0.05;与0.1 μg/mL组常氧比较,③P<0.05;与1 μg/mL组常氧比较,④P<0.05
组别0 μg/mL组0.1 μg/mL组1 μg/mL组迁移细胞数常氧61.28±5.96 98.72±9.65①114.68±10.59①缺氧96.69±9.42①152.35±14.64②③162.85±15.36②④
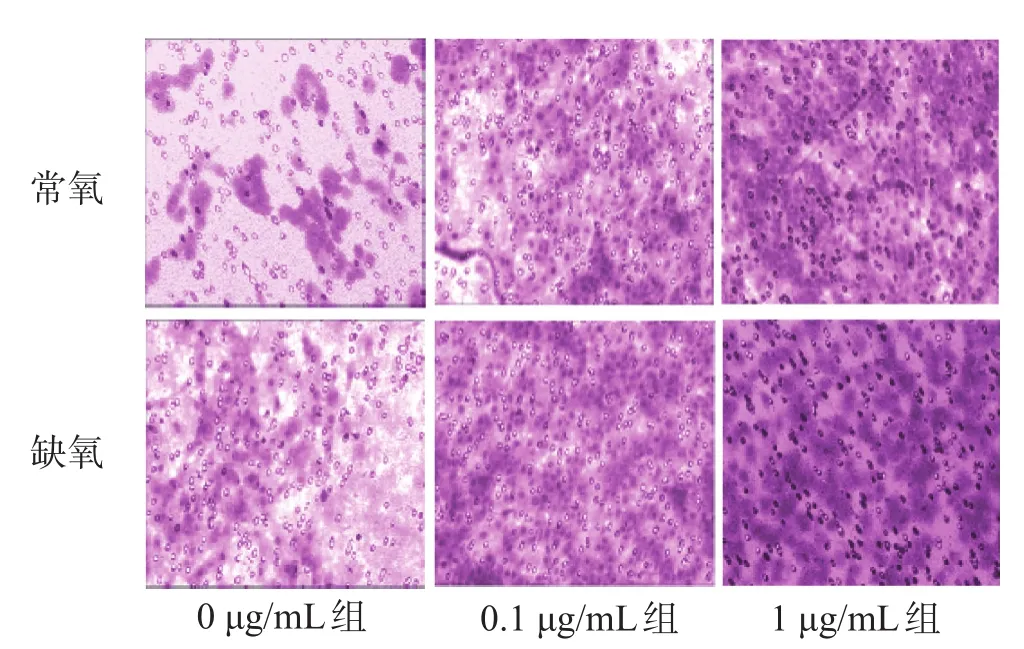
图2 常氧或缺氧情况下的VEGF抗体对C6细胞迁移的影响(×200)
2.5 常氧/缺氧条件下VEGF抗体对C6细胞侵袭的影响
在常氧情况下,0.1 μg/mL组和1 μg/mL组的C6细胞的侵袭能力明显增强(P<0.05);0 μg/mL组的C6细胞在缺氧情况下较常氧更具有侵袭力(P<0.05),0.1 μg/ mL组和1 μg/mL组的C6细胞的侵袭能力明显增强(P<0.05),且强于常氧情况(P<0.05),见图3、表3。
表3 常氧或缺氧情况下VEGF抗体对C6细胞侵袭的影响(±s)

表3 常氧或缺氧情况下VEGF抗体对C6细胞侵袭的影响(±s)
注:与0 μg/mL组常氧比较,①P<0.05;与0 μg/mL组缺氧比较,②P<0.05;与0.1 μg/mL组常氧比较,③P<0.05;与1 μg/mL组常氧比较,④P<0.05
组别0 μg/mL组0.1 μg/mL组1 μg/mL组迁移细胞数常氧48.28±4.54 98.45±8.69①102.46±9.65①缺氧69.35±6.24①181.59±16.32②③205.68±18.96②④
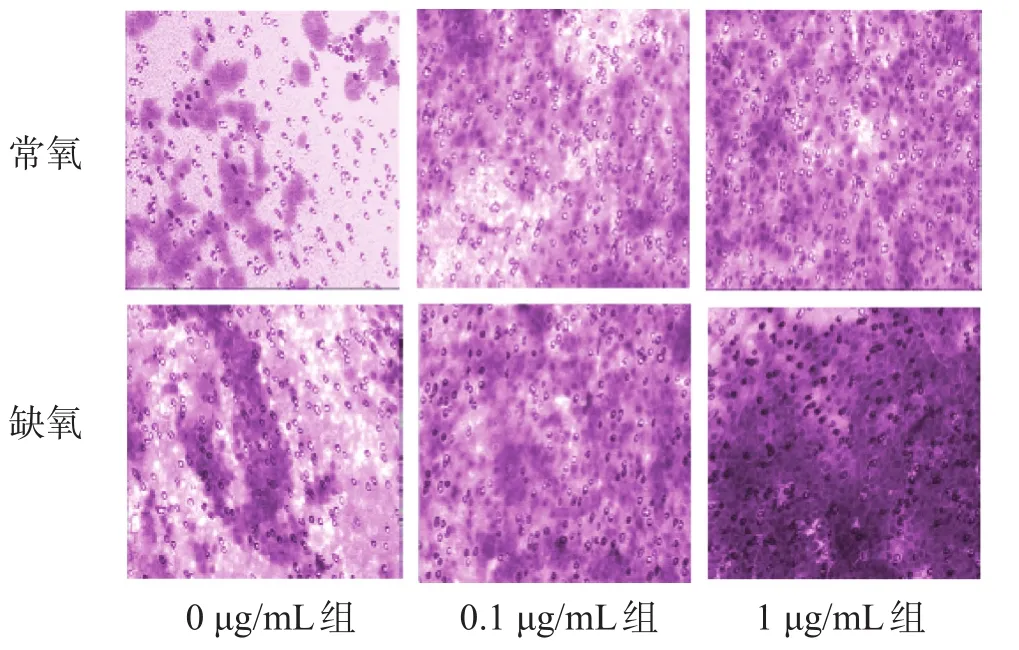
图3 常氧/缺氧情况下的VEGF抗体对C6细胞侵袭的影响(× 200)
2.6 常氧/缺氧条件下VEGF抗体对C6细胞FAK、Pyk2磷酸化的影响
在常氧和缺氧情况下,0.1 μg/mL组的FAK总蛋白表达无变化,1 μg/mL组的FAK总蛋白表达下降(P<0.05);此外,单纯的缺氧处理未能使FAK总蛋白表达改变,而在缺氧情况下,1 μg/mL组的C6细胞的FAK总蛋白表达较常氧情况增高(P<0.05);缺氧和VEGF抗体的干预均未使得FAK-Tyr397自身磷酸化水平发生改变。在常氧及缺氧情况下,不同浓度VEGF抗体处理后,Pyk2总蛋白的表达差异无统计学意义;在常氧情况下,不同浓度VEGF抗体处理未引起Pyk2-Tyr402磷酸化水平改变;而在缺氧环境下,0.1 μg/mL组和1 μg/ mL组的C6细胞的Pyk2-Tyr402磷酸化水平明显增高,差异有统计学意义(P<0.05),见图4、表4。
3 讨论
在正常情况下,细胞内的HIF-α极不稳定,数分钟之内就会被泛素蛋白酶体(ubiquitin-proteasome path-way)降解,而在缺氧环境下,HIF-1α会转移至细胞核,与HIF-1β亚单位结合,参与相应基因的转录调控。在各种模拟细胞缺氧的实验方法之中,CoCl2模拟缺氧环境应用得较为广泛。CoCl2可抑制HIF-1α在细胞质的降解,导致HIF-1α堆积,继而模拟缺氧环境。由于Co-Cl2对细胞有一定的毒性作用,本研究评估CoCl2对C6胶质瘤细胞的影响。MTT实验结果显示,当CoCl2作用浓度波动于100 μmol/L以下时,C6细胞未出现明显的增殖抑制;当CoCl2作用浓度达到200 μmol/L时,C6细胞的相对活性明显下降,出现增殖抑制,与之前的报道基本吻合[9,10]。Western blotting结果示,正常细胞的细胞质内含有一定量的HIF-1α;以50 μmol/L的CoCl2处理C6细胞时,HIF-1α的含量增加;CoCl2达100 μmol/ L时,HIF-1α的含量更高。结合既往研究[10],本研究认为100 μmol/L的CoCl2处理细胞12~24 h后,会引起HIF-1α过度表达,较适合用于模拟体外缺氧。因此,后续试验中采取100 μmol/L的CoCl2处理C6细胞模拟缺氧环境。
表4 常氧/缺氧条件下VEGF抗体对C6细胞FAK、Pyk2磷酸化的影响(±s)
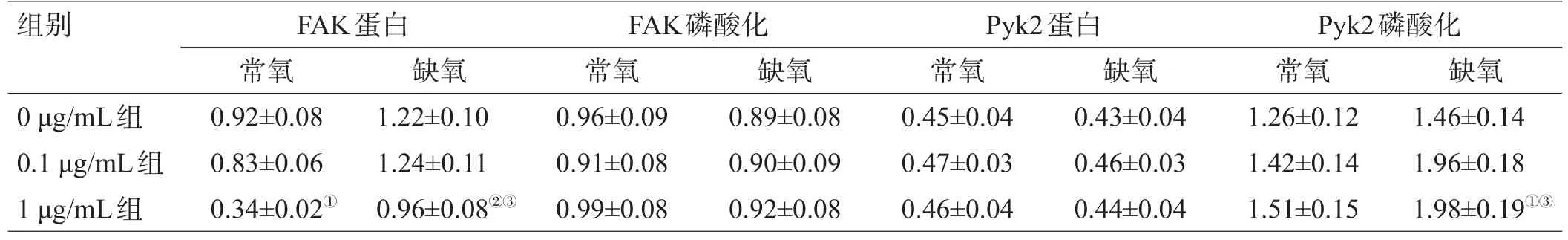
表4 常氧/缺氧条件下VEGF抗体对C6细胞FAK、Pyk2磷酸化的影响(±s)
注:与0 μg/mL组常氧比较,①P<0.05;与0 μg/mL组缺氧比较,②P<0.05;与1 μg/mL组常氧比较,③P<0.05
组别0 μg/mL组0.1 μg/mL组1 μg/mL组FAK蛋白常氧0.92±0.08 0.83±0.06 0.34±0.02①缺氧1.22±0.10 1.24±0.11 0.96±0.08②③FAK磷酸化常氧0.96±0.09 0.91±0.08 0.99±0.08缺氧0.89±0.08 0.90±0.09 0.92±0.08 Pyk2蛋白常氧0.45±0.04 0.47±0.03 0.46±0.04缺氧0.43±0.04 0.46±0.03 0.44±0.04 Pyk2磷酸化常氧1.26±0.12 1.42±0.14 1.51±0.15缺氧1.46±0.14 1.96±0.18 1.98±0.19①③
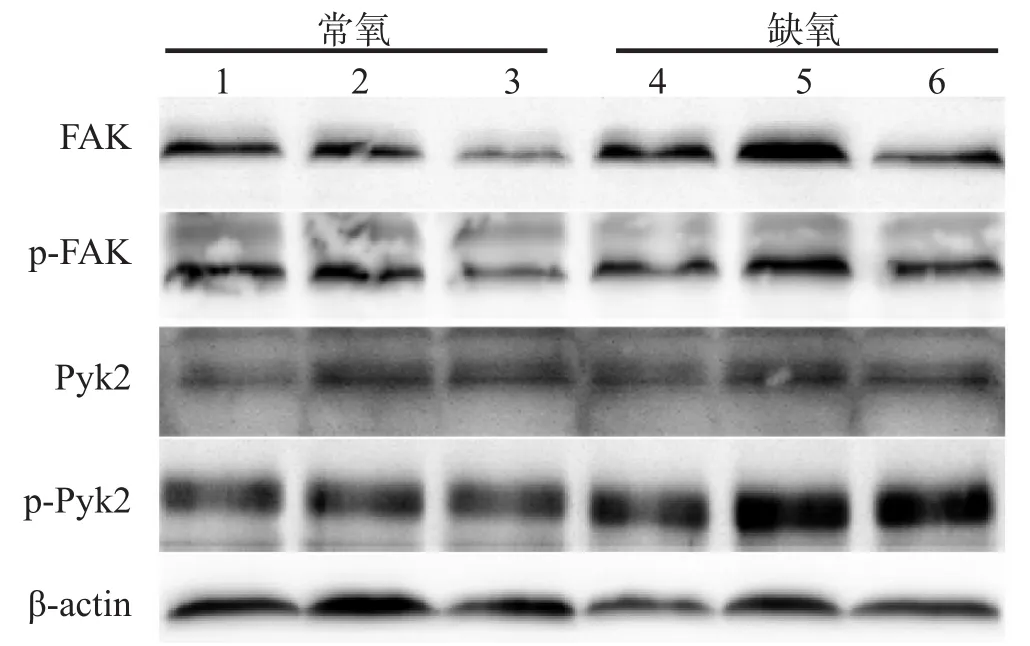
图4 Western blotting检测常氧或缺氧情况下VEGF抗体对C6细胞FAK和Pyk2总蛋白及其磷酸化水平的影响
既往研究[11]已证实,VEGF/VEGFR-2信号通路的激活可趋化内皮细胞增殖。传统观点认为,VEGFR-2仅存在于血管内皮细胞中。现有的研究[12]则对这一观点提出质疑,认为胶质瘤细胞中也存在VEGFR-2,胶质瘤细胞所分泌的VEGF不仅结合内皮细胞的VEGFR-2,而且也以自分泌的方式,结合肿瘤细胞自身的VEGFR-2,这被认为与胶质瘤的治疗抵抗密切相关。Knizetova等[13]运用VEGFR-2抑制剂(SU1498)阻断星形细胞瘤的这一自分泌信号通路,抑制星形细胞瘤的生长,且增强肿瘤细胞对电离辐射的敏感性,认为c-Raf/MAPK、PI3K/Akt和PLC/PKC均参与调控这一通路的激活。既往研究表明[14,15],FAK/Pyk2与胶质瘤的迁移、侵袭行为密切相关。其中,FAK涉及细胞周期和细胞生存的调节,FAK激活后以促进胶质瘤细胞的增殖为主,在敲除Pyk2的细胞中FAK激活并不能促进细胞迁移,反而对细胞迁移具有一定的抑制作用;Pyk2激活以促进胶质瘤细胞的迁移和侵袭为主,对胶质瘤细胞的增殖有负向调节作用;FAK和Pyk2之间的平衡是胶质瘤细胞增殖和迁移的重要调节因素。
综上所述,本研究发现100 μmol/L的CoCl2在12 h内造成C6胶质瘤细胞HIF-1α的堆积,且未造成细胞毒性,因此可用于模拟C6细胞的体外缺氧。在常氧及缺氧情况下,VEGF抗体未对C6细胞的增殖活性造成影响,但可增强C6细胞的侵袭迁移能力。在常氧及缺氧情况下,VEGF抗体未通过改变FAK-Tyr397位点的磷酸化水平来影响C6细胞的增殖活性。胶质瘤细胞的侵袭迁移能力变化是由多个因素调控的病理生理过程,在常氧情况下,VEGF抗体未改变C6细胞Pyk2-Tyr402位点的磷酸化水平。而在缺氧情况下,VEGF抗体的干预可使Pyk2-Tyr402位点的磷酸化水平增高,引起C6细胞的侵袭迁移能力进一步增强。
[1]冒平,王茂德,李瑞春,等.缺氧条件下共培养血管内皮细胞对C6胶质瘤细胞促进生长和抑制凋亡的作用[J].中华神经医学杂志,2012,11: 1115-1118.
[2]Ohgaki H.Epidemiology of brain tumors[J].Methods Mol Biol,2009, 472:323-342.
[3]Van Meir EG,Hadjipanayis CG,Norden AD,et al.Exciting new advances in neuro-oncology:the avenue to a cure for malignant glioma[J]. CACancer J Clin,2010,60:166-193.
[4]梁晨,王茂德.缺氧共培养胶质瘤细胞对内皮细胞生长及凋亡的影响[J].现代肿瘤医学,2011,19:660-663.
[5]Abreu-Rodriguez I,Sanchez SR,Martins AP,et al.Functional and transcriptional induction of aquaporin-1 gene by hypoxia;analysis of promoter and role of Hif-1alpha[J].PLoS One,2011,6:e28385.
[6]Anelli V,Gault CR,Cheng AB,et al.Sphingosine kinase 1 is up-regulated during hypoxia in U87MG glioma cells.Role of hypoxia-inducible factors 1 and 2[J].J Biol Chem,2008,283:3365-3375.
[7]韩学哲,丁艳,金成洙,等.缺氧诱导C6大鼠脑胶质瘤细胞亲环素A蛋白表达及其意义[J].神经解剖学杂志,2009,25:196-200.
[8]徐静波,李英夫,何伟铭,等.榄香烯和VEGF多克隆抗体联合应用对C6胶质瘤增殖的抑制作用[J].中国老年学杂志,2008,28:1072-1074.
[9]Brown JM,Wilson WR.Exploiting tumour hypoxia in cancer treatment [J].Nat Rev Cancer,2004,4:437-447.
[10]楚胜华,朱志安.HIF-1α对胶质瘤U251细胞增殖及侵袭的影响[J].现代肿瘤医学,2012,20:221-224.
[11]Sakurai Y,Ohgimoto K,Kataoka Y,et al.Essential role of Flk-1 (VEGF receptor 2)tyrosine residue 1173 in vasculogenesis in mice[J]. Proc NatlAcad Sci USA,2005,102:1076-1081.
[12]Hamerlik P,Lathia JD,Rasmussen R,et al.Autocrine VEGF-VEGFR2-Neuropilin-1 signaling promotes glioma stem-like cell viability and tumor growth[J].J Exp Med,2012,209:507-520.
[13]Knizetova P,Ehrmann J,Hlobilkova A,et al.Autocrine regulation of glioblastoma cell cycle progression,viability and radioresistance through the VEGF-VEGFR2(KDR)interplay[J].Cell Cycle,2008,7:2553-2561.
[14]Lucio-Eterovic AK,Piao Y,de Groot JF.Mediators of glioblastoma resistance and invasion during antivascular endothelial growth factor therapy [J].Clin Cancer Res,2009,15:4589-4599.
[15]Schaller MD.Cellular functions of FAK kinases:insight into molecular mechanisms and novel functions[J].J Cell Sci,2010,123:1007-1013.
(本文编辑:王晶)
Effect of VEGF Monoclonal Antibody on Proliferation,Invasion and Migration of C6 Glioma Cellsin vitro
LI Jun,YE Liang,WANG Fan.Department of Neurosurgery,Mianyang 404 Hospital,Sichuan 621000,China
Objective:To observe the effect of vascular endothelial growth factor(VEGF)monoclonal antibody on C6 glioma cells’proliferation,migration and invasionin vitro.Methods:CoCl2was added in culture medium to imitate hypoxic culture condition.C6 glioma cells were treated by VEGF antibody with different concentrations(0.1 μg/mL and 1 μg/mL)under normoxic or hypoxic conditions.Cell proliferation was detected by MTT assay.The ability of cell migration and invasion were evaluated by Transwell testing assay.The expression of HIF-1α protein,FAK/Pyk2 total protein and level of FAK-Tyr397/Pyk2-Tyr402 phosphorylation were detected by Western blot.Results:Treatment with 200 μmol/L CoCl2significantly inhibited the proliferation of C6 glioma cells(P<0.05).10 μg/mL VEGF antibody significantly inhibited the proliferation of C6 glioma cells(P<0.05).Compared to the normoxic condition,hypoxiia increased the migration and invasion of C6 cells(P<0.05). Under the normoxic and hypoxic condition,the VEGF antibody can increase the migration and invasion of C6 (P<0.05).Compared to the normoxic condition,hypoxia can enhance the migration and invasion by VEGF antibody to C6 cell(P<0.05).The expression of total FAK protein was decreased in C6 cells by VEGF antibody only in the 1μg/ml concentration(P<0.05).Under hypoxic condition,the phosphorylation levels of Pyk2-Tyr402 was increased in C6 cells after VEGF antibody treatment(P<0.05).Conclusion:Under hypoxic condition,VEGF antibody can increase the phosphorylation levels of Pyk2-Tyr402,which contribute to the invasion and migration of C6 cells.
glioblastoma;migration;invasion;hypoxic;vascular endothelial growth factor(VEGF)
R741;R741.02
ADOI10.16780/j.cnki.sjssgncj.2017.01.002
绵阳市404医院神经外科四川绵阳621000
中华医学会临床医学科研专项资金(No.12020600360)
2015-11-13
李俊gdhuanghb@163. com

