不同振荡速率制备阳性对照在医疗器械生物学评价中的应用
孙晓霞,黄经春,王鸾鸾,王昕,侯丽
国家食品药品监督管理局 济南医疗器械质量监督检验中心 山东省医疗器械生物学评价重点实验室,山东 济南250101
不同振荡速率制备阳性对照在医疗器械生物学评价中的应用
孙晓霞,黄经春,王鸾鸾,王昕,侯丽
国家食品药品监督管理局 济南医疗器械质量监督检验中心 山东省医疗器械生物学评价重点实验室,山东 济南250101
医疗器械生物学评价中试验样品制备的标准化是保证其试验结果具有可靠性和可比性的关键。为了进一步明确样品制备过程中振荡速率对浸提液溶出物的影响,本研究以国际标准ISO10993-12: 2007中推荐的阳性标准物质(SPU-ZDEC)为试验样品,检测了不同振荡速度下浸提液的细胞毒性。结果表明,医疗器械生物学实验中不同的样品振荡速率对检测结果具有显著影响,本研究对于今后标准制定中规定样品制备的标准化问题提供可靠的实验依据,有着重要的参考意义。
二乙基二硫代氨基甲酸锌;细胞毒性;振荡速率;恒温培养振荡器;酶标仪
引言
医疗器械生物学评价中在进行试验以及解释试验结果时,应考虑器械在人体应用时的接触性质、程度、频率、时间和条件等因素,此外,还要关注的一个重要因素即:试验样品的制备。试验样品的选择和制备标准化是保证生物学评价试验结果可靠性和可比性的关键一步。ISO10993-12:2007中规定样品浸提应在搅拌或环流的条件下进行,即采用动态方法进行浸提,但并未详细规定动态浸提的具体方法和参数(如转速,旋转方式等)。在实际检验工作中,不同的动态参数会直接影响检测结果。由于细胞毒性试验是目前公认的一种鉴别筛选生物相容性材料良好性的最敏感的体外试验方法,故本实验室对ISO10993-12: 2007(即GBT16886.12: 2005)中推荐的阳性标准物质(ZDEC)以不同振荡速率浸提并通过系列稀释进行体外细胞毒性检测,试验结果表明不同的振荡浸提速率对细胞毒性结果具有显著影响。本研究为今后医疗器械生物学试验样品制备的标准化及相应国际标准的修订提供了试验依据。
1 材料与方法
1.1 试验样品
含有0.1%二乙基二硫代氨基甲酸锌(SPU-ZDEC)的聚氨酯薄膜,购自Hatano Research Institute/Food and Drug Safty Center, Japan。
1.2 阴性对照
高密度聚乙烯,购自Hatano Research Institute/Food and Drug Safety Center, Japan。
1.3 溶剂对照
不含试验材料的MEM培养基(含10%胎牛血清)。
1.4 试验方法
1.4.1 试剂与细胞
MEM培养基:赛默飞世尔生物化学制品(北京)有限公司,批号:NWE0403。
胎牛血清:杭州四季青生物工程材料有限公司,批号:100517。
细胞:小鼠成纤维细胞系L929(购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所)。
1.4.2 主要仪器
会上,常务副总经理杨瑞生、副总经理刘江涛、马朝辉分别就集团公司2018年农资经营、房地产项目开发及资金运作情况进行了详细介绍,对下一步工作进行了认真部署。
恒温培养振荡器3台,规格型号:ZHWY-100B,上海智诚分析仪器制造有限公司。
酶标仪,规格型号:MK3,热电(上海)仪器有限公司。
1.4.3 样品浸提液的制备
放置于恒温培养振荡器中,振荡频率设置为60、90、120 rpm,温度为(37±1)℃,时间为(24±2) h。第4份放置于37恒温培养箱中静置培养(24±2) h。同时,阴性对照和溶剂对照以同样方式处理。浸提结束后,用对照溶剂将试验样品的浸提液分别稀释成如下浓度梯度:2%、4%、6%、8%、10%,以进行体外细胞毒性试验[1-2]。
1.4.4 试验方法
按照ISO10993-5: 2009(GBT16886.12: 2003)医疗器械生物学评价体外细胞毒性试验MTT法进行试验[3-7]。
1.4.5 数据分析
根据ISO10993-5: 2009(GBT16886.12: 2003)医疗器械生物学评价体外细胞毒性试验8.5细胞毒性测定部分,利用试验样品浸提液光密度平均值(OD570e)和溶剂对照组光密度平均值(OD570b),通过如下公式进行结果分析:
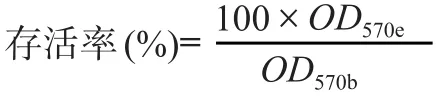
1.5 统计学分析
每组实验至少重复3次,所有实验结果都以平均值±标准差的形式展示。
2 结果
2.1 不同振荡速度的ZDEC浸提液对细胞毒性试验的影响
将培养24 h的L929细胞,弃去培养上清,分别加入制备的样品浸提液、阴性对照及溶剂对照,每组6复孔,100μL/孔,继续培养24 h后更换新鲜含血清培养基,通过MTT掺入法检测570 nm的吸光度(参照波长650 nm)。与溶剂对照组相比,当样品制备的振荡速度为0(即静止浸提)时,随着ZDEC浸提浓度的增加OD570/650数值改变不明显,然而,经过振荡浸提后,随着ZDEC浸提浓度的增加OD570/650数值显著降低,说明振荡后的ZDEC浸提物能够抑制L929细胞增殖,且这种增殖抑制作用具有浓度依赖性(表1)。同时,试验结果显示:样品制备时,ZDEC浸提浓度为2%、4%、6%时,60 rpm相比于静止浸提液的OD570/650数值无明显差异,随着浸提浓度的增加(8%和10%)60 rpm浸提液的OD570/650数值明显降低,但是仍大于90 rpm和120 rpm的OD数值;90 rpm相较于120 rpm浸提也得到了类似60 rpm和静止浸提的变化,即120 rpm浸提液(8%和10%)的OD570/650数值明显降低,其它浓度差异不明显。此外,相较于溶剂对照组,阴性对照组的OD数值无显著改变。
2.2 不同振荡速度的ZDEC浸提液进行细胞毒性试验的IC50值分析
同时,分析不同振荡速度的ZDEC浸提液对细胞存活率的影响(图1),也可以得到与表1相一致的结果。静止浸提后,改变ZDEC浸提浓度不会影响细胞存活率;然而振荡浸提后,随着ZDEC浸提浓度的增加细胞的存活率越低,浸提液对细胞的增殖抑制效应越明显。此外,在相同的ZDEC浸提浓度下,不同振荡速率(60、90、120 rpm)对细胞的增殖抑制效应不明显。通过各组细胞存活率所得到的抑制率,根据文献中推荐的方法来计算相应的IC50值[8-10],见图2,也进一步证实上述试验结果。
2.3 不同振荡速度的ZDEC浸提液细胞毒性形态学分析
结合ISO 10993-5:2009 (GBT16886.12: 2003) 浸提液细胞毒性形态学定性分级,显微镜下显示,浸提介质对照组和阴性对照组的细胞形态良好,增殖明显(图3)。而试验样品浸提组,相同ZDEC浓度下,随着振荡速度的提高,L929细胞明显皱缩,增殖被抑制,细胞毒性级别明显增大。
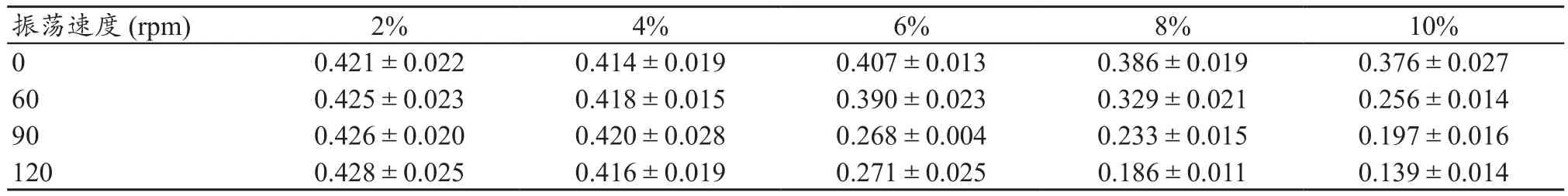
表1 不同振荡速度的ZDEC浸提液进行细胞毒性试验对细胞OD值的影响
结合ISO 10993-5:2009 最新修订草案[3]中规定的浸提液细胞毒性形态学定性分级,显微镜下显示,浸提介质对照组(Cell-blank)和阴性对照组(Cell-NC)的细胞形态良好、增殖明显,细胞毒性为0级(图3)。而试验样品组,静止浸提时各组细胞生长良好、增殖明显,无毒性反应(细胞毒性为0级);同时,振荡浸提组,浓度为2%和4%的细胞毒性亦为0级,60 rpm浸提时6%浸提液稀释组<20%的细胞圆缩死亡,显示轻微毒性反应(细胞毒性为1级),90 rpm和120 rpm浸提时6%浸提液稀释组的死亡细胞明显增多,胞浆内颗粒增多(细胞毒性为2级),除此之外的60、90、120 rpm其余浸提液稀释组(8%和10%)均显示明显的细胞皱缩、增殖抑制现象,显示为重度毒性反应,细胞毒性均为4级。
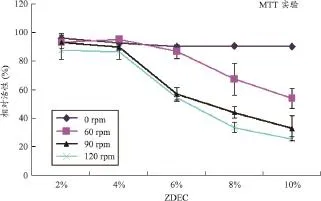
图1 不同振荡速度的ZDEC浸提液对细胞存活率的影响

图2 不同振荡速度的ZDEC浸提液进行细胞毒性试验的IC50值分析
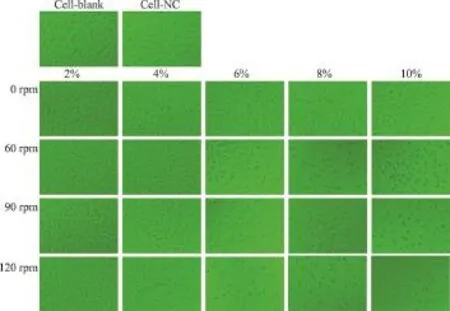
图3 显微镜观察ZDEC浸提液的细胞毒性
3 讨论
在医疗器械生物学试验过程中,标准化的试验样品制备是保证生物学评价试验结果具备可靠性和可比性的关键。在ISO10993-12:2007 (GBT16886.12: 2005) 中规定,浸提是模拟器械正常使用过程中通过评价可沥滤材料对病人和使用者的一种模拟产品适用条件的处理方法。浸提是一个复杂的过程,受时间、温度、表面积与体积比、浸提介质以及材料的相平衡的影响。人体在使用医疗器械以达到临床诊断/治疗的过程中,机体(或血液)的运动会导致该器械在体内的代谢及其毒性作用发生改变,因此,不能采用静息浸提的方式来评价医疗器械的细胞毒作用。尽管,ISO10993-12:2007 (GBT16886.12: 2005) 中10.3.6规定样品浸提应在搅拌或环流的条件下进行,但并未详细规定动态浸提的具体方法和参数(如转速,旋转方式等)。然而,对于医疗器械的检测,统一的计量单位、标准化的测量或检测方法是实现正确测量的必要条件。本文以ISO10993-12:2007 中推荐的阳性标准物质(SPU-ZDEC)为实验材料,以不同振荡速率浸提该实验材料,通过检测各浸提液的细胞毒性,分析水平振荡浸提的振荡速率对SPU-ZDEC的可沥滤物及其细胞毒作用的影响,以探讨样品制备过程中的不同振荡速率对评价医疗器械引起细胞毒性反应的意义。
体外细胞毒性试验广泛适用于各种医疗器械和材料的评价,其目的是评价医疗器械引起细胞毒性反应的潜在可能性,这种方法不仅可以快速、灵敏、有效地对供试品的体外细胞生物学行为作出判断,而且还有助于对一种医疗器械是否有必要采用昂贵的体内实验作出科学的判定。本研究中选用国际通用的阳性标准物质(SPU-ZDEC)作为研究对象,通过不同振荡速率浸提后,用MTT掺入法检测各浸提液的细胞毒性。按照ISO10993-5: 2009 (GBT16886.12: 2003),由于含血清的细胞培养基既能支持细胞生长,又能做为极性和非极性浸提介质,故在本次研究中,我们选择含血清的细胞培养基作为浸提介质。根据ISO10993-12:2007 (GBT16886.12: 2005)中的样品制备原则,按0.1 g/mL浸提比例进行制备,选择适用于细胞毒性试验的(37±1)℃,(24±2)℃条件,于恒温培养振荡器中完成振荡浸提。实验结果显示,振荡浸提能增加SPU-ZDEC的细胞毒性,60 rpm浸提时的细胞毒性明显大于静止浸提而小于90 rpm浸提,并且120 rpm浸提时的细胞毒性大于90 rpm浸提但增加毒性作用不明显。这一结果提示,在进行细胞毒性试验的样品制备时,不仅要看试验样品的材料、特性,与人体的接触程度和接触时间,样品制备的时间和温度,还要考虑样品制备过程中振荡速率这一重要因素。本文通过水平振荡的方式观察振荡浸提对细胞毒性的影响,此外对于其它的环流或搅拌等动态浸提方式而引起的细胞毒作用有待进一步实验解决。
IC50值是指细胞活性抑制50%时抑制剂的浓度,也有学者将其用于医疗器械细胞毒性试验中标准参照材料的选择[11-13]。本研究中,我们通过细胞毒性试验中细胞存活率所得到的抑制率,计算了不同振荡速度的SPU-ZDEC浸提液的IC50值,60 rpm浸提的IC50值为10.45%,90 rpm浸提的IC50值为7.47%,120 rpm浸提的IC50值为6.73%(图2)。此外,通过显微镜下观察不同振荡速度浸提液的细胞毒性(图3)。结果表明,定量分级评价与定性评价之间具有良好的相关性。然而,IC50值一般用于评价单一化合物的细胞毒性反应,医疗器械浸提液多为混合物,因此需要对其适用性进行验证[14-16]。
综上所述,本研究发现,振荡浸提有助于医疗器械和材料中潜在的毒性成分释放发挥细胞毒作用,浸提过程中增加振荡速率会增强材料的细胞毒作用,这一结果为今后标准制定中规定样品制备的标准化问题提供可靠的实验依据,有着重要的参考意义。
[1] ISO10993-12-2007,Biological evaluation of medical devices-Part 12: Sample preparation and reference materials[S].
[2] GB/T16886-12-2005,医疗器械生物学评价-第12部分:样品制备与参照样品[S].
[3] ISO10993-5-2009.Biological evaluation of medical devices-Part 5:Tests for in vitro cytotoxicity[S].
[4] GB/T 16886-5-2003.医疗器械生物学评价-第5部分:体外细胞毒性试验[S].
[5] 郭磊,刘魁,张世亮,等.氧化镁膜AZ31B镁合金材料的细胞毒性研究[J].稀有金属材料与工程,2008,37(6):1027-1031.
[6] 高焕方,张胜涛,罗天元,等.AZ31B镁合金表面锌系磷化膜制备工艺及性能研究[J].材料工程,2009,(9):51-55.
[7] 游丽英.镁合金表面锌系磷化膜制备工艺及性能研究[D].长春:吉林大学,2007.
[8] 王海涛,徐玉茵,周静,等.RTCA法用于医疗器械体外细胞毒性试验的研究[J].毒理学杂志,2016,(3):224-226.
[9] 吴邦耀,罗卓荆,孟浩,等.胶原-明胶支架材料交联改性的制备及细胞毒性实验研究[J].生物医学工程与临床,2007,11 (6):420-425.
[10] 吴邦耀.新型组织工程神经支架材料的生物安全性评价[J].西安:第四军医大学,2008.
[11] 王昕,施燕平,朱雪涛.具药新生儿脐带敷料的细胞毒性试验[J].生物医学工程研究,2005,24(4):263-265.
[12] 黄姝杰,关静,李志宏,等.载药敷料体外细胞毒性及释药性评价[J].医用生物力学,2010,25(1):32-35.
[13] 林志群,赵大川,郎敏,等.载纳米银海藻酸钙敷料的制备及体外细胞毒性、抗菌性能的检测[J].生物医学工程研究,2016,35(2):113-117.
[14] 黄桂娟,景红霞,夏栋林,等.纳米银猪脱细胞真皮敷料的细胞毒性评估[J].中国组织工程研究,2010,14(25):4607-4610.
[15] Basic Principles of Biological Safety Evaluation Required for Application for Approval to Market Medical Devices[M]. Japan:MHLW,2012:33.
[16] Tsuchiya T,Ikarashi Y,Hats H,et al.Comparative Studies of the Toxicity of Standard Reference Materials in Various Cytotoxicity Tests and ln Vivo Implantation Tests[J].J Appl Biomater,1993,4(2):153-156.
本文编辑 苏欣
Preparation of Positive Control with Different Oscillation Rate in the Application of Medical Devices Biological Evaluation
SUN Xiao-xia, HUANG Jing-chun, WANG Luan-luan, WANG Xin, HOU Li
Key Lab of Biological Evaluation of Medical Devices of Shandong Province, Jinan Quality Supervision and Inspection Center for Medical Devices, State Food and Drug Administration, Jinan Shandong 250101, China
Standardization of test sample preparation is key to ensuring a reliable and comparable test results in biological evaluation of medical devices. In order to further clarify the effect of oscillation rate during soluble material extraction, we tested the positive standard material of SPU-ZDEC recommended by ISO10993-12: 2007 and detected the cytotoxicity of extract with different oscillation rate. Results showed that different sample oscillation rates have significant impacts on test results in biological tests of medical devices. This study provided a reliable experimental basis for the standardization of sample preparation, which is of great reference meaning.
SPU-ZDEC; cytotoxicity; oscillation rate; constant shaking incubator; microplate reader
R197.39
A
10.3969/j.issn.1674-1633.2017.02.002
1674-1633(2017)02-0005-04
2016-11-10
山东省自然科学基金青年基金项目(ZR2014CQ041);国家重点研发计划课题(2016YFC1103202;2016YFC1103205)。
王瑾晔,教授。
通讯作者邮箱:jinyewang@sjtu.edu.cn

