载紫杉醇聚合物胶束的制备工艺优化
魏淑明, 范清英, 宋 煜
紫杉醇(paclitaxel,PTX)是首个从天然植物中分离出来的抗癌药,在临床上广泛应用于卵巢癌、乳腺癌、非小细胞肺癌等[1-3]。但由于PTX在水中的溶解度极低(<1 μg/mL)[4],导致其口服吸收差,且PTX在体内不能专一作用于肿瘤细胞,对正常细胞也有杀伤毒性。目前国内上市应用的均为注射剂,常用制剂Taxol®采用聚氧乙烯蓖麻油和无水乙醇助溶,增加溶解度的同时也带来了毒性、高敏性等不良反应[5],从而使临床治疗受到限制。近年新上市的PTX新制剂,较传统注射剂Taxol®虽能降低或去除过敏反应、减小药物毒副作用,但在提高肿瘤靶向性及耐受剂量方面仍表现不足。因此,制备合适的载体,增加PTX的溶解度,改善靶向性,降低给药系统的毒性,是需要解决的问题。
普通纳米药物载体可以在一定程度上提高药物的水溶性,并通过EPR效应靶向于肿瘤细胞,但在实际应用中到达靶位的效果并不理想。若能结合肿瘤特异性靶向策略,则药物靶向肿瘤的能力能进一步提高。透明质酸(hyaluronic acid,HA)是一种对肿瘤细胞具有高亲和性的天然高分子材料,可以与癌细胞细胞膜上的受体如CD44蛋白结合,因而HA及其衍生物被广泛用于抗肿瘤药的靶向递送体系的研究中,在增加药物溶解度及提高靶向性上具明显优势[6]。甘草次酸(glycyrrhetinic acid,GA)为甘草的主要成分,具有抗病毒、促进细胞凋亡等多种的药理学活性[7],同时,Negishi等证实肝实质细胞膜组分中含有大量GA特异结合位点[8],使得GA及其衍生物具有肝靶向性[9]。可以推测,以HA与GA两者结合的GA(HSG)偶联物载体若能顺利包载PTX制纳米胶束制剂,在体内递送中可以利用EPR效应的被动靶向、肿瘤细胞CD44受体和GA受体发挥协同主动靶向等多种靶向机制来增加PTX在肿瘤部位尤其是肝的靶向蓄积作用,从而提高治疗指数,减少不良反应。笔者以HSG偶联物为载体材料,制备载PTX的PTX/HSG聚合物胶束,优化HSG偶联物对PTX的载药能力,并考察其稳定性。
1 材料与方法
1.1材料
1.1.1试剂 HSG偶联物(实验室自制);透析袋(批号:151220,上海市绿鸟科技发展有限公司);PTX原料药(批号:902-1308001,福建南方制药股份有限公司);PTX标准品(批号:100382-201603,纯度99.9%,中国食品药品检定研究院);水为蒸馏水;其它试剂均为分析纯。
1.1.2仪器 超声波细胞粉碎机(JY92-2D,宁波市芝生物科技股份有限公司);激光粒径测定仪(NICOMPTM380ZLS,美国Santa Barbara公司);高效液相色谱仪(LC-20AT,日本岛津公司);双光束紫外可见分光光度计(TU-1901,北京普析通用仪器有限责任公司);透射电子显微镜(H7650,日本日立公司)。
1.2方法
1.2.1包封率和载药量的测定
1.2.1.1检测波长的确定 精密称取适量PTX标准品,甲醇溶解、配制溶液,按照《中国药典》2015年版附录中紫外分光光度法,以甲醇为空白溶液,在200~500 nm波长范围内进行紫外扫描,确定检测波长。
1.2.1.2色谱条件 色谱柱:Diamonsil®Platisil ODS(250 mm×4.6 mm,5 μm);流动相:甲醇-水(75∶25,V/V);流速:1 mL/min;检测波长:227 nm;进样量:20 μL;柱温:30 ℃。
1.2.1.3标准曲线制备 精密称取PTX 10 mg置于50 mL容量瓶中,用甲醇溶解定容,得200 μg/mL的储备液。逐步稀释配制浓度分别为20,10,5,2,1,0.5 μg/mL的PTX溶液,0.45 μm微孔滤膜过滤,进样,按1.2.1.2项色谱条件下测定,记录峰面积A。以峰面积(A)为纵坐标,浓度(C)为横坐标,绘制标准曲线,得到线性回归方程。
1.2.1.4回收率 配制高、中、低(20,5,0.5 μg/mL)3种浓度的PTX标准溶液,加入偶联物,按1.2.1.2项色谱条件测定并计算回收率。
1.2.1.5精密度 配制高、中、低浓度(分别为20,5,0.5 μg/mL)的PTX标准溶液,在同1天内连续进样5次及连续5 d进样测定并计算日内精密度、日间精密度。
1.2.1.6供试品溶液的制备及包封率和载药量测定 将PTX/HSG聚合物胶束溶液3 000 r/min离心15 min,得上清液过滤,取滤液100 μL置10 mL容量瓶中用甲醇稀释至刻度,过0.45 μm滤膜,取续滤液按1.2.1.2项色谱条件测定并计算载入胶束中的PTX量。按以下公式计算包封率(encapsulation efficiency,EE)、载药量(drug loading,DL):


1.2.2载药工艺考察
1.2.2.1载药方法筛选
1.2.2.1.1直接溶解法 精密称取18 mg的HSG偶联物于西林瓶中,加蒸馏水3 mL溶解,加入PTX药物粉末10 mg,在磁力搅拌器上剧烈搅拌15 min,然后于冰浴下探头超声30 min后用蒸馏水透析过夜。透析袋中倒出胶束溶液,3 000 r/min离心15 min,上清液过0.8 μm滤膜过滤,即得PTX/HSG聚合物胶束溶液。
1.2.2.1.2乳化法 精密称取18 mg的HSG偶联物于西林瓶中,加蒸馏水3 mL溶解,逐滴滴加浓度为25 mg/mL的PTX的二氯甲烷溶液400 μL于上述载体溶液中,在磁力搅拌器上剧烈搅拌15 min,然后于冰浴下探头超声30 min后室温敞口搅拌过夜,胶束溶液3 000 r/min离心15 min,上清液过0.8 μm滤膜过滤,即得PTX/HSG聚合物胶束溶液。
1.2.2.1.3透析法 精密称取18 mg的HSG偶联物于西林瓶中,加蒸馏水3 mL溶解,逐滴滴加浓度为25 mg/mL的PTX的乙醇溶液400 μL于上述载体溶液中,在磁力搅拌器上剧烈搅拌15 min。然后于冰浴下探头超声30 min后用蒸馏水透析过夜。透析袋中倒出胶束溶液,3 000 r/min离心15 min,上清液过0.8 μm滤膜,即得PTX/HSG聚合物胶束溶液。
1.2.2.2药载比的筛选 通过1.2.2.1项实验,在得出最适合的载药方法的情况下,暂设载体浓度为6 mg/mL,超声时间为30 min,考察HSG∶PTX (w/w)比例分别1.8∶1,1.6∶1,1.3∶1,1∶1时HSG偶联物的载药情况,筛选出最佳药载比。
1.2.2.3载体浓度的影响 固定其他变量,考察不同载体浓度(4,6,8 mg/mL)对HSG偶联物増溶PTX的影响。
1.2.2.4超声时间的影响 固定其他变量,考察不同超声时间(20,30,40,50 min)对HSG偶联物载药能力的影响。
1.2.2.5优化条件的验证 按照优化后的处方工艺制备3批PTX/HSG载药胶束,以包封率、粒径等为指标验证载药工艺。
1.2.3形态学研究 取载药胶束溶液,滴至覆有碳支持膜的铜网上,停留2 min,以滤纸吸去多余溶液,滴加2%的磷钨酸溶液负染2 min,自然干燥,透射电镜(transmission electron micros cope,TEM)观察PTX/HSG载药胶束粒径大小及粒子形态。
1.2.4稳定性的考察 将PTX/HSG聚合物胶束溶液置4 ℃冰箱储存,10 d内测定其粒径、载药量与包封率,以包封率、粒径等为指标判断PTX/HSG聚合物胶束是否发生聚集。
2 结 果
2.1PTX检测波长的确定 通过紫外分光光度计波长扫描可得,PTX的最大吸收波长为227 nm,由此确定PTX醇的色谱检测波长为227 nm。
2.2标准曲线及线性范围 对不同浓度(C)的PTX溶液所得的峰面积(A)进行线性回归,得到回归标准曲线A=38 676C-1 387.5(r=0.999 9),结果表明,在0.5~20.0 μg/mL范围内线性良好,符合定量检测要求。
2.3回收率及精密度 高、中、低3个浓度水平的PTX样品的回收率与精密度良好,符合含量测定方法学要求(表1)。
2.4载药工艺的考察
2.4.1载药方法筛选 通过直溶法与乳化法制备的PTX/HSG胶束包封率低且粒径大,使用透析法制备的载药胶束具有较高的包封率而且粒径与多分散指数(polydispersity index,PI)小,因此透析法是更适合HSG偶联物载药的方法(表2)。
表1回收率与精密度实验结果
Tab1Recovery and precision of the experimental results
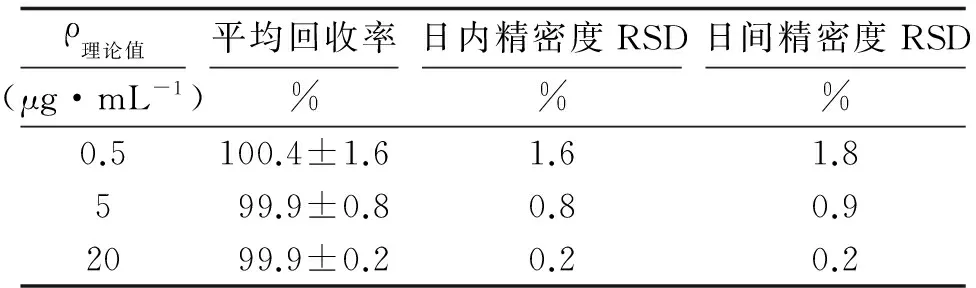
ρ理论值(μg·mL-1)平均回收率%日内精密度RSD%日间精密度RSD%0.5100.4±1.61.61.8599.9±0.80.80.92099.9±0.20.20.2
n=3. RSD:相对标准偏差.
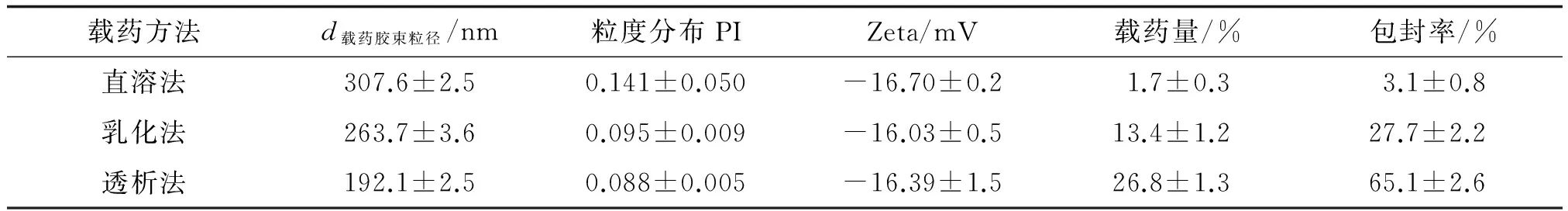
表2 不同载药方法对载药胶束粒径及包封率等的影响
n=3. PI:多分散指数;Zeta:Zeta电位.
2.4.2药载比的筛选 药载比PTX∶HSG由1∶1.8增至1∶1.3时,PTX投入量越多,载药胶束的载药量及包封率逐渐提高,而载药胶束粒径变化却不明显。但当药载比达1∶1时,载药量虽然仍在提高但包封率却在下降,而且此时的粒径也明显变大,说明HSG胶束对PTX的载药能力已经达到饱和。而药载比为1∶1.3时,载药胶束有较高的载药量与包封率。因此,综合以上数据可以得出:药载比PTX∶HSG=1∶1.3为最佳药载比(表3)。
2.4.3载体浓度的影响 载体浓度大小影响聚合物胶束的载药量、包封率及粒径。当载体浓度为6 mg/mL时,载药胶束的载药量及包封率显著优于其它浓度,且粒径较小,故选择6 mg/mL作为载药工艺中载体的浓度(表4)。
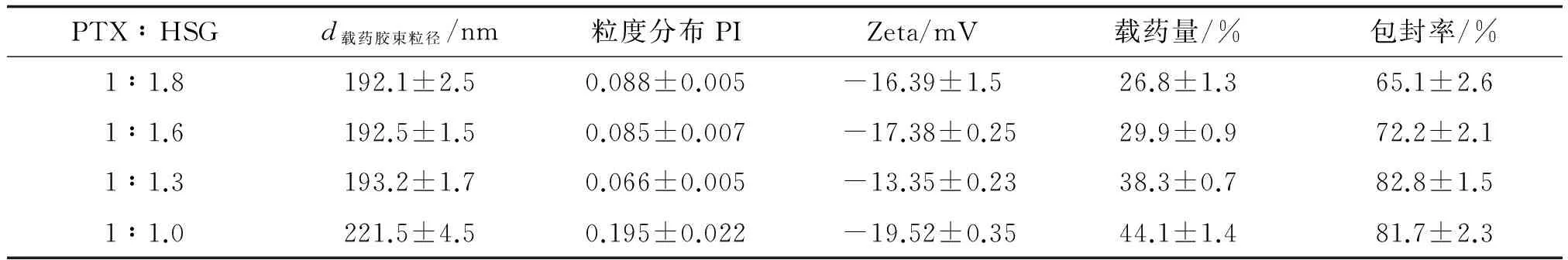
表3 不同药载比对载药胶束粒径及包封率等的影响
n=3. PTX:紫杉醇; HSG:透明质酸-甘草次酸; PI:多分散指数; Zeta:Zeta电位.
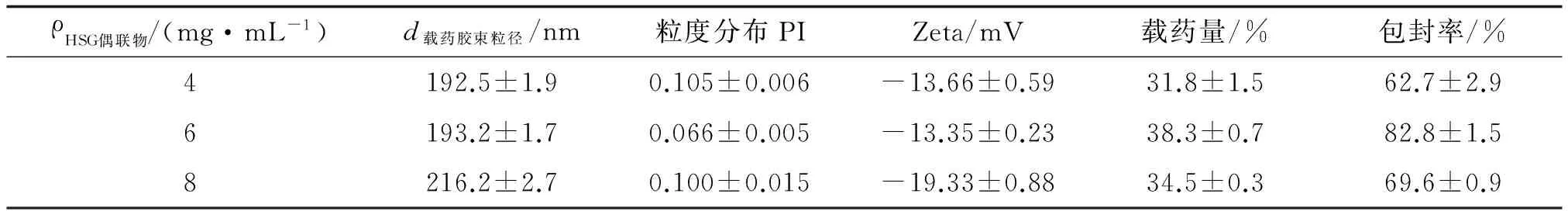
表4 不同载体浓度对载药胶束粒径及包封率等的影响
n=3. HSG:透明质酸-甘草次酸; PI:多分散指数; Zeta:Zeta电位.
2.4.4载药超声时间的影响 超声时间的长短对载药胶束的载药量与包封率影响并不大,但却能影响载药胶束的粒径。超声时间太短(20 min),载药粒径偏大。而超声时间达30 min,至此过后延长超声时间,粒径不再有太大变化。综合上述结果且为节省时间,最终选择载药超声时间为30 min(表5)。
2.4.5优化条件的验证 按照筛选出的最佳载药工艺制备3批PTX/HSG载药胶束(表6),平均载药量为(38.63±0.42)%,平均包封率为(83.19±1.23)%,平均粒径为(192.2±0.5)nm,重现性良好。

表5 不同载药超声时间对载药胶束粒径及包封率等的影响
n=3. PI:多分散指数;Zeta:Zeta电位.

表6 优化条件的验证结果
PI:多分散指数;Zeta:Zeta电位.
2.5形态学研究 TEM图可以看出,PTX/HSG载药胶束呈近球形,粒径在190 nm左右,粒径分布较均匀(图1)。

TEM:透取电镜.图1 PTX/HSG胶束TEM图Fig 1 TEM image of PTX/HSG micelles
2.6稳定性的考察 PTX/HSG聚合物胶束10 d内粒径略有增加,载药量与包封率有所降低,但未发生明显变化(表7),说明10 d内PTX/HSG聚合物胶束避光4 ℃条件下在水溶液中较稳定,胶束并未发生聚集。
3 讨 论
包封率和载药量是评价聚合物胶束制备工艺的重要指标。测定包封率的关键就是将被包封药物与游离药物分离,常用的有超滤法、透析法和反透析法等[10-11]。本研究采用离心(3 000 r/min,15 min)过膜(0.8 μm微孔滤膜)的方法来分离游离PTX。由于聚合物胶束将疏水性药物包封于其疏水内核,在测定包封药物时必须将药物完全释放出来。根据PTX和HSG载体的溶解特性,本研究采用甲醇作为破乳剂。
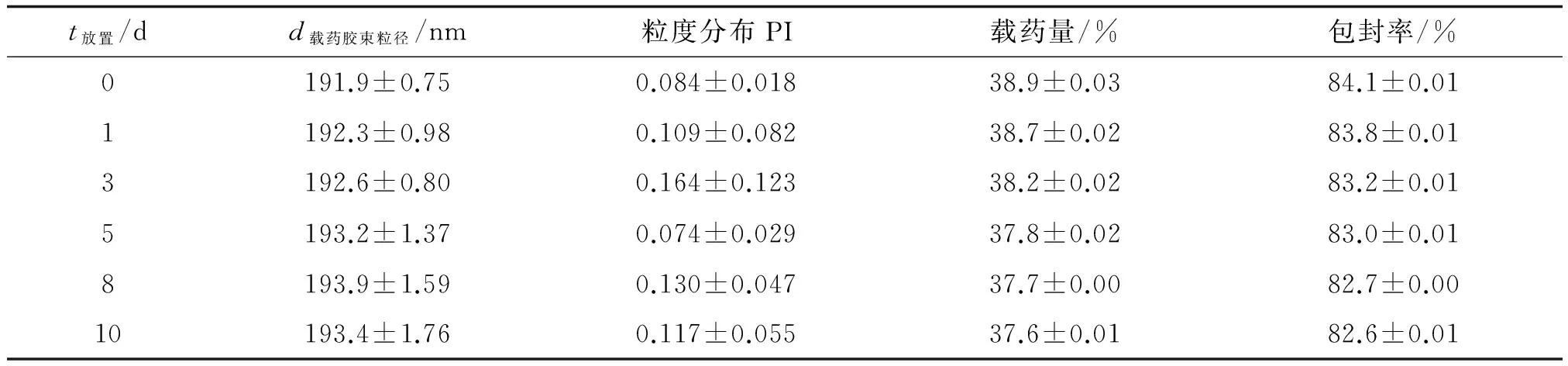
表7 PTX/HSG胶束的储存稳定性
PTX:紫杉醇; HSG:透明质酸-甘草次酸; PI:多分散指数;Zeta:Zeta电位; PI:多分散指数.
聚合物胶束的载药方法有很多,在实际应用过程中,应当根据药物以及聚合物的理化性质,以及制备胶束的特点等因素选择合适的制备方法。因为其他的制备方法如化学结合法与静电作用对载体及药物的要求比较多,这也大大限制了这两种方法的应用,故本研究在载药方法的筛选中只考虑物理法。
聚合物胶束在4 ℃的环境中短期储存较稳定,推测若长期在水性环境中保存,可能发生药物聚集、融合、药物渗漏等,导致药物稳定性变差、贮存期短,不能满足临床使用对药物制剂稳定性的要求,而将聚合物胶束制成冻干粉可有效解决此类问题,今后课题组将对冻干工艺进行研究。
[1] Ahn H K, Jung M, Sym S J,etal. A phase Ⅱ trial of CremorphorEL-free paclitaxel (Genexol-PM) and gemcitabine in patients with advanced non-small cell lung cancer[J].CancerChemotherPharmacol, 2014,74(2):277-282.
[2] Kumar A, Hoskins P J, Tinker A V. Dose-dense paclitaxel in advanced ovarian cancer[J].ClinicalOncology, 2015,27(1):40-47.
[3] 姚志伟,秦科宇,王宇翀,等.纳米紫杉类药物在乳腺癌治疗中的研究现状[J].现代生物医学进展,2016,16(21):4177-4180.
[4] Yao H, Ju R J, Wang X,etal. The antitumor efficacy of functional paclitaxel nanomicells in tranting resistant breast cancer by oral delivery[J].Biomaterials, 2011,32(12):3285-3302.
[5] Liu Z, Zhang F, Koh G Y,etal. Cytotoxic and antiangiogenic paclitaxel solubilized and permeation enhanced by natural product nanoparticles[J].AnticancerDrugs, 2015,26(2):167-179.
[6] Jain A, Jain S K, Ganesh N,etal. Design and development of ligand-appended polysaccharidic nanoparticles for the delivery of oxaliplatin in colorectal cancer[J].NanomedicineNanotechnologyBiology&Medicine, 2010,6(1):179-190.
[7] Jin M, Wu H J. Advancement on pharmacological action of glycyrrhetinic acid[J].MedicalRecapitulate, 2009,15(11):1712-1715.
[8] Negishi M, Irie A, Nagata N,etal. Specific binding of glycyrrhetinic acid to the rat liver membrane[J].BiochimBiophysActa, 1991,1066(1):77-82.
[9] 郭 华,杨承玲,王 蔚,等.基于海藻酸钠衍生物的肝靶向纳米前药的构建及抗肿瘤活性研究[J]. 高等学校化学学报,2014,35(8):1835-1842.
[10] 刘志红.多西他赛Pluronic P123胶束制剂的研究[D].济南:山东大学药学院,2012.
[11] 杨 涛,金大德,崔福德. 紫杉醇脂质体药物含量及包封率的测定[J].药物分析杂志,2008,28(2):231-234.

