新型丝素蛋白膜的结构和热分解动力学机理
于海洋 王 昉 刘其春 马青玉 顾正桂
(1南京师范大学分析测试中心,南京 210023;2南京师范大学化学与材料科学学院,南京 210023;3南京师范大学物理科学与技术学院,南京 210023)
新型丝素蛋白膜的结构和热分解动力学机理
于海洋1,2王 昉1,*刘其春1,2马青玉3顾正桂2,*
(1南京师范大学分析测试中心,南京 210023;2南京师范大学化学与材料科学学院,南京 210023;3南京师范大学物理科学与技术学院,南京 210023)
采用氯化钙-甲酸溶解新方法,制备了氯化钙含量分别为 1.50%(w,质量分数)和 3.00%(w)的新型丝素蛋白膜 SF-1.5 和 SF-3.0。运用傅里叶变换红外光谱技术和 X 射线衍射技术对样品的分子构象和结晶结构进行了表征。同时,利用热重技术对比研究了两种膜的热稳定性和热分解特性,依据 Kissinger、Ozawa 和Vyazovkin模型,考察了氯化钙含量对丝素蛋白膜热分解反应的热力学参数和动力学参数以及其机理函数的影响。结果表明,丝素蛋白膜 SF-1.5 中蛋白分子主要以 β-折叠结构为主,丝素蛋白膜 SF-3.0 中蛋白分子构象主要以无规卷曲为主;SF-3.0 膜在不同升温速率下的分解温度、活化能和活化焓均低于 SF-1.5 膜,SF-1.5 膜 的 热 稳 定 性 优 于 SF-3.0 膜 。 另 外 , 利 用 Achar法 和 Coats-Redfern 法 研 究 发 现 : 丝 素 蛋 白 膜 在190.00-330.00 °C 的热分解过程遵循二维扩散(圆柱形对称)机理。
丝素蛋白;热分解机理;热力学;热重;傅里叶变换红外光谱
Key Words:Silk fibroin;Thermal decomposition mechanism;Thermodynamics;Thermogravimetry; Fourier transform infrared spectroscopy
1 引言
蚕丝作为一种天然生物高分子材料,具有很好的生物相容性、生物降解性和优良的机械性能1-4。因而,近年来,人们对蚕丝进行了大量的研究,期待其实际应用可以由传统的纺织品逐渐向电子、光学和生物医用等产品延伸5,6,例如有机薄膜晶体管7、组织工程支架8和生物传感器9等。
天然蚕丝的主要成分是丝素蛋白,再生丝素蛋白材料是由蚕丝经脱胶、溶解,再经过冷冻干燥、自然干燥或者通过静电纺丝等工序而制成的10-12,然而再生丝素蛋白材料性能的优劣,在很大程度上受到制备工艺的影响13。传统的制备方法是通过无机盐水溶液、磷酸溶液或离子液体制备14,15,但制备出的丝素蛋白溶液不够稳定,会有蛋白沉淀析出,且其性能表现不佳,而且需要较长时间才可以制得16,17,我们根据这一方法已制备出了水溶性丝素蛋白膜18。最近有研究发现19:用氯化钙-甲酸体系不仅能有效解决上述难题,还能够制备出力学性能优越且不溶于水以及具有纳米纤维的丝素蛋白膜。本文也开展了这方面研究并发现:这种新方法与传统方法制备相比,制备简单易操作,可以调控材料在水中的溶解特性,制备不同结构的丝素材料,从而应用于生物医药20、食品21和化妆品22等不同领域23。
目前,人们对丝素蛋白结构和力学性能的研究较多1-4,但对丝素蛋白热稳定性的研究却很少,特别是丝素蛋白的热力学和热分解反应动力学的研究。众所周知,热分析技术是研究固体材料的一种有效手段,通过它可以评估材料的热稳定性,包括热分解温度、热降解速率和老化时间等特性24,同时也可以进行热力学和热分解动力学研究25-27。靳成伟等28采用热重-差示扫描量热-傅里叶变换红外(TG-DSC-FTIR)联用技术,对配合物的热分解过程进行了研究,发现两种配合物具有良好的热稳定性,在热分解过程中中性配体较酸性优先失去,同时伴随着气态的有机分子以及CO2、CO、H2O等小分子的逸出,此外还通过热力学方程,计算得到配合物的舒平摩尔热容和热力学函数值。Sreeram 等29通过等温热重量分析法对聚对苯乙烯撑共轭聚合物膜进行反应动力学研究。结果发现,聚对苯氯乙烯脱氯化氢作用的活化能显著低于聚氯乙烯发生脱氯化氢作用所需的活化能,所以后者可以在更低的温度下发生脱除氯化氢反应。何甜等24在溶剂热条件下合成了三个具有不同穿插结构的配合物1、2和3,分别具有三种Z字链、[2+2]型的四重穿插结构和双核结构单元的三重穿插结构。他们又利用热重/微分热重和差示扫描量热技术研究了这三种配合物的热分解过程,通过 Kissinger和 Ozawa-Doyle法对这三种配合物的分解过程进行了热动力学分析,得出试样的反应速率关系,并认为具有特殊的[2+2]型四重穿插结构的配合物稳定性最好。
此外,由于国内对中国家蚕丝的研究比较多,所以本文选用了不同于中国家蚕丝的泰国家蚕丝作为研究对象。虽然它们都来自于桑科的家蚕丝,但由于地域和生长环境不同,具有不一样的体貌和特性。我们已做了前期研究,并发表了相关论文18。
因此,本文采用氯化钙-甲酸体系制备来自于泰国家蚕丝的不同氯化钙浓度的丝素膜,利用热重(TG)技术分析了丝素蛋白膜的热稳定性和热 分 解 过 程 , 并 采 用 Kissinger法 、 Ozawa 法 和Vyazovkin法分别计算了丝素膜热分解过程的动力学参数和热力学参数。同时,运用傅里叶变换红外(FTIR)光谱技术和 X 射线衍射(XRD)技术,对样品的分子构象和结晶结构进行了表征,探讨其热稳定性机理和氯化钙浓度对膜热分解过程的热力学和动力学参数的影响。此外,还利用 Achar法(微分法)和 Coats-Redfern 法(积分法)进行热分解最可几机理函数的判定。总之,本研究能够有助于人们对丝素蛋白膜热变性和稳定性以及热分解机理的了解30,31,为丝素蛋白材料及其复合材料的合成研究与实际生产工艺路线的选择提供有益信息,对促进绿色天然材料的实际利用具有重要的理论与实践意义。
2 实验部分
2.1 试 剂
泰国家蚕丝(泰国Nakornratchasima皇后养蚕中心,美国 Rowan 大学 Xiao Hu 教授实验室提供);无水氯化钙(96.00%AR 纯度),甲酸(88.00%AR 纯度),丙酮(99.50%AR 纯度),广东汕头市西陇化工厂。
2.2 材料制备
量 取 2.00 L 去 离 子 水 , 加 热 至 沸 腾 , 加 入4.24 g NaHCO3,待其完全溶解后,再将 5.00 g 家蚕 丝 放 入 其 中 , 于 100.00 °C 搅 拌 处 理 30.0 min。取出脱胶后的蚕丝,用去离子水充分洗涤,重复洗涤三次,放在通风处干燥。以无水氯化钙为溶质,甲酸为溶剂,分别配置成 1.50%(w,质量分数)和 3.00%(w)浓度的氯化钙-甲酸溶液,然后称取一定等质量的脱胶蚕丝,分别溶解到这两种不同浓度的氯化钙溶液中,配置成 8.00%(w)的丝素蛋白溶液。再将丝素蛋白溶液过滤、最后浇铸成膜。将膜放入去离子水中漂洗2-3次,取出后再自然风 干 , 即 可 以 得 到 由 氯 化 钙 浓 度 为 1.50%(w)和3.00%(w)的氯化钙-甲酸溶液制成的两种丝素蛋白膜 SF-1.5 和 SF-3.0。
2.3 实验仪器和测试条件
FTIR 测定:采用美国 Thermo Nicolet公司下的NEXUS-670 型 FTIR 光谱仪,将样品直接放在 Ge晶体上,旋转OMNI采样器固定钮,压住样品,利用单反射ATR-OMNI采样器进行信号收集,在分辨 率 为 4 cm-1, 扫 描 次 数 为 32 次 , 光 谱 范 围 为1750-1450 cm-1进 行 红 外 光 谱 测 定 ;XRD 测 定 :日本理学 公 司 生 产 的 D/max2500/pc 型 X 射线衍射仪 使 用 Cu Kα辐 射 ,在 管压 40 kV, 管流 200 mA,衍射角 2θ 范围为:5°-50°,扫描速率 5(°)·min-1条件下进行测试;TG 测定:利用美国 PerkinElmer公司生产的 Pyris 1 TGA 热重分析仪在 N2气氛作为保护气,氮气流速为 50 mL·min-1的情况下,分别以 2、5、10 和 15 °C·min-1的升温速率将样品由室温加热到 600.00 °C。
3 结果与讨论
3.1 丝素蛋白膜的红外结构分析
红外光谱的酰胺谱带可分为酰胺A和B、酰胺I、II、III、IV、V、VI、VII32。但根据红外光谱自身特点,一般研究酰胺I区(对应的是C=O伸缩振动和 C―N 伸缩振动)和酰胺 II区(对应的是 C―N 伸缩振 动 和 N―H 变形振 动)33。图 1 是 SF-1.5 和 SF-3.0 两种丝素蛋白膜的 FTIR 谱图。由图 1a可知 SF-1.5 的特征吸收峰位在 1625 cm-1(酰胺 I区)和 1522 cm-1(酰胺 II区);图 1b 中 SF-3.0 的特征吸收峰位在1645 cm-1(酰胺 I区)和 1534 cm-1(酰胺 II区)。从图1 中可以看出,SF-3.0 在酰胺 I区的 1625 cm-1处和酰 胺 II区 的 1522 cm-1处 的 特 征 吸 收 峰 均 不 明 显 ,然而其对应的特征吸收峰位却在酰胺 I区1645 cm-1和酰胺 II区 1534 cm-1出现新的特征吸收峰。有研究表明34,35:红外特征吸收峰在 1625 和 1522 cm-1处的都归属于 β-折叠结构,1645 和 1534 cm-1处的吸收峰都归属于无规卷曲结构。由此可以认为 SF-1.5中主要以 β 折叠为主,SF-3.0 中主要以无规卷曲为主。
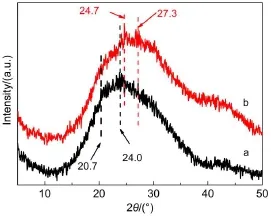
图2 两种丝素蛋白膜的X射线衍射谱图Fig.2 X-ray diffraction(XRD)patterns of two silk fibroin films a:SF-1.5;b:SF-3.0
3.2 丝素蛋白膜的X射线衍射分析
图2 是 SF-1.5 和 SF-3.0 的 XRD 谱图。一般认为,丝素蛋白有两种结晶结构,即 silk I和 silk II结构。silk I结构的主要构象是 α-螺旋,其对应的衍射角 2θ 在 12.2°、28.2°、24.7°和 27.9°附近,silk II结构(主要构象是 β-折叠)的主要衍射峰位在 18.9°、20.7°和 24.0°附近36,37。从谱图上分析得出:SF-1.5中在宽衍射峰中有两个小衍射峰,分别在 20.7°和24.0°,根据衍射峰位的判断,这个蚕丝膜中含有一定量的 silk II结构(β-折叠结构);SF-3.0 的宽衍射峰中也同样出现两个小衍射峰,但与 SF-1.5 的相比,其衍射峰都向高位偏移,并且其对应的衍射峰位分别在 24.7°和 27.3°,这两处的衍射峰归属于silk I结 构 。 由 此 可 见 ,SF-3.0 内 的 silk II结 构 向silk I结构转变,且 silk II结晶含量较 SF-1.5 的要少。这一现象表明较高的氯化钙浓度可能会破坏丝素蛋白分子链间的氢键38,使其 silk II含量降低。
我们将蚕丝膜的XRD谱图进行高斯函数拟合,其拟合结果如图3所示。用同样的方法对FTIR谱图进行拟合,并将两种谱图拟合后的β-折叠含量列于表 1。从表 1 看出:XRD 与 FTIR 拟合结果很接近,说明这两种分析手段可以相互补充,互为印证,并且根据其拟合后的结果来看,进一步验证了 SF-3.0 中β-折叠含量要比 SF-1.5 的要低。
3.3 丝素蛋白膜的热分解过程
由图4可知,丝素蛋白膜材料存在两个失重阶段:第一阶段的失重台阶是在 190.00 °C 之前,这主要是一些自由水和低沸点化合物39,失重量约为1%;第二阶段失重是从 190.00 °C 开始,同时丝素蛋白膜在 278.00 °C 左右达到最大分解速率,并且在 600.00 °C 总失重量可达 60%左右,这一阶段可以认为是丝素蛋白膜中丝素蛋白分子间侧链和主链遭到破坏引起的分解失重40。

表1 两种丝素蛋白膜的FTIR和XRD的拟合结果Table 1 Fitting results of two kinds of silk fibroin films by FTIR and XRD

图4 两种丝素蛋白膜在 10 °C·min-1的 TG 和 DTG 曲线Fig.4 TG and DTG curves of two silk fibroin films at a heating rate(β)of 10 °C·min-1
从图 4A 中可以看出,SF-1.5 的起始分解温度比 SF-3.0高,这可能是由于高浓度的钙离子对丝素蛋白分子间的氢键破坏程度更大,使其 silk II(β-折叠)含量减小(表 1),导致其分子链段更加无序化,非晶化程度增大,从而使得膜的分解温度降低,热稳定性下降41。从图 4B 的微分热重(DTG)曲线看出在 190.00 °C 之前两条曲线变化趋势一致,随着温度继续升高,SF-3.0 率先开始分解,且起始分解温度较 SF-1.5 低 10.00 °C 左右,最大分解速率温度也比 SF-1.5 的低,这一现象与 TG 曲线的热分解起始温度情况相一致。
3.4 丝素蛋白膜的热分解动力学参数测定
从 TG 和 DTG 曲线(图 5)中可以获得不同升温速率(2、5、10 和 15 °C·min-1)下 SF-1.5 和 SF-3.0 的热分解动力学基础数据,列于表 2。王亚明等42指出高分子链的运动与升温速率有关,当升温速率提高时,分子链段运动的松弛时间滞后于实验观察时间,会产生热滞后效应。本实验也遵循这样的规律。从表2中可以看出,丝素膜起始分解温度和丝素蛋白膜的最大分解速率温度,即失重反应所对应的特征温度均随着升温速率的提高向高温方向偏移43,但不影响总失重量44。我们将对丝素蛋白膜第二阶段(190.00-500.00 °C)的热分解反应进行动力学探究,揭示其老化时间、热稳定性及反应机理等,为丝素蛋白膜在不同应用领域上的研究提供更多有用信息。
从图5B和5D中看出,大约从起始分解温度(Onset温度)250.00 °C 开始,丝素蛋白膜的分子骨架断裂,试样开始发生大规模分解反应,分解速率逐渐增大,两种试样的最大失重速率所对应的温度不超过 310.00 °C。之后,分解速率开始逐渐减小。其中,SF-1.5 试样的 DTG 主峰中含有一小肩峰(约 330.00-500.00 °C),我们认为这个过程是独 立 于 最 大 分 解 速 率 (190.00 - 330.00 °C)那 部 分的。因此,本文运用TG-DTG技术,采用三种方法 Ozawa 法、Kissinger法和 Vyazovkin 法44,45分别对丝 素 蛋 白 膜 在 190.00 - 330.00 °C 和 330.00 -500.00 °C 这 两 个 分解过程进行 了 动 力 学参数(活化能 E 和指前因子的自然对数 lnA)计算,其过程如下。

图5 两种丝素蛋白膜在不同升温速率下的TG和DTG曲线Fig.5 TG and DTG curves of two silk fibroin films at different heating rates
将表 2 中数据代入(1)、(2)和(3)式中进行线性回归拟合,求得其相应的活化能Eα。


表2 不同升温速率下两种丝素蛋白膜的热分解温度Table 2 Thermal decomposition temperatures of two kinds of silk fibroin films at different heating rates

其 中 ,β为 升 温 速 率 (K · min-1);A为 指 前 因 子(s-1);Eα为 转 化 率α下 对 应 的 活 化 能(kJ·mol-1);g(α)为分解反应的积分函数;R为理想气体常数(8.31 J·K-1·mol-1);Tp为最大失重速率对应的温度(K);Tα为转化率α下对应的温度(K)。

表3 不同转化率下两种丝素蛋白膜的动力学参数aTable 3 Kinetic parameters of two kinds of silk fibroin films at different conversionsa
综合以上拟合结果,将其计算结果列于表3和表4。由表3中看出,Ozawa法和Vyazovkin法计算SF-1.5 的活化能分别为 189.81 和 190.31 kJ·mol-1,SF-3.0 的活化能分别 174.88 和 173.85 kJ·mol-1,这两种方法计算的活化能数值很接近,Kissinger法计 算 SF-1.5 和 SF-3.0 的 活 化 能 分 别 是 189.55 和174.84 kJ·mol-1,从数值上我们发现:Ozawa 法和Vyazovkin 法与 Kissinger法计算结果均非常接近。说明通过这三种方法所得到的丝素蛋白膜的热分解活化能较为准确可信。为了得到更加准确的活化能,我们分别将 SF-1.5 和 SF-3.0 下三种方法所得的活化能取平 均值,即 SF-1.5 的平均活化 能E¯为189.89 kJ·mol-1,ln(A/s-1)为 39.47,SF-3.0 的平均活 化 能E¯为 174.52 kJ·mol-1,ln(A/s-1)为 36.38。根据两种膜的动力学计算结果来看,SF-3.0 的平均反应活化能E¯要低于 SF-1.5,众所周知,反应活化能越低,表明反应活性就越强,分解反应就越容易发生,因此 SF-3.0的膜就越易发生分解,这与丝素蛋白膜TG分析的结论(图4)相一致。
另 外 , 从 表 4 中 我 们 发 现 , 用 Ozawa 法 和Vyazovkin 法 这 两 种 方 法 计 算 SF-1.5 和 SF-3.0 在330.00-500.00 °C 区间的活化能与 Kissinger法计算的活化能差异较大,且这两种方法计算的活化能随着转化率的增大均呈现出先增大后减小的变化趋势,变化较大。有研究表明46:这种分解过程较为复杂,并且可以认为此分解是多步反应过程,同时,DTG 曲线(图 5(B,D))上的多个微小峰也证实本试样的分解过程存在多步速率。因此,下面本文着重对 190.00-330.00 °C 范围内的分解过程进行热动力学研究。

表4 不同转化率下两种丝素蛋白膜的动力学参数aTable 4 Kinetic parameters of two kinds of silk fibroin films at different conversionsa

表5 两种丝素蛋白膜的热力学参数aTable 5 Thermodynamic data of two kinds of silk fibroin filmsa
表6 两种丝素蛋白膜的热分解动力学基础数据aTable 6 Kinetics of thermal decomposition based data of two kinds of silk fibroin filmsa
3.5 丝素蛋白膜热分解热力学参数测定
通过将表3中计算的活化能、指前因子代入到式(4)-(6)24,进行求解热力学参数活化焓、熵以及吉布斯自由能,并将结果列于表5。
表7 SF-1.5 的热分解微分法和积分法计算结果aTable 7 Results of SF-1.5 thermal decomposition in differential method and integral methoda


式中,ΔG≠为活化吉布斯自由能,ΔH≠为活化焓 ,ΔS≠为活化熵,h 为普朗克常数(6.63 × 10-34J·s-1),R 为气体常数(8.31 J·mol-1·K-1),kB为玻尔兹曼常数(1.38 × 10-23J·K-1),T 为绝对温度(K)。

表8 SF-3.0的热分解微分法和积分法计算结果aTable 8 Results of SF-3.0 decomposition in differential method and integral methoda
从表5中看出,ΔG≠>0表明丝素蛋白膜的分解过程并不是自发进行的,需要外界提供能量才会发生热分解。表 5 中 SF-1.5 和 SF-3.0 这些热力学参数都为正值,说明 SF-1.5 和 SF-3.0 分解过程需要吸收一定的能量(ΔG≠> 0),在 SF 分解过程中非共价键的断裂(ΔH≠> 0),及 SF 结构的打开增加了体系的无序性(ΔS≠> 0)47。但我们发现 SF-3.0 不同升温速率所对应的 ΔG≠和 ΔH≠都比 SF-1.5 的要小,说明 SF-3.0 较易发生分解行为,SF-3.0 中的非共价键数量较 SF-1.5 要少,换句话说,较高浓度的钙离子对丝素蛋白分子链段间的非共价键(氢键)破坏程度较大,使得其链段无序程度增大,即 SF-3.0 较 SF-1.5 的结晶程度要低,这一结 果与 FTIR 和 XRD 分析结果相一致。此外,由于反应速率受活化能的影响:活化能越大,分解反应速率越慢48。从表 3中 看 出 SF-1.5 的 平 均 活 化 能 E¯比 SF-3.0 大 , 所 以SF-1.5 的热分解反应速率较 SF-3.0 要缓慢,SF-1.5样品的热稳定性比 SF-3.0要好。
3.6 丝素蛋白膜的等温失重时间比较49

通过式(7)可计算任意温度 TH下达到某一失重量 所 需 的 时 间 t。 式 中 : β(升 温 速 率)为 15 °C· min-1,T 在 β 升温速率下达到某失重量时所对应的温度。经计算,SF-3.0 在 190.00 °C 下失重 0.50%所需时间为 52.6 s左右,而 SF-1.5 在 190.00 °C 下失重0.50% 所 需 时 间 则 大 约 需 要 5.5 s。 说 明 SF-1.5 较SF-3.0 有更很好的热稳定性。
3.7 丝素蛋白膜的热分解最可几机理函数判定
本研究中采用 Achar和 Coats-Redfern 两种方法对 SF-1.5 进行热分解机理推测,Achar法和 Coats-Redfern 法分别如下50:

其中,dα/dt为分解反应速率;f(α)为微分形式机理函数;g(α)为积分形式机理函数;β 为升温速率(K· min-1);lnA 为指前因子的自然对数;Eα为转化率 α下对应的活化能(kJ·mol-1);R 为理想气体常数(8.31 J·K-1·mol-1);Tα为转化率 α 下对应的温度(K)。
将 TG 和 DTG 曲线(图 5)中 15 °C·min-1升温速率下 SF-1.5 和 SF-3.0 的不同转化率所对应动力学基础数据列于表 6。将表 6 数据分别代入式(8)和(9)中,再进行线性拟合,求出不同机理函数所对应的动力学参数,如 Eα、lnA 和 r(表 7 和表 8)。
根据文献51:(a)Eα和 lnA 符合热分解反应的一般规律(Eα值在 80.00-250.00 kJ·mol-1,ln(A/s-1)在16.12-69.08);(b) 相关系 数 r > 0.990;(c) 由微分和积分两种方法所得平均 lnA 值与 Kissinger中所测的 lnA 值最 为接近;(d) 由微 分和积分两种 方法所得活化能的平均值与 Ozawa法得到的平均活化能最为接近。如果同时满足以上四个条件,那么所对应的机理函数即为热分解反应最可几机理函数52。
比较表 7 中的 Eα、lnA 和 r,可以看出只有函数序号为18的机理函数同时满足上述4个条件,因此SF-1.5的热分解反应的机理函数为:
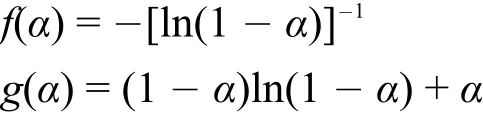
采用与 3.7 节中相同的方法,计算 SF-3.0 在 190-330 °C分解阶段的动力学所对应的动力学参数,求得 Eα、lnA 以及 r见表 8。通过与上述判定机理函数的4点要求相比较,结果发现,也只有18号的机理函数最合适。故其最可几机理函数仍然为:
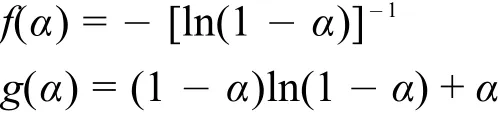
结果表明,SF-1.5 与 SF-3.0 都遵循二维扩散机制(圆柱形对称),符合 Valensi方程53。
4 结论
(1)利用氯化钙-甲酸溶液制备了两种新型丝素蛋白膜(SF-1.5 和 SF-3.0),通过 FTIR 和 XRD 表征及拟合结果发现:SF-1.5 中主要以 silk II(β-折叠)结构为主,而 SF-3.0 中主要是 silk I(α-螺旋或无规则线团)结构。
(2) 根据 TG 和 DTG 曲 线得出:SF-1.5 的起始分解温度和最大分解速率温度都比 SF-3.0 高。此外,随着升温速率的增大,SF-1.5 和 SF-3.0 在不同升温速率下的分解温度都增大,但其最终残余量是基本一致。
(3)分别运用 Kissinger、Ozawa和 Vyazovkin 方法对 SF-1.5 和 SF-3.0 进行线性回归拟合求解其活化能,结果发现:在 190.00-330.00 °C 温度区间,这三种方法求得的活化能相差不大,说明通过这三种方法所得到的丝素蛋白的热分解活化能较为准确可信,SF-1.5 和 SF-3.0 的平均活化能(E¯)分别为189.89 和 174.52 kJ·mol-1。而 330.00-500.00 °C 之间的分解过程存在多步反应过程。根据DTG曲线上最大的峰值温度计算出热力学参数(ΔH≠,ΔG≠, ΔS≠)。ΔG≠> 0 表明丝素蛋白膜的分解过程并不是自发进行的。同时,SF-3.0 不同升温速率所对应的ΔG≠和 ΔH≠值都比 SF-1.5 的要小,可见 SF-3.0 更容易发生热分解行为。此外,通过对两种膜的等温失 重 时 间 计 算 发 现 , SF-3.0 在 190.00 °C 下 失 重0.50%所需时间为 5.5 s左右,而 SF-1.5 在 190.00 °C下失重 0.50%所需时间则大约需要 52.6 s,说明 SF-1.5 较 SF-3.0 有更很好的热稳定性。
(4) 采 用 Achar和 Coats-Redfern 两 种 方 法 分 别对 SF-1.5 和 SF-3.0 在 190.00-330.00 °C 间的热分解进行机理推测,发现它们的热分解最可几机理函数 均为f(α)= - [ln(1 -α)]-1(微 分 形 式)和g(α)= (1 -α)ln(1 -α)+α(积分形式),并且都遵循二维扩散机制(圆柱形对称),都符合 Valensi方程。
(1)Nuanchai,K.;Prasong,S.;Wilaiwan,S.Biotechnology2009,8(4),468.doi:10.3923/biotech.2009.468.472
(2)Yu,S.;Yang,W.;Chen,S.;Chen,M.;Liu,Y.;Shao,Z.;Chen, X.RSC Adv.2014,4(35),18171.doi:10.1039/C4RA02113D
(3)Chen,M.;Shao,Z.;Chen,X.J.Biomed.Mater.Res.Part A2012,100(1),203.doi:10.1002/jbm.a.33265
(4)Koh,L.D.;Cheng,Y.;Teng,C.P.;Khina,Y.W.;Loha,X.J.; Teea,S.Y.;Lowa,M.;Ye,E.;Yua,H.D.;Zhang,Y.W.;Han,M. Y.Prog.Polym.Sci.2015,46,86.doi:10.1016/j. progpolymsci.2015.02.001
(5)Capelli,R.;Amsden,J.J.;Generali,G.;Toffanin,S.;Benfenati, V.;Muccini,M.;Kaplan,D.L.;Omenetto,F.G.;Zamboni,R.Org.Electron.2011,12,1146.doi:10.1016/j.orgel.2011.04.005
(6)Pereira,R.F.P.;Silva,M.M.;Bermudez,V.D.Z.Macromol. Mater.Eng.2014,300(12),1171.doi:10.1002/ mame.201400276
(7)Wang,C.H.;Hsieh,C.Y.;Hwang,J.C.Adv.Mater.2011,23, 1630.doi:10.1002/adma.201004071
(8)Okamoto,M.;John,B.Prog.Polym.Sci.2013,38(10-11), 1487.doi:10.1016/j.progpolymsci.2013.06.001
(9)Muller,C.;Hamedi,M.;Karlsson,R.;Jansson,R.;Marcilla,R.; Hedhammar,M.;Inganas,O.Adv.Mater.2011,23,898. doi:10.1002/adma.201003601
(10)Byette,F.;Bouchard,F.;Pellerin,C.;Paquin,J.;Marcotte,I.; Mateescu,M.A.Polym.Bull.2011,67(1),159.doi:10.1007/ s00289-010-0438-z
(11)Zhou,J.;Zhang,B.;Shi,L.J.;Zhong,J.;Zhu,J.;Yan,J.;Wang, P.;Cao,C.B.;He,D.ACS Appl.Mater.Interfaces2014,6(24), 21813.doi:10.1021/am502278b
(12)Zhao,H.;Ren,X.;Zhang,Y.;Huang,L.Bio-Med.Mater.Eng.2015,26(Suppl.1),89.doi:10.3233/BME-151293
(13)Zhang,F.;Lu,Q.;Yue,X.X.;Zuo,B.Q.;Qin,M.D.;Li,F.; Kaplan,D.L.;Zhang,X.G.Acta Biomaterialia2014,12,139. doi:10.1016/j.actbio.2014.09.045
(14)Matsumoto,K.;Uejima,H.;Iwasaki,T.;Sano,Y.;Sumino,H.J. Appl.Polym.Sci.1996,60,503.doi:10.1002/(SICI)1097
(15)Zhang,C.;Song,D.;Lu,Q.;Hu,X.;Kaplan,D.L.;Zhu,H.Biomacromolecues2012,13,2148.doi:10.1021/bm300541g
(16)Qiang,L.;Xiao,H.;Wang,X.;Kluge,J.A.;Lu,S.;Cebe,P.; Kaplan,D.L.Acta Biomaterialia2010,6(4),1380. doi:10.1016/j.actbio.2009.10.041
(17)Rockwood,D.N.;Preda,R.C.;Yücel,T.;Wang,X.;Lovett,M. L.;Kaplan,D.L.Nat.Protoc.2011,6,1612.doi:10.1038/ nprot.2011.379
(18)Wang,F.;Wolf,N.;Rocks,E.M.;Vuong,T.;Hu,X.J.Therm. Anal.Calorim.2015,122(3),1069.doi:10.1007/s10973-015-4736-4
(19)Zhang,F.;You,X.;Dou,H.;Liu,Z.;Zuo,B.Q.;Zhang,X.G.ACS Appl.Mater.Inter.2015,7(5),3352.doi:10.1021/ am508319h
(20)Okhawilai,M.;Rangkupan,R.;Kanokpanont,S.; Damrongsakkul,S.Int.J.Biol.Macromol.2010,46(5),544. doi:10.1016/j.ijbiomac.2010.02.008
(21)Wu,M.H.;Zhu,L.;Zhou,Z.Z.;Zhang,Y.Q.J.Nanopart.2013,2013,1.doi:10.1155/2013/901401
(22)Chen,F.S.;Ye,C.J.;Yao,Z.J.Natural Product Research and Development2013,No.25,388.[陈复生,叶崇军,魏兆军 .天然产物的研究与开发,2013,No.25,388.]doi:10.3969/j. issn.1001-6880.2013.03.024
(23)Oshkovr,S.A.;Eshkoor,R.A.;Taher,S.T.;Ariffin,A.K.; Azhari,C.H.Compos.Struct.2012,94(8),2337.doi:10.1016/j. compstruct.2012.03.031
(24)He,T.;Yue,K.F.;Chen,S.P.;Zhou,C.S.;Yan,N.Acta Phys.-Chim.Sin.2016,32(6),1397.[何 甜,岳可芬,陈三平,周春生,晏 妮 .物理化学学报,2016,32(6),1397.] doi:10.3866/PKU.WHXB201603102
(25)Zheng,L.;Fan,B.H.;Pu,X.X.;Pan,Y.;Dong,J.X.;Guan,W.Acta Phys.-Chim.Sin.2015,31(11),2036.[郑 玲,樊本汉,卜晓雪,潘 懿,董家新,关 伟.物理化学学报,2015,31(11), 2036.]doi:10.3866/PKU.WHXB201509111
(26)Li,J.;Chen,L.Z.;Wang,J.L.;Lan,G.C.;Hou,H.;Li,M.Acta Phys.-Chim.Sin.2015,31(11),2049.[李 静,陈丽珍,王建龙,兰贯超,侯 欢,李 满.物理化学学报,2015,31(11), 2049.]doi:10.3866/PKU.WHXB201510092
(27)Huo,J.X.;Song,S.W.;Jin,C.W.;Ren,N.;Geng,L.N.; Zhang,J.J.Acta Phys.-Chim.Sin.2016,32(4),901.[霍建霞,宋素伟,靳成伟,任 宁,耿丽娜,张建军.物理化学学报,2016,32(4),901.]doi:10.3866/PKU.WHXB201602173
(28)Jin,C.W.;Wang,Y.;Su,S.L.;Zhang,J.J.Acta Phys.-Chim. Sin.2016,32(9),2232.[靳成伟,王 叶,宿素玲,张建军.物理化学学报,2016,32(9),2232.]doi:10.3866/PKU. WHXB201605263
(29)Sreeram,A.;Patel,N.G.;Venkatanarayanan,R.I.;DeLuca,S. J.;Yuyab,P.A.;Krishnan,S.Polym.Test.2014,37(8),170. doi:10.1016/j.polymertesting.2014.04.012
(30)Yang,Z.;He,Y.H.Acta Phys.-Chim.Sin.2016,32(4),921. [杨 镇,何远航 .物理化学学报,2016,32(4),921.] doi:10.3866/PKU.WHXB201512251
(31)Xiong,W.H.;Zhang,W.C.;Yu,C.P.;Shen,R.Q.;Cheng,J.; Ye,J.H.;Qin,Z.C.Acta Phys.-Chim.Sin.2016,32(8),2093.[熊文慧,张文超,俞春培,沈瑞琪,程 佳,叶家海,秦志春.物理化学学报,2016,32(8),2093.]doi:10.3866/PKU. WHXB201605121
(32)Zhou,W.;Chen,X.;Shao,Z.Z.Prog.Chem.2006,18(11), 1514.[周 文,陈 新,邵正中 .化学进展,2006,18(11), 1514.]doi:10.3321/j.issn:1005-281X.2006.11.014
(33)Tao,Y.Z.;Yan,Y.;Xu,W.L.;Zhou,W.H.Acta Polym.Sin.2010,No.1,27.[陶咏真,鄢 芸,徐卫林,周文慧.高分子学报,2010,No.1,27.]
(34)Xie,M.X.;Liu,Y.Chem.J.Chin.Univ.2003,24(2),226.[谢孟峡,刘 媛 .高等学校化学学报,2003,24(2),226.] doi:10.3321/j.issn:0251-0790.2003.02.007
(35)Paquet-Mercier,F.;Lefèvre,T.;Auger,M.;Pézolet,M.Soft Matter2012,9(9),208.doi:10.1039/C2SM26657A
(36)Liu,T.Preparation and Characterization of Silk Fibroin-based Scaffolds with Nanofibrous Structure.Ph.D.Dissertation, Soochow University:Suzhou,2012.[刘 涛 .具备纳米结构特征SF基支架的构建及其结构性能研究[D].苏州:苏州大学, 2012.]
(37)Minoura,N.;Aiba,S.I.;Higuchi,M.;Gotoh,Y.;Tsukada,M.; Imai,Y.Biochem.Biophys.Res.Commun.1995,208(2),511. doi:10.1006/bbrc.1995.1368
(38)Cheng,X.;He,Q.J.;Zhang,A.M.Spectrosc.Spect.Anal.2004,24(3),295.[成 煦,何其佳,张爱民.光谱学与光谱分析,2004,24(3),295.]doi:10.3321/j.issn:1000-0593.2004.03.011
(39)Wang,J.;Yu,F.;Qu,L.;Meng,X.;Wen,G.Biomed.Mater.2010,5(4),041002.doi:10.1088/1748-6041/5/4/041002
(40)Feng,X.X.;Chen,J.Y.;Zhang,J.C.;Guo,Y.H.Acta Chim. Sin.2006,64(22),2281.[冯新星,陈建勇,张建春,郭玉海 .化学学报,2006,64(22),2281.]doi:10.3321/j.issn:0567-7351.2006.22.013
(41)Huang,B.;Dai,Y.;Ban,X.X.;Jiang,W.;Zhang,Z.H.;Sun,K. Y.;Lin,B.P.;Sun,Y.M.Acta Phys.-Chim.Sin.2015,31(8), 1621.[黄 斌,代 钰,班鑫鑫,蒋 伟,张兆杭,孙开涌,林保平,孙岳明 .物理化学学报,2015,31(8),1621.]doi:10.3866/ PKU.WHXB201506121
(42)Wang,Y.M.;Liu,L.;Luo,Y.F.;Jia,D.M.Acta Phys.-Chim. Sin.2008,24(6),1100.[王亚明,刘 岚,罗远芳,贾德民.物理化学学报,2008,24(6),1100.]doi:10.3866/PKU. WHXB20080633
(43)Cao,X.X.;Gao,J.G.;Du,Y.G.Polym.Mater.Sci.Eng.2011,No.6,106.[曹新鑫,高俊刚,杜永刚.高分子材料科学与工程,2011,No.6,106.]
(44)Wang,F.;Sheng,S.J.;Huang,D.;Ma,Q.Y.Chin.J.Pharm. Anal.2014,No.4,673.[王 昉,盛沈俊,黄 东,马青玉.药物分析杂志,2014,No.4,673.]
(45)Kandelbauer,A.;Wuzella,G.;Mahendran,A.;Taudes,I.; Widsten,P.Chem.Eng.J.2013,152(2-3),556.doi:10.1016/j. cej.2009.05.027
(46)Zhuo,L.;Kou,K.;Yao,P.;Wu,G.;Wang,Y.J.Therm.Anal. Calorim.2015,119(3),2039.doi:10.1007/s10973-014-4360-8
(47)Xiong,Y.H.;Su,J.H.;Liu,X.P.J.Mol.Catal.2010,24(5), 435.[熊亚红,苏健鸿,刘小平 .分子催化,2010,24(5),435.]
(48)Guo,H.;Wang,Y.B.;Ni,X.M.;Wang,J.;Han,W.L.Journal of China University of Mining&Technology2016,45(3),591. [郭 慧,王延斌,倪小明,王 晋,韩文龙.中国矿业大学学报,2016,45(3),591.]
(49)Liu,W.F.;Lin,M.L.Guangzhou Chemical Industry2004,31(1),6.[刘文峰,林木良 .广东化工,2004,31(1),6.] doi:10.3969/j.issn.1007-1865.2004.01.003
(50)Liu,S.;Chen,M.;Hu,Q.;Wang,J.;Kong,L.Bioresour. Technol.2013,129(2),381.doi:10.1016/j.biortech.2012.11.006
(51)Hu,R.Z.;Yang,Z.Q.;Liang,Y.J.Thermochim.Acta1988,123(15),135.doi:10.1016/0040-6031(88)80017-0
(52)Zhang,J.J.;Wang,R.F.;Li,J.B.;Liu,H.M.;Yang,H.F.J. Therm.Anal.Calorim.2000,62(3),747.doi:10.1007/s10973-004-0582-5
(53)Chen,D.Y.;Liu,R.H.;Cai,J.M.Trans.Chin.Soc.Agric.Eng.2007,23(2),188.[陈东雨,刘荣厚,蔡均猛.农业工程学报,2007,23(2),188.]doi:10.3321/j.issn:1002-6819.2007.02.037
Structure and Kinetics of Thermal Decomposition Mechanism of Novel Silk Fibroin Films
YU Hai-Yang1,2WANG Fang1,*LIU Qi-Chun1,2MAQing-Yu3GU Zheng-Gui2,*
(1Center of Analysis and Testing,Nanjing Normal University,Nanjing 210023,P.R.China;2School of Chemistry and Materials Science,Nanjing Normal University Jiangsu,Nanjing 210023,P.R.China;3School of Physics and Technology,Nanjing Normal University,Nanjing 210023,P.R.China)
Anew CaCl2-formic acid dissolution method was used to prepare silk fibroin(SF)films.Films SF-1.5 and SF-3.0 were prepared using 1.50%(w,mass fraction)and 3.00%(w)CaCl2-formic acid solutions, respectively.The molecular conformations and crystal structures of the films were characterized by Fourier transform infrared spectroscopy and X-ray diffraction.The thermal stability,thermal decomposition properties, and effect of CaCl2concentration on the thermodynamic parameters,kinetic parameters,and formation mechanism of the SF films were investigated using thermogravimetry techniques and the models of Kissinger, Ozawa,and Vyazovkin.The results showed that the SF-1.5 film mainly contained β-sheet structure,while the main molecular conformation in the SF-3.0 film was random coils.The decomposition temperature,activation energy,and activation enthalpy of SF-3.0 were lower than those of SF-1.5,while the thermal stability of SF-1.5 was higher than that of SF-3.0.In addition,the thermal decomposition of the SF films was studied by the Achar and Coats-Redfern methods.The mechanism of decomposition of these SF films followed the two-dimensional diffusion(cylindrical symmetry)law in the temperature range of 190.00-330.00 °C.
O642;O643;O641
10.3866/PKU.WHXB201611023
Received:October 10,2016;Revised:November 2,2016;Published online:November 2,2016.
*Corresponding authors.WANG Fang,Email:wangfang@njnu.edu.cn;Tel:+86-13851614122.GU Zheng-Gui,Email:07160@njnu.edu.cn; Tel:+86-13801581773.
The project was supported by the National Natural Science Foundation of China(11474166)and the College of Natural Science Foundation of Jiangsu Province,China(15KJB150018).
国家自然科学基金(11474166)和江苏省高校自然科学基金(15kJB150018)资助项目© Editorial office of Acta Physico-Chimica Sinica

