Notch信号通路与银屑病发病的关系及作用机制
狄伟
(山东中医药大学,济南271100)
Notch信号通路与银屑病发病的关系及作用机制
狄伟
(山东中医药大学,济南271100)
目的 探讨Notch信号通路与银屑病发病的关系及作用机制。方法 分别用RT-PCR、Western blotting技术检测30例银屑病患者皮损区皮肤组织(病例组)及其周边非皮损区皮肤组织(对照组)、30例正常人皮肤组织(正常组)中Notch1、Jagged1 mRNA和蛋白表达;将人永生化角质形成细胞HaCaT随机分为Jagged1-Fc融合蛋白组、DAPT组、常规对照组,分别加入含Notch信号通路特异性激活剂(Jagged1-Fc融合蛋白,终浓度0、0.5、1、2 μg/mL)、Notch信号通路特异性阻断剂(DAPT,终浓度0、5、10、20 μmol/L)、常规细胞培养液干预24、48、72 h。用Western blotting法检测细胞内Bcl-2、Bax、Keratin1、Involucrin蛋白表达,用MTT法检测HaCaT细胞增殖活力,用流式细胞术检测细胞凋亡率。结果 病例组Notch1、Jagged1 mRNA及蛋白相对表达量高于对照组与正常组(P均<0.05)。干预0、24、48、72 h,Jagged1-Fc融合蛋白组细胞增殖率随干预浓度升高依次升高,DAPT组随干预浓度降低依次降低(P均<0.05)。与常规对照组比较,Jagged1-Fc融合蛋白组细胞凋亡率降低、DAPT组升高(P均<0.05)。与常规对照组比较,Jagged1-Fc融合蛋白组Bcl-2蛋白相对表达量升高,Bax蛋白相对表达量降低(P均<0.05);DAPT组Bcl-2蛋白相对表达量降低,Bax蛋白相对表达量升高(P均<0.05)。与常规对照组比较,Jagged1-Fc融合蛋白组Keratin1及Involucrin蛋白相对表达量降低(P均<0.05);DAPT组Keratin1及Involucrin蛋白相对表达量升高(P均<0.05)。结论 银屑病的发生与Notch信号通路的激活相关,其可能的作用机制为Notch信号通路促进角质形成细胞增殖、抑制其凋亡与分化。
银屑病;Notch信号通路;角质形成细胞;细胞增殖;细胞凋亡;细胞分化
银屑病是一种常见的慢性炎症性皮肤病,其主要病理特征为角质形成细胞过度增殖,导致表皮可凋亡的角质形成细胞异常分化,并伴随皮肤炎症浸润及血管生成异常等[1,2]。银屑病病程较长、易复发且较难治愈[3]。目前关于银屑病的发病原因和机制尚无定论,但普遍认为与遗传和环境相关[4]。Notch信号通路由多种分子及蛋白组成,参与多种疾病的发生过程,与银屑病的发生密切相关。目前研究较多的是Notch信号通路与免疫介导机制在银屑病发病中的作用[5]。角质形成细胞是构成表皮结构的主要细胞,约占表皮细胞总数的80%。多种皮肤肿瘤及炎症性皮肤病的发生与角质形成细胞增殖、凋亡、分化异常相关[6]。HaCaT细胞是从成人皮肤中分离的永生化角质形成细胞系,其遗传特性稳定,增殖、分化特性与角质形成细胞相似,在进行实验研究时常用来替代角质形成细胞[7]。2014年4月~2015年6月,本研究观察Notch信号通路关键因子在银屑病皮损区皮肤中的表达情况及对HaCaT细胞增殖、凋亡及分化的影响,探讨Notch信号通路在银屑病发病中的作用机制。
1 材料与方法
1.1 皮肤组织标本来源 选择同期山东省中医院就诊的斑块型银屑病患者30例(病例组),均经皮肤组织病理检查确诊。其中男18例、女12例,年龄18~75(32.6±7.4)岁。采集患者皮损区皮肤组织为病例组,同时采集距皮损区1 cm非皮损区皮肤组织作为对照组。纳入标准:皮损区近2周未外涂药物,近1个月未接受免疫抑制剂及其他药物治疗。排除标准:年龄<18岁或>75岁;合并皮肤肿瘤或其他增生性皮肤病;有心脑血管、肝、肾及造血系统等严重原发性疾病或其他情况不适合取材者。同期选取本院皮肤科留存的健康人皮肤组织样本30例作为正常组,健康人男16例、女14例,年龄18~69(34.2±6.8)岁。三组性别、年龄比较差异无统计学意义(P均>0.05)。三组去除皮下结缔组织与皮下脂肪后,于液氮中速冻,-80 ℃冰箱中保存备用。
1.2 细胞、试剂及仪器 人永生化角质形成细胞系HaCaT,购于中国科学院细胞库。Notch信号通路特异性激活剂(Jagged1-Fc融合蛋白)和Notch信号通路特异性阻断剂(DAPT),购于美国R&D System公司;TRIzol、逆转录试剂盒、荧光定量试剂(SYBR Green I),购于日本TaKaRa公司;Notch1、Jagged1、B淋巴细胞瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、角蛋白1(Keratin1)和重组人外皮蛋白(Involucrin)单克隆抗体,购于美国Abcam公司;辣根过氧化物标记的二抗,购于北京中杉金桥生物技术有限公司;DMEM培养基、100 μg/mL碘化丙啶(PI)、Annexin-V-FITC,购于美国Sigma公司;MTT试剂盒购于普洛麦格北京生物技术有限公司;BCA蛋白定量试剂盒、5×SDS蛋白上样缓冲液,购于天根生化科技有限公司;FBS,购于杭州四季青生物工程材料研究所。CO2培养箱,购于常州菲普实验仪器厂;倒置显微镜,购于日本尼康;RT-PCR仪,购于瑞士Roche公司;流式细胞仪,购于美国BD公司;Multiskan MK3 型酶标仪,购于芬兰 Thermo Labsys2tems公司。
1.3 细胞培养及处理 从液氮罐中取出装有HaCaT细胞的冻存管,放入37 ℃恒温水浴锅中快速解冻,待细胞冻存液融解后,将细胞移至5 mL无菌离心管中,加入含有10% FBS的DMEM培养液3 mL稀释冻存液中的DMSO,1 000 r/min离心5 min,去除上清液。加入新的培养液吹打重悬细胞沉淀,接种到细胞培养皿中,置于37 ℃,5% CO2培养箱中培养。细胞贴壁后换液1次,去除漂浮的死细胞,之后定期换液,待细胞融合度达80%以上时,用0.25%的胰酶消化并收集细胞,按1∶3的比例进行传代培养。取对数生长期的HaCaT细胞,去除细胞培养液,用PBS清洗细胞2次,用0.25%的胰酶消化,待细胞呈单个存在时终止消化,离心收集细胞沉淀。用培养液重悬、计数后,将细胞浓度调整为5×104/mL,每孔200 μL接种于经紫外照射灭菌的96孔培养板中,置于37 ℃、5% CO2培养箱中培养24 h后,去除细胞培养液,将细胞随机分为Jagged1-Fc融合蛋白组、DAPT组、常规对照组,分别加入含(终浓度0、0.5、1、2 μg/mL)Jagged1-Fc融合蛋白、(终浓度0、5、10、20 μmol/L)DAPT、常规细胞培养液进行培养。
1.4 皮肤组织中Notch1、Jagged1 mRNA表达检测 用RT-PCR技术。取三组皮肤组织,用TRIzol法提取总RNA。紫外分光光度计检测总RNA浓度,琼脂糖凝胶电泳检测总RNA质量;用PrimeScriptTM RT Reagent kit逆转录试剂盒合成将RNA逆转录成cDNA,用RT-PCR试剂盒检测。根据GenBank数据库中公布的人Notch1和Jagged1 mRNA序列,用Primer5.0软件设计RT-PCR引物,送上海派森诺生物科技有限公司合成,引物序列为Notch1-F:5′-GTCAACGCCGTAGATGACCT-3′,Notch1-R:5′-CAGGTTGTACTCGTCCAGCA-3′;Jagged1-F:5′-GTCCCACTGGTTTCTCTGGA-3′,Jagged1-R:5′-CCACAGACGTTGGAGGAAAT-3′;β-actin-F:5′-TGACGTGGACATCCG-CAAAG-3′,β-actin-R:5′-CTGGAAGGTGGACAGCGAG-G-3′。RT-PCR扩增条件:预变性95 ℃ 5 min,变性95 ℃ 30 s,退火60 ℃ 30 s,延伸72 ℃ 30 s,35个循环。用β-actin作为内参,采用2-ΔΔCt法计算目的基因相对表达量。
1.5 皮肤组织中Notch1、Jagged1蛋白及HaCaT细胞内Bcl-2、Bax、Keratin1、Involucrin蛋白表达检测 采用Western blotting法。取三组皮肤组织,按照蛋白提取试剂盒说明书提取皮肤组织总蛋白;HaCaT细胞经Jagged1-Fc融合蛋白、DAPT处理。用0.25%的胰酶消化、收集细胞,按照蛋白提取试剂盒说明书提取HaCaT细胞总蛋白。按照试剂盒说明书测定组织及细胞总蛋白浓度。蛋白上清液稀释至统一浓度后,与Loading buffer按体积4∶1混匀,100 ℃煮沸5 min使蛋白变性。将变性蛋白样品加入SDS蛋白凝胶上样孔中,每孔50 μL,常规方法垂直电泳。电泳结束取出蛋白凝胶,按照滤纸、PVDF膜、蛋白凝胶、滤纸的顺序在4 ℃转膜过夜。PBST洗涤3次,PVDF膜用5%脱脂奶粉封闭2 h,然后依次与一抗(500倍稀释)、二抗(1 000倍稀释)孵育,滴加ECL显色液,在暗室中曝光,用Odyssey成像系统扫描各条带灰度值,β-actin条带作为内参照。目的蛋白相对表达量=目的蛋白灰度值/β-actin灰度值。
1.6 HaCaT细胞增殖活力检测 采用MTT法。HaCaT细胞经Jagged1-Fc融合蛋白、DAPT处理,置于37 ℃、5% CO2培养箱中培养24、48、72 h,每孔加入0.5%的MTT溶液20 μL,继续培养4 h,弃去培养液,加入DMSO 150 μL,低速振荡10 min溶解蓝紫色结晶。用空白调零孔调零,用酶标仪测定波长570 nm处光密度(A)值,A值与细胞数量呈正比,以A值作为评价细胞增殖活力的指标。
1.7 HaCaT细胞凋亡率检测 采用流式细胞术。取对数生长期的HaCaT细胞分别用终浓度为2 μg/mL的Jagged1-Fc融合蛋白、终浓度为20 μmol/L DAPT处理72 h,弃去细胞培养液,PBS清洗细胞2次,加入0.25%的胰蛋白酶消化、收集细胞,以不做处理的细胞作对照。细胞计数,用细胞培养液重悬细胞,调整细胞为1×106/mL。取细胞悬液1 mL加入1.5 mL离心管中,4 ℃,1 200 r/min,离心5 min,弃上清液。向细胞沉淀中加入Binding Buffer 200 μL,充分混匀后分别加入PI 5 μL和Annexin V-FITC 5 μL,避光室温孵育20~30 min,加入Binding Buffer 400 μL,用流式细胞仪检测HaCaT细胞凋亡情况,计算细胞凋亡率。

2 结果
2.1 各组皮肤组织中Notch1、Jagged1 mRNA及蛋白的表达比较 正常组Notch1、Jagged1 mRNA相对表达量分别为1.00±0.09、1.00±0.11,蛋白相对表达量分为0.39±0.12、0.67±0.08;对照组Notch1、Jagged1 mRNA相对表达量分别为1.16±0.16、1.17±0.21,蛋白相对表达量分别为 0.43±0.01、0.71±0.11;病例组Notch1、Jagged1 mRNA相对表达量分别为3.64±0.15、2.36±0.32,蛋白相对表达量分别为1.29±0.13、1.46±0.15。病例组Notch1、Jagged1 mRNA及蛋白相对表达量高于其他两组(P均<0.05),对照组与正常组Notch1、Jagged1 mRNA及蛋白相对表达量比较差异无统计学意义(P均>0.05)。
2.2 Notch信号通路对HaCaT细胞增殖的影响 见表1。
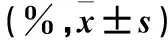
表1 Jagged1-Fc融合蛋白组与DAPT组细胞增殖率比较
2.3 Notch信号通路对HaCaT细胞凋亡的影响 Jagged1-Fc融合蛋白组、DAPT组、常规对照组凋亡率分别为4.76%±1.13%、26.87%±3.18%、13.69%±2.05%;与常规对照组比较,Jagged1-Fc融合蛋白组细胞凋亡率降低、DAPT组升高(P均<0.05)。
2.4 Notch信号通路对HaCaT细胞凋亡相关蛋白表达的影响 常规对照组、Jagged1-Fc融合蛋白组、DAPT组Bcl-2蛋白相对表达量分别为0.63±0.11、1.28±0.15、0.29±0.08,Bax蛋白相对表达量分别为0.57±0.08、0.16±0.08、1.17±0.16。与常规对照组比较,Jagged1-Fc融合蛋白组Bcl-2蛋白相对表达量升高,Bax蛋白相对表达量降低(P均<0.05);DAPT组Bcl-2蛋白相对表达量降低, Bax蛋白相对表达量升高(P均<0.05)。
2.5 Notch信号通路对HaCaT细胞分化的影响 常规对照组、Jagged1-Fc融合蛋白组、DAPT组Keratin1蛋白相对表达量分别为0.53±0.08、0.29±0.06、1.03±0.14,Involucrin蛋白相对表达量分别为0.86±0.17、0.39±0.06、1.27±0.16。与常规对照组比较,Jagged1-Fc融合蛋白组Keratin1及Involucrin蛋白相对表达量降低(P均<0.05);DAPT组Keratin1及Involucrin蛋白相对表达量升高(P均<0.05)。
3 讨论
Notch信号通路是介导细胞之间相互接触的重要信号通路,在机体多种组织器官中均有表达,能够调控细胞增殖、分化、凋亡等过程[8]。研究证实Notch信号通路的异常激活与多种恶性肿瘤的发生相关。如刘天舒等[9]研究发现,阻断Notch信号通路能够抑制肺癌干细胞的生长。在造血系统中,Notch信号通路激活能够促进造血组细胞增殖并抑制其分化[10]。皮肤是人体重要的组织器官,与全身免疫系统密切相关,具有非特异性免疫防御功能。表皮多种细胞中均有Notch信号分子的表达。有研究报道,Notch信号通路关键因子Notch1、Notch2及HES-1在银屑病患者外周血T细胞中表达上调[11];Jagged1是Notch信号通路的主要配体之一,有研究发现Jagged1在血热型银屑病表皮中表达增强[12],提示Notch信号通路可能参与银屑病的发生过程。本研究采集了银屑病患者皮损区皮肤组织、周边非皮损区皮肤组织及正常人皮肤组织,用RT-PCR和Western blotting检测Notch信号通路配体受体Notch1、Jagged1的表达,发现Notch1、Jagged1 mRNA和蛋白在银屑病患者皮损区皮肤组织呈现高表达。说明Notch信号通路与银屑病的发病过程相关,这与其他研究结果一致。
角质形成细胞是构成表皮结构的主要细胞,具有很强的增殖及分化能力,是皮肤组织免疫及屏障的重要功能细胞[13]。正常状态下,角质形成细胞的增殖与凋亡处于动态平衡状态,两者相互制约维持表皮的正常厚度与角质层的形成,其增殖、凋亡、分化异常会导致多种皮肤疾病的发生[14]。银屑病的发病机制尚不清楚,但是表皮角质形成细胞过度增殖及异常分化是其主要特点之一,多数学者还认为银屑病的发生与表皮角质形成细胞凋亡减少有关[15]。本研究以HaCaT细胞为实验材料,用Jagged1-Fc融合蛋白激活Notch信号通路,DAPT阻断Notch信号通路,结果显示,激活Notch信号通路能够促进HaCaT细胞增殖;而阻断Notch信号通路能够抑制HaCaT细胞增殖。
Bcl-2基因家族在通过线粒体途径调控细胞凋亡中具有重要作用,其中Bcl-2是一种抑凋亡基因[16],Bax是一种促凋亡基因[17],Bcl-2和Bax能够形成异源或同源二聚体,对细胞凋亡的调节作用由两者的比值决定,其中Bcl-2蛋白表达减少,Bax蛋白表达增加,促进细胞的凋亡,反之则抑制细胞凋亡[18]。本实验结果显示,激活Notch信号通路能够抑制HaCaT细胞凋亡,并明显促进Bcl-2蛋白表达,抑制Bax蛋白表达;阻断Notch信号通路则能够促进HaCaT细胞凋亡,并明显抑制Bcl-2蛋白表达,促进Bax蛋白表达,提示Notch信号通路调控HaCaT细胞凋亡可能与Bcl-2基因家族相关。
Keratin1是表皮颗粒层特异性蛋白,Involucrin是棘皮层特异性蛋白,二者可作为HaCaT细胞分化的标志蛋白[19,20]。本研究发现,用Jagged1-Fc融合蛋白激活Notch信号通路能够下调Keratin1和Involucrin蛋白表达;用DAPT阻断Notch信号通路能够上调Keratin1和Involucrin表达,说明激活Notch信号通路能够抑制HaCaT细胞分化,阻断Notch信号通路能够促进HaCaT细胞分化。
综上所述,Notch信号通路关键因子在银屑病患者皮损区皮肤组织中表达上调,激活Notch信号通路能够促进角质形成细胞的增殖、抑制角质形成细胞的凋亡和分化。反之,阻断Notch信号通路能够抑制角质形成细胞的增殖、促进角质形成细胞的凋亡和分化。
[1] 王大虎,王卿,李玉平,等.银屑病皮损中端粒酶活性、血管内皮生长因子的表达及其相关性分析[J].临床皮肤科杂志,2015,44(10):618-619.
[2] Lowes MA, Suárez-Farias M, Krueger JG. Immunology of psoriasis[J]. Annu Rev Immunol, 2014,32(1):227-255.
[3] 董淑英.寻常性银屑病患者血清白细胞介素-17和-22水平及其与预后的相关性[J].中国老年学杂志,2016,36(5):1165-1166.
[4] Mustonen A, Mattila K, Leino M, et al. Psoriasis causes significant economic burden to patients[J]. Dermatol Ther, 2014,4(1):115-124.
[5] 孔原,白彦萍.Notch家族蛋白在银屑病发病机制中的作用研究[J].临床皮肤科杂志,2015,44(3):135-139.
[6] van den Bogaard EH, Tjabringa GS, Joosten I, et al. Crosstalk between keratinocytes and T cells in a 3D microenvironment: a model to study inflammatory skin diseases[J]. J Invest Dermatol, 2014,134(3):719-727.
[7] Sun B, Ding R, Yu W, et al. Advanced oxidative protein products induced human keratinocyte apoptosis through the NOX-MAPK pathway[J]. Apoptosis, 2016,21(7):825-835.
[8] Takebe N, Nguyen D, Yang SX. Targeting notch signaling pathway in cancer: clinical development advances and challenges[J]. Pharmacol Ther, 2014,141(2):140-149.
[9] 刘天舒,毛志福,刘军韬,等.Notch信号通路在肺癌干细胞中的表达及其对增殖的影响[J]. 中华实验外科杂志,2015,32(1):84-87.
[10] 田登梅,梁英民,韩骅,等.内皮细胞靶向的可溶性Notch配体hD1R蛋白对脐血造血干/祖细胞增殖和植入的影响[J].中华血液学杂志,2014,35(10):885-890.
[11] 郝平生,周倩,张婧.寻常型银屑病(血热证)外周血中性白细胞 Notch 信号通路表达初探[J].辽宁中医杂志,2015,42(7):1186-1188.
[12] Skarmoutsou E, Trovato C, Granata M, et al. Biological therapy induces expression changes in Notch pathway in psoriasis[J]. Arch Dermatol Res, 2015,307(10):863-873.
[13] Pasparakis M, Haase I, Nestle FO. Mechanisms regulating skin immunity and inflammation[J]. Nat Rev Immunol, 2014,14(5):289-301.
[14] Hobbs RP, DePianto DJ, Jacob JT, et al. Keratin-dependent regulation of Aire and gene expression in skin tumor keratinocytes[J]. Nat Genet, 2015,47(8):933-938.
[15] Chamcheu JC, Pal HC, Siddiqui IA, et al. Prodifferentiation, anti-inflammatory and antiproliferative effects of delphinidin, a dietary anthocyanidin, in a full-thickness three-dimensional reconstituted human skin model of psoriasis[J]. Skin Pharmacol Physiol, 2015,28(4):177-188.
[16] Yang D, Okamura H, Teramachi J, et al. Histone demethylase Jmjd3 regulates osteoblast apoptosis through targeting anti-apoptotic protein Bcl-2 and pro-apoptotic protein Bim.[J]. Biochim Biophys Acta, 2016,1863(4):650-659.
[17] Groβe L, Wurm CA, Brüser C, et al. Bax assembles into large ring-like structures remodeling the mitochondrial outer membrane inapoptosis[J]. EMBO J, 2016,35(4):402-413.
[18] Zhao B, He T. Chidamide, a histone deacetylase inhibitor, functions as a tumor inhibitor by modulating the ratio of Bax/Bcl-2 and P21 in pancreatic cancer[J]. Oncol Rep, 2015,33(1):304-310.
[19] Matsuda M, Hamada T, Numata S, et al. A three-dimensional in vitro culture model of Hailey-Hailey disease[J]. Exp Dermatol, 2015,24(10):788-789.
[20] Suwa E, Yamaura K, Sato S, et al. Increased expression of the histamine H4 receptor following differentiation and mediation of the H4 receptor on interleukin-8 mRNA expression in HaCaT keratinocytes[J]. Exp Dermatol, 2014,23(2):138-140.
10.3969/j.issn.1002-266X.2017.05.011
R758.63
A
1002-266X(2017)05-0036-04
2016-11-01)

