固尔苏治疗新生儿急性呼吸窘迫综合征临床疗效观察
肖琳
·论著·
固尔苏治疗新生儿急性呼吸窘迫综合征临床疗效观察
肖琳
目的:观察固尔苏治疗新生儿急性呼吸窘迫综合征临床疗效。方法:选取宾阳县妇幼保健院收治的新生儿急性呼吸窘迫综合征患儿100例按照随机数字表法分为2组各50例。2组患儿均接受机械通气治疗,观察组给予猪肺磷脂注射液(固尔苏)100~200 mg/kg,以注射器经气管内插管滴注至下段气管,对照组不给予固尔苏治疗。观察比较2组患儿治疗后机械通气参数、临床总有效率及并发症发生情况。结果:治疗前,2组PIP,RR,PEEP,FiO2比较,差异均无统计学意义(P>0.05);治疗后,2组RR较治疗前及2组间差异均无统计学意义(P>0.05);治疗后,2组PIP,PEEP,FiO2较治疗前显著降低,且观察组PIP,PEEP,FiO2明显低于对照组,差异均有统计学意义(P<0.05)。治疗总有效率观察组为96.0%,明显高于对照组的82.0%,差异有统计学意义(P<0.05)。2组治疗过程中主要的并发症包括:肺漏气,颅内出血,BPD,VAP,NEC,ROP和PDA,经积极对症治疗后均明显好转。2组各类并发症比较,差异均无统计学意义(P>0.05)。结论:固尔苏在新生儿急性呼吸窘迫综合征的治疗中临床应用价值较高,能有效改善患儿机械通气参数,提高临床疗效,治疗中并发症发生率较低,且均能耐受,安全性高。
呼吸窘迫综合征,新生儿; 固尔苏; 治疗结果
新生儿呼吸窘迫综合征常见于早产儿,易引起呼吸衰竭,是导致早产儿死亡的的主要疾病之一,肺部发育不成熟、缺乏肺泡表面活性物质是其主要的发病机制[1]。近年来,我国新生儿呼吸窘迫综合征的发病率呈上升趋势,同时具有进展快、病情重、病死率较高等特点[2],因此,对该病的预防、早期诊疗都有着十分重要的临床意义。目前临床上通常对该类患儿采用肺表面活性物质治疗。为寻求新生儿呼吸窘迫综合征更为合理有效的治疗方法,我们采用固尔苏治疗新生儿急性呼吸窘迫综合征,疗效满意,现报告如下。
1 资料与方法
1.1 一般资料 选取宾阳县妇幼保健院2011年8月-2014年1月收治的新生儿急性呼吸窘迫综合征患儿100例作为观察对象,(1)入选标准:符合Sweet DG,Carnielli V,Greisen G等制定的《欧洲新生儿呼吸窘迫综合征防治指南-2010版》[3]中关于新生儿呼吸窘迫综合征的诊断标准。(2)剔除标准:①严重肝、肾疾病及合并其他急慢性疾病者。②依从性差、药物耐受度差者。③先天性心脏病、代谢性疾病等。本研究经我院医学伦理委员会批准,所有患儿家属均签署知情同意书。将符合入选标准100例患儿按照随机数字表法分为2组各50例。对照组男31例,女19例;胎龄29~38周,平均胎龄(35.0±1.6)周;出生体重1 870~2 980 g,平均体重(2185±205)g。观察组男30例,女20例;胎龄30~37周,平均胎龄(34.3±1.8)周;出生体重1 905~3 012 g,平均体重(2203±215)g。2组新生儿的性别、胎龄、出生体重等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法 对患儿血氧饱和度、心率、呼吸、体温等生命体征进行监测,注意使水电解质维持平衡,静脉输液量应适量,忌过多或过少,若患儿未经口喂养,提供胃肠外静脉营养支持。为降低患儿支气管发育不良的发生率,可适量给予维生素A(广州珠江制药厂,规格:2.5万单位;国药准字H44024923),可给予广谱抗生素治疗或预防感染,对各种并发症及时采取有效措施进行处理。观察组给予猪肺磷脂注射液(意大利 Chiesi Farmaceutici S.p.A.商品名:固尔苏;批准文号:H20080428;规格:3 mL:0.24 g)治疗,剂量100~200 mg/kg。均在患儿入院后尽早给药,使用前均加入2~4 mL灭菌注射液,轻振荡成混悬液,约37℃下预热。用法:给药前,吸净患儿口鼻中的分泌物,以无菌注射器吸取药液,以仰卧位、再仰卧位,左侧卧位,右侧卧位自患儿气管插管注入药液,每个体位注入约1/3的剂量,其中仰卧位、再仰卧位合计注入1/3的剂量。时间约为2 min,完成后以球囊加压呼吸1~2 min,频率为40~60次/min,使药液均匀分布于肺内。在给用药6 h后对患儿进行拍背吸痰,以此减少药液的损失,但存在明显气道阻塞的患儿除外。对照组不给予固尔苏治疗,仅采用常规处理。
1.3 观察指标 2组治疗前后机械通气参数,包括:吸气峰压(peak inspiratory pressure,PIP)、呼气末正压通气(positive end expiratory pressure,PEEP)、吸入气中的氧浓度分数(fraction of inspiration O2,FiO2)、呼吸频率(respiratory rate,RR);2组治疗总有效率;2组并发症发生率。
1.4 疗效标准[4]临床疗效分为4个等级:(1)治愈:症状、体征完全消失,各项指标恢复正常。(2)显效:症状、体征明显好转,呼吸平稳,X线检查显示两肺肺纹理均清晰,呻吟消失,血气指标正常,无酸碱平衡失调、电解质紊乱。(3)有效:呼吸较平稳,X线检查显示异常阴影有所改善,呻吟消失,血气指标也有所好转。(4)无效:症状、体征均未见好转甚至出现恶化。治疗总有效率=(治愈例数+显效例数+有效例数)/该组总例数×100%。
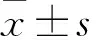
2 结果
2.1 2组患儿治疗前后机械通气参数比较 治疗前,2组PIP,RR,PEEP,FiO2比较,差异均无统计学意义(P>0.05);治疗后,2组RR较治疗前差异均无统计学意义(P>0.05),且2组间RR差异无统计学意义(P>0.05);治疗后,2组PIP,PEEP,FiO2较治疗前显著降低,且观察组PIP,PEEP,FiO2明显低于对照组,差异均有统计学意义(P<0.05)。见表1。

表1 2组患儿治疗前后机械通气参数比较 (n;
2.2 2组患儿治疗总有效率比较 观察组治疗总有效率为96.0%,明显高于对照组的82.0%,差异有统计学意义(χ2=5.0051,P<0.05)。见表2。
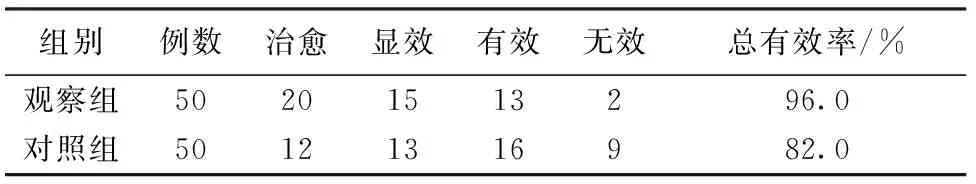
表2 2组患儿治疗总有效率比较
2.3 2组患儿并发症发生率比较 2组治疗过程中主要的并发症包括:肺漏气、颅内出血、支气管肺发育不良(BPD)、呼吸机相关性肺炎(VAP)、新生儿坏死性小肠结肠炎(NEC)、早产儿视网膜病变(ROP)、动脉导管未闭(PDA),经积极对症治疗后均明显好转。2组各类并发症比较,差异均无统计学意义(P>0.05)。见表3。

表3 2组患儿并发症发生率比较
注:()内数字为发生率/%。
3 讨论
新生儿呼吸窘迫综合征是一种较为常见的早产儿疾病,其发病原因是早产儿的肺部发育不成熟、肺表面缺乏活性物质而出现肺液体运转障碍、肺不张,引发肺毛细血管肺泡间渗出性、高通透性病变,从而导致肺顺应性降低、广泛肺泡萎陷[5-7]。该病是导致早产儿死亡的主要原因之一[8]。临床上主要采取外源性肺泡表面活性物质进行替代治疗,肺泡表面活性物质是由肺泡II型细胞分泌出一种磷脂蛋白质复合物,能使毛细支气管末端的表面张力降低、调节肺泡表面张力、保护肺泡上皮细胞,因而可用于治疗新生儿呼吸窘迫综合征,可改善患儿病情的严重程度,提高治疗效果[9-12]。
国内外大量临床研究[13-16]证实,固尔苏治疗新生儿呼吸窘迫综合征的临床总有效率高达90%以上,患儿的机械通气参数明显降低,肺功能得到明显改善。本研究中,观察组和对照组分别采用猪肺磷脂注射液(固尔苏)治疗和不采用固尔苏治疗。结果显示,治疗前,2组PIP,RR,PEEP,FiO2比较,差异均无统计学意义(P>0.05);治疗后,2组RR较治疗前差异均无统计学意义(P>0.05),且2组间RR差异无统计学意义(P>0.05);治疗后,2组PIP,PEEP,FiO2较治疗前显著降低,且观察组PIP,PEEP,FiO2明显低于对照组,差异均有统计学意义(P<0.05)。观察组治疗总有效率为96.0%,明显高于对照组的82.0%,差异有统计学意义(P<0.05)。表明固尔苏治疗新生儿呼吸窘迫综合征的疗效明显,可有效降低患儿的机械通气参数,改善患儿肺部功能。此外,研究还发现,2组治疗过程中主要的并发症包括:肺漏气,颅内出血,BPD,VAP,NEC,ROP和PDA,经积极对症治疗后均明显好转。2组各类并发症比较,差异均无统计学意义(P>0.05),表明经固尔苏治疗后,患儿并发症发生率无明显上升,且相关并发症经积极对症治疗后均可好转,说明固尔苏的治疗安全性较高,可放心使用。固尔苏是一种较常用的肺泡表面活性物质,可降低肺泡表面张力、使萎陷肺泡重新充气,进而明显改善失调的肺通气血流比例,最终起到改善肺功能的作用[17]。国内外相关学者[18-21]研究表明,固尔苏在新生儿呼吸窘迫综合征中的疗效显著。固尔苏提取自猪肺组织,属于混悬液制剂,保存环境为2~8℃,使用时将温度加热至37℃即可使用,临床使用推荐剂量为100~200 mg/kg,且表面活性物质剂量为100 mg/kg时较小剂量的表面活性物质临床应用效果更好[22-24]。
综上所述,固尔苏在新生儿急性呼吸窘迫综合征的治疗中临床应用价值较高,不仅能有效改善患儿机械通气参数,提高临床疗效,且治疗中并发症发生率较低,且均能耐受,安全性高,值得临床推广应用。
[1] 徐丽梅.鼻塞CPAP在新生儿呼吸窘迫综合征患儿中的临床效果研究[J].中国医学创新,2014,13(5):57-58.
[2] 田军.肺表面活性物质和机械通气联合应用治疗新生儿呼吸窘迫综合征效果分析[J].中国医学创新,2012,10(36):53-54.
[3] SWEET DG,CARNIELLI V,GREISEN G,等.欧洲新生儿呼吸窘迫综合征防治指南(2010版)[J].中华儿科杂志,2011,49(1):27-33.
[4] 赵冰,潘家华.不同肺表面活性物质治疗新生儿呼吸窘迫综合征疗效比较[J].中国新生儿科杂志,2014,29(3):158-161.
[5] 李锦芬,俞生林.肺表面活性物质联合经鼻间歇正压通气治疗新生儿呼吸窘迫综合征[J].实用药物与临床,2013,16(2):157-158.
[6] 廖燕,黄国盛,黄海燕,等.三种剂量肺表面活性物质治疗新生儿呼吸窘迫综合征的临床分析[J].中国医师进修杂志,2015,38(11):783-787.
[7] PAUL S,RAO S,KOHAN R,et al.Poractant alfa versus beractant for respiratory distress syndrome in preterm infants: A retrospective cohort study[J].Journal of paediatrics and child health,2013,49(10):839-844.
[8] 高存娇.经鼻双水平正压通气与持续正压通气治疗新生儿呼吸窘迫综合征的比较[J].中国医学创新,2015,12(3):63-66.
[9] 郑观荣,张志明.经喉罩应用肺表面活性物质治疗新生儿呼吸窘迫综合征的临床观察[J].临床儿科杂志,2013,31(3):296.
[10] 陈海华.猪肺磷脂与牛肺表面活性物质治疗新生儿呼吸窘迫综合征的疗效比较[J].临床肺科杂志,2015,21(1):55-58.
[11] 王承峰,陈光明.肺表面活性物质在新生儿呼吸窘迫综合征治疗中的应用[J].中国妇幼保健,2013,28(10):1602-1604.
[12] NADERI HM,MURRAY JC,DAGLE JM,et al.Single mutations in ABCA3 increase the risk for neonatal respiratory distress syndrome in late preterm infants (gestational age 34-36 weeks)[J].American journal of medical genetics,Part A,2014,164A(10):2676-2678.
[13] JARGIN SV.Surfactant therapy of pulmonary conditions excluding those with primary surfactant deficiency and bronchoscopy as delivery method: An overview of Russian patents and publications[J].Recent patents on drug delivery & formulation,2013,7(2):134-137.
[14] YILMAZ O,KAHVECI H,ZEYBEK C,et al.Inhaled iloprost in preterm infants with severe respiratory distress syndrome and pulmonary hypertension[J].American Journal of Perinatology,2014,31(4):321-326.
[15] RICOTTI A,SALVO V,ZIMMERMANN LJ,et al.N-SIPPV versus bi-level N-CPAP for early treatment of respiratory distress syndrome in preterm infants[J].The journal of maternal-fetal &; neonatal medicine,2013,26(13):1346-1351.
[16] 孙旭红.肺表面活性物质联合NCPAP治疗新生儿呼吸窘迫综合征的临床分析[J].中国医药指南,2016,14(16):65-66.
[17] POLIN RA,CARLO WA.Surfactant replacement therapy for preterm and term neonates with respiratory distress[J].Pediatrics,2014,133(1):156-163.
[18] CUEVAS GUAMAN M,SBRANA E,SHOPE C,et al.Administration of antenatal glucocorticoids and postnatal surfactant ameliorates respiratory distress syndrome associated neonatal lethality in Erk3(-/-) mouse pups[J].Pediatric Research,2014,76(1):24-32.
[19] 劳国荣,张剑,罗世康,等.呼吸窘迫综合征并发支气管肺发育不良早期胸部影像的研究[J].中国医学创新,2013,27(13):94-96.
[20] YOST CC,SOLL RF.Early versus delayed selective surfactant treatment for neonatal respiratory distress syndrome[J].cochrane Database syst Rev,2000,1(12):77-82.
[21] GRASSO C,SCIACCA P,GIACCHI V,et al.Effects of Sustained Lung Inflation, a lung recruitment maneuver in primary acute respiratory distress syndrome, in respiratory and cerebral outcomes in preterm infants[J].Early human development,2015,91(1):71-75.
[22] YANG CF,LIN CH,CHIOU SY,et al.Intratracheal budesonide supplementation in addition to surfactant improves pulmonary outcome in surfactant-depleted newborn piglets[J].Pediatric Pulmonology,2013,48(2):151-159.
[23] FETTAH N,DILLI D,BEKEN S,et al.Surfactant for acute respiratory distress syndrome caused by near drowning in a newborn[J].Pediatric emergency care,2014,30(3):180-181.
[24] CURSTEDT T,HALLIDAY HL,SPEER CP.A Unique Story in Neonatal Research:The Development of a Porcine Surfactant[J].Neonatology,2015,107(4):321-329.
Clinical comparative study of curosurf for treatment of neonatal acute respiratory distress syndrome
XIAOLin.
(MaternalandChildHealthHospitalofBinyangCounty,Guangxi530021,China)
Objective:To study the clinical application of curosurf for treatment of neonatal acute respiratory distress syndrome.Methods:100 cases of neonatal acute respiratory distress syndrome were selected and randomly divided into two groups, 50 cases in each.The two groups of patients received treatment of different lung surface active agent. The observation group was given poractant alfa injection (curosurf) 100 ~ 200 mg/kg, while the control group was only given conventional treatment without curosurf.The parameters of mechanical ventilation, clinical total effective rate and complication were observed and compared between the two groups after treatment.Results: Before the treatment,by comparing the two groups' PIP,RR,PEEP and FiO2,there were no significant differences(P>0.05). After the treatment, the two groups' RR showed no significant difference(P>0.05) from before treatment,and between the two groups(P>0.05).The two groups' PIP,PEEP and FiO2were significantly lower than those before the treatment,and the observation group's were significantly lower than those of the control group.The differences were statistically significant(P<0.05).The total effective rate of the observation group was 96%,significantly higher than that of the control group (82%).The difference was statistically significant(P<0.05).The main complications of the 2 groups included pulmonary air leakage, intracranial hemorrhage,BPD,VAP,NEC,ROP and PDA.After positive symptomatic treatment all were significantly improved.There were no significant differences in the two groups(P>0.05).Conclusion:Curosurf is of high clinical application value in treatment of neonatal acute respiratory distress syndrome.It can effectively improve the ventilation parameters and clinical efficacy and reduce complications. It is worth clinical application.
Respiratory distress syndrome, neonatal; Curosurf; Treatment outcome
广西壮族自治区宾阳县妇幼保健院 儿科,530021
肖琳(1982-),女,主治医师,大学。
10.14126/j.cnki.1008-7044.2017.02.016
R 722.12
A
1008-7044(2017)02-0168-04
2016-10-26)

