信息型氧化还原反应方程式的书写技巧
雷范军++吴惠华

信息型氧化还原反应方程式的书写是2016年全国各地高考化学的必考题型之一,其侧重考查学生对氧化还原反应、离子反应、电化学、质量守恒定律等基本概念和基本理论的应用能力,以及学生的信息素养、自主学习能力、化学语言运用能力。此类题型要求学生提炼新的知识或发现新知识的某些特征,并结合已有知识,合理应用新信息进行推理,以解决新的复杂的化学问题,难度较大。有关信息不仅包括最新的科研成果以及生产工艺,而且包括最新的研究方法、新的工业生产过程以及新的应用。下面以2016年高考化学试题中有关信息型氧化还原反应方程式的书写试题为例,对该类题型的解题方法及技巧进行总结。
一、书写氧化还原反应方程式的基本思维模型
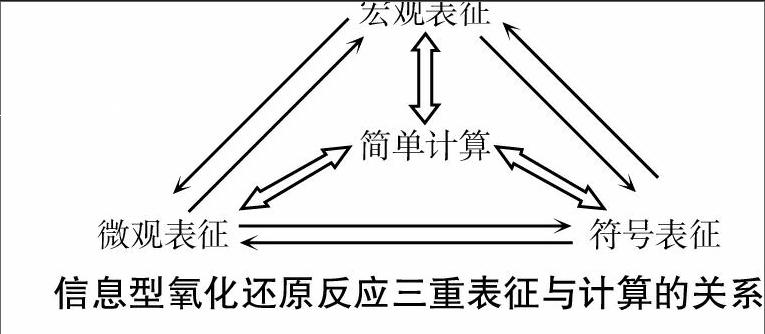
有关氧化还原反应的化学方程式、离子方程式、电极反应式是具有明显学科特征的化学用语。它们既抽象又简单明了,却表征了多个维度、多个层面的信息,从宏观表征上看,可以代表反应物和生成物的宏观性质(气体体积缩小或增大、固体质量减少或增大多少克等)、实验宏观现象、消耗反应物或生成生成物多少摩尔等定性和定量两大方面的诸多关系;从微观表征上看,可以代表其中蕴含的物质组成与结构、分子、原子、离子、转移电子、质量守恒定律(原子守恒、电子守恒、电荷守恒)、电解质的溶解与电离程度、盐类水解等多种信息(详见下图)。分析此类试题的关键是打通任何一个信息型氧化还原反应方程式的三重表征之间的相互转换关系。书写信息型氧化还原反应方程式时,基本思维模型如下:提取实质→推敲原理→配平书写→复核验证。[宏观表征
简单计算][微观表征 符号表征]
信息型氧化还原反应三重表征与计算的关系
1.从题给信息中准确提取实质
根据题给信息书写一个陌生的氧化还原反应方程式,首先要从题给信息中准确提取出氧化剂、还原剂、氧化产物、还原产物,知道反应物和生成物的化学式(或反应物和生成物在溶液中电离出的离子符号)、反应条件、反应是否可逆、是否需要标“↑”和“↓”等基本要素。确定反应物和生成物时,特别要注意元素的化合价及其升降变化,溶液的酸碱性,盐类水解,相关物质的氧化性、还原性,要注意区分最初反应物和中间反应物、最终产物和中间产物,要重视“过量”“少量”“反应物比例”等决定生成物化学式的关键条件。如果从试题提供的新信息中无法准确地提取实质性内容,就难以书写正确的氧化还原反应方程式。
2.推敲有关规则和原理
书写信息型氧化还原反应方程式的常见错误形式较多,主要有写错反应物或生成物的化学式、违反质量守恒定律、违反客观反应事实等。解答过程中一定要认真推敲在酸性或碱性介质中各种反应物和生成物的存在形式、元素化合价升降总数是否相等、两边粒子的电荷总数是否守恒、两边各原子个数是否都相等。首先,要根据题给信息判断反应物和生成物是气体、液体还是固体,如果是水溶液中进行的氧化还原反应,还要考虑是否生成沉淀、是否完全电离、是否存在酸式酸根离子等;其次,要熟悉常见元素的化合价,能够根据化学式中各元素的化合价代数和为零的原则,判断变价元素的化合价,或者根据多核离子中各元素的化合价代数和等于所带电荷数的规则,判断变价元素的化合价,运用氧化还原反应规律,分析判断氧化剂和还原剂中变价元素的价态特征(最高价、中间价、最低价),以及氧化产物和还原产物中变价元素的价态(尤其是常见变价元素的稳定价态)等;最后,要根据物质的分类、电离、水解、化学反应等分析反应所在的酸碱性环境,因为溶液的酸碱性或pH大小决定了元素的存在形式。
3.正向配平氧化还原反应方程式的基本原则和步骤
氧化还原反应的微观本质是电子的转移,氧化剂得电子总数(或元素化合价降低总数)等于还原剂失电子总数(或元素化合价升高总数),电子得失守恒原理是氧化还原反应方程式的配平原则。常用配平方法是元素化合价升降的最小公倍数法,基本步骤如下:一标,标明反应前后化合价有变化的元素的化合价;二等,通过求最小公倍数使化合价升降总数相等;三定,确定氧化剂与还原剂的化学计量系数;四平,用观察法配平其他物质的化学计量系数;五查,检查质量、电荷、电子转移是否分别守恒。
4.复核验证
复核验证是提高答题准确率的重要保证,通常从如下几个方面进行:该氧化还原反应方程式是否只有已经得出的这种情况?是否与试题中所要求的吻合?所写反应物、生成物是否正确?所得出的各种生成物在给定酸性或碱性条件下能否大量共存?是否遗漏了反应条件、“[]”“↑”和“↓”?该条件下所写的生成物能否与过量的反应物继续反应?
例1.(2016·全国卷Ⅲ,改编)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10-3 mol·L-1 。反应一段时间后溶液中离子浓度的分析结果如下表:
[离子\&[SO2-4]\&[SO2-3]\&[NO-3]\&[NO-2]\&Cl-\&c/mol·L-1\&8.35×10-4\&6.87×10-6\&1.5×10-4\&1.2×10-5\&3.4×10-3\&]
(1)NaClO2的化学名称为 。
(2)写出NaClO2溶液脱硫、脱硝过程中主要反应的离子方程式: , 。
解析:(1)NaClO2中氯元素的化合价为0-[(+1)+2×(-2)]=+3,高氯酸钠、氯酸钠、次氯酸钠的化学式分别为NaClO4、NaClO3、NaClO,它们所含氯元素的化合价分别+7、+5、+1,+7 >+5 >+3 >+1,由此推断,NaClO2的化学名称为亚氯酸钠。(2)①亚氯酸不是强酸,其酸性介于氯酸和次氯酸之间,因此NaClO2属于强碱弱酸盐,其溶液呈堿性,由于H+在弱碱性溶液中不能大量共存,因而脱硝过程中的主要反应方程式中不能出现H+,只能用OH-平衡两边的电荷。由表中硫、氮、氯元素的化合价推断,SO2和NO均在脱硝过程中作还原剂,NaClO2作氧化剂,氯元素由+3价降低到-1价,得到4个电子,硫元素由+4价升高为+6价,失去2个电子,氮元素由+2价升高到+5价,失去3个电子,浓度较大的[SO2-4]和[NO-3] 是主要的氧化产物,Cl-是还原产物,结合最小公倍数法、电荷守恒、原子守恒配平可得:[ClO-2]+2SO2+4OH- [2SO2-4] +Cl-+2H2O,4NO+[3ClO-2]+4OH- [4NO-3] +2H2O+3Cl-。前者是脱硫过程中主要反应的离子方程式,后者是脱硝过程中主要反应的离子方程式。
答案:(1)亚氯酸钠
(2)[ClO-2]+2SO2+4OH- [2SO2-4]+Cl-+2H2O 4NO+[3ClO-2]+4OH- [4NO-3]+2H2O+3Cl-
点评:本题需要提取的实质内容是NaClO2溶液脱硫、脱硝过程中主要反应的离子方程式,需要分析该盐溶液的酸碱性。如果根据反应一段时间后溶液中离子浓度及电荷守恒原理判断酸碱性,结果恰好相反,导致失分。
二、逆向配平信息型氧化还原反应方程式的技巧
书写只有一种元素的化合价既升高又降低或分解反应型的氧化还原反应方程式时,由于氧化剂和还原剂是同一种反应物,氧化产物和还原产物是不同的生成物,通常不适合使用正向配平法,宜反其道而行之,采用逆向配平法更方便、更准确。例如,书写硫黄溶于热的浓KOH溶液生成K2S、K2SO3的反应方程式的过程如下。
1.写、标、列、定
写出有关反应物和生成物的化学式,标出变价元素的化合价,列出化合价升高和降低数值(见下图),确定氧化剂、还原剂、氧化产物和还原产物。该反应中变价元素只有硫,因此S既是氧化剂又是还原剂,K2SO3是氧化产物,K2S是还原产物。[S+KOH(浓) [ ]K2S+K2SO3+H2O][0 -2 +4] [化合价升高4][化合价降低2]
2.运用电子得失总数相等、质量守恒定律配平
根据最小公倍数法确定化合价升降总数,进而确定氧化产物、还原产物的化学计量系数,最后分别根据观察法确定既是氧化剂又是还原剂的反应物的系数以及其他反应物和生成物的系数。如该反应中S的化合价既升高又降低,根据化合价升降总数相等知,K2S的化学计量数为2,K2SO3的化学计量数为1,因此S的化学计量数为3。由反应前后钾原子个数相等可知,KOH的系数为6。由反应前后氢原子个数相等可知,H2O的系数为3。即3S+ 6KOH(浓) [ ]2K2S+K2SO3+3H2O。
例2.(2016·全国卷Ⅰ)高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下: [烘炒锅][CO2歧化法][电解法][KMnO4][K2MnO4][沉降
析晶][水浸][平炉][回碱][加热][富氧空气][氢氧化钾][软锰矿][预热]
回答下列问题:
(1)“平炉”中发生的化学方程式为 。
(2)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应。反应中生成KMnO4、MnO2和 (填化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③“电解法”和“CO2歧化法”中,K2MnO4的理论利用率之比为 。
解析:(1)由题意可知,平炉内发生氧化还原反应,MnO2是还原剂,其中所含锰元素由+4价升高到+6价,失去2个电子,发生氧化反应,生成的K2MnO4 是氧化产物。富氧空气中的O2是氧化剂,其中所含氧元素由0价降低到-2价,得到(2×2)个电子,发生还原反应,由最小公倍数法正向配平可得,MnO2、O2的系数分别为2、1。由反应前后锰原子个数相等可知,K2MnO4的系数为2。由反应前后钾原子个数相等可知,KOH的系数为4。由反应前后氢原子个数相等可知,水的系数为2。即2MnO2+4KOH+O2 [ ]2K2MnO4+2H2O。(2)①由题意可知,K2MnO4既是氧化剂又是还原剂,其中所含锰元素由+6价升高到+7价,失去1个电子,KMnO4是氧化产物,同时锰元素又由+6价降低到+4价,得到2个电子,MnO2是还原产物。由最小公倍数法逆向配平可得,KMnO4、MnO2的系数分别为2、1,由反应前后锰原子个数相等可知,K2MnO4的系数为3。由反应前后钾原子个数相等可得,K2CO3的系数为2。由反应前后碳原子个数相等可知,CO2的系数为2。即3K2MnO4+2CO2 2KMnO4+MnO2+2K2CO3。所得正盐还能在溶液中与过量的CO2反应,生成酸式盐,即K2CO3+CO2+H2O 2KHCO3。上述两步反应的总反应式为3K2MnO4+4CO2+2H2O 2KMnO4+MnO2+4KHCO3。②电解槽中阳极发生氧化反应,锰元素由+6价升高到+7价,失去 1个电子,即[MnO2-4] -e- [MnO-4]。阴极发生还原反应,氢元素由+1价降低到0价,得到1个电子,即2H++2e- H2↑或2H2O+2e- H2↑+2OH-。③“电解法”的总反应式为2K2MnO4+2H2O 2KMnO4+H2↑+2KOH,K2MnO4的理论利用率为100%;“CO2歧化法”的总反应式为3K2MnO4+4CO2+2H2O 2KMnO4+MnO2+4KHCO3,K2MnO4的理论利用率为[23]×100%。则二者之比为100%∶[23]×100%=3∶2。
答案:(1)2MnO2+4KOH+O2 [ ]2K2MnO4+2H2O
(2)①KHCO3 ②[MnO2-4] -e- [MnO-4]
H2 ③ 3∶2
点评:本题第(1)問宜用正向配平法,而第(2)问的第③小问宜用逆向配平法,因为前者生成的K2MnO4既是氧化产物又是还原产物,后者消耗的K2MnO4既是氧化剂又是还原剂。无论是哪一种方法,配平原则相同,仅仅是氧化剂、还原剂、氧化产物、还原产物、其余反应物和生成物的系数先后确定的顺序不同。在分析推断上述问题的过程中,要防止出现如下错误:忽视反应条件、反应的可逆性;漏写生成物与过量的反应物继续发生的化学反应,如 例2中,由同温同浓度下,K2CO3的水解程度大于KHCO3可知,K2MnO4溶液中通入CO2气体使体系呈中性或弱碱性时,应该生成碳酸氢钾,而非碳酸钾,但不少学生忽视了上述实质性内容,漏掉了反应K2CO3+CO2+H2O 2KHCO3。
三、定性分析
陌生型氧化还原反应方程式的书写与物质的分类、组成和性质密切相关,书写时要依据物质的电离、离子方程式的书写规则、电荷守恒定律等。
例3.(1)(2016·全国卷Ⅰ)+6价铬的化合物毒性较大,常用NaHSO3将废液中的[Cr2O2-7] 还原成Cr3+,该反应的离子方程式为
。
(2)(2016·全国卷Ⅱ)双氧水是一种重要的氧化剂、漂白剂和消毒剂。双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为 。
解析:(1)由题意可知,NaHSO3是还原剂,其电离出的[HSO-3]中硫元素由+4价升高到+6价,被氧化为[SO2-4],[Cr2O2-7]是氧化剂,其中铬元素由+6价降低到+3价,正向配平可得:[Cr2O2-7] +[3HSO-3] +5H+ 2Cr3++[3SO2-4] +4H2O。(2)双氧水可以被酸性高锰酸钾溶液氧化为氧气,正向配平可得:[2MnO-4] +6H++5H2O2 2Mn2++8H2O+5O2↑。
答案:(1)[Cr2O2-7]+[3HSO-3]+5H+ 2Cr3++[3SO2-4] +4H2O
(2)[2MnO-4]+6H++5H2O2 2Mn2++8H2O+5O2↑
点评:书写信息型氧化还原反应方程式时,有些问题只需要用氧化还原反应的有关概念和规律分析就能进行判断,有些问题则需要用电解质的电离、溶液的酸碱性、粒子的存在形式以及变价元素的常见稳定价态和存在形式等进行综合分析。例如,本题第(1)问中弱酸的酸式酸根离子不能拆写成酸根离子和氢离子的形式,且硫元素只能由+4价升高到相邻的+6价,一定变成硫酸根离子。
四、定量判断
前面几道例题,基本只需要进行定性分析就能写出氧化还原反应方程式,但是还有一些试题往往与氧化还原反应的相关计算综合在一起考查。当试题中既含有定性角度的信息又含有定量角度的信息时,需要根据配平的氧化还原反应方程式或关系式计算氧化剂与还原剂(或氧化产物与还原产物等)的物质的量之比、氧化能力(或还原能力)之比、原料的利用率等。
例4.(2016·江苏卷)过氧化钙 (CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O,反应式为Ca(OH)2+H2O2+6H2O CaO2·8H2O。
水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:[O2 MnO(OH)2 I2 [S4O2-6]] [Mn2+ I- [S2O2-3]]
(1)写出O2将Mn2+氧化成MnO(OH)2的离子方程式: 。
(2)取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.010 00 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧量(用mg·L-1表示),写出计算过程:
。
解析:(1)由題意可知,氧化步骤中锰元素由+2价升高到+4价,失去2个电子,则Mn2+是还原剂,每个Mn2+失去2个电子,而氧元素由0价降低到-2价,得到2个电子,则O2是氧化剂,每个O2得到4个电子,由电子得失守恒、电荷守恒、原子守恒配平可知,O2将Mn2+氧化成MnO(OH)2沉淀的离子方程式是O2+2Mn2++4OH- 2MnO(OH)2↓ ,而非O2+2Mn2++4H2O 2MnO(OH)2↓+4H+。(2)同理,酸性条件下MnO(OH)2氧化I-、Na2S2O3还原I2的离子方程式分别为MnO(OH)2+2I-+4H+ Mn2++I2+3H2O,I2+[2S2O2-3] 2I-+[S4O2-6]。计算该水样中的溶解氧量时,首先,计算标准溶液中Na2S2O3或[S2O2-3]的物质的量,根据I2+[2S2O2-3] 2I-+[S4O2-6]及其中两反应物的物质的量之比等于系数之比,计算被Na2S2O3还原的I2的物质的量。然后,根据MnO(OH)2+2I-+4H+ Mn2+ + I2+3H2O及其中MnO(OH)2与I2的物质的量之比等于系数之比,计算被I-还原的MnO(OH)2的物质的量,根据O2+2Mn2++2H2O 2MnO(OH)2↓+4H+及其中O2和 MnO(OH)2的物质的量之比等于系数之比,计算被Mn2+还原的溶解O2的物质的量。最后,根据m=n·M计算该水样中的溶解氧量(用mg·L-1表示)。
答案:(1)[2Mn2+]+O2+4OH- 2MnO(OH)2↓
(2)在100.00 mL水样中:
I2+[2S2O2-3] 2I-+[S4O2-6]
n(I2) =[c(Na2S2O3)?V(Na2S2O3)2]
=[0.010 00 mol?L-1×13.50×10-3 L2]
= 6.750×10-5 mol
n[MnO(OH)2]=n(I2)=6.750×10-5 mol
n(O2)=[12]n[MnO(OH)2]=[12]×6.750×10-5 mol=3.375×10-5 mol
水中溶解氧量为:[3.375×10-5 mol×32 g?mol-1×1000 mg?g-1 100.00×10-3 L]=10.80 mg·L-1
点评:《考试说明》中还要求学生:“能够将分析解决问题的过程和成果,用正确的化学术语及文字、图表、模型、图形等表达并作出解释的能力。”这种能力实际就是指化学语言的运用能力,这种能力对培养学生的基本科学素养具有重要作用,是推动学生创新意识和实践能力发展的重要基础。为了体现这一考查目标,近年来高考化学试题中有关信息型氧化还原反应方程式的书写及计算问题的回答具有较大的开放性,均需准确运用化学专业语言和文字语言进行分析和表述。不少学生在思维过程和方法上可能问题不大,但是他们的语言表达得不够准确,每年因此失分的情况并不鲜见。
五、定性和定量相结合,进行综合探究
信息型氧化还原反应方程式属于符号表征,信息型氧化还原反应方程式的书写与宏观表征具有密切的联系,二者之间的转换也是近年来高考探究实验、工艺流程、反应原理的相关试题中的常见设问方式。信息型氧化还原反应方程式试题不仅仅涉及元素化合价及其升降变化、氧化剂、还原剂、氧化产物、还原产物、最小公倍数法、正向配平、逆向配平、质量守恒定律、离子共存、物质在酸性或碱性溶液中的存在形式、生成物与过量反应物继续反应等问题,还涉及气体的压强变化、固体的质量变化、溶液中反应生成什么颜色的沉淀或放出什么颜色或气味的气体、是否发生倒吸等宏观实验现象问题。解答此类问题时,需要从书写、配平、物质的性质及变化等定性、定量相互结合的角度去分析和推理。
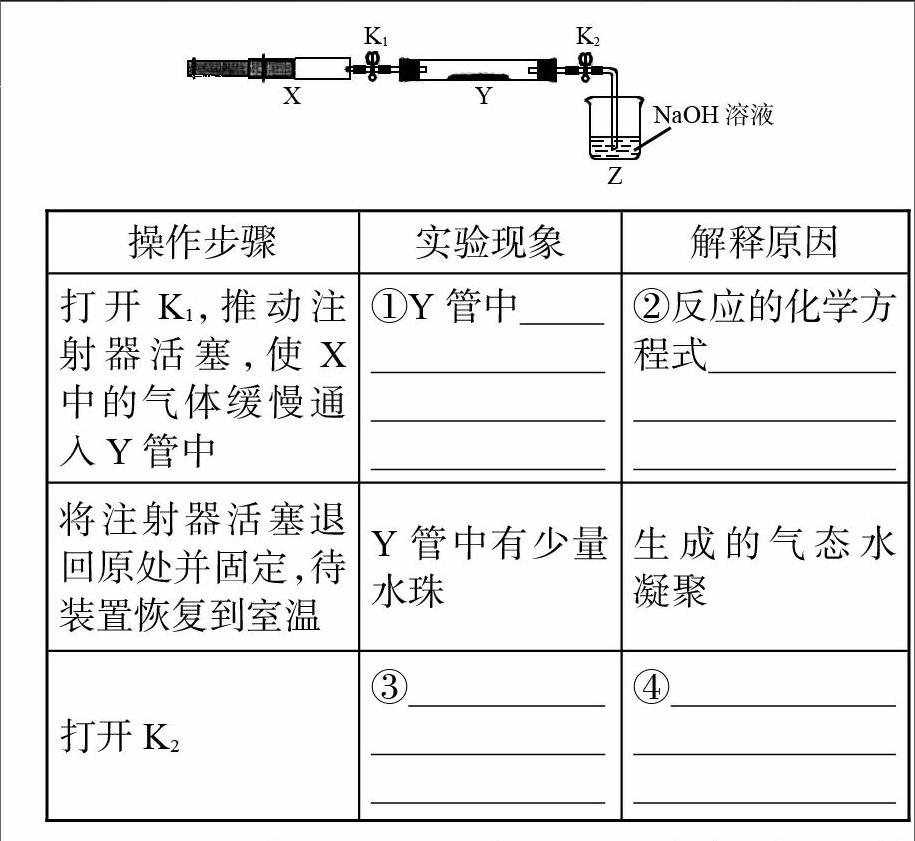
例5.(2016·全国卷Ⅰ)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。将收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按下图所示装置进行实验。
[操作步骤\&实验现象\&解释原因\&打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中\&①Y管中
\&②反应的化学方程式
\&将注射器活塞退回原处并固定,待装置恢复到室温\&Y管中有少量水珠\&生成的气态水 凝聚\&打开K2\&③ \&④ \&]
解析:①NH3、NO2分别是无色气体、红棕色气体,前者具有还原性,后者具有氧化性,二者相遇时能发生归中反应,生成无色无污染的N2和H2O,则Y管中红棕色气体慢慢变浅。 ②由于N2既是氧化产物又是还原产物,因此宜用正向配平法,1个NH3分子失去3个电子,氮元素由-3价升高到0价,1个NO2分子得到4个电子,氮元素由+4价降低到0价,由最小公倍数法配平可得,还原剂和氧化剂的系数分别为4、3。由反应前后氮原子个数相等可知,氧化产物和还原产物(氮气)的系数为[72]。由反應前后氢原子或氧原子个数相等可知,H2O的系数为6。即4NH3+3NO2[催化剂 ][72]N2+6H2O。由于化学方程式中系数不能是分数或小数,因此需要将系数加倍去掉分母:8NH3+6NO2[催化剂 ]7N2+12H2O。④由反应物和生成物的性质可知其状态,则常温常压下Y管中发生的反应为8NH3(g)+6NO2(g)[催化剂 ]7N2(g)+12H2O(l)。由于气体反应物的化学计量系数之和大于气体生成物的化学计量系数(8+6=14 > 7),因此该反应是气体体积或物质的量减小一半的反应。在恒温恒容下,由阿伏加德罗定律的推论(压强之比等于气体的物质的量之比)可知,Y管中气体的压强减小一半。③当打开夹子K2时,因为外界大气压约是Y中气体压强的2倍,外界大气压能够将Z中所盛 NaOH溶液压入Y中,产生倒吸现象。
答案:①红棕色气体慢慢变浅 ②8NH3+6NO2[催化剂 ]7N2+12H2O ③Z中NaOH溶液产生倒吸现象 ④反应后气体分子数减少,Y管中压强小于外压
点评:信息型氧化还原反应的书写及其应用的实质是有关物质及其变化的宏观表征、微观表征、符号表征三者之间的两两转换问题,也是化学教学需要重点突破的问题。只有打通了三重表征之间的联系之门,学生对信息型氧化还原反应方程式的认知才能达到较高的
(下转第27页)
(上接第26页)
程度,才能构建自己的思维导图,使自己的备考更加高效。
综上所述,今年高考化学试题继续秉承“源于教材、高于教材”的命题理念,密切联系生产、生活实际,突出对氧化还原反应方程式的书写及相关计算等应用能力的考查,要求学生利用化学基本概念、基本理论和元素化合物等知识分析和解决实际问题。其在设问角度、呈现方式等方面进行创新,进一步凸显对学生的信息素养以及语言表达能力的考查,加强对学生实验探究能力的考查,有利于区分不同水平的学生,对中学化学课程改革和教学起到积极的引领作用。正因为如此,学生在备战高考时要重视培养运用化学语言及文字表达或交流的能力,仅仅培养答题技巧是不够的。

