比较滴鼻与口服植物乳杆菌NC8对雏鸡T淋巴细胞的影响
(吉林农业大学动物科学技术学院吉林省动物微生态制剂工程研究中心,吉林长春130118)
比较滴鼻与口服植物乳杆菌NC8对雏鸡T淋巴细胞的影响
刘玉颖,杨文涛,赵亮,杨桂连,王春凤
(吉林农业大学动物科学技术学院吉林省动物微生态制剂工程研究中心,吉林长春130118)
随着乳酸菌等安全级微生物在食品、医药、饲料、养殖等领域中的应用及不断发展,正确认识、使用乳酸菌显得尤为重要。为了探寻一个最佳的乳酸菌给予途径,以植物乳杆菌NC8为研究对象,通过滴鼻与口服两种不同途径,按一定剂量免疫雏鸡。并对免疫后雏鸡脾脏及外周血T淋巴细胞含量进行检测。结果表明,植物乳杆菌NC8能够增强雏鸡免疫能力,且滴鼻与口服两种途径相比较,滴鼻途径效果相对显著。
乳酸菌;T淋巴细胞;雏鸡;免疫能力
乳酸菌(Lactobacillus)是以可发酵碳水化合物产生大量乳酸为特点的厌氧菌,具有易于培养、操作简单、安全性高等诸多优点[1]。有研究表明,乳酸菌可通过与宿主免疫系统相互作用发挥免疫调节活性,改善肠道菌群平衡,增强特异性抗体含量[2],增强或抑制[3]T细胞的活化,以及影响细胞因子表达谱的变化。另外,乳酸菌能刺激雏鸡产生多方面免疫反应,提高生产性能[4],并抑制肠道中食源性致病菌的繁殖。
T淋巴细胞是介导细胞免疫的重要细胞,具有多种生物学功能。主要由CD4+T细胞与CD8+T细胞组成。近年来发现,调节性CD4+T细胞通过分泌各种细胞因子在自身免疫性疾病[5]、移植排斥等多种疾病的免疫应答中具有重要调控功能。而CD8+T细胞可杀伤病毒或细菌感染的靶细胞以及肿瘤细胞,是介导细胞免疫的重要效应T细胞[6]。因此,对T淋巴细胞及其相关免疫应答的研究具有重要意义。
植物乳杆菌NC8是从青储饲料中分离的一种乳酸杆菌,本研究通过滴鼻及口服两种不同的途径[7]给予雏鸡一定剂量的NC8,通过流式细胞术检测免疫后雏鸡脾脏及外周血T淋巴细胞表面CD4+T细胞与CD8+T细胞的表达量,以及通过淋巴细胞增殖试验检测免疫后雏鸡脾脏T淋巴细胞的转化能力。以期筛选出一种最佳乳酸菌给予途径,旨在大批量生产养殖中,为禽类饲喂乳酸菌等微生态制剂的作用和途径提供一个参考依据。
1 材料与方法
1.1 菌株植物乳杆菌NC8由吉林农业大学动物微生态实验室保存。
1.2 实验动物1日龄未接受免疫无病源雏鸡50羽,购自北京梅里亚维通实验动物技术有限公司;鸡笼火焰消毒,水槽、饲槽等器具严格蒸煮消毒,自由饮水、采食。
1.3 主要试剂与仪器RPMI-1640(GIBCO公司);胎牛血清(GBICO公司);Mouse Anti-Chicken CD8α-PE、Mouse Anti-Chicken CD3-FITC、Mouse Anti-Chicken CD4-RPE(Southern Biotech公司);淋巴细胞分离液(GE Healthcare Bio Sciences公司);PHA-P(Sigma公司);MTS(Promega公司); FACSCanto II流式细胞仪(美国BD公司);CO2培养箱(Hereaus公司);酶标仪(美国BIOTEK公司)。
1.4 NC8的活化在超净工作台中,用镊子夹取白色移液枪头沾取少量NC8冻干粉粉末,将枪头一并投入5 mL MRS液体培养基中,37℃静置厌氧培养10 h后,将菌液沉淀摇起至均匀后,吸取100 μL加入5 mL MRS液体培养基传代培养10 h,测OD值约为2.3左右,取100 μL菌液进行倍比稀释,涂于MRS固体培养基,单个菌落计数,最终用1.0×109CFU/200 μL NC8菌液剂量以口服、滴鼻两种不同途径免疫雏鸡。连续免疫3 d为1次,间隔1 d,共4次[8]。
1.5 流式细胞术检测雏鸡T淋巴细胞含量脾脏及外周血单细胞悬液的制备:(1)雏鸡给予乳酸菌14 d后,翅下无菌采集外周抗凝血,等体积稀释。处死,无菌操作剪开腹腔,分离脾脏。将200目叠好铜网置于35 mm无菌平皿中,加入1 mL RPMI-1640培养基(10%胎牛血清、1%双抗),取鸡1/4脾脏置于铜网上,用平底注射器内芯缓慢研磨得到单细胞悬液;(2)用淋巴细胞分离液对脾脏单细胞悬液及外周血进行分离,得到的淋巴细胞层液体加入1 mL冷的RPMI-1640培养基,洗涤细胞沉淀2次后,用1 mL RPMI-1640培养基重悬细胞,得到单细胞悬液,置于4℃,备用。原液50倍稀释,显微镜下细胞计数板计数;(3)将备好的脾脏及外周血单细胞悬液以每管1×106个细胞进行分管,用1 mL FACS洗涤细胞沉淀2次,2 000 r/min(4℃)离心5 min,弃上清,留100 μL重悬细胞。加入稀释好的流式抗体,混匀后4℃孵育40 min。用1 mL FACS洗涤细胞沉淀2次,留100 μL重悬细胞,BD FACSCanto II流式细胞仪检测。
1.6 MTS比色法检测雏鸡脾脏淋巴细胞增殖将上述淋巴细胞悬液,按5×105Cell/100 μL体系进行铺板,整个操作过程需严格保证无菌。试验设置空白对照组(加RPMI-1640)、对照组(加淋巴细胞悬液)和试验组,每组设3个重复孔。取5×105个淋巴细胞置于96孔板中补加RPMI-1640至90 μL,试验组加入10 μL PHA-P(终浓度为10 μg/mL),42℃,5%CO2培养44 h;然后加入MTS,20 μL/孔; 42℃,5%CO2的环境下培养4 h。用酶标仪于490 nm波长检测各孔吸光度(A)值,并计算刺激指数(SI)。SI=[(试验组的A值-空白对照组的A值)/ (对照组的A值-空白对照组的A值)]。
2 试验结果
2.1 雏鸡脾脏及外周血中T淋巴细胞数量的变化结果T淋巴细胞两个重要的表面标志是CD4+和CD8+,二者是机体免疫调节的枢纽,在免疫反应中具有重要作用。本试验检测雏鸡脾脏、外周血CD4+、CD8+T细胞含量以及CD4+/CD8+值。结果显示:(1)滴鼻与口服NC8组雏鸡脾脏CD4+T细胞含量与空白对照组相比均显著(P<0.05,图1)升高。滴鼻与口服NC8组雏鸡外周血中CD4+T含量与空白对照组相比升高差异均极显著(P<0.01,图2);(2)滴鼻与口服NC8组雏鸡脾脏中CD8+T淋巴细胞含量与空白对照组相比均有升高,但差异不显著(图1)。然而,滴鼻与口服NC8组雏鸡外周血中CD8+T淋巴细胞含量与空白对照组相比升高差异均显著(P<0.05,图1.2);(3)脾脏与外周血淋巴细胞CD4+/CD8+比值均显示,滴鼻与口服NC8组雏鸡与空白对照组相比均有所升高,尤其,滴鼻NC8组雏鸡脾脏CD4+/CD8+比值与空白对照组相比差异极显著(P<0.01,图3),口服NC8组雏鸡与空白对照组相比差异显著(P<0.05,图1.3)。提示口服与滴鼻NC8均能在一定程度上增强雏鸡免疫力,两种途径相比,滴鼻NC8效果相对显著。
2.2 雏鸡脾脏T淋巴细胞增殖能力的检测雏鸡免疫NC8 14 d后,分离脾脏淋巴细胞,MTS比色法检测T淋巴细胞增殖能力。结果显示,滴鼻与口服NC8组雏鸡脾脏T淋巴细胞增殖能力与空白对照组相比均有增强,其中滴鼻免疫植物乳杆菌NC8极显著(P<0.001,图4)增强了雏鸡淋巴细胞增殖活性,而口服植物乳杆菌NC8与空白对照组之间差异不显著。
3 讨论

图1 滴鼻/口服免疫植物乳杆菌NC814天后雏鸡脾脏T淋巴细胞含量

图2 滴鼻/口服免疫植物乳杆菌NC814d后雏鸡外周血T淋巴细胞含量

图3 滴鼻/口服免疫植物乳杆菌NC814d后雏鸡脾脏(左)外周血(右)CD4+/CD8+比值变化
在以往的研究中,各种益生菌通过免疫调节活性具有显著的抗菌作用,且口服乳酸菌已被证明能有效的预防流感病毒感染小鼠[9-11]。完整的细菌通过胃的酸性环境,可能会受到损伤,故有人建议鼻内给予乳杆菌属,可直接增加呼吸系统的免疫作用,进而有效地防止呼吸道感染。有报道表明,共生细菌能保持肠道内的免疫平衡,在呼吸道黏膜[12]通过适当的激活炎症反应调节免疫,因此对滴鼻与口服乳酸菌增强机体免疫能力这两种途径进行比较显得极具意义。
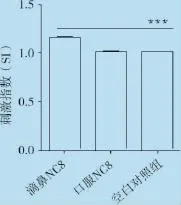
图4 滴鼻/口服免疫植物乳杆菌NC8 14d后雏鸡脾脏淋巴细胞增殖能力变化
CD4+和CD8+T细胞是机体免疫调节的枢纽,正常值范围内的CD4+/CD8+值高时,表明机体处于高的免疫状态,当CD4+/CD8+的比例失调或缺陷时,会导致各种免疫疾病发生。本研究中试验组的CD4+T淋巴细胞含量、CD4+/CD8+值均高于对照组,尤其是滴鼻NC8组极其显著。试验结果表明,一定剂量的植物乳杆菌NC8可以增强雏鸡细胞免疫能力,且以滴鼻的方式免疫效果相对较好。此外,由于CD4+T细胞在功能上具有辅助B淋巴细胞产生抗体的作用,因此我们下一步将会对NC8提高雏鸡体液免疫方面进行研究。
本试验通过比较乳酸菌提高雏鸡免疫能力的两种不同途径,旨在改善传统乳酸菌饲喂模式,优化乳酸菌在畜禽养殖业中的益生作用,以期更好的抑制病原菌和抗感染,尽量避免抗生素应用,减少药物残留,促进绿色、健康养殖。
[1]王春凤.重组基因工程乳酸菌的研究进展[J].吉林农业大学学报,2008,30(4):571-579.
[2]Kikuchi Y,Kunitoh-Asari A,Hayakawa K,et al.Admin istration of Lactobacillus plantarum Strain AYA Enhances IgA Secretion and Provides Survival Protection against Influenza Virus Infection in Mice[J].PLoS One.2014Jan22;9(1):e86416.doi:10.1371.
[3]Yoshida A,Yamada K,Yamazaki Y,et al.Lactobacillus gasseri OLL2809and its RNA suppress proliferation of CD4+T cells through a MyD88-dependent signalling pathway[J].Immunology,2011Aug;133(4):442-451.
[4]廖玉英,黄英飞,韦凤英,等.不同益生菌制剂对黄羽肉鸡生长性能不同益生菌制剂对黄羽肉鸡生长性能、屠宰性能及肉品质的影响[J].中国家禽,2014,23:29-32.
[5]Tesmer L A,Lundy K,Sarkar S,et al.Th17cells in human disease.Immunol[J].Immunol Rev,2008Jun,223:87-113.
[6]Jenkins MR1,La Gruta N L,Doherty P C,et al.Visualizing CTL activity for different CD8+effector T cells supports the idea that lower TCR/epitope avidity may be advantageous for target cell killing[J].Cell Death Differ,2009Apr,16(4):537-542.
[7]Youn H N,Lee D H,Lee Y N,et al.Intranasal administration of live Lactobacillus species facilitates protection against influenza virus infection in mice[J].Antiviral Res,2012Jan,93(1):138-143.
[8]Youn H N,Lee Y N,Lee D H,et al.Effect of intranasal administration of Lactobacillus fermentum CJL-112on horizontal transmission of influenza virus in chickens[J].Poult Sci,2012Oct,91 (10):2517-2522.
[9]Shao-Hua Shi,Wen-Tao Yang,Gui-Lian Yang,et al.Immunoprotection against Influenza Virus H9N2by the Oral Administration of Recombinant Lactobacillus plantarumNC8 Expressing Hemagglutinin in BALB/c Mice[J].Virology,2014Sep,464-465: 166-176.
[10]He F,Morita H,Kubota A,et al.Effect of orally administered non-viable Lactobacillus cells on murine humoral immune responses[J].Microbiol Immunol,2005,49(11):993-997.
[11]Inoue R,Nishio A,Fukushima Y,et al.Oral treatment with probiotic Lactobacillus johnsonii NCC533(La1)for a specific part of the weaning period prevents the development of atopic dermatitis induced after maturation in model mice,NC/Nga[J].Br J Dermatol,2007,156(3):499-509.
[12]Hori T,Kiyoshima J,Shida K,et al.Effect of intranasal administration of Lactobacillus casei Shirota on influenza virus infection of upper respiratory tract in mice[J].Clin.Diagn.Lab.Immunol,2001,8,593-597
Comparison the Effect of intranasal and oral administration of Lactobacillus plantarum NC8in chicken on T lymphocytes
LIU Yu-ying,YANG Wen-tao,ZHAO Liang,YANG Gui-lian,WANG Chun-feng
(College of Animal Science and Technology,Jilin Agricultural University,Jilin Provincial Engineering Research Center of Animal probiotics,Changchun 130118,China)
With the applicationand development of the safety level of microorganisms such as Lactic acid bacteria in the fields of food,medicine,feed,etc,understanding and use of lactic acid bacteria is particularly important.To develop an effective way to administratrate the lactic acid bacteria,a lactobacillus plantarum NC8 was selected in this study.After the administration of a certain dose of lactic acid bacteria by the intranasal and oral ways.then T lymphocyte in spleen and peripheral blood of chickens were analyzed test.The results showed that NC8 could enhance the immune ability of chickens,Compared with oral administration,the effect of intranasal route was relatively obvious.
Lactic acid bacteria;T lymphocytes;chicken;Immunity
s:YANG Gui-lian;WANG Chun-feng
S858.31
A
0529-6005(2017)01-0023-04
2015-07-21
国家“863”计划项目(2013AA102806,2011AA10A-215);国家自然科学基金项目(31272552,31272541,81170358);教育部新世纪优秀人才支持计划项目(NCET-10-0175);吉林省科技发展计划项目(20111816);吉林省世行贷款农产品质量安全项目(2011-Y07)
刘玉颖(1988-),女,硕士生,主要从事动物微生态与黏膜免疫的研究,E-mail:462532430@qq.com
杨桂连,E-mail:yangguilian@jlau.edu.cn;王春凤,E-mail:wangchunfeng@jlau.edu.cn

