大片段PCR方法检测CYP2D6*5基因分型的选择与优化
柴 琳,刘 红,许 莉,李一石
·药学研究·
大片段PCR方法检测CYP2D6*5基因分型的选择与优化
柴 琳,刘 红*,许 莉,李一石
目的 经过比较选择更优化的大片段PCR方法,应用到临床研究中对CYP2D6*5基因分型检测。方法 选择两种大片段PCR方法(传统和巢式大片段PCR)进行比较优化,并对329例健康男性人群进行CYP2D6*5基因分型的检测。结果 本研究中传统大片段PCR方法分型检测率为92.6%,巢式大片段PCR方法分型检测率为100%;在研究群体中CYP2D6*5等位基因的发生频率为3.9%(n=26)。结论 优化的大片段PCR方法使CYP2D6*5基因分型更高效明确,且巢式大片段PCR方法优于传统大片段PCR方法。
CYP2D6*5;大片段PCR;巢式大片段PCR;基因分型
0 引言
药物代谢酶参与了多种药物在人体内的代谢[1],其具有3种表型:弱代谢型(PM)、中间代谢型(IM)和快代谢型(RM)[2]。目前已知药物代谢酶的3种表型与其基因多态性有关。其中,弱代谢者会引起更多临床关注,因其在药物正常剂量下会产生过度或持续的治疗作用(或者药物相关毒性),即基因倾向的药物不良影响。除此之外,对于需要被药物代谢酶活化的化合物,弱代谢者的药物反应会被削弱,即弱代谢者很可能在标准剂量下无法达到理想的治疗效果。
细胞色素P450 2D6(CYP2D6)介导多种药物(如抗抑郁药物、阿片类药物、抗精神病药物和β-肾上腺素受体阻滞剂等)的氧化代谢[3]。CYP2D6的基因具有高度多态性,已有100多个等位基因变异[4],这些基因多态性可能引起个体或种族间CYP2D6的体内活性差异。对于CYP2D6弱代谢者,在高加索人中约占5%~10%[5];然而在中国、日本等亚洲人群中仅占1%~2%左右[6]。导致其弱代谢的等位基因变异有CYP2D6*3(移码突变)、CYP2D6*4(碱基置换突变)和CYP2D6*5(缺失突变),其中CYP2D6*5导致药物代谢酶失活。CYP2D6*5是一种CYP2D6全基因缺失的突变体,在高加索人中的出现频率为2%~7%[3],在中国人中为3%~7%[7-8]。
目前,CYP2D6*5基因分型通常采用DNA印迹杂交或Taqman探针等方法,通常比较复杂、昂贵、耗时;大片段PCR法可将整个基因缺失扩增出来,相对低廉,操作性强,辨识度高。由于长模板扩增自身的困难性,CYP2D6*5检测的相关文献报道很少。本研究对比了2种针对CYP2D6*5基因分型检测的大片段PCR方法,即传统大片段PCR方法[9]和巢式大片段PCR法[10],旨在选择更优化的大片段PCR方法,应用于临床研究中对CYP2D6*5基因分型检测中。
1 材料和方法
1.1 材料
1.1.1 血样标本 选择329例健康男性志愿者,所有标本都来自中国汉族人群。伦理委员会批准该项研究进行,并获得了所有参与受试者的知情同意。
1.1.2 主要试剂和仪器 LA Taq试剂盒(宝生物工程有限公司),λDNA HindⅢ、1 kb DNA Ladder(天根生化科技有限公司),普通PCR仪(美国ABI 9700),琼脂糖水平电泳仪(北京市六一仪器厂),全自动数码凝胶成像分析系统(上海天能Tanon 2500),常规耗材均为Axygen公司。
1.1.3 引物 CYP2D6*5基因分型检测引物由英潍捷基(上海)贸易有限公司合成。引物序列见表1。

表1 CYP2D6*5基因分型试验引物列表
1.2 方法
1.2.1 DNA提取 采用血液基因组DNA提取试剂盒(天根)按照说明提取全血DNA。
1.2.2 传统大片段PCR方法 利用大片段PCR法进行CYP2D6*5基因分型试验。大片段PCR反应在20 μL总体积中进行,包括0.1 μmol/L引物CYP2D6*5-F1和CYP2D6*5-R2,1 μmol/L引物CYP2D6*5-F3,0.3 mmol/L dNTPs,2.5 mmol/L MgCl2,LA PCR缓冲液,1 U LA Taq酶与1.6 μL基因组DNA。反应条件参数:94 ℃预变性1 min;98 ℃变性20 s,70 ℃延伸6 min,进行30个循环;然后70 ℃继续延伸6 min。反应结束后,取5 μL PCR扩增产物在0.7%琼脂糖凝胶上进行电泳检测。
1.2.3 优化的传统大片段PCR方法 对传统大片段PCR方法进行优化:扩大PCR反应体系至50 μL,两对引物分别在独立的PCR体系中进行扩增。优化的大片段PCR反应在50 μL总体积中进行,包括0.2 μmol/L引物CYP2D6*5-F1和CYP2D6*5-R2(另一体系为0.2 μmol/L引物CYP2D6*5-F3和CYP2D6*5-R2),0.3 mmol/L dNTPs,2.5 mmol/L MgCl2,LA PCR缓冲液,2 U LA Taq酶与1.6 μL基因组DNA。反应条件参数同前。
1.2.4 巢式大片段PCR方法 利用巢式大片段PCR的方法进行CYP2D6*5基因分型试验。巢式大片段PCR的第1次PCR反应在50 μL总体积中进行,包括0.3 μmol/L引物CYP2D6*5-i和CYP2D6*5-ii,0.15 μmol/L引物CYP2D6*5-iii和CYP2D6*5-iv,0.4 mmol/L dNTPs,10×含Mg2+LA PCR缓冲液,1 U LA Taq酶与150 ng基因组DNA。反应条件参数见表2。

表2 巢式大片段PCR反应条件
反应结束后取5 μL PCR扩增产物在1%琼脂糖凝胶上进行电泳检测。第1次PCR的扩增产物50倍稀释后作为巢式大片段PCR的第2次PCR反应模板。第2次PCR反应在50 μL总体积中进行,包括0.3 μmol/L引物CYP2D6*5-v和CYP2D6*5-vi,0.15 μmol/L引物CYP2D6*5-iii和CYP2D6*5-vii,1.0 mmol/L dNTPs,10×含Mg2+LA PCR缓冲液,2.5 U LA Taq酶与1 μL扩增产物稀释液。反应条件同前。反应结束后取2 μL PCR扩增产物10倍稀释液在1%琼脂糖凝胶上进行电泳检测。
1.2.5 优化的巢式大片段PCR方法 对巢式大片段PCR方法进行优化:增加dNTPs浓度到1.0 mmol/L,增加LA Taq酶到2.5 U。同时对反应条件进行优化,具体参数见表3。

表3 优化后巢式大片段PCR反应条件
2 结果
2.1 传统大片段PCR及优化 图1为传统大片段PCR方法,引物F1、R2扩增出3.5 kb条带,为CYP2D6*5检测的特异性片段;引物F3、R2扩增出4.7 kb条带,为CYP2D6基因特异性片段。优化后的独立反应体系与混合反应体系相比较,扩增条带更清晰,分型更明确。

图1 传统大片段PCR及优化CYP2D6*5基因分型预试验
图1为传统大片段PCR方法及优化,Marker为λDNA HindⅢ Ladder,C为空白对照,a、b、c为样品。其中4.7 kb是CYP2D6基因检测的特异性片段,3.5 kb是CYP2D6*5检测的特异性片段。样品a、b检测到2个片段,表明其为CYP2D6*5杂合体,而样品c仅检测到CYP2D6基因特异性片段,未检测到CYP2D6*5。
2.2 巢式大片段PCR及优化 图2为巢式大片段PCR方法,第1次PCR反应中引物i、ii、iii、iv扩增出5.1 kb和3.2 kb 2个条带,其中3.2 kb为CYP2D6*5检测的特异性片段,5.1 kb为CYP2D6基因特异性片段;第2次PCR反应中引物iii、v、vi、vii扩增出4.1 kb和3.1 kb 2个条带,其中3.1 kb为CYP2D6*5检测的特异性片段,4.1 kb为CYP2D6基因特异性片段。优化后的PCR反应不仅大大缩短了反应时间,而且提高了扩增效率,使扩增条带更清晰;巢式大片段PCR方法增加了CYP2D6*5基因分型试验的扩增特异性和分型灵敏度。
图2A为巢式大片段PCR方法,图2B为优化的巢式大片段PCR方法,Marker为1 kb DNA Ladder,C为空白对照,b、c为样品。第1次PCR反应中5.1 kb是CYP2D6基因检测的特异性片段,而3.2 kb是CYP2D6*5检测的特异性片段;第2次PCR反应中4.1 kb是CYP2D6基因检测的特异性片段,而3.1 kb是CYP2D6*5检测的特异性片段。样品b检测到2个片段,表明其为CYP2D6*5杂合体,而样品c仅检测到CYP2D6基因特异性片段,未检测到CYP2D6*5。
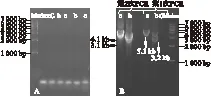
图2 巢式大片段PCR及优化CYP2D6*5基因分型预试验
2.3 优化的CYP2D6*5基因分型试验 采用优化的大片段PCR方法进行CYP2D6*5基因分型试验(见图3、图4),两种方法分型结果一致。对于优化的传统大片段PCR方法,如果加入的DNA模板量不足或者PCR失败,扩增条带不清晰,很容易导致CYP2D6*5分型误判,分型检测率为92.69%。相较而言,优化的巢式大片段PCR方法反应稳定高效,扩增条带清晰,分型明确,分型检测率为100%。

图3 优化的传统大片段PCR CYP2D6*5基因分型试验
图3A为优化的传统大片段PCR中F3/R2体系,图3B为优化的传统大片段PCR中F1/R2体系,Marker为λDNA HindⅢLadder,C为空白对照,1~9为样品。其中4.7 kb是CYP2D6基因检测的特异性片段,而3.5 kb是CYP2D6*5检测的特异性片段。样品2、9检测到2个片段,表明其为CYP2D6*5杂合体,而样品1、3、4、5、6、7、8仅检测到CYP2D6基因特异性片段,未检测到CYP2D6*5。

图4 优化的巢式大片段PCR CYP2D6*5基因分型试验
图4A为第1次PCR反应,其中5.1 kb是CYP2D6基因检测的特异性片段,而3.2 kb是同一PCR反应中CYP2D6*5检测的特异性片段;图4B为第2次PCR反应,4.1 kb是CYP2D6基因检测的特异性片段,而3.1 kb是同一PCR反应中CYP2D6*5检测的特异性片段。Marker为1kb DNA Ladder,C为空白对照,1~9为样品。样品2、9检测到2个片段,表明其为CYP2D6*5杂合体,而样品1、3、4、5、6、7、8仅检测到CYP2D6基因特异性片段,未检测到CYP2D6*5。
2.4 CYP2D6*5基因分型结果 巢式大片段PCR CYP2D6*5基因分型试验结果分析表明,329个样本中有26个样本扩增出2个特异性片段,即CYP2D6*5杂合体。CYP2D6*5在本研究试验群体中的出现频率为3.7%,同相关研究比较略低[7,10]。见表4。

表4 CYP2D6*5基因频率结果
3 讨论
CYP2D6位于22号染色体长臂(33q13.1)上,负责CYP2D6蛋白的调控,参与了很多药物的代谢。CYP2D6基因分型的一大难点是CYP2D6与上游的假基因CYP2D8P和同源基因CYP2D7连接紧密。本研究专注于正确地识别CYP2D6基因缺失,这种缺失会影响许多重要临床药物的代谢。为了在药物临床试验前确定相关的基因信息,需要确定一种简单稳定的CYP2D6基因分型试验体系,以便于快速识别出志愿者中CYP2D6野生型和基因缺失型。由于CYP2D6*5是CYP2D6全基因缺失,需要利用大片段PCR将其从整个基因中扩增出来。正因为长模板扩增的困难性,CYP2D6*5检测的相关文献报道很少。本研究优化了2种CYP2D6*5基因分型试验中大片段PCR方法,提高了扩增的效率和CYP2D6*5分型的准确度。同传统大片段PCR方法相比,巢式大片段PCR通过引物的设计,有效地缩短了扩增产物长度(野生型扩增产物缩短了1 kb,缺失型缩短了300 bp),对于CYP2D6*5基因分型可信度更高。第1次PCR后,基本可以判定CYP2D6*5的基因分型,嵌套在第1次PCR产物中的第2次PCR,减少了误判并增加了分型灵敏度。
总之,本研究优化的两种大片段PCR方法快速可靠,成本低且不需要特殊的试剂和仪器。此外,本研究确定了一种稳定的CYP2D6* 5快速分型方法,即优化的巢式大片段PCR。其可作为一个内部标准应用到CYP2D6基因缺失影响的药物临床研究中。同时,CYP2D6基因绝大多数突变为SNP,用Taqman探针和PCR-RFLP方法即可检测(CYP2D6*5除外),本研究CYP2D6*5的分型检测方法可作为SNP检测分析的补充,对群体进行CYP2D6基因检测分析。
[1] Sim SC,Ingelman-Sundberg M.The Human Cytochrome P450 (CYP) Allele Nomenclature website:a peer-reviewed database of CYP variants and their associated effects[J].Hum Genomics,2010,4(4):278-281.
[2] Gervasini G,Benítez J,Carrillo JA.Pharmacogenetic testing and therapeutic drug monitoring are complementary tools for optimal individualization of drug therapy[J].Eur J Clin Pharmacol,2010,66(8):755-774.
[3] Ingelman-Sundberg M.Genetic polymorphisms of cytochrome P450 2D6 (CYP2D6):clinical consequences,evolutionary aspects and functional diversity[J].Pharmacogenomics J,2005,5(1):6-13.
[4] Sim SC.CYP2D6 allele nomenclature[EB/OL]:http://www.cypalleles.ki.se/cyp2d6.htm,2016-1-19.
[5] Ozawa S,Soyama A,Saeki M,et al.Ethnic differences in genetic polymorphisms of CYP2D6,CYP2C19,CYP3As and MDR1/ABCB1[J].Drug Metab Pharmacokinet,2004,19(2):83-95.
[6] Bertilsson L,Dahl ML,Dalén P,et al.Molecular genetics of CYP2D6:clinical relevance with focus on psychotropic drugs[J].Br J Clin Pharmacol,2002,53(2):111-122.
[7] Ji L,Pan S,Marti-Jaun J,et al.Single-step assays to analyze CYP2D6 gene polymorphisms in Asians:allele frequencies and a novel *14B allele in mainland Chinese[J].Clin Chem,2002,48(7):983-988.
[8] Garcia-Barceló M,Chow LY,Chiu HF,et al.Genetic analysis of the CYP2D6 locus in a Hong Kong Chinese population[J].Clin Chem,2000,46(1):18-23.
[9] Okubo M,Murayama N,Miura J,et al.A rapid multiplex PCR assay that can reliably discriminate the cytochrome P450 2D6 whole-gene deletion allele from 2D6*10 alleles[J].Clin Chim Acta,2012,413(19-20):1675-1677.
[10]Ota T,Hayashida M,Ishii M,et al.Long PCR-based genotyping for a deleted CYP2D6 gene without DNA extraction[J].Drug Metab Pharmacokinet,2014,29(3):283-285.
[11]周仁芳,曾爱平.浙江沿海地区汉族人群CYP2D6基因拷贝数多态性研究[J].中国实验诊断学,2008,12(7):860-863.
Selection and optimization of long-PCR method for CYP2D6*5 genotyping assay
CHAI Lin,LIU Hong*,XU Li,LI Yi-shi
(Key Laboratory of Clinical Trial Research in Cardiovascular Drugs,Ministry of Health,State Key Laboratory of Cardiovascular Disease,Fuwai Hospital,National Center for Cardiovascular Diseases,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100037,China)
Objective To select a long-PCR method which is applied to the clinical research of CYP2D6*5 genotyping.Methods Two long-PCR methods were selected,compared and optimized to detect the genotyping of CYP2D6*5 in 329 Chinese male subjects.Results In our study,successful detection rate of traditional long-PCR method was 92.6%,however the rate of nested long-PCR method was 100% and CYP2D6*5 allele frequency in our study was 3.9% (n=26).Conclusion Optimization made these two long-PCR methods of CP2D6*5 more effective and accurate.Furthermore,the nested long-PCR is working better than the traditional one.
CYP2D6*5;Long-PCR;Nested long-PCR;Genotyping
2016-09-09
卫生部心血管药物临床研究重点实验室,中国医学科学院阜外医院,北京协和医学院,北京 100037
2010年国家临床重点专科建设项目——《卫生部重点实验室项目》;“重大新药创制”科技重大专项——《心血管创新药物临床研究技术平台建设》(2012ZX09303-008-001)
10.14053/j.cnki.ppcr.201703019
*通信作者

