羟基酪醇对H2O2损伤的神经细胞株PC12凋亡影响及其机制
刘旭东,李静 ,柳太云
(1遵义市第一人民医院,贵州遵义563000;2贵州省人民医院)
羟基酪醇对H2O2损伤的神经细胞株PC12凋亡影响及其机制
刘旭东1,李静1,柳太云2
(1遵义市第一人民医院,贵州遵义563000;2贵州省人民医院)
目的观察羟基酪醇对过氧化氢(H2O2)损伤的神经细胞株PC12凋亡的影响,并探讨其作用机制。方法将第5代对数期PC12细胞分为对照组、H2O2组、观察组进行培养;对照组不加H2O2和羟基酪醇,H2O2组加H2O2,观察组加H2O2及羟基酪醇。细胞培养24 h,采用CCK8比色法测算各组细胞存活率,同时测定各组细胞乳酸脱氢酶(LDH)和ROS,Hoechst 33258 荧光染色法测算细胞凋亡率,实时荧光定量PCR检测各组细胞Bax、Bcl-2、Caspase-3 mRNA,免疫印迹试验检测各组NF-κB、p-NF-κB Ser536蛋白 ,酶联免疫吸附测定法测定各组IL-1β和TNF-α。结果与对照组相比,H2O2组细胞存活率降低(Plt;0.05)、细胞凋亡率上升(Plt;0.05);与H2O2组相比,观察组细胞存活率上升(Plt;0.05)、细胞凋亡率降低(Plt;0.05)。与对照组相比,H2O2组LDH释放率和ROS水平升高(P均lt;0.05);与H2O2组相比,观察组LDH释放率和ROS水平降低(P均lt;0.05)。与对照组相比,H2O2组Bax mRNA相对表达量升高(Plt;0.05)、Bcl-2 mRNA相对表达量降低(Plt;0.05)、Caspase-3 mRNA相对表达量升高(Plt;0.05);与H2O2组相比,观察组Bax mRNA相对表达量降低(Plt;0.05)、Bcl-2 mRNA相对表达量升高(Plt;0.05)、Caspase-3 mRNA相对表达量降低(Plt;0.05)。与对照组相比,H2O2组NF-κB、p-NF-κB Ser536蛋白表达量增加(P均lt;0.05);与H2O2组相比,观察组NF-κB、p-NF-κB Ser536蛋白表达量减少(P均lt;0.05)。与对照组相比,H2O2组TNF-α和IL-1β的水平升高(P均lt;0.05);与H2O2组相比,观察组TNF-α和IL-1β的水平降低(P均lt;0.05)。结论羟基酪醇可抑制H2O2损伤的PC12细胞凋亡,其作用机制是防止LDH从细胞中释放并清除ROS、反向调节相关凋亡基因的表达,同时减少炎症靶蛋白和炎症因子的表达。
羟基酪醇;PC12细胞;神经细胞;嗜铬细胞瘤;细胞凋亡;凋亡基因;乳酸脱氢酶;活性氧簇;炎症因子
活性氧簇(ROS)是氧分子的部分还原代谢产物的总称,具有很高的生物活性,作为第二信使,它们在多种细胞因子生物活性的启动过程中发挥着重要的作用,参与调节细胞的增殖、分化和凋亡[1,2]。氧化应激参与许多神经系统变性疾病的病理进程,包括阿尔茨海默病、帕金森病和亨廷顿氏病[3]。ROS引起生物大分子的不可逆损害是氧化应激的主要结果[4]。特级初榨橄榄油是地中海饮食的核心。流行病学研究[5~7]表明坚持地中海饮食可能降低年龄依赖性神经变性的风险,特别是老年痴呆症。橄榄油中的酚类化合物——羟基酪醇是一种天然抗氧化剂,能有效清除各种自由基[8,9]、抑制癌细胞生长并诱导细胞凋亡[10,11]和保护心血管[12,13]。相比其他自由基清除剂,如维生素E、2,6-二叔丁基对甲苯酚或白藜芦醇,羟基酪醇表现出更强的抗氧化能力[14~16]。有证据表明,羟基酪醇也可发挥神经保护作用,例如,从喂养羟基酪醇的小鼠的脑组织中发现乳酸脱氢酶(LDA)呈羟基酪醇剂量依赖性降低,表明羟基酪醇对啮齿动物神经具有保护作用[17]。此外,羟基酪醇可显著减轻过氧化氢(H2O2)诱导的人神经母细胞瘤细胞的DNA损伤[18]。2015年5月1日~2017年3月30日,我们观察了羟基酪醇对H2O2损伤的神经细胞株PC12凋亡的影响,并对其作用机制进行了探讨。现将结果报告如下。
1 材料与方法
1.1 细胞和试剂 来源于嗜铬细胞瘤的神经细胞株PC12细胞。羟基酪醇,RPMI1640和FBS,抗生素和抗真菌溶液,NF-κB和p-NF-κB Ser536抗体,CCK8,LDH和ROS检测试剂盒,检测TNF-α和IL-1β的ELISA试剂盒。本研究所用引物由上海生物工程公司设计合成。
1.2 方法
1.2.1 细胞分组及培养 将PC12细胞加入含10% FBS、1%双抗的RPMI1640培养基,置37 ℃、体积分数5% CO2、饱和湿度培养箱培养,每2~3 d更换培养基1次。待细胞铺满瓶底80%以上,用0.25%胰酶/0.1% EDTA消化,1 000 r/min离心5 min,按1∶3传代培养。将第5代对数期PC12细胞分为对照组、H2O2组、观察组进行培养。对照组不加H2O2和羟基酪醇,H2O2组加200 μmol/L的H2O2,观察组加200 μmol/L的H2O2及25、50、100 μmol/L 的羟基酪醇 。
1.2.2 细胞存活率测算 采用CCK8比色法。 上述三组细胞(接种于96 孔培养板)培养24 h后,吸去上清,按照说明书每孔加入 CCK8 溶液10 μL及培养基100 μL, 并设置空白对照组(只有培养基100 μL和CCK溶液10 μL而没有细胞)37 ℃避光孵育1 h。酶标仪上测定样本450 nm的光密度值(OD值)。计算细胞存活率, 细胞存活率=[(OD值观察组或H2O2组-OD值空白对照组)/(OD值对照组- OD值空白对照组)]×100%。将对照组的细胞存活率定义为100%。
1.2.3 细胞LDH释放率测算 上述三组细胞培养24 h后,分别收集各组细胞上清液;同时消化收集各组PC12细胞并加入0.2%的Triton X-100裂解细胞,4 ℃、10 000 g 离心2 min ,收集上清。按照LDH检测试剂盒说明书操作,然后在酶标仪上测定490 nm处OD值(细胞上清液中检测的OD值代表胞外OD值,细胞裂解液中检测的OD值代表胞内OD值)。计算LDH释放率,LDH释放率=[胞外OD值/(胞外OD值+胞内OD值)]×100% 。
1.2.4 细胞ROS测定 上述三组细胞培养24 h后,分别加2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)10μmol/L,37 ℃孵育30 min,PBS洗涤3次。收集细胞并用PBS重悬,加入96孔板,按照ROS检测试剂盒说明书,用488 nm激发波长、525 nm发射波长检测各组二氯荧光素(DCF)[DCFH-DA是一种可自由穿过细胞膜的无荧光物质,细胞内的酯酶可将其水解生成不能通透细胞膜的二氯荧光黄(DCFH),细胞内的ROS能够将DCFH氧化生成DCF,DCF可以发出荧光,检测其荧光强弱能够反映细胞内ROS的水平],将检测到的DCF的荧光强度换算成百分比,并以此表示ROS水平。
1.2.5 凋亡细胞检测 采用Hoechst 33258染色法。上述三组细胞(以1×108/L接种于6孔培养板)培养24 h后,用3.7%的多聚甲醛室温下固定30 min,PBS洗涤3次(每次1 min),用Hoechst 33258处理30 min,荧光显微镜下观察并计数凋亡细胞数,计算凋亡率。
1.2.6 细胞Bax、Bcl-2、Caspase-3 mRNA检测 采用实时荧光定量PCR法。上述三组细胞培养24 h后,收集各组细胞,TRIzol抽提总RNA,分光光度计测RNA纯度及浓度后用Revert Aid First Strand cDNA synthesis Kit逆转录为cDNA。采用SYBR green染色法,以各组cDNA为模板,加入缓冲液、引物等进行PCR,各样本重复3次;反应条件:95 ℃变性2 min,以后每个循环条件为95 ℃ 10 s、60 ℃ 20 s、72 ℃ 20 s,循环40次。Bax的上游引物为5′-TCCACCAAGAAGCTGAGCGAG-3′,下游引物为5′-GTCCAGCCCATGATGGTTCT-3′;Bcl-2的上游引物为5′-TTCTTTGAGTTCGGTGGGGTC-3′,下游引物为5′-TGCATATTTGTTTGGGGCAGG-3′;Caspase-3的上游引物为5′-GACAACAACGAAACCTCCG-3′,下游引物为5′-ATCTTCCTTAGAAACACTATCCAT-3′;β-actin的上游引物物为5′-ACTCGTCATACTCCTGCT-3′,下游引物为5′-GAAACTACCTTCAACTCC-3′。Bax、Bcl-2、Caspase-3 mRNA的相对表达量以2-ΔΔCt表示 。
1.2.7 细胞NF-κB、p-NF-κB Ser536蛋白检测 采用Western blotting 法。上述三组细胞培养24 h后,用冷PBS洗涤2次,RARI裂解细胞,离心并收集上清后检测NF-κB、p-NF-κB Ser536蛋白,采用10% SDS-PAGE凝胶胶电泳,用 Quantity One软件分析目的条带的灰度值。
1.2.8 细胞培养液TNF-α、IL-1β检测 上述三组细胞培养24 h后,分别将培养基收集入微量离心管,离心10 min,将上清液分离出来,用ELISA法检测TNF-α和IL-1β。
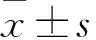
2 结果
2.1 各组细胞存活率比较 加入25、50、100 μmol/L羟基酪醇的观察组细胞存活率分别为66.3%、75.9%、83.4%,H2O2组为58.6%,对照组为100%;H2O2组与对照组相比,Plt;0.05;观察组与H2O2组相比,P均lt;0.05;观察组细胞存活率随羟基酪醇剂量增加而升高(组间相比,P均lt;0.05)。
2.2 各组LDH释放率和ROS水平比较 加入25、50、100 μmol/L 羟基酪醇的观察组LDH释放率分别为180.6%±5.9%、145.7%±7.6%、115.2%±5.5%,H2O2组为203.1%±5.1%,对照组为100.0%±3.9%;H2O2组与对照组相比,Plt;0.05;观察组与H2O2组相比,P均lt;0.05;观察组LDH释放率随羟基酪醇剂量增加而降低(组间相比,P均lt;0.05)。
加入25、50、100 μmol/L 羟基酪醇的观察组ROS水平分别为176.4%±5.6%、142.4%±4.3%、108.8%±2.6%,H2O2组为219.6%±2.8%,对照组为81.3%±2.1%;H2O2组与对照组相比,Plt;0.05;观察组与H2O2组相比,P均lt;0.05;观察组ROS水平随羟基酪醇剂量增加而降低(组间相比,P均lt;0.05)。
2.3 各组细胞凋亡率及Bax、Bcl-2、Caspase-3 mRNA表达比较 100 μmol/L 羟基酪醇观察组、H2O2组、对照组细胞凋亡率分别为38.02%±1.97%、63.99%±4.69%、5.26%±1.12%;H2O2组与对照组相比,Plt;0.05;100 μmol/L 羟基酪醇观察组与H2O2组相比,Plt;0.05。
100 μmol/L 羟基酪醇观察组、H2O2组、对照组Bax mRNA相对表达量分别为1.16±0.08、1.70±0.23、1.00±0.03;H2O2组与对照组相比,Plt;0.01;100 μmol/L 羟基酪醇观察组与H2O2组相比,Plt;0.01。100 μmol/L 羟基酪醇观察组、H2O2组、对照组Bcl-2 mRNA相对表达量分别为0.83±0.03、0.62±0.14、1.00±0.05;H2O2组与对照组相比,Plt;0.01;100 μmol/L 羟基酪醇观察组与H2O2组相比,Plt;0.01。100 μmol/L 羟基酪醇观察组、H2O2组、对照组Caspase-3 mRNA相对表达量分别为1.15±0.04、2.03±0.01、1.00±0.02;H2O2组与对照组相比,Plt;0.01;100 μmol/L 羟基酪醇观察组与H2O2组相比,Plt;0.01。
2.4 各组细胞NF-κB、p-NF-κB Ser536蛋白表达比较 100 μmol/L 羟基酪醇观察组、H2O2组、对照组NF-κB蛋白灰度值分别为1.34±0.01、2.70±0.08、1.00±0.07;H2O2组与对照组相比,Plt;0.01;100 μmol/L 羟基酪醇观察组与H2O2组相比,Plt;0.05。100 μmol/L 羟基酪醇观察组、H2O2组、对照组p-NF-κB Ser536蛋白灰度值分别为1.15±0.07、2.03±0.01、1.00±0.03;H2O2组与对照组相比,Plt;0.01;100 μmol/L 羟基酪醇观察组与H2O2组相比,Plt;0.01。
2.5 各组TNF-α和IL-1β表达比较 100 μmol/L羟基酪醇观察组、H2O2组、对照组TNF-α表达量分别为(140.5±9.7)、 (230.3±10.5)、(10.7±2.3) pg/mL,IL-1β表达量分别为 (260.3±26.2)、(610.5±20.6)、(71.2±15.3)pg/mL;H2O2组与对照组相比,P均lt;0.01;100 μmol/L 羟基酪醇观察组与H2O2组相比,Plt;0.01。
3 讨论
羟基酪醇是橄榄油主要有效成分,可减少H2O2诱导的细胞氧化损伤。本研究结果显示,羟基酪醇可抑制H2O2损伤的PC12细胞凋亡。
氧化应激参与脑缺血和中风的病理生理过程[19]。ROS的积累可能导致各种形式的蛋白质、脂质和DNA氧化,诱导细胞损伤[20]。本研究结果显示,200 μmol/L的H2O2能够显著刺激PC12细胞ROS的积累和LDH释放;加入羟基酪醇后,其以剂量依赖的方式降低ROS的产生并抑制LDH漏出。这些结果表明,羟基酪醇减轻了H2O2诱导的细胞毒性和氧化损伤,阻止细胞凋亡。
ROS被认为是细胞存活、增殖、分化和凋亡的关键介质[21,22]。Bcl-2蛋白家族包括Bax和Bcl-2,与ROS引起的细胞凋亡相关。ROS还可以激活Caspase-3引起参与DNA修复的聚合酶PARP的裂解。本研究发现,200 μmol/L的H2O2诱导PC12细胞细胞凋亡,而且细胞Bax mRNA表达增加、Bcl-2 mRNA表达下降、Caspase-3 mRNA表达增加。而100 μmol/L的羟基酪醇干预后PC12细胞凋亡程度有所降低,而且Bax mRNA表达下降、Bcl-2 mRNA表达增加、Caspase-3 mRNA表达下降。这一结果表明,羟基酪醇通过对PC12细胞Bax、Bcl-2、Caspase-3 mRNA表达的调节而阻止细胞凋亡。
氧化应激诱导的神经炎症是引起神经损伤和相关疾病的一个重要因素。研究[23,24]表明,慢性炎症涉及神经变性疾病和细胞损伤。许多炎症靶蛋白,包括MMP-9、COX-2、iNOS和某些黏附分子的产生与ROS密切相关[25,26]。NF-κB通过调控多种基因的表达,参与免疫反应、炎症反应和细胞凋亡等。本研究发现,H2O2诱导后,PC12细胞中NF-κB和其活性形式p-NF-κB(Ser536)表达增加,同样TNF-α和IL-1β的表达也显著增加。而加入100 μmol/L羟基酪醇后,NF-κB、p-NF-κB(Ser536)、TNF-α和IL-1β的表达水平均降低。这表明羟基酪醇还能校正H2O2诱导的异常炎症信号通路。
综上所述, 羟基酪醇可抑制H2O2损伤的PC12细胞凋亡,其作用机制是防止LDH从细胞中释放并清除ROS,反向调节相关凋亡基因的表达,同时减少炎症靶蛋白和炎症因子的表达。推测羟基酪醇可以作为抗氧化应激保护剂和细胞内ROS的清除剂,有可能成为治疗缺血性脑损伤的一种新的药物。
[1] Sauer H, Wartenberg M, Hescheler J. Reactive oxygen species as intracellular messengers during cell growth and differentiation[J]. Cell Physiol Biochem, 2001,11(4):173-186.
[2] Goutzourelas N, Stagos D, Spanidis Y, et al. Polyphenolic composition of grape stem extracts affects antioxidant activity in endothelial and muscle cells[J]. Mol Med Rep, 2015,12(4):5846-5856.
[3] Jia BS, Gao Y. Protective effect of trihexyphenidyl on hydrogen peroxide-induced oxidative damage in PC12 cells[J]. Neurosci Lett, 2008,437(1):50-54.
[4] Dasgupta A, Zheng J, Bizzozero OA. Protein carbonylation and aggregation precede neuronal apoptosis induced by partial glutathione depletion[J]. ASN Neuro, 2012,4(3):161-174.
[5] Scarmeas N, Stern Y, Mayeux R, et al. Mediterranean diet,Alzheimer disease, and vascular mediation[J]. Arch Neurol, 2006,63(12):1709-1717.
[6] Scarmeas N, Stern Y, Mayeux R, et al. Mediterranean diet and mid cognitive impairment[J]. Arch Neurol, 2009,66(2):216-225.
[7] Feart C, Samieri C, Rondeau V, et al. Adherence to a Mediterranean diet, cognitive decline, and risk of dementia[J]. JAMA, 2009,302(6):638-648.
[8] De PR, Ruiz GV, Hoult JR. Inhibition of leukocyte 5-lipoxygenase by phenolics from virgin olive oil[J]. Biochem Pharmacol,1999,57(4):445-449.
[9] Manna C, Galletti P, Cucciola V, et al. Olive oil hydroxytyrosol protects human erythrocytes against oxidative damages[J]. J Nutritional Biochem, 1999,10(3):159-165.
[10] Coccia A, Bastianelli D, Mosca L, et al. Extra virgin olive oil phenols suppress migration and invasion of T24 human bladder cancer cells through modulation of matrix metalloproteinase-2[J]. Nutr Cancer, 2014,66(6):946-954.
[11] Coccia A, Mosca L, Puca R, et al. Extra-virgin olive oil phenols block cell cycle progression and modulate chemotherapeutic toxicity in bladder cancer cells[J]. Oncol Rep, 2016,36(6):3095-3104.
[12] Zrelli H, Matsuoka M, Kitazaki S, et al. Hydroxytyrosol reduces intracellular reactive oxygen species levels in vascular endothelial cells by upregulating catalase expression through the AMPK-FOXO3a pathway[J]. Eur J Pharmacol, 2011,660(2-3):275-282.
[13] Zrelli H, Matsuoka M, Kitazaki S, et al. Hydroxytyrosol induces proliferation and cytoprotection against oxidative injury in vascular endothelial cells: role of Nrf2 activation and HO-1 induction[J]. J Agric Food Chem, 2011,59(9):4473-4482.
[14] Visioli F, Bellomo G, Galli C. Free radical-scavenging properties of olive oil polyphenols[J]. Biochem Biophys Res Commun, 1998,247(1):60-64.
[15] Galletti P, Di Gennaro CI, Migliardi V, et al. Diverse effects of natural antioxidants on cyclosporin cytotoxicity in rat renal tubular cells[J]. Nephrol Dial Transplant, 2005,20(8):1551-1558.
[16] Trujillo M, Mateos R, Collantesd T, et al. Lipophilic 3hydroxytyrosyl esters.Antioxidant activity in lipid matrices and biological systems[J]. J Agric Food Chem, 2006,54(11):3779-3785.
[17] Gonzalez-Correa JA, Navas MD, Lopez-Villodres JA, et al. Neuroprotective effect of hydroxytyrosol and hydroxytyrosol acetate in rat brain slices subjected to hypoxia-reoxygenation[J]. Neurosci Lett, 2008,446(2-3):143-146.
[18] Young J, Wahle KW, Boyle SP. Cytoprotective effects of phenolic antioxidants and essential fatty acids in human blood monocyte and neuroblastoma cell lines: surrogates for neurological damage in vivo[J]. Prostaglan Leuk Essent Fat Aci, 2008,78(1):45-59.
[19] Li RC, Morris MW, Lee SK, et al. Neuroglobin protects PC12 cells against oxidative stress[J]. Brain Res, 2008,1190(1):159-166.
[20] Giorgio M, Trinei M, Migliaccio E, et al. Hydrogen peroxide: a metabolic by-product or a common mediator of ageing signals[J]. Nat Rev Mol Cell Biol, 2007,8(9):722-728.
[21] Dröge W. Free radicals in the physiological control of cell function[J]. Physiol Rev, 2002,82(1):47-95.
[22] Bernhardi R, Eugenín J. Alzheimer's disease: redox dysregulation as a common denominator for diverse pathogenic mechanisms[J]. Antioxid Redox Signal, 2012,16(9):974-1031.
[23] Guo RB, Wang GF, Zhao AP, et al. Paeoniflorin protects against ischemia-induced brain damages in rats via inhibiting MAPKs/NF-κB-mediated inflammatory responses[J]. PLoS One , 2012,7(11):1-11.
[24] Bettcher BM , Kramer JH. Inflammation and clinical presentation in neurodegenerative disease: a volatile relationship[J]. Neurocase, 2013,19(2):182-200.
[25] Lee IT, Yang CM. Role of NADPH oxidase/ROS in pro-inflammatory mediators-induced airway and pulmonary diseases[J]. Biochem Pharmacol, 2012,84(5):581-590.
[26] Chiurchiù V, Maccarrone M. Chronic inflammatory disorders and their redox control: From molecular mechanisms to therapeutic opportunities[J]. Antioxid Redox Signal, 2011,15(9):2605-2641.
10.3969/j.issn.1002-266X.2017.43.012
R363
A
1002-266X(2017)43-0038-04
柳太云(E-mail: 515385437@163.com)
2017-06-23)

