甘薯及其近缘野生种三浅裂野牵牛(Ipmoea trifida)原生质体融合的初步研究
李丽++李云
摘要:利用酶解法从贵州省甘薯地方品种兴义薯和二倍体近缘野生种三浅裂野牵牛(I.trifida)的无菌试管苗幼嫩叶柄中分离得到大量原生质体。用聚乙二醇(PEG)融合法融合这2个品种的原生质体,将融合原生质体培养在含有0.05 mg/L 2,4-D和 0.5 mg/L KT的改良MS培养基中。结果表明,3~5 d后融合原生质体发生第1次细胞分裂;培养12周后,形成直径达1~2 mm的小愈伤组织。将这些小愈伤组织转移到含有0.05 mg/L 2,4-D和0.5 mg/L KT的MS培养基上,使愈伤组织增殖。
关键词:甘薯;三浅裂野牵牛(I.trifida);原生质体;PEG融合法
中图分类号: S531.01文献标志码: A
文章编号:1002-1302(2016)12-0094-02
收稿日期:2015-11-04
基金项目:现代农业产业技术体系建设专项资金(编号:CARS-11-C-24);贵州省农业科学院研究生科研创新基金(编号:黔农科合[创新基金]2012008)。
作者简介:李丽(1982—),女,贵州铜仁人,硕士,副研究员,从事甘薯生物技术育种研究。E-mail:ilovelily317@163.com。
通信作者:李云,硕士,研究员,从事甘薯育种研究。E-mail:814480795@qq.com。
贵州省甘薯地方品种较少,且产量低、易感病,制约着贵州甘薯产业的发展。因此,为了丰富贵州省甘薯资源,改良甘薯品质特性,须将地方品种与具有优异基因的野生种进行杂交,从而创造特异的甘薯新材料。而甘薯常规育种一般采用有性杂交和自然芽变的方法进行系统选择,这些方法具有一定的局限性。近年发展起来的原生质体融合技术,对甘薯品种改良和育种具有重要意义。通过原生质体融合,不同种类的原生质体不经过有性阶段,在一定条件下融合创造杂种,能克服甘薯杂交不亲和性,创造甘薯种间杂种。国内外原生质体融合技术在甘薯上的应用已取得很大进展,不仅获得了甘薯融合原生质,而且培育出杂种植株。Sihachakr等首次获得了甘薯原生质的再生植株體系,改良了甘薯品质[1]。Belarmino等用电融合法融合甘薯和三浅裂野牵牛(Ipmoea trifida)(四倍体)的原生质体,获得1株再生植株[2]。Liu等用聚乙二醇(PEG)融合法获得甘薯和I.triloba及I.lacunosa的融合原生质体,获得少量再生植株[3-7]。Zhang等获得了甘薯品种栗子香和I. lacunosa的种间体细胞杂种植株[8]。Guo等获得了甘薯品种徐薯18和I. cairica的46株种间体细胞杂种植株[9]。Yang等获得徐薯18与I. triloba的体细胞杂种植株,并从中筛选出具有膨大块根的抗旱杂种植株[10]。王晶珊等利用PEG融合方法,获得甘薯(I. batatas)B不亲和群内品种Koganesengan和Bitambi的45株原生质体再生植株[11]。但是,目前贵州省尚未有此方面的报道。因此,本研究以甘薯二倍体近缘野生种三浅裂野牵牛(I.trifida)与贵州省地方品种兴义薯为材料,对其原生质体融合进行研究,对于丰富贵州省甘薯种质资源、改善甘薯品质都具有一定的意义。
1材料与方法
1.1植物材料
供试材料为贵州省甘薯地方品种兴义薯和二倍体近缘野生种三浅裂野牵牛(I.trifida)。用其无菌试管苗的幼嫩叶柄分离原生质体。
1.2叶柄原生质体分离和融合
根据Liu等的培养方法[3-7],利用酶解法从贵州省甘薯地方品种兴义薯和I.trifida的叶柄分离得到大量原生质体。在融合处理之前,用W5液[125.0 mmol/L CaCl2·2H2O、154.0 mmol/L NaCl、5.0 mmol/L KCl、5.0 mmol/L葡萄糖、5.0 mmol/L 2-吗啉乙磺酸(MES),pH值为5.6]于 2 000 r/min、4 min离心洗涤1次后,收集原生质体,悬浮于W5液中,使其密度约为 106个/mL。以体积比2 ∶[KG-*3]1混合兴义薯和野生种I.trifida的原生质体悬浮液,将原生质体混合液滴于培养皿底部,在其上滴加PEG融合液[30.0% PEG 6000、0.1 mol/L Ca(NO2)2·4 H2O、0.5 mol/L甘露醇,pH值为9.0],处理10 min。融合处理后,将融合原生质体用W5液洗1次,再用培养基洗2次后进行培养。
1.3融合原生质体培养和愈伤组织的形成
根据Liu等的培养方法[3-7],将融合原生质体培养在含有0.05 mg/L 2,4-D和0.5 mg/L KT的改良MS培养基中,用Parafilm将培养皿密封,将融合原生质体放在27 ℃、黑暗条件下静置培养。4周后,将培养基的甘露醇浓度降低到 0.3 mol/L,蔗糖浓度增至2.0%,其余成分不变。培养8周后,将形成的小愈伤组织转入到含有0.05 mg/L 2,4-D、0.5 mg/L KT和3.0%蔗糖的MS培养基中,在上述条件下继续培养。12周后形成直径1.0~2.0 mm的小愈伤组织,并将其转移到添加0.05 mg/L 2,4-D和0.5 mg/L KT的固体培养基上,在(27±1) ℃、黑暗条件下培养,使愈伤组织增殖。
2结果与分析
2.1原生质体分离和融合
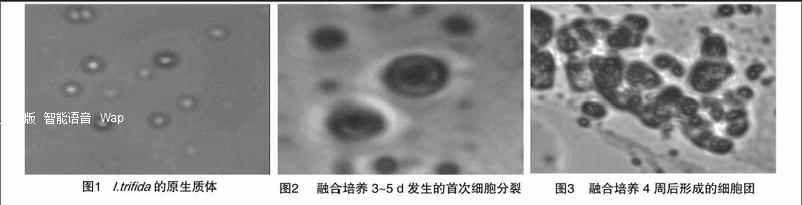
由图1可知,利用酶解法从贵州省甘薯地方品种兴义薯和近缘野生种(I.trifida)无菌苗的幼嫩叶柄中分离得到大量原生质体,呈球形,大小不一,不易看到细胞核。在PEG融合液的作用下,2个亲本的原生质体迅速发生融合。在倒置显微镜下观察可见,原生质体既有二重融合、多重融合,也有未融合的单个原生质体。
2.2融合原生质体培养及愈伤组织形成
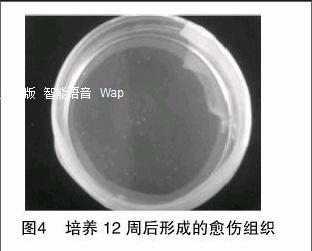
由图2可知,将分离得到的原生质体培养于改良的MS液体培养基中,3~5 d内观察到首次细胞分裂。由图3可见,培养4周后,细胞分裂形成细胞团。将融合原生质体悬浮于液体培养基中,于27 ℃黑暗培养12周后,由图4可见,细胞团形成直径为1.0~2.0 mm的白色松脆愈伤组织,将其转移到添加0.05 mg/L 2,4-D和0.5 mg/L KT的固体培养基上,在27 ℃黑暗条件下培养,可使愈伤组织增殖。
3讨论与结论
本研究利用与Liu等[3-7]相似的培养体系,愈伤组织形成慢,杂种植株再生率低,这与前人报道[1,3-7]一致,其主要原因是叶柄作为分离原生质体的材料不理想。刘庆昌等建立了甘薯胚性细胞悬浮培养系,能在短时间内获得大龄再分化能力高的胚性悬浮细胞[12]。张冰玉等利用甘薯品种栗子香的胚性悬浮细胞原生质体获得与I.triloba叶柄原生质体的融合产物,获得了大量种间体细胞杂种植株[13]。王晶珊等利用甘薯品种Bitambi的胚性愈伤组织原生质体实现了高频率的植株再生[11]。甘薯本身是再分化比较困难的植物[7,11],整个培养过程太长,一般达半年以上,过长的培养周期也会降低细胞的分化能力。如果原生质体数量过少或者活力较差,也会影响彼此间的融合。所以甘薯及其近缘野生种的原生质体融合需要大量有活力的甘薯品种及近缘野生种的原生质体,而且还需要适合融合原生质体植株再生的培养体系。因此,在下一步试验中,笔者将利用甘薯胚性悬浮细胞进行原生质体分离、培养与融合,优化原生质体杂种植株再生体系,以便获得大量愈伤组织,实现种间体细胞杂种植株的有效再生。
[HS2*2][HT8.5H]参考文献:[HT8.SS]
[1]Sihachakr D,Ducreux G. Plant regeneration from protoplast culture of sweet potato(Ipomoea batatas Lam.)[J]. Plant Cell Reports,1987,6(5):326-328.
[2]Belarmino M M,Abe T,Sasahara T. Shoot formation from protoplast-derived calli of sweet potato and its wild relatives and the initiation of somatic hybrid[J]. Japan J Breed,1993,43(S2):15.[HJ1.7mm]
[3]Liu Q C,Kokubu T,Sato M. Plant regeneration from callus and protoplasts of sweet potato,Ipomoea batatas (L.) Lam.[J]. Mem Fac Agr Kagoshima Univ,1992,28:47-53.
[4]Liu Q C,Kokubu T,Sato M. Plant regeneration from protoplast fusion of Ipomoea batatas (L.) Lam and I. triloba L.[J]. Mem Fac Agr,Kagoshima Univ,1993,29:43-47.
[5]劉庆昌,王家旭,李惟基,等. 甘薯及其近缘野生种的原生质体融合和种间体细胞杂种植株再生[J]. 农业生物技术学报,1994,2(1):85-90.
[6][JP2]刘庆昌,米凯霞,周海鹰,等. 甘薯和Ipomoea lacunose的种间体细胞杂种植株再生及鉴定[J]. 作物学报,1998,84(5):529-535.
[7]刘庆昌,王晶珊,国分桢二,等. 甘薯及其近缘野生种原生质体的植株再生[J]. 作物学报,1995,21(1):25-28.
[8]Zhang B Y,Liu Q C,Zhai H,et al. Production of fertile interspecific somatic hybrid plants between sweet potato and its wild relative,Ipomoea lacunosa[J]. Acta Horticulturae,2002,583:81-85.
[9]Guo J M,Liu Q C,Zhai H,et al. Regeneration of plants from Ipomoea cairica L. protoplasts and production of somatic hybrids between I. cairica L. and sweetpotato,I. batatas (L.) Lam[J]. Plant Cell Tissue and Organ Culture,2006,87(3):321-327.
[10]Yang Y,Guan S,Zhai H,et al. Development and evaluation of a storage root-bearing sweetpotato somatic hybrid between Ipomoea batatas (L.) Lam. and I. triloba L.[J]. Plant Cell,Tissue and Organ Culture,2009,99(1):83-89.
[11]王晶珊,刘庆昌,田浦悟,等. 甘薯胚性愈伤组织原生质体的高频率植株再生[J]. 农业生物技术学报,1997,5(3):259-263.
[12]刘庆昌,米凯霞. 甘薯胚性悬浮细胞培养系的建立[J]. 作物学报,1997,23(1):22-26.
[13][JP2]张冰玉,刘庆昌,翟红,等. 甘薯及其近缘野生种种间体细胞杂种植株的有效再生[J]. 中国农业科学,1999,32(6):23-27.

