利用染色体片段代换系定位水稻抽穗开花期耐热性QTL
张昌泉++陈飞++洪燃++李钱峰++顾铭洪++刘巧泉
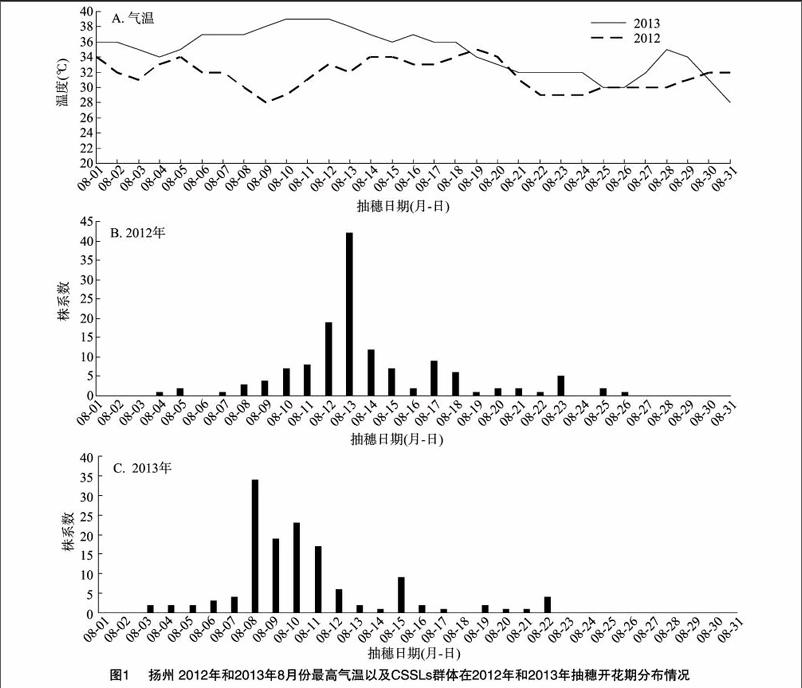
摘要:利用以粳稻日本晴为受体、籼稻9311为供体的经全基因组重测序的染色体片段代换系为材料,以水稻耐热指数[(常温结实率-高温结实率)/常温结实率]为评价指标,通过比较江苏扬州2013年大田极端高温和2012年常温条件下水稻耐热性的差异来定位水稻耐热性QTL (数量性状基因座位)。共检测到3个耐热性QTL,分别位于第2、第4和第12号染色体上,LOD(logarithm of odds)值分别为2.56、4.02和2.79,贡献率分别为4.95%、7.99%和544%。其中qHT12.1表现为正向效应,而qHT2.1和qHT4.1表现为负效应。相关研究为后续耐热QTL的精细定位、克隆和高温钝感型优异品种的培育提供了依据。
关键词:水稻;染色体片段代换系;QTL;耐热性
中图分类号: S511.03文献标志码: A
文章编号:1002-1302(2016)12-0120-04
收稿日期:2016-09-18
基金项目:国家自然科学基金(编号:31561143008、31401354);江苏省自然科学基金(编号:BK20140484);教育部博士点基金(编号:20133250120001)。
作者简介:张昌泉(1981—),男,山东即墨人,博士,讲师,研究方向为水稻品质遗传改良。Tel:(0514)87937537;E-mail:cqzhang@yzu.edu.cn。
通信作者:刘巧泉,博士,教授,研究方向为水稻品质遗传改良。Tel:(0514)87979242;E-mail:qqliu@yzu.edu.cn。
随着全球气候变暖,温室效应加剧,近几年全球范围内极端高温事件发生频繁[1],农作物尤其是水稻产量和品质受到了严重影响[2-3]。研究表明超过水稻最适生长温度后,温度平均每上升1 ℃可造成10%的减产[4]。与此同时,温度的升高也会间接影响气候变化,从而造成高温与干旱同时发生的频率增加,加重了高温以及干旱对水稻产量和品质造成的危害。高温所造成的水稻减产效应主要是通过影响开花期花粉的发育和授粉行为障碍而造成结实率显著下降引起的水稻大幅减产。研究发现,水稻颖壳温度在超过35 ℃的温度下持续1 h就能造成花粉活力丧失而不育[5]。因此,鉴定和筛选耐热性水稻品种资源,定位和克隆耐热相关基因或QTL (quantitative trait loci),深入了解水稻耐热性的分子遗传调控机制是解决水稻高温热害、应对全球气候变暖的根本途径[6]。
近年来在水稻耐热性方面已有较多的报道,研究表明水稻耐热性的遗传基础复杂,是由多基因控制的数量性状。在基因克隆方面,目前只有2个耐热基因被克隆,如OgTT1所编码的蛋白酶体α2亚基能够保护细胞免受热害[7]。此外,Wang等最近克隆的热耐生长调控因子TOGR1能通过调控rRNA的稳定性来忍受热损伤[8]。水稻抽穗开花期育性相关的耐热基因目前尚未有克隆,但已经鉴定出一批与抽穗开花期耐热性相关的重要QTL位點,尽管理论上通过聚合这些QTL可以提高水稻的耐热性,但由于定位QTL所用群体的差异以及QTL重现性的原因,这些QTL很难被有效利用。染色体片段代换系是通过多次回交和自交并结合分子标记辅助选择技术建立起来的一套染色体片段导入系,由于遗传背景单一,在复杂QTL精细定位和克隆方面具有非常强的优势。本研究以1套由粳稻品种日本晴为受体、籼稻品种9311为供体构建的经过全基因组重测序鉴定基因型的染色体片段代换系(chromosome segment substitution lines,CSSLs)为材料[9],通过比较该CSSLs群体在2013年扬州大田极端高温和2012年常温条件下结实率的差异来定位水稻耐热性QTL。相关研究结果对于后续耐热QTL的精细定位和克隆以及高温钝感水稻新品种的培育提供了理论依据。
1材料与方法
1.1试验材料与种植环境
用于本试验的材料包括粳稻品种日本晴和籼稻品种9311和以日本晴为受体、9311为供体构建的1套包括138个系的染色体片段代换系。该套材料是在实验室已经进行全基因组重测序基础上继续扩建并再次进行全基因组重测序基因分型而得到的遗传背景清晰的染色体片段代换系,其中,导入片段覆盖率为95.58%。上述材料分别于2012年和2013年种植于扬州大学试验农场同一试验田,通过随机区组法,每个系种植3个重复,每系40苗。其中9311分2批播种,后续分析所用9311数据为提前批次播种材料(开花期在8月中旬)。
2012年种植的上述试验材料在水稻抽穗开花期大田气候相对2013年较为正常。由图1-A可见,从8月初到8月底,2013年的日最高温度明显高于2012年,且都超过30 ℃。与之对应的试验材料的抽穗开花期大部分位于这一阶段(图1-B、图1-C)。因此,可以通过2年间大田气温的差异来比较分析CSSLs群体对高温的响应。
1.2试验方法
1.2.1水稻田间农艺性状调查与耐热指数
CSSLs群体以及双亲的农艺性状调查包括5项。生育期:通过随机调查每个系5株水稻始穗期到播种期的天数来定义该系的抽穗期;总粒数:通过随机选取每个系的6个主穗,计算每穗总粒数并取平均数;实粒数:在调查总粒数的同时,统计单个穗上所有充实籽粒之和,取其平均数;结实率:单个水稻穗上实粒数与总粒数之比,每个系随机取6个穗,取其平均值。水稻耐热指数定义为每个系2012年(常温)结实率与2013年(高温)结实率的差值除以2012年结实率,该指数越小,说明该系耐热性越好,指数越大,说明该系耐热性越差。
1.2.2Bin-map绘制
基于全基因组重测序数据,参照 Paran 等[10]的方法,根据每个系中包含代换片段的差异和在群体中代换片段的区域重叠,将供体片段人工切割成为一个独立的重组断点(Bin),共构建了138个代换系的重组断点图谱(Bin-Map)图。通过分析,共得到了367个Bin,Bin的大小范围在0.01~8.92 Mb之间。
1.2.3数据处理和QTL定位
农艺性状的输入采用Excel软件完成,基本统计分析采用SPSS 16.0软件完成。利用Windows QTL IciMapping 3.3软件,采用逐步回归似然比的方法来检测籼粳稻染色体片段代换系的遗传效应。将每个Bin计作1个分子标记用于软件分析。LOD值设为2.5,Permutation test为1 000,P<0.05,当LOD值>Permutation test值时,即说明该Bin存在1个QTL位点,并可以得到相应的LOD值、贡献率和效应值。QTL命名遵循McCouch制定的原则[11]。
2结果与分析
2.1亲本及CSSLs群体耐热性的表现
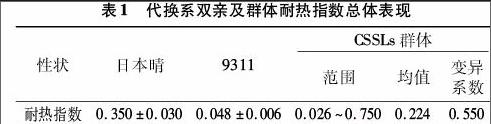
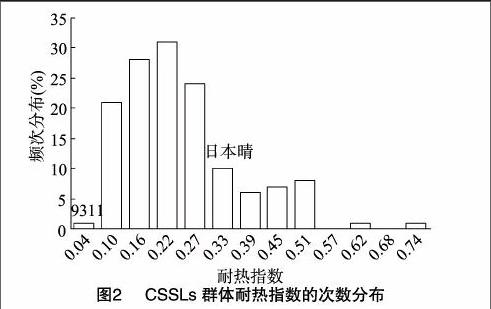
首先分析了CSSLs群体的亲本籼稻9311和粳稻日本晴的耐热指数。由表1可见,9311的耐热指数为0.048,日本晴的耐热指数为0.350,即在高温条件下,9311的平均结实率与正常年份相比下降了4.8%,而日本晴下降了35.0%。这说明2亲本间耐热指数具有极显著差异,并且日本晴易受环境高温影响从而导致结实率变化过大,耐热指数较大,耐热性不好。与之相反,9311受高温影响较小,适应性较强,其基因组中可能携带有耐热相关的QTL或基因。随后分析了CSSLs群体中不同系的耐热指数变化,发现群体耐热性变异幅度非常大,变异系数为0.550。耐热指数从0.026到0.750都有分布,耐热指数均值为0.224。从次数分布(图2)上来看,耐热指数呈现连续性分布特点,其中双亲位于分布柱状图主峰的两侧,说明耐热指数性状是由多基因控制的数量性状,并且CSSLs群体的不同系间差异较大。
2.2耐热性QTL定位
Map图谱,并将每一个Bin计作1个分子标记,利用QTL Icimapping V 3.3软件对耐热性进行了QTL分析。由表2可见,共检测到耐热性QTL 3个,分别位于第2、第4和第12号染色体上。其中qHT2.1被定位在水稻2号染色体上物理位置为470~6.58 Mb之间1.88 Mb的区间内,其表现为负效应,即耐热性较差,但该位点LOD值偏低。而qHT4.1被定位在水稻第4染色体上1段0.57 Mb的区间内,该区段较小且效应值相对最大,但同样为负效应,表现为不耐热。此外,qHT12.1被定位在第12号染色体上1段1.47 Mb的区间内,其表现为正效应,LOD值为2.79,贡献率为5.44%,该位点具有较好的耐热性。
2.3耐熱性QTL稳定性分析
尽管基于生育期分析,CSSLs群体抽穗开花期大部分都位于高温天气范围内,但也有个别系高温年份抽穗开花期对应的日最高温度并不高,因此,重点分析了包含有上述Bin株系的抽穗期和耐热指数,发现这些系的抽穗期都在高温天气范围内且耐热指数也表现出很好的趋势,并无矛盾之处。此外,由图3可见,通过重叠作图法,qHT2.1在4个系中都有携带,且表现出与亲本日本晴极显著的差异。CSSLs群体中有2个系携带qHT4.1,与不含有该位点的系N92以及亲本日本晴的耐热指数同样存在极显著差异。耐热性较强的qHT12.1存在于3个系中,其耐热指数与亲本日本晴相比也存在极显著差异。上述结果表明,这3个检出的QTL比较可靠且在不同的系中能够重复检出。
[FK(W22][TPZCQ3.tif]
3讨论与结论
本研究利用1套经全基因组重测序方式获得的遗传背景清晰的CSSLs群体为研究材料,利用不同年份间水稻抽穗开花期温度的差异作为处理,以相对结实率为耐热性指标,对CSSLs群体的耐热性进行了分析。结果表明,水稻抽穗开花期的耐热性表现为连续分布,属于典型的数量遗传性状。本研究所用的CSSLs群体是在分子标记检测基础上构建并经全基因组重测序方式进行了基因型的鉴定,由于每个株系的遗传背景和供体染色体片段的长度及位置均已准确获知,因此,在QTL定位的精确性方面有了很大的提高[9]。利用该套材料,一共鉴定了3个QTL,其中只有qHT12.1具有较好的耐热性,因此,可以在该区段内开发分子标记以用于高温钝感水稻新品种的培育。另外2个QTL尽管来源于高温钝感的籼稻9311,但其表现为不耐热。因此,在育种利用方面,可以选择日本晴中对应位点的QTL作为耐热QTL加以利用。
近年来关于水稻耐热性QTL定位的报道已有很多,一般采用籼粳交构建的重组自交系进行分析,少数利用籼籼交群体进行了研究。在耐热性鉴定方面都是采用在人工气候室高温处理的策略,尽管有效控制了温度和湿度,但只能模拟自然高温气候条件,而大田高温气候涉及各种因素,其对水稻的热胁迫尚未有QTL定位研究。本研究利用2013年水稻抽穗开花期的自然极端高温天气作为高温处理,与正常温度年份作比较,所鉴定的QTL更能真实反映这些位点的耐热效应。从鉴定结果来看,检出的QTL较少,说明了大田环境的复杂性。从已有的耐热QTL研究来看,赵志刚等利用低世代回交群体鉴定了3个QTL[12];陈庆全等利用籼籼交构建的重组自交系群体仅检测到了1个稳定耐热QTL[13];盘毅等利用重组自交系群体鉴定了2个QTL[14];刘周等利用籼籼交群体构建的BC2F3导入系群体定位到12个耐热性QTL,其中在第12号染色体上检测到的qHSI12.1[15],与本研究中定位到的qHT12.1位置十分接近,且效应也类似,可能是同一个位点;Ye等利用多个群体检测到3个能重复出现的QTL,并利用近等基因系精细定位了其中的qHTSF4.1[16],经比较,该QTL尽管位于4号染色体,但并不与本研究中的qHT4.1重合。本研究中另外鉴定到的2个位点都与已知的不重合,可能是新的位点。综上所述,尽管目前几乎在每一条染色体上都有QTL被检测到,但多数耐热性QTL的遗传效应较小且在不同的品种中差异很大,暗示了抽穗期耐热性的遗传机制非常复杂,为相关基因的精细定位和克隆造成了很大困难。
随着水稻耐热性研究的不断深入,耐热水稻资源的挖掘和有利耐热QTL的鉴定和利用是当下水稻耐热性改良的重要研究方向[6]。尽管已有很多QTL被鉴定出来,但QTL定位的精度和稳定性多数需要进一步验证,只有少数QTL如qHTSF4.1可能比较有利用价值。当然,已经克隆的耐热基因如OgTT1和TOGR1更是后续育种利用的重要基因资源。本研究中定位到的3个QTL由于所在株系遗传背景清晰,效应也比较明确,尤其是qHT4.1的定位區间非常小,为后续QTL精细定位和克隆奠定了很好的基础。对于qHT12.1,由于其表现为耐热性,因此可以以此为供体,用于耐热粳稻新品种的改良。
[HS2][HT8.5H]参考文献:[HT8.SS]
[1]Deryng D,Conway D,Ramankutty N,et al. Global crop yield response to extreme heat stress under multiple climate change futures [J]. Environmental Research Letters,2014,9:034011.
[2]Liu Q H,Wu X,Ma J Q,et al. Effects of high air temperature on rice grain quality and yield under field condition [J]. Agronomy Journal,2013,105(2):446-454.
[3]Zhang C Q,Zhou L H,Zhu Z B,et al. Characterization of grain quality and starch fine structure of two japonica rice (Oryza sativa) cultivars with good sensory properties at different temperatures during the filling stage [J]. Journal of Agricultural and Food Chemistry,2016,64(20):4048-4057.
[4]Peng S,Huang J,Sheehy J E,et al. Rice yields decline with higher night temperature from global warming [J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(27):9971-9975.
[5]Jagadish S V K,Muthurajan R,Oane R,et al. Physiological and proteomic approaches to address heat tolerance during anthesis in rice (Oryza sativa L.) [J]. Journal of Experimental Botany,2010,61(1):143-156.
[6]Sreenivasulu N,Butardo V M J,Misra G,et al. Designing climate-resilient rice with ideal grain quality suited for high-temperature stress [J]. Journal of Experimental Botany,2015,66(7):1737-1748.
[7]Li X M,Chao D Y,Wu Y,et al. Natural alleles of a proteasome α2 subunit [HJ1.85mm]gene contribute to thermotolerance and adaptation of African rice [J]. Nature Genetics,2015,47(7):827-833.
[8]Wang D,Qin B X,Li X,et al. Nucleolar DEAD-Box RNA helicase TOGR1 regulates thermotolerant growth as a pre-rRNA chaperone in rice [J]. PLoS Genetics,2016,12(2):e1005844.
[9]Zhang H,Zhao Q,Sun Z Z,et al. Development and high-throughput genotyping of substitution lines carring the chromosome segments of indica 9311 in the background of japonica Nipponbare [J]. Journal of Genetics and Genomics,2011,38(12):603-611.
[10]Paran I,van der Voort J R,Lefebvre V,et al. An integrated genetic linkage map of pepper (Capsicum spp.) [J]. Molecular Breeding,2004,13(3):251-261.
[11]Mc Couch S R,Kochert G,Yu Z H,et al. Molecular mapping of rice chromosomes [J]. Theoretical and Applied Genetics,1988,76(6):815-829.
[12]赵志刚,江玲,肖应辉,等. 水稻孕穗期耐热性 QTLs分析[J]. 作物学报,2006,32(5):640-644.
[13]陈庆全,余四斌,李春海,等. 水稻抽穗开花期耐热性QTL的定位分析[J]. 中国农业科学,2008,41(2):315-321.
[14]盘毅,罗丽华,邓化冰,等. 水稻开花期高温胁迫下的花粉育性QTL定位[J]. 中国水稻科学,2011,25(1):99-102.
[15]刘周,唐启源,李飞,等. 籼稻开花期耐热性鉴定与 QTL 定位分析[J]. 分子植物育种,2015,13(1):16-31.
[16]Ye C R,Tenorio F A,Redoa E D,et al. Fine-mapping and validating qHTSF4.1 to increase spikelet fertility under heat stress at flowering in rice [J]. Theoretical and Applied Genetics,2015,128(8):1507-1517.

