流溪河入侵鱼类豹纹脂身鲶繁殖生物学研究
刘 飞,韦 慧,顾党恩,牟希东,罗 渡,徐 猛,胡隐昌
(1.农业部休闲渔业重点实验室,中国水产科学研究院珠江水产研究所,广州,510380;2.上海海洋大学水产与生命技术学院,上海 201306)
流溪河入侵鱼类豹纹脂身鲶繁殖生物学研究
刘 飞1,2,韦 慧1,顾党恩1,牟希东1,罗 渡1,徐 猛1,胡隐昌1
(1.农业部休闲渔业重点实验室,中国水产科学研究院珠江水产研究所,广州,510380;2.上海海洋大学水产与生命技术学院,上海 201306)
2015年12月-2016年10月,在广州市流溪河采集入侵鱼类豹纹脂身鲶(Pterygoplichthyspardalis)283尾用于繁殖生物学研究。结果显示:流溪河豹纹脂身鲶在3-9月性成熟系数较高。雄性最小性成熟个体体长204 mm,体重154.88 g;雌性最小性成熟个体体长201 mm,体重183.01 g;最早性成熟年龄均为1龄。其平均成熟卵径为1.87 mm,绝对繁殖力为636-6 148粒,平均绝对繁殖力为2 524.49粒,平均相对繁殖力为10.43粒/g。绝对繁殖力与体长和体重呈显著的正相关。繁殖群体性比为(♀∶♂)为 1∶1.15,符合1∶1比例。卵径分布为单峰型。研究表明豹纹脂身鲶具有性成熟早、繁殖力高等特征,有利于其在分布区域迅速建群扩张,并对河流生态系统形成危害。
豹纹脂身鲶(Pterygoplichthyspardalis);性腺发育;周年变化;怀卵量
鱼类入侵从中世纪的欧洲开始显现,伴随着殖民移民和世界贸易的发展,渐渐席卷全球,对水域生态系统造成严重危害[1]。我国生物多样性资源极为丰富[2],但是外来鱼类入侵已经成为破坏水生生物多样性的主要威胁[3],且在我国愈演愈烈[4]。以云南省为例,由于近年来盲目而频繁的进行鱼类引种,洱海和滇池等高原湖泊原有的鱼类很多已经濒临灭绝[5]。广东省地处我国改革开放的第一线,国际贸易相对我国其他地区较发达,同时气候温暖,适宜生长的物种相对寒冷地区较多,因而成为我国遭受外来鱼类入侵最严重的地区之一[6],外来鱼类如尼罗罗非鱼(Oreochromisniloticus)、莫桑比克罗非鱼(Oreochromismossambica)、奥利亚罗非鱼(Oreochromisaureus)、豹纹脂身鲶(Pterygoplichthyspardalis)、革胡子鲶(Clariasleather)、食蚊鱼(Cambusiaaffinis)、麦瑞加拉鲮(Cirrhinamrigala)、露斯塔野鲮(Labeorohita)、斑点叉尾鮰(Lctaluruspunctatus)和大口黑鲈(Micropterussalmoides)等已成为广东省主要水系渔获物常见种类[7]。但我国对外来鱼类入侵的入侵机制、入侵效应、风险评估及管理对策等相关领域的研究进展还很有限,因而我国应对外来鱼类入侵问题提高重视,加大研究力度,以便降低鱼类入侵对我国生物多样性、入侵地生态系统及生态环境的破坏,并依据这些研究制定相应的生态系统恢复策略[8]。
豹纹脂身鲶,别名清道夫,吸盘鱼、琵琶鱼、琵琶鼠鱼,属于鲶形目(Siluriformes)骨甲鲶科(Loricariidae)翼甲鲶属(Pterygoplichthys)鱼类。原产于南美洲亚马逊河流域,目前已在美国、墨西哥、南非、东南亚、日本、台湾等国家和地区形成入侵[9-12]。据报道,豹纹脂身鲶能够与本地鱼类竞争食物和生境,排挤本地鱼类[13];破坏网具,影响渔民渔业生产活动[14];其掘洞产卵行为能够造成河堤水土流失[15];改变河流养分循环[16]。豹纹脂身鲶最早于1990年作为观赏鱼类引进中国广东省[17],随着观赏渔业贸易传播至全国各省。并于2014年被列入国家环保部和中国科学院发布的入侵物种名单。但对豹纹脂身鲶在野外的建群状况及生态影响尚不清楚。
广州地处亚热带沿海,属海洋性亚热带季风气候,年平均气温21.9 ℃,最低温-2.6 ℃,最高温39.1℃,年降雨量1720.5 mm,平均相对湿度77%。流溪河,珠江水系二级支流,位于广州西北部(113°46' 52" E,23°45' 22" N),主流全长156 km,流域面积2 300 km2,中上游建有国家级光倒刺鲃水产种质资源保护区和从化市级唐鱼自然保护区,是广州市淡水鱼类物种多样性最丰富的区域之一。在2007-2008年广州市渔业资源调查中发现流溪河中有豹纹脂身鲶的分布,但后续并未见关于豹纹脂身鲶入侵生物学相关报道,对其生态影响也不清楚[18]。是否能够在野外繁殖并产生可持续种群是评价外来物种建群成功和生态影响的重要指标。本研究以流溪河人和段为研究区域,按月份采样,探索豹纹脂身鲶繁殖生物学的时间节律,阐明豹纹脂身鲶在流溪河的建群状况,旨在为外来鱼类的管理和防控提供理论依据。
1 材料与方法
1.1 样本采集
用虾笼、刺网和抛网等工具在流溪河人和段采集豹纹脂身鲶样本,采样时间为2015年12月~2016年10月,共计418尾,其中可鉴定出性别的样本共计283尾。
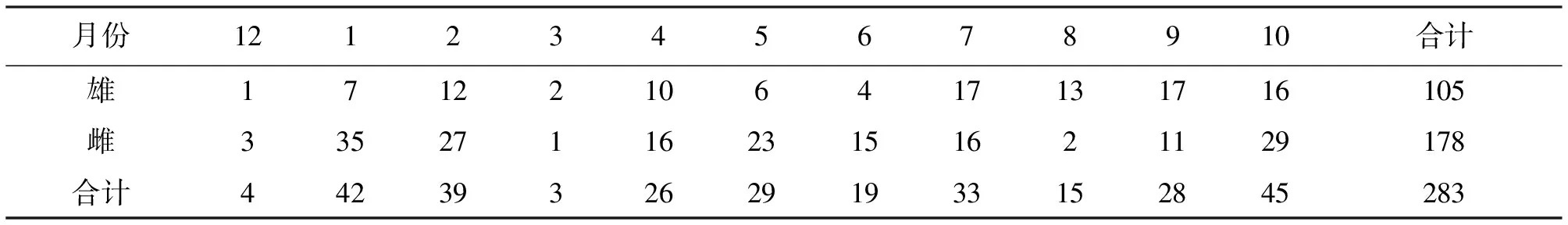
表1 雌雄豹纹脂身鲶样本采集情况表
1.2 样本处理
样品采集后于新鲜状态下测量全长、体长、体重、性腺重、肝胰脏重、脂肪重和去内脏体重。使用电子天平进行质量的测量(精确到0.01 g),使用量程为60 cm的直尺进行形态数据的测量(精确到0.1 cm)。并通过对性腺发育状况,对所有样本的性别进行鉴定,根据性腺形态及色泽特征判别雌性、雄性、未成熟及静息期幼鱼。卵巢淡黄色、黄色,卵粒沉积卵黄的为雌性,精巢淡玫瑰红色或乳白色的为雄性,性腺透明细线状或扁平带状肉眼难以辨别雌雄为未成熟及静息期幼鱼[19]。根据性腺在不同发育期表现出的不同形态特征,分别对应6个性腺发育期,用罗马数字I~ VI表示[18]。采用重量估算法测量绝对繁殖力[20],以成熟期(IV 、V期)卵巢为研究材料,取半个卵巢,称重,用5%的福尔马林溶液固定保存,用计数器计数所有沉淀和可以分离的卵粒,用以计算其绝对繁殖力和相对繁殖力。取IV期卵巢作为卵径测量材料,从卵巢上、中、下、前、后五个部位随机抽取100粒卵,使用数显游标卡尺进行卵径测量,精确至0.01 mm。
1.3 数据处理
成熟系数、肥满度、绝对繁殖力和相对繁殖力分别采用以下公式进行计算[19,21]:成熟系数(Gonado-somatic index)=(性腺重/去内脏体重)×100%,肥满度=(去内脏体重/体长3)×100,绝对繁殖力=(样品卵粒数/样品重)×卵巢重,相对繁殖力=绝对繁殖力/去内脏体重,单位为(粒/g)。IBM SPSS Statistics 22.0软件对测量数据进行数据分析,使用SigmaPlot 10.0和Photoshop CS 6 进行图片处理。
2 结果与分析
2.1 成熟系数与性腺发育期的周年变化
统计283尾(雄:105尾;雌:178尾)个体的月平均成熟系数。12月雌鱼的成熟系数为(0.39±0.14)%,处于周年最低值;12月至2月越冬期间雌鱼卵巢发育96%位于Ⅱ期,越冬后Ⅱ期卵巢开始向Ⅲ期卵巢慢慢发育;4月成熟系数开始显著上升,Ⅲ期卵巢出现比例剧增,并出现少量IV期、V期雌鱼;6-8月份为繁殖旺季,卵巢主要为Ⅳ期、Ⅴ期,7月份雌鱼成熟系数达到峰值(9.74±2.18)%,之后持续缓慢下降,并且随着部分亲鱼繁殖活动的结束,Ⅵ期卵巢出现比例不断提高,雌鱼成熟系数在12月降到谷值(图1A)。周年内雄鱼成熟系数明显低于雌鱼,但成熟系数及性腺发育期周年变化趋势与雌鱼基本保持一致。雄鱼的成熟系数在2月份最低,3月成熟系数上升较慢;4月、5月和6月成熟系数也呈现一路稳定上升的趋势,至7月达到峰值(0.21±0.05)%;8月后繁殖系数开始降低,9月份又出现一个小的峰值(0.17±0.07)%,之后逐步降低(图1B)。
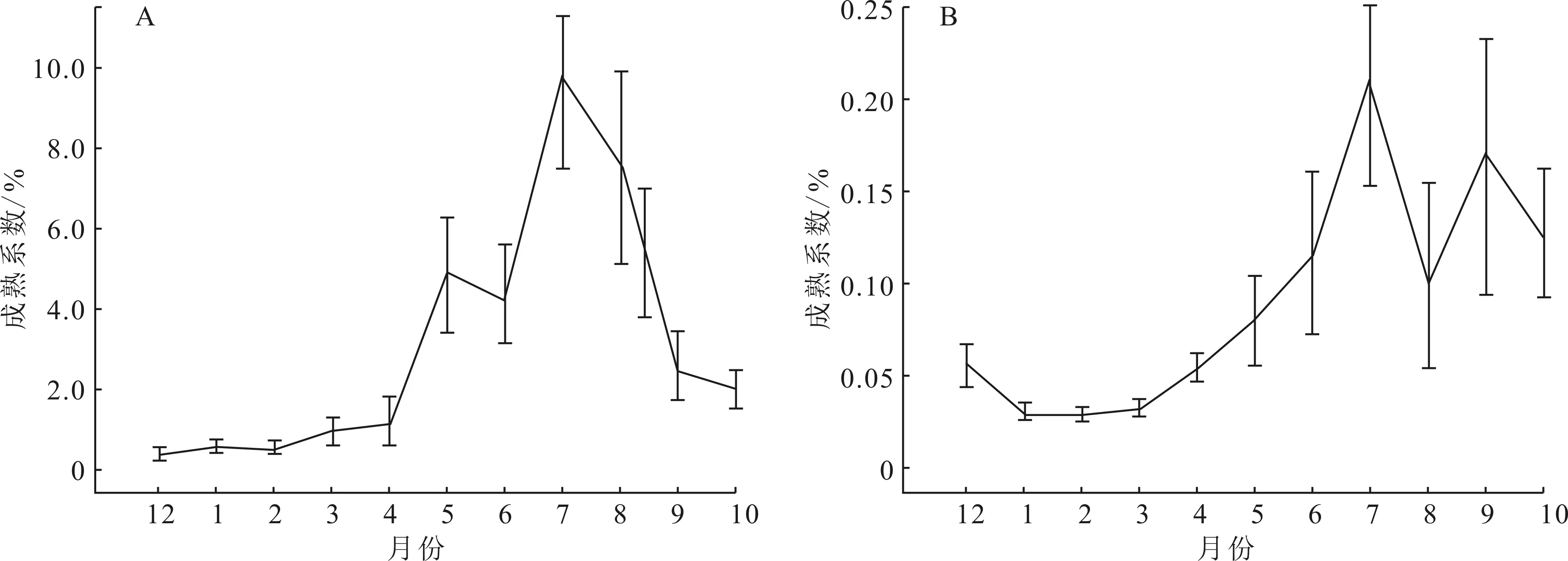
图1 豹纹脂身鲶雌(A)、雄鱼(B)成熟系数周年变化Fig.1 Annual change of gonado-somatic index in female (A) and male (B) of P.pardalis
2.2 卵径分布
从283尾样本中采集到性腺发育IV期雌鱼56尾。卵巢从4月开始发育,卵粒数在6-7月达到最高。卵径均值(1.87±0.96) mm,6-8月,平均卵径2.05 mm,占绝对优势。卵径分布曲线为单峰形(图2),推测豹纹脂身鲶属于同步产卵类型。
2.3 肥满度
雌鱼肥满度在12月份出现一个峰值(1.69±0.08),之后从2月份开始上升,在5月份出现最高值(1.87±0.13),在8月份出现谷值 (图3A)。雄鱼肥满度在12月份出现一个峰值(1.74±0.08),之后从1月份开始慢慢上升,2月份开始迅速攀升,在3月份出现周年最高峰值(1.77±0.09),之后下降;在6月份出现谷值后又慢慢回升(图3B)。
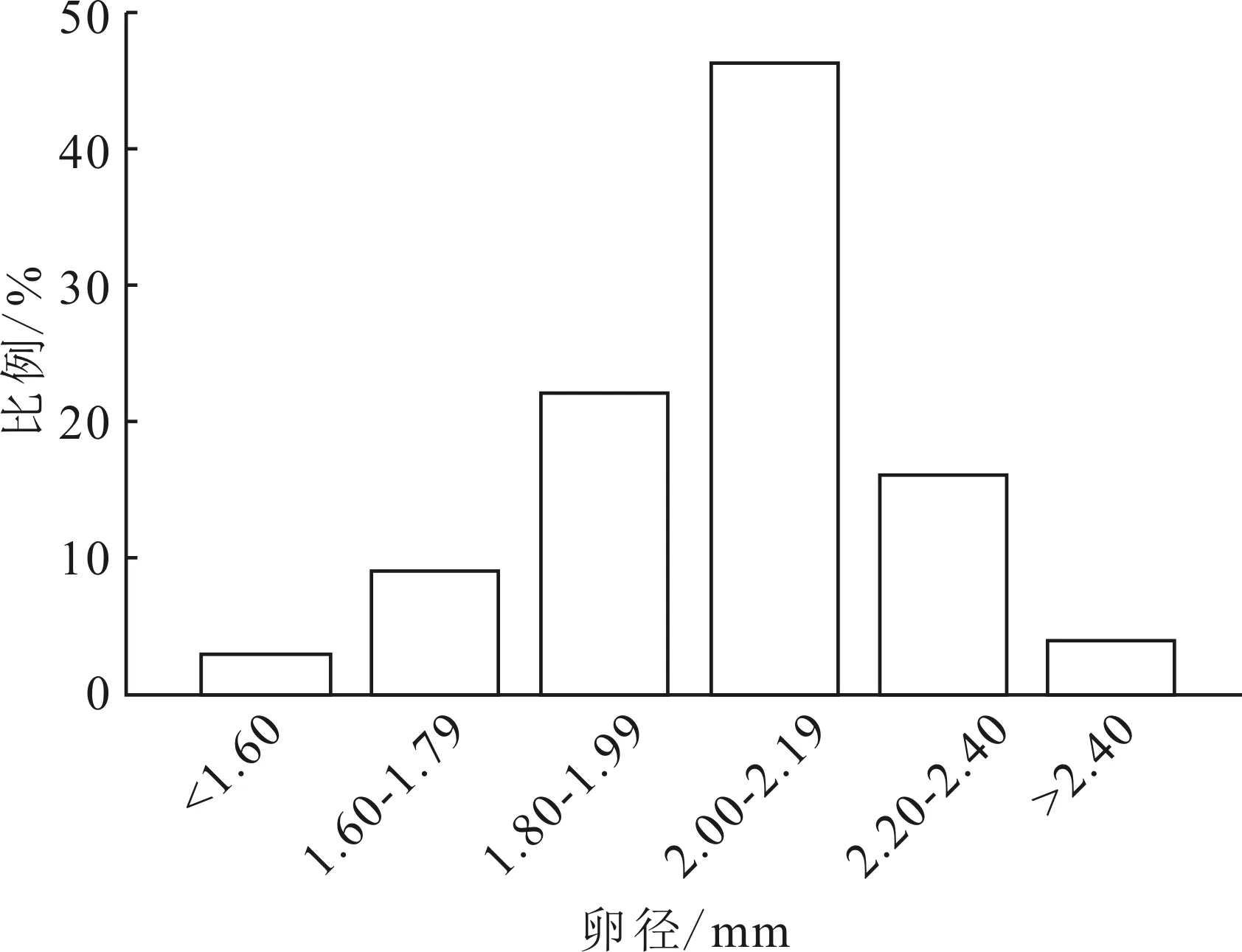
图2 56尾Ⅳ期豹纹脂身鲶卵巢中卵径的分布Fig.2 Oocyte diameter distribution in 56 P.pardalis orary at stage Ⅳ
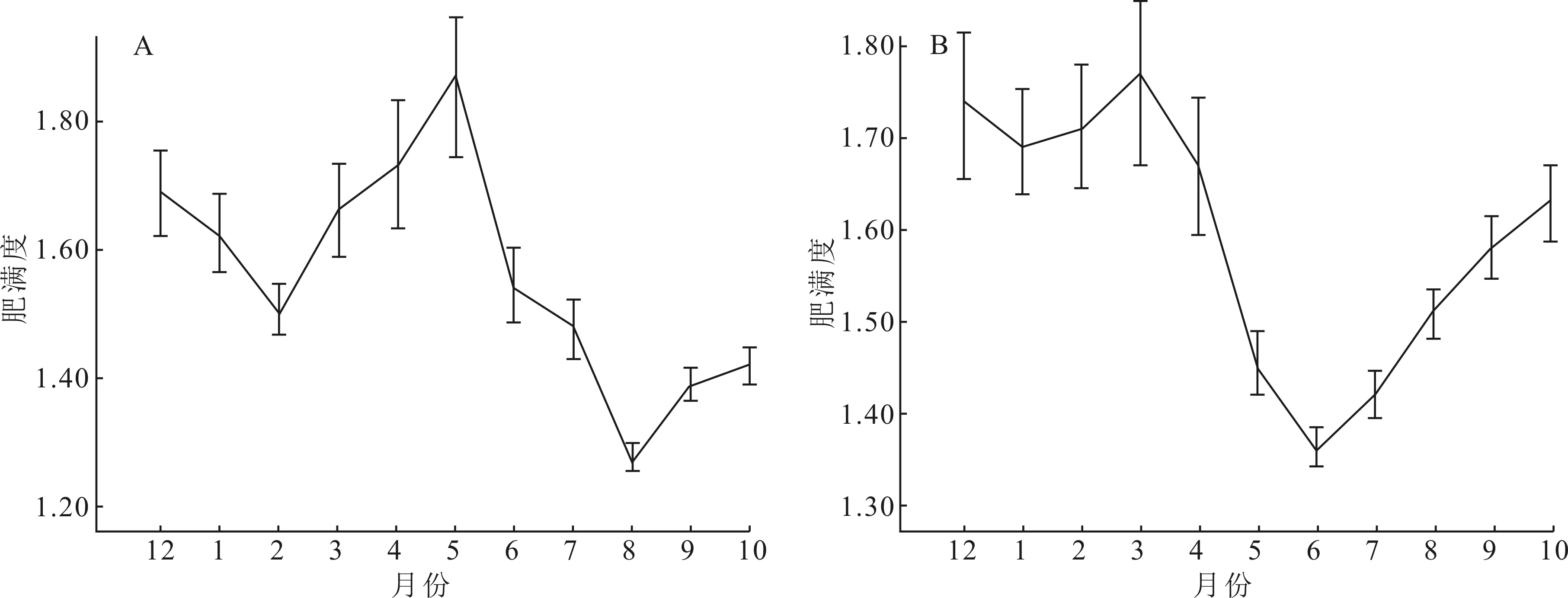
图3 豹纹脂身鲶雌(A)、雄鱼(B)肥满度周年变化Fig.3 Annual change of fullness in female (A) and male (B) of P.pardalis
2.4 繁殖力
统计56尾雌鱼的绝对繁殖力和相对繁殖力(表2)。56尾性成熟个体,体长范围201~341 mm,体重范围183.01~642.43 g。绝对繁殖力为636~6 148粒,均值(2 231±1 643)粒;相对繁殖力范围5~39粒/g,均值为(10±4)粒/g。
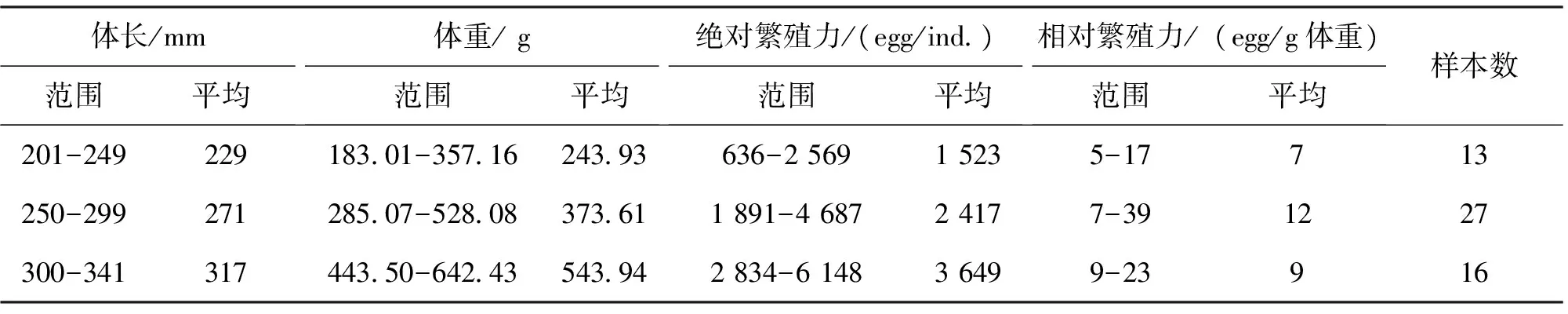
表2 豹纹脂身鲶的繁殖力
分别用直线方程和幂函数方程拟合绝对繁殖力(F)与体长(L)和体重(W)的关系,获得绝对繁殖力与体长、体重的关系式。绝对繁殖力与体长关系式:F=32.947L-6129.558(n=56,R2=0.530,P<0.01),F=3.484×10-6L(R2=0.544,P<0.01)(图4A)。绝对繁殖力与体重关系式:F=8.531W-412.671(n=56,R2=0.516,P<0.01),F=1.243×W1.619(R2=0.529,P<0.01)(图4B)。绝对繁殖力与体长、体重幂函数方程和直线方程的相关系数相差不大,表明豹纹脂身鲶绝对繁殖力随体长、体重的增加而增加。
相对繁殖力与体长、体重的相关性不显著。在体长小于299 mm时,相对繁殖力的均值随着体长的增加而增加至(10±3)粒/g;体长在300~341mm之间,相对繁殖力略有下降且保持在9粒/g(图5A)。体重小于400.0 g时,相对繁殖力的均值随体重的增加而增至(12±3)粒/g;体重在400~600 g之间时,相对繁殖力呈现下降趋势;体重大于600.0 g时,相对繁殖力保持在9粒/g(图5B)。
2.5 繁殖群体结构组成
在能够鉴定出性别的283尾样本中,雌鱼178条,雄鱼105条,雌∶雄=1.70∶1(x2=12.449,P<0.05);在性腺为III期的129尾样本中,雌鱼96尾,雄鱼33尾,雌∶雄=1∶0.35(x2=30.767,P<0.05);在性腺为IV-Ⅴ期的114尾样本中,雌鱼59尾,雄鱼68尾,雌∶雄=1∶1.15(x2=0.561,P>0.05),符合1∶1比例。
雄性最小性成熟个体体长204 mm,体重154.88 g,成熟系数为0.13%。雌性最小性成熟个体体长201 mm,体重183.01g;成熟系数为3.03%,最早性成熟年龄均为1龄。
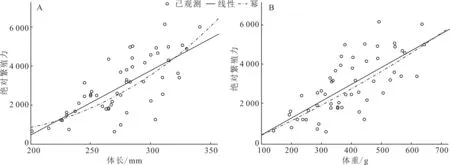
图4 豹纹脂身鲶绝对繁殖力与体长(A)、体重(B)的关系曲线Fig.4 Correlation curve between body length (A),total weight (B) and absolute fecundity of P.pardalis
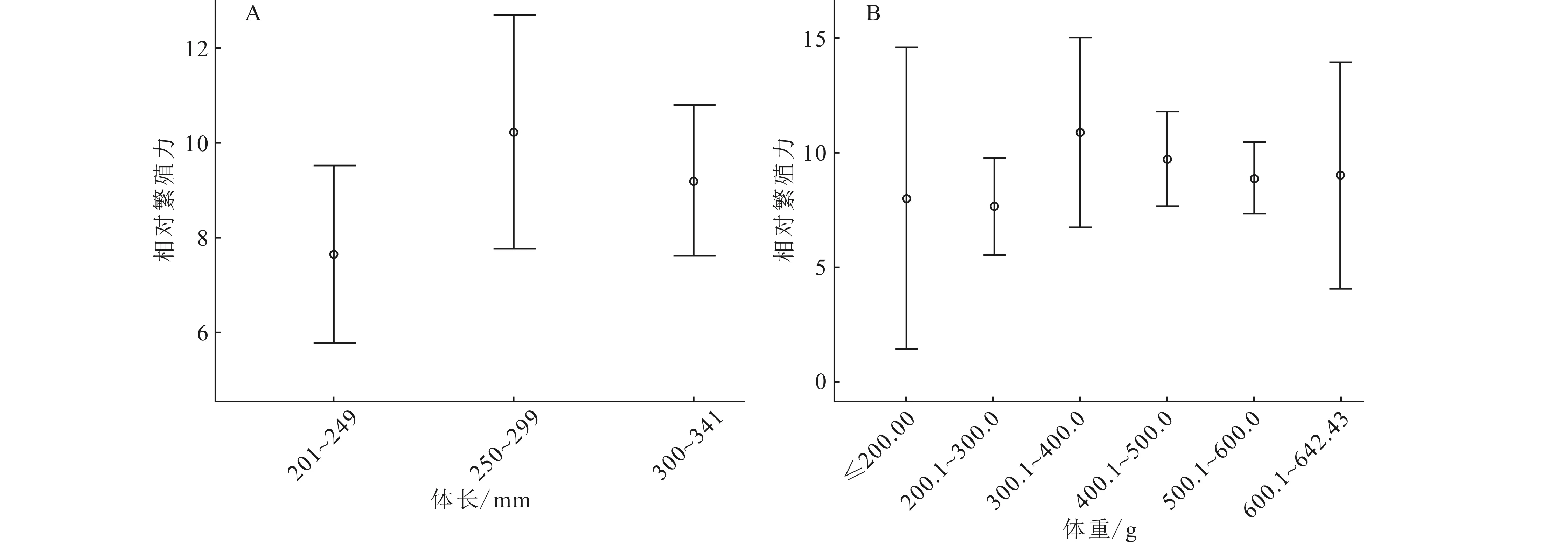
图5 豹纹脂身鲶相对繁殖力随体长(A)、体重(B)增加变化特征(均值±标准差)Fig.5 Variation of relative fecundity along with the increase of body length (A),total weight (B) of P.pardalis (Mean±SD)
3 讨论
在鱼类生活史过程中,繁殖群体的数量和繁殖持续的时间可以用成熟系数的波动直观表现;种群整体的繁殖潜力一般和成熟系数成正比[22]。同时鱼类的性腺发育与产卵繁殖在其整个生活史过程中不仅受到诸如性激素等内在生理因子的调控,而且还会受到来自外界环境因子的影响,例如光照、水流、水温以及营养因子等都会对其性腺的发育和产卵繁殖造成一定影响[23-26]。豹纹脂身鲶的成熟系数呈现出明显的周期年变化,3月份广州天气开始回暖,成熟系数也随之逐渐升高,并发现少量IV期及V期性腺。本研究中雌、雄鱼的成熟系数均在7月达到峰值,6-8月份卵巢主要为Ⅳ期、Ⅴ期,之后成熟系数开始逐渐下降,但9月份仍出现少量IV期、V期卵巢,因此结合成熟期和繁殖期卵巢出现时间及持续时间以及成熟系数的周年变化规律等理化指标特征的监测和分析可以推测豹纹脂身鲶的繁殖季节为3-9月,繁殖旺季为6-8月。与豹纹脂身鲶在台湾和美国佛罗里达洲的繁殖节律一致[27-28]。但在原产地,豹纹脂身鲶主要在雨季开始繁殖(5-10月)[29]。其原产地亚马逊河流域巴西境内,雨季平均水位46.3 m,旱季水位较雨季降低12~15 m,最低水位只有4.4 m,水位波动幅度大。流溪河人和段全年最低水位14.93 m,洪峰水位17.3 m,水位变化较稳定。说明入侵地稳定的水位条件可能是豹纹脂身鲶延长繁殖时间的重要原因。不同地区不同生境的豹纹脂身鲶繁殖习性上略有差异,反映了鱼类繁殖行为对生境的高度适应能力,这有利于仔鱼保持较高的出膜和成活率,从而保证有足够种群补充[23]。跟雌鱼略有不同的是,9月份雄鱼的成熟系数又出现一个较小的波动,这种现象可能跟错过繁殖时间导致成熟精子退化被吸收有关。同时在一次性产卵鱼类瓦氏黄颡鱼的研究中该现象也曾出现[21,30]。对此,杨家云[30]认为雄鱼为了减少越冬时期的能量消耗,在越冬前有排精现象。
判断鱼类产卵类型的依据通常采用成熟系数周年变化和卵径分布等[21,31-33]。豹纹脂身鲶在繁殖季节产卵结束后,成熟系数会出现急剧变化,呈现降低的趋势。样本解剖及测量结果表明,卵径1.80-2.10 mm范围内的个体占统计量的64.41%,卵径分布呈现明显的单峰型特征,进一步证实了豹纹脂身鲶具有同步产卵的繁殖习性。
肥满度的季节变化明显,和性成熟系数的周年变化存在相反的趋势,可以用来衡量鱼体的营养状况、丰满程度和环境条件等[19,21]。12月到2月期间处于水温低下的越冬期,自然水域饵料丰沛程度较低,豹纹脂身鲶摄食量减少,肥满度呈现一个较低的水平;2月后,天气变暖,豹纹脂身鲶生长加速,营养物质在体内迅速累积,雌、雄鱼的肥满度上升显著,繁殖活动会大量消耗体内能量,故而体内储存的大量物质和脂肪被消耗,肥满度出现较小值;在繁殖旺季6-8月份,肥满度处于周年最小值,而成熟系数处于周年最大值;繁殖活动结束后,越冬前的10-12月份,为度过食物紧缺的寒冬时节,鱼体开始大量存储营养物质和脂肪,肥满度呈现快速上升趋势。
繁殖力是评估种群数量变动的重要指标,体现了物种或种群对环境变动的适应特征[19]。豹纹脂身鲶卵径均值为1.87 mm,较常见鲶形目鱼类偏大,瓦氏黄颡鱼(Pelteobaggrusvachelli)为1.5 mm[23],光泽黄颡鱼(Pelteobaggrusnitidus)为1.56 mm[34],革胡子鲶(Clariidaegariepinus)为1.05 mm[35]。说明豹纹脂身鲶的单位体重繁殖投入、仔鱼出膜和成活率可能会较其他鲶形目鱼类高。从而可以保证当繁殖群体数量较少时仍可维持一定的种群数量[32]。
豹纹脂身鲶卵径大,意味着卵含有更多的营养物质供孵化后的仔鱼利用,从而增加每个卵发育成为成体的机会,故而出膜率和成活率高[19]。全年都具有一定比例的性成熟个体,说明豹纹脂身鲶已经在其分布区域建立可持续种群。样本采集期间,通过走访渔民,调查渔获物组成与比例,我们发现豹纹脂身鲶的入侵已经给流溪河渔民带来很大困扰,豹纹脂身鲶的大量繁殖减少了其他经济鱼类的捕获量,并且破坏网具,严重影响了渔民的生产活动,造成了经济损失。因此,豹纹脂身鲶做为一种常见的观赏鱼,在养殖和交易过程中,要避免逃逸并加强对自然种群的监测,以掌握其种群状态及生态危害。同时我们应加强对豹纹脂身鲶的生物学和生态学研究,制定合适的管理和防治策略,在一定范围内对入侵灾害严重区域的豹纹脂身鲶进行集中清理。
[1] Sala O E, Chapin F S Ⅲ, Gardner R H, et al. Global Change, Biodiversity and Ecological Complexity[M]. Cambridge: Cambridge University Press, 1999: 304-328.
[2] 秦 伟, 贾文方, 杭雪花. 鱼类多样性保护与渔业的可持续发展[J]. 淡水渔业, 1999, 29(9):10-13.
[3] 汤娇雯, 张 富, 陈兆波. 我国生物多样性保护策略[J]. 淡水渔业, 2009, 39(4):77-81.
[4] 万方浩, 郭建英, 王德辉, 等. 中国外来入侵生物的危害与管理对策[J]. 生物多样性, 2002, 10(1):119-125.
[5] 周 伟. 云南湿地生态系统鱼类物种濒危机制初探[J]. 生物多样性, 2000, 8(2):163-168.
[6] Radhakrishnan K V, Lan Z J, Zhao J. Invasion of the African sharp-tooth catfishClariasgariepinus( Burchell, 1822) in South China[J]. Biol Invas, 2011, 13:1723 -1727.
[7] 顾党恩, 牟希东, 胡隐昌, 等. 广东省主要水系外来水生动物初步调查[J]. 生物安全学报, 2012, 21(4):272-276.
[8] 潘 勇, 曹文宣, 徐立蒲, 等. 鱼类入侵的生态效应及管理策略[J]. 淡水渔业, 2005, 35(6):61-64.
[9] Fuller P L, Nico L G, Williams J D. Nonindigenous fishes introduced to inland waters of the United States [M]. Bethesda, Maryland:American Fisheries Society, 1999:613.
[10] Jones R W, Weyl O L, Swartz E R, et al. Using a unified invasion framework to characterize Africa’s first loricariid catfish invasion [J]. Biol Invas, 2013, 15:2139-2145.
[11] Ishikawa T, Tachihara K. Introduction history of non-native freshwater fish in Okinawa-jima Island: ornamental aquarium fish pose the greatest risk for future invasions [J]. Ichthyol Res, 2014, 61:17-26.
[12] Jumawa J C, Herrera A A. Ovary morphology and reproductive features of the female suckermouth sailfin catfish,Pterygoplichthysdisjunctivus(Weber 1991) from Marikina River, Philippines [J].Asian Fish Sci, 2014, 27:75-89.
[13] Pound K L, Nowlin W H, Huffman D G, et al. Trophic ecology of a nonnative population of suckermouth catfish (Hypostomusplecostomus) in a central Texas spring-fed stream [J]. Environ Biol Fish, 2011, 90:277-285.
[14] Chavez J M, Manohar S K, Pagulayan R C, et al. New Philippine record of South American sailfin catfishes (Pisces: Loricariidae) [J]. Zootaxa, 2006, 1109:57-68.
[15] Nico L G, Jelks H L, Tuten T. Non-native suckermouth armored catfishes in Florida: Description of nest burrows and burrow colonies with assessment of shoreline conditions [J]. Aquat Nuis Spec Res Prog (ANSRP) Bull, 2009, 9(1):1-30.
[16] Capps K A, Flecker A S. Invasive aquarium fish transform ecosystem nutrient dynamics [J]. Proceed Royal Soc B-Biol Sci, 2013, 280:1520.
[17] 李家乐, 董志国, 李应森, 等. 中国外来水生动植物[M].上海:上海科学技术出版社, 2007: 57.
[18] 赵 俊, 易祖盛, 周先叶, 等. 广州市水生动植物本底资源[M]. 北京:科学出版社, 2010:185-210.
[19] 殷名称. 鱼类生态学[M]. 北京:中国农业出版社, 1995.
[20] 凌建忠, 严利平, 林龙山, 等. 东海带鱼繁殖力及其资源的合理利用[J]. 中国水产科学, 2005, 12(6):726-730.
[21] 段中华, 孙建贻. 瓦氏黄颡鱼的繁殖生物学研究[J]. 水生生物学报, 1999, 23(6):610-616.
[22] Alabsawy M A E. The reproductive biology and the histological and ultrastructural characteristics in ovaries of the female gadidae fishMerlucciusmerlucciusfrom the Egyptian Mediterranean water [J]. Afric J Biotech, 2010, 9(17):2544-2559.
[23] Wootton R J. Ecology of Teleost Fishes. Fish and Fisheries Series [M]. University of Michigan, Chapman and Hall, 1990:1-370.
[24] 何长才. 两种海拔最高的鱼类及其分布[J]. 四川动物, 1996, 15(3):116-117.
[25] 何德奎, 陈咏霞, 陈毅峰. 高原鳅属TriPlophysa鱼类的分子系统发育和生物地理学研究[J]. 自然科学进展, 2006, 16(11):1395-1404.
[26] Lashari P K, Narejo N T, Laghari M Y, et al. Studies on the gonado somatic index and fecundity of a carp Cirrhinusreba (Hamilton) from fishponds of district Jacobabad, Sindh, Pakistan [J]. Pakistan J Zool, 2007, 39(2):95-98.
[27] Liang S, Wu H, Shieh B. Size structure, reproductive phenology, and sex ratio of an exotic armored catfish (Liposarcusmultiradiatus) in the Kaoping River of southern Taiwan [J]. Zool Stud, 2005, 44:252-259.
[28] Gibbs M A, Shields J H, Lock D W, et al. Reproduction in an invasive exotic catfishPterygoplichthysdisjunctivusin Volusia Blue Spring, Florida, U.S.A [J]. J Fish Biol, 2008, 73:1562-1572.
[29] Moroni F T, Ortega A C, Moroni R B, et al. Limitations in decision context for selection of Amazonian armoured catfish acari-bod (Pterygoplichthyspardalis) as candidate species for aquaculture [J]. Int J Fish Aquacult, 2015, 7:142-150.
[30] 杨家云. 嘉陵江瓦氏黄颡鱼的繁殖生物学[J]. 西南师范大学学报(自然科学版), 1994, 19(6):639-645.
[31] 刘 筠, 刘素娴, 寿孝锺, 等. 草鱼性腺发育研究[J]. 湖南师范学院学报, 1962,(4):63-96.
[32] 曹克驹, 李明云. 凫溪香鱼繁殖生物学的研究[J]. 水产学报, 1982, 6(4):107-118.
[33] 刘明典, 黄福江, 朱佳志, 等. 大鳞裂峡鲃繁殖生物学特征[J]. 动物学杂志, 2015, 50(3):405-414.
[34] 谌海虎. 赣江南昌段光泽黄颡鱼的年龄、生长和繁殖特征的初步研究[D]. 武汉:华中农业大学, 2010.
[35] 朱赟杰. 外来鱼类革胡子鲶在华南地区的分布和种群生物学研究[D]. 上海:上海海洋大学, 2016.
(责任编辑:张红林)
Reproductive biology ofPterygoplichthyspardalisin the Liuxi River
LIU fei1,2, WEI Hui1, GU Dang-en1, MU Xi-dong1, LUO Du1,XU Meng1, HU Yin-chang1
( 1.KeyLaboratoryofRecreationalFisheriesResearch,MinistryofAgriculture/PearlRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Guangzhou510380,China;2.CollegeofFisheriesandLifeScience,ShanghaiOceanUniversity,Shanghai201306,China)
To study reproductive biology of an invasive fish species,Pterygoplichthyspardalis, 283 specimens were collected from December 2015 to September 2016 in the Liuxi River, Guangzhou city. Sexual maturity coefficient ofP.pardaliswas relative high from March to September. The minimum size of mature male was 204 mm, and the minimum body weight was 154.88 g. The minimum size and weight of mature female were 201 mm and 183.01 g, respectively. The minimum age at maturity was age 1 for male and female. The mean mature oocyte diameter was 1.87 mm, and the absolute fecundity was 636-6 148 eggs. The mean absolute fecundity was 2 524.49 eggs and the mean relative fecundity was 10.43 eggs /g. Absolute fecundity positively correlated with body length and body weight. Sex ratio (♀∶♂) of mature individuals was 1∶1.15, which accorded with the 1∶1 ratio. These results suggested thatP.pardalismatured at small size and age, with high fecundity in the Liuxi River, which may contribute to population establishment and spread, resulting in adverse impact on the freshwater ecosystem.
Pterygoplichthyspardalis; gonad development; year cycle; fecundity
2016-11-08;
2017-01-18
农业部外来入侵生物防治项目(2130108)
刘 飞(1991- ),男,硕士研究生,专业方向为鱼类生态学。E-mail:liufei636@163.com 通讯作者:胡隐昌,E-mail:huyc22@163.com
S931
A
1000-6907-(2017)02-0042-07

