拟南芥器官大小调控基因AtKIX8启动子的克隆和表达分析
何露霞, 李梦婷, 袁 晔, 王利琳, 陈哲皓
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
拟南芥器官大小调控基因AtKIX8启动子的克隆和表达分析
何露霞, 李梦婷, 袁 晔, 王利琳, 陈哲皓
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
为研究拟南芥器官大小调控基因AtKIX8的表达模式,以期进一步研究其功能机制,克隆了该基因启动子序列,获取了启动子-GUS转基因报告植株.利用GUS组织化学染色检测了该启动子作用位置,利用荧光定量PCR分析了启动子对外源激素及冷胁迫的响应.结果表明该启动子诱导GUS基因在幼苗茎尖分生区,成株茎、叶主脉中特异性表达,生长素和低温处理显著提高GUS基因的表达量.说明拟南芥AtKIX8基因启动子具备组织特异性表达模式,且能受到外源生长素和低温的诱导.
拟南芥;器官大小;AtKIX8基因;启动子;克隆;表达分析
拟南芥AtKIX8(At3g24150)基因编码产物属于KIX蛋白家族成员,该家族11个成员的N-末端均含有保守KIX结构域[1].研究认为KIX结构域可能介导了与转录因子活化域的互作[2],有报道称含有KIX蛋白结构域的CBP/p300和MED15蛋白分别参与了开花时间调控[3]和水杨酸信号响应[4],而最新的研究推测该基因参与了植物器官大小及形态的调控[5].植物器官大小调控在生产实践中有广泛的应用前景,对研究植物形态外观、生存繁殖、胁迫抗性等品质的遗传有重要指导意义,但目前对KIX蛋白在拟南芥器官大小调控中的功能作用还知之甚少,也未见对其启动子以及基因调控、表达模式的研究报道.为进一步揭示该基因的功能,有必要对AtKIX8启动子及其表达模式进行研究.利用在线软件PlantCARE可对基因启动子区所含结构元件作出预测[6],预测的调控元件多能响应外界信号,如TGA-1和AuxRE受到外源生长素的诱导作用[7-8];DRE/CRT是拟南芥干旱和低温胁迫诱导元件[9];ABRE元件能响应干旱胁迫中ABA的应答等等[10],通过实验验证,可以进一步了解其表达和调控模式.
本研究以拟南芥AtKIX8基因启动子为研究对象,克隆得到该基因启动子长、短片段各一个,分析了其所包含的潜在调控元件;构建启动子-GUS报告基因表达载体,获取转基因纯合启动子报告株系;利用转基因报告系研究拟南芥AtKIX8基因的组织表达模式和潜在的转录调控机制.为进一步揭示拟南芥AtKIX8基因的功能机理和调控机制提供线索.
1 材料和方法
1.1 材料
本实验使用野生型拟南芥Columbia-0,农杆菌菌株GV3101,使用含GUS报告基因的植物表达载体pCAMBIA1301.克隆试剂盒、限制性内切酶购于Takara宝生物工程(大连)有限公司;T4DNA连接酶、大肠杆菌DH5α感受态细胞、逆转录试剂盒(TransScript First-Strand cDNA Synthesis)购于北京全式金生物技术有限公司;所有引物订购自生工生物工程(上海)股份有限公司;其他材料均购于北京康为世纪生物科技有限公司.
1.2 方法
1.2.1 拟南芥AtKIX8基因启动子序列预测分析
根据拟南芥信息网(http://www.arabidopsis.org/)中的AtKIX8(At3g24150)基因序列及其所在染色体的位置信息,将基因转录起始位点前3 000 bp的DNA序列作为预测的启动子序列,利用在线软件PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对这一序列进行转录调控元件分析.
1.2.2 拟南芥AtKIX8基因启动子克隆及植物表达载体构建
以AtKIX8基因转录起始位点前3 000bp的DNA序列设计长、短2个片段的克隆引物,含KpnI酶切位点的长片段上游引物为:5′-GGTACCGCAAGAGTCAGCCTAACAAGTA-3′;短片段的上游引物为:5′-GGTACCGCTGTCAAAGTTGCTGAAGGT-3′;设计含NcoI酶切位点的长、短片段下游通用引物为:5′-CCATGGGGAAATGGAAATGGTGTGATTC-3′.
以野生型拟南芥基因组DNA为模板,PCR扩增得到2个目的片段,反应条件为:94 ℃预变性5min,94 ℃变性30s,55 ℃退火30s,72 ℃长、短片段各延伸3min、1min,30个循环后72 ℃延伸10min.产物经1%琼脂糖凝胶电泳后割胶回收纯化.纯化产物经T-A克隆、菌落PCR检测和质粒KpnI/NcoI双酶切验证后送生工生物工程(上海)股份有限公司测序.测序正确的克隆载体及空表达载体pCAMBIA1301进行KpnI/NcoI双酶切,分别回收目的片段及空表达载体大片段进行连接,重组质粒经验证后通过冻融法分别转入根癌农杆菌GV3101[11].
1.2.3 拟南芥培养及基因转化筛选
拟南芥种子经表面消毒后无菌水冲洗5次,点入B5培养基,4 ℃放置2~3d破除种子休眠后移入光照培养.培养条件为:22 ℃恒温,湿度60%,光照强度10 000lx,16h光照/8h黑暗长日照条件.7~10d幼苗移入土中培养,至3~4周后开花,即可用于基因转化.拟南芥基因转化使用花序浸润法[12].转基因阳性植株的筛选使用12.5mg/L潮霉素(hygromycin).抗性植株经过3代的筛选分离,获取纯合的转基因系.
1.2.4 转基因植株的GUS组织化学染色
利用X-gluc(5-bromo-4-chloro-3-indolyl-β-D-glucuronicacid)对转基因株系进行GUS蛋白组织化学染色.整株转基因幼苗或部分成熟植株器官在X-gluc终溶液(1mg/mLX-gluc,0.5mM高铁氰化钾,0.5mM亚铁氰化钾,0.1%TritonX-100,50mM磷酸缓冲液,10mMEDTA,pH7.0)中37 ℃染色过夜,70%酒精脱色至叶绿素完全消失,拍照记录植株染色情况.
1.2.5 转基因植株处理实验及实时荧光定量PCR
选取生长状态基本一致的10d转基因纯合幼苗,分别转移至添加10μmol/L生长素(IAA)、50μmol/L赤霉素(GA3)和200μmol/L脱落酸(ABA)的培养基上,以转移到新B5固体培养基上幼苗为对照,光照处理12h.低温处理使用4 ℃冰箱,并以不透光包裹后置于光照培养箱中培养12h的幼苗为对照.
使用Trizol法提取实验组和对照组的茎尖分生组织区RNA,经过DNA酶处理纯化后电泳分析并测定浓度,逆转录获取cDNA.实时定量PCR以拟南芥多聚泛素酶基因(ubiquitin5, UBQ5)作为内参,上游引物:5′-CGTGGTGGTGCTAAGAAGAGG-3′;下游引物:5′-GAAAGTCCCAGCTCCACAGGT-3′;GUS基因(uidA)作为目的基因,上游引物:5′-TGTAATGTTCTGCGACGCTCAC-3′;下游引物:5′-TCGGTGATGATAATCGGCTGA-3′.使用CFX96(Bio-Rad,USA)定量PCR仪,10μL反应体系包含2×UltraSYBRMixture5μL,cDNA1μL及上下游引物各0.5μL,每个反应含3个平行重复.反应程序:95 ℃ 10min;95 ℃ 15s,60 ℃ 1min循环40次,以溶解曲线检查产物扩增的特异性.每个样品进行3次独立实验重复,使用2-△△Ct相对定量法计算GUS基因相对表达量[13].
2 结果与分析
2.1 拟南芥AtKIX8基因预测启动子的序列分析
以拟南芥AtKIX8基因转录起始位点前3 000bp的DNA序列作为预测的启动子序列,用PlantCARE软件在线分析其启动子区域的特异性转录因子结合位点及其潜在功能,结果如表1所示.

表1 拟南芥AtKIX8基因启动子区顺式作用元件分析Tab. 1 Predicted cis-acting elements of the AtKIX8 gene promoter
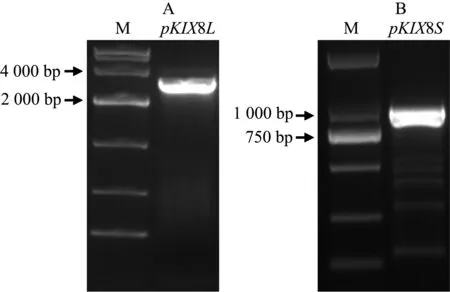
A:AtKIX8基因长启动子PCR扩增; B:AtKIX8基因短启动子PCR扩增;M:DNA Marker.图1 拟南芥AtKIX8基因启动子PCR扩增Fig. 1 PCR amplification of AtKIX8 gene promoters
分析发现拟南芥AtKIX8基因启动子含有多种植物激素响应元件、光响应元件、低温响应元件和其他一些组织特异性调控序列.预示该基因的表达可能受植物激素、光和低温这些外界因素的诱导,也可能与分生组织、胚乳和花粉的形成或相关功能有关.
2.2 拟南芥AtKIX8基因启动子的克隆
为研究AtKIX8基因的启动子区域及其表达调控模式,我们克隆了长、短2个片段的启动子序列,其中长片段pKIX8L为2 851bp,短片段pKIX8S为954bp,如图1A、1B所示,与预期大小一致.
此2片段经回收及T-A克隆、菌落PCR检测、质粒、双酶切验证和公司测序后获取了序列完全正确的克隆质粒,可用于后续的表达载体构建.
2.3 植物表达载体pKIX8∷GUS构建及农杆菌转化
植物表达载体pCAMBIA1301中含pCaMV35S∷GUS结构,其中GUS报告基因前的pCaMV35S启动子可使用Kpn I/Nco I双酶切去除.利用这2个限制性内切酶以及DNA连接酶,分别将长、短克隆片段替换表达载体中的pCaMV35S启动子,获得了含有pKIX8L∷GUS、pKIX8S∷GUS的重组植物表达载体.重组质粒进行KpnI/NcoI双酶切验证结果分别如图2A、2B所示.
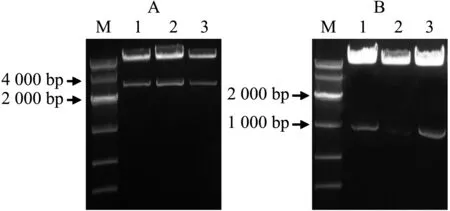
A:pKIX8L∷GUS表达载体双酶切;B:pKIX8S∷GUS表达载体双酶切;M:DNA Marker;1-3:不同克隆.图2 pKIX8L∷GUS、pKIX8S∷GUS表达载体酶切Fig. 2 Digestion of expression vectors of pKIX8L∷GUS and pKIX8S∷GUS
选取验证正确的重组质粒通过冻融法,被分别导入根癌农杆菌GV3101感受态细胞.农杆菌菌落PCR结果分别如图3A、3B所示,阳性克隆可进一步用于拟南芥植株的遗传转化.
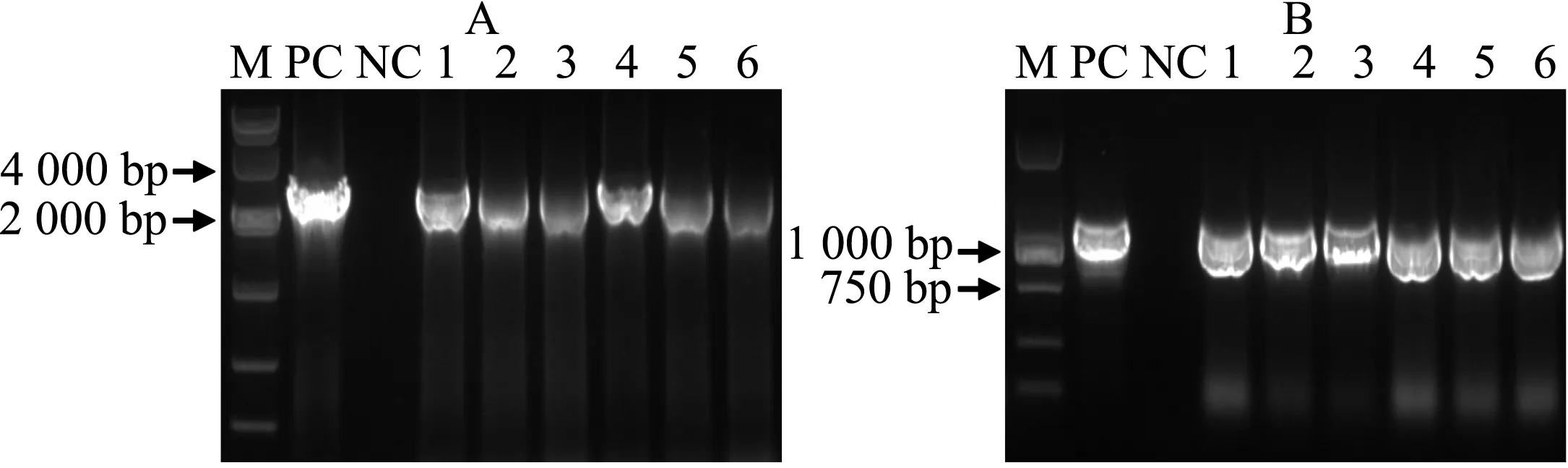
A:含pKIX8L∷GUS表达载体的农杆菌菌落PCR;B:含pKIX8S∷GUS表达载体的农杆菌菌落PCR; M:DNA Marker;PC:阳性对照;NC:阴性对照;1-6:不同克隆.图3 含pKIX8L∷GUS、pKIX8S∷GUS表达载体的农杆菌菌落PCRFig. 3 Colony PCR of Agrobacteria harbouring expression vectors
2.4 拟南芥AtKIX8基因表达模式检测
经3代分离筛选,最终各自获取转基因纯合T3代植株7株和6株.针对10d幼苗和4周开花植株的GUS组织化学染色结果如图4所示,在AtKIX8基因启动子的驱动下,GUS基因主要集中在10d幼苗的茎尖分生组织区表达,另外仅在下胚轴的中柱、主根的中柱以及幼叶的主脉等维管系统中能观测到其表达(图4A);GUS基因主要在开花植株叶片的主脉以及茎中强表达,其他部位均未检出(图4B).该染色结果在同一载体的不同转基因株系间一致,长、短片段驱动下的基因组织特异性表达效果没有显著区别.
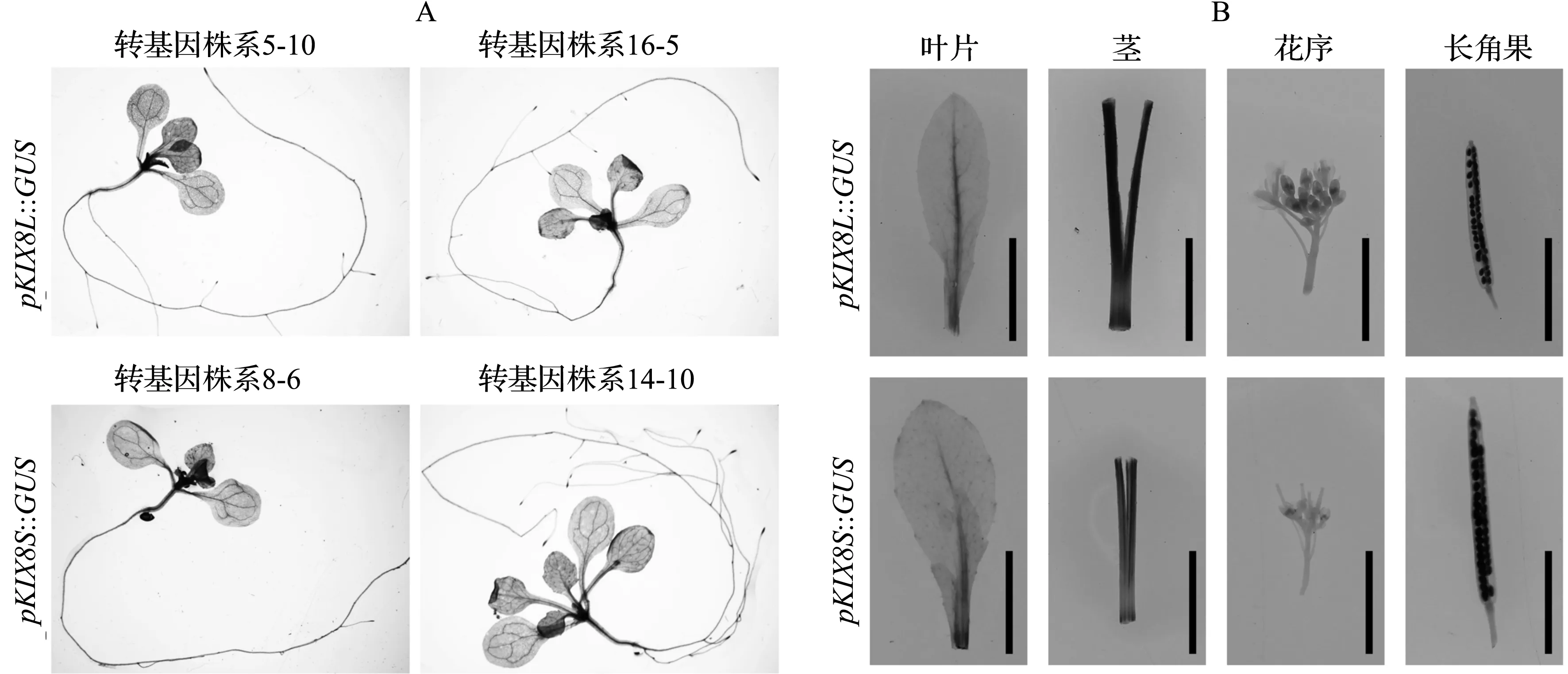
A:10 d幼苗的GUS染色结果;B:4周植株的GUS染色结果;比例尺=5 mm.图4 pKIX8启动子驱动下GUS基因在拟南芥中的表达Fig. 4 The expression of GUS gene driven by pKIX8 promoter in Arabidopsis
2.5 拟南芥AtKIX8基因启动子对植物激素和低温胁迫的响应
为进一步研究AtKIX8基因受到的表达调控,根据表1中的元件分析结果,选取了不同植物激素和低温胁迫对转基因植株进行处理.利用定量PCR检测了不同激素和低温处理下GUS基因的表达情况,结果如图5所示.在生长素IAA处理下,GUS基因的表达量在长、短片段启动子的驱动下均有2倍以上的显著提升(P<0.05),但长、短启动子的驱动效果无明显差异(图5A);在赤霉素GA3和脱落酸ABA处理下,GUS基因的表达量在长短片段启动子的驱动下均没有显著的变化(图5B、C);在低温(4 ℃)处理下,GUS基因的表达均有显著提高(P<0.05),但长、短启动子的驱动效果无明显差异(图5D).结果表明,AtKIX8启动子仅能够响应低温和外源IAA,对GA和ABA并不敏感.
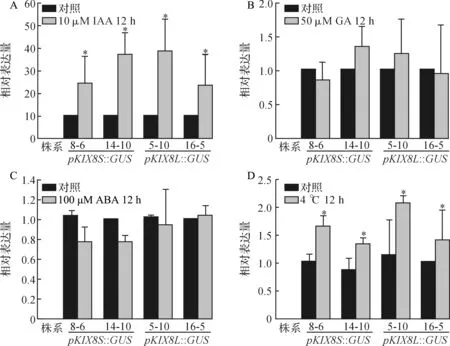
A:10 μM IAA处理12 h下GUS基因表达变化;B:50 μM GA3处理12 h下GUS基因表达变化; C:200 μM ABA处理12 h下GUS基因表达变化;D:4 ℃冷处理12 h下GUS基因表达变化; *:差异显著,P<0.05.图5 不同处理下GUS基因表达量变化Fig. 5 Relative expression levels of GUS under different treatment
3 讨 论
拟南芥AtKIX8基因属于KIX蛋白家族成员,研究表明该基因表达产物可能通过抑制其他基因的表达[14],调控植物器官的大小[6].为阐明AtKIX8基因的功能机理及其转录调控机制,本研究预测分析了其启动子序列,并进行了克隆研究.
报告基因GUS常被用于植物中启动子表达模式的分析,在各个物种中均有报道,例如拟南芥蔗糖载体蛋白基因SUC2启动子驱动GUS基因在拟南芥莲座叶、茎和萼片的韧皮部高度特异性表达[15];大豆硫转运蛋白GmSULTR1;2b启动子驱动GUS基因在根毛、根表皮和中柱内特异性表达[16]等等.预测中AtKIX8基因启动子区存在多个组织特异性表达元件(表1),通过本研究发现,拟南芥AtKIX8基因启动子确实具备组织特异性,主要限制于幼苗期茎尖分生组织区及维管组织中,以及开花植株的茎和主叶脉中(图4).植物顶端分生组织区决定了叶、侧枝、花原基的形成,进而调控了植物各器官的生长发育及其大小[17-18],预示AtKIX8基因可能通过参与调控分生组织区功能进而影响植物器官大小.
预测发现该基因启动子区存在包括低温诱导元件以及多种植物激素特异诱导元件(表1).对上述转基因报告株系进行的各类植物激素和低温处理表明,AtKIX8基因启动子在本实验中仅受到生长素和低温的诱导(图5).生长素在植物生长发育过程中具有重要的调控作用,尤其能通过影响细胞分裂、伸长和分化来决定器官的最终大小和形状[19-20],预示AtKIX8基因有可能通过调节生长素反应来调控器官的大小.干旱和低温诱导元件DRE/CRT在拟南芥中特异性结合DREB2s转录因子,诱导下游基因表达提高植物胁迫抗性[21-22],而器官大小的调节则是提高胁迫抗性的其中一种有效方式[23],预示AtKIX8基因也有可能通过参与胁迫应答来调控器官大小.虽然启动子序列分析显示其具备脱落酸及赤霉素响应元件,但本实验中该启动子对两者均不敏感,可能与该基因的组织特异性及时序性表达模式有关,也可能受到处理浓度及时间的影响,还需进一步实验证实.
另外本实验中克隆的启动子长、短片段表达模式基本一致,且均能响应外源生长素和冷胁迫,驱动效果无明显差异,说明954bp的短片段已经包含了该基因的主要启动子功能区段.
[1]THAKURJ,AGARWALP,PARIDAS,etal.SequenceandexpressionanalysesofKIXdomainproteinssuggesttheirimportanceinseeddevelopmentanddeterminationofseedsizeinrice,andgenomestabilityinArabidopsis[J].MolecularGeneticsandGenomics:MGG,2013,288(7/8):329-346.
[2]JEDIDII,ZHANGF,QIUH,etal.ActivatorGcn4employsmultiplesegmentsofMed15/Gal11,includingtheKIXdomain,torecruitmediatortotargetgenesinvivo[J].TheJournalofBiologicalChemistry,2010,285(4):2438-2455.
[3]HANS,SONGJu,NOHY,etal.RoleofplantCBP/p300-likegenesintheregulationoffloweringtime[J].ThePlantJournal:forCellandMolecularBiology,2007,49(1):103-114.
[4]CANETJ,DOBNA,TORNEROP. Non-recognition-of-BTH4,anArabidopsismediatorsubunithomolog,isnecessaryfordevelopmentandresponsetosalicylicacid[J].ThePlantCell, 2012, 24(10): 4220-4235.
[5]GONZALEZN,PAUWELSL,BAEKELANDTA,etal.Arepressorproteincomplexregulatesleafgrowthinarabidopsis[J].ThePlantCell,2015,27(8):2273-2287.
[6]ROMBAUTSS,DÉHAISP,VANMONTAGUM,etal.PlantCARE,aplantcis-actingregulatoryelementdatabase[J].NucleicAcidsResearch,1999,27(1):295-296.
[7]LINCOLNC,BRITTONJH,ESTELLEM.Growthanddevelopmentoftheaxr1mutantsofArabidopsis [J].PlantCell,1990,2(11):1071-1080.
[8]LEYSERO.Auxinsignalling:thebeginning,themiddleandtheend[J].CurrentOpinioninPlantBiology,2001,4(5):382-386.
[9]AGARWALM,HAOYujin,KAPOORA,etal.AR2R3typeMYBtranscriptionfactorisinvolvedinthecoldregulationofCBFgenesandinacquiredfreezingtolerance[J].TheJournalofBiologicalChemistry,2006,281(49):37636-37645.
[10] NARUSAKA Y, NAKASHIMA K, SHINWARI Z, et al. Interaction between two cis-acting elements, ABRE and DRE, in ABA-dependent expression ofArabidopsisrd29Agene in response to dehydration and high-salinity stresses[J]. The Plant Journal : for Cell and Molecular Biology,2003,34(2):137-148.
[11] GYNHEUNG A. Binary ti vectors for plant transformation and promoter analysis [J]. Method Enzymol,1987,153:292-305.
[12] CLOUGH S J, BENT A F. Floral Dip: a simplified method for agrobacterium-mediated transformation ofArabidopsisthaliana[J]. Plant Journal,1998,16(6):735-743.
[13] GINZINGER D, GODFREY T, NIGRO J, et al. Measurement of DNA copy number at microsatellite loci using quantitative PCR analysis[J]. Cancer Research,2000,60(19):5405-5409.
[14] CAUSIER B, ASHWORTH M, GUO W, et al. The TOPLESS interactome: a framework for gene repression inArabidopsis[J]. Plant Physiology,2012,158(1):423-438.
[15] TRUERNIT E, SAUER N. The promoter of theArabidopsisthalianaSUC2 sucrose-H+symporter gene directs expression of beta-glucuronidase to the phloem: evidence for phloem loading and unloading by SUC2[J]. Planta,1995,196(3):564-570.
[16] 周小琼,丁一琼,左丽,等.大豆硫转运蛋白基因GmSULTR1;2b启动子的克隆及活性分析[J].中国农业科学,2015,48(8):1650-1659.
[17] NOLE-WILSON S, TRANBY T, KRIZEK B. AINTEGUMENTA-like (AIL) genes are expressed in young tissues and may specify meristematic or division-competent states[J]. Plant Molecular Biology,2005,57(5):613-628.
[18] 雍伟东,种康,许智宏,等.高等植物开花时间决定的基因调控研究[J].科学通报,2000,45(5):455-466.
[19] KRIZEK B, ANDERSON J. Control of flower size[J]. Journal of Experimental Botany,2013,64(6):1427-1437.
[20] VARAUD E, BRIOUDES F, SZÉCSI J, et al. AUXIN RESPONSE FACTOR8 regulatesArabidopsispetal growth by interacting with the bHLH transcription factor BIGPETALp[J]. The Plant Cell,2011,23(3):973-983.
[21] MATSUKURA S, MIZOI J, YOSHIDA T, et al. Comprehensive analysis of riceDREB2-type genes that encode transcription factors involved in the expression of abiotic stress-responsive genes[J]. Molecular Genetics and Genomics,2010,283(2):185-196.
[22] 黄吉祥,任丽平,曹明富.植物抗胁迫类转录因子研究进展[J].杭州师范学院学报(自然科学版),2008,7(1):55-59.
[23] JOHNSON K, LENHARD M. Genetic control of plant organ growth[J]. The New Phytologist,2011,191(2):319-333.
Promoter Cloning and Expression Pattern Analysis of an Organ-size-control GeneAtKIX8 inArabidopsis
HE Luxia, LI Mengting, YUAN Ye, WANG Lilin, CHEN Zhehao
(College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 310036, China)
To understand the expression pattern of an organ-size-control geneAtKIX8 and further elucidate its function mechanism inArabidopsis, promoter ofAtKIX8 was cloned and promoter-GUS transgenic lines were obtained. The location of GUS protein was detected by staining, and the response ofAtKIX8 gene promoter to phytohormone and cold stress was analyzed by real-time RT-PCR. The results showed that the expression of GUS gene was restricted in shoot apical meristems in seedlings, and in stems and primary veins of leaves in flowering plants. Real-time PCR results displayed that the expression of GUS gene was up-regulated obviously with auxin and cold treatments. It showed that this promoter had a tissue-specific expression pattern, and could be induced by exogenous auxin and cold treatments.
Arabidopsisthaliana; organ size;AtKIX8 gene; promoter; clone; expression analysis
2016-06-03
浙江省自然科学基金项目(LY14C020004).
陈哲皓(1982—),男,讲师,博士,主要从事植物生理与发育研究.E-mail:zhchen@hznu.edu.cn
10.3969/j.issn.1674-232X.2017.02.008
Q
A
1674-232X(2017)02-0158-06

