丹参水提液对染镉大鼠肾损伤的干预作用
张倩倩, 何 玲, 滕玉莲, 吕晓云
(1. 兰州大学第二医院, 甘肃 兰州, 730030;2. 广东省珠海市第二人民医院, 广东 珠海, 519000;3. 兰州大学校医院, 甘肃 兰州, 730030; 4. 兰州大学中西医结合研究所, 甘肃 兰州, 730030)
丹参水提液对染镉大鼠肾损伤的干预作用
张倩倩1, 何 玲2, 滕玉莲3, 吕晓云4
(1. 兰州大学第二医院, 甘肃 兰州, 730030;2. 广东省珠海市第二人民医院, 广东 珠海, 519000;3. 兰州大学校医院, 甘肃 兰州, 730030; 4. 兰州大学中西医结合研究所, 甘肃 兰州, 730030)
目的 探讨丹参水提液对染镉大鼠肾损伤的干预作用及其可能的作用机制。方法 健康Wistar大鼠,雌雄各20只,鼠龄6周。适应性喂养1周,随机分组,空白组8只,模型组32只,空白组腹腔注射生理盐水5 mL/(kg·d),模型组以2.8 mg/(kg·d)氯化镉溶液腹腔注射。连续造模4周,观察大鼠一般情况,检测大鼠肾功能指标、肾脏组织病理改变。造模成功后,将模型组随机分为给药组、阴性、阳性对照组及空白对照组。给药组[丹参水提液高剂量2.7 g/(kg·d)、丹参水提液低剂量1.35 g/(kg·d)]灌胃,阳性对照组亚硒酸钠溶液0.05 mg/(kg·d)灌胃,阴性及空白对照组给予同体积生理盐水2.7 mL/(kg·d)。各组治疗10周,实验终末收集血清、尿液,并留取肾脏组织,待检测。结果 丹参水提液低、高剂量组24 h尿量低于阴性对照组,而血清超氧化物歧化酶(SOD)明显升高,丙二醛(MDA)显著降低,总抗氧化能力(T-AOC)增强明显,血尿素氮、血清肌酐含量降低,尿蛋白(β2-MG)含量下降。病理切片可见阴性对照组肾脏近曲小管上皮细胞浑浊、肿胀变性、坏死; 丹参水提液低、高剂量组血清、皮质镉含量低于阴性对照组; 丹参水提液低、高剂量组凋亡率低于阴性对照组。结论 丹参水提液能加速体内镉代谢,可有效干预镉致肾损伤,有助于延缓慢性肾功能衰竭,改善肾功能,保护肾脏。
丹参水提液; 镉; 肾损伤; 抗氧化损伤; 细胞凋亡
随着世界经济的飞速发展,全球范围内出现了越来越多的重金属镉污染事件,严重威胁到人类生命健康[1-2]。本研究探讨丹参水提液对镉致肾脏损伤的干预作用,现报告如下。
1 资料与方法
1.1 药物与试剂
氯化镉(分析纯),批号130309,天津市光复科技发展有限公司; 亚硒酸钠(分析纯),批号070510, 上海中秦化学试剂有限公司; 丹参中药饮片,批号20151006, 岷县蘅阳中药材有限责任公司; 血肌酐试剂盒(批号20151015)、尿素氮试剂盒(批号20150928)、SOD、MDA试剂盒,批号分别为20151102、20151023, 均有南京建成生物工程研究所提供; 血清总抗氧化能力(T-AOC)试剂盒(批号20151005); 尿β2-MG(兰州大学第一医院中心实验室检验)。
1.2 中药煎煮方法
丹参生药饮片用自来水浸泡30 min, 用水量以轻压药材时水高出药平面约2 cm为宜。将浸泡好的丹参饮片加水至液面淹没过饮片约2~3 cm, 用砂锅进行煎煮,未沸前用武火,沸后用文火、小火保持微沸状态,煎煮20~30 min后提取药汁,滤渣重新提取煎煮10~20 min提取滤液。将2次滤液进行合并浓缩得到含有生药量为0.5 g/mL丹参水提取液[3], 分装入玻璃瓶置于4℃冰箱备用,用时升至室温摇匀后再进行灌胃。
1.3 实验仪器
超净工作台(苏净集团安泰公司)、全自动生化分析仪(瑞士罗氏公司)、 离心机(上海安亭科技仪器厂)、721型分光光度计(杭州汇尔仪器有限公司)、显微镜(广州启跃光电仪器有限公司)、原子吸收法分光光度计石墨炉法(德国耶拿分析仪器股份公司)、流式细胞仪(美国Beekman coulter公司)、医学实验室用干燥箱(宁波新芝生物科技股份有限公司)、实验室用恒温水浴箱(杭州三浦精密仪器有限公司)。
1.4 动物分组与给药
健康的Wistar大鼠,雌雄各20只,鼠龄6周,喂以常规饲料,保持温度20℃~25℃, 湿度40%~70%, 适应性喂养1周后,随机分为2组,分别是空白对照组、模型组。空白对照组8只,模型组32只,常规饲养,空白对照组腹腔注射生理盐水5 mL/(kg·d), 模型组以2.8 mg/(kg·d)氯化镉溶液腹腔注射,即配制的氯化镉溶液5 mL/(kg·d)。连续4周后,观察大鼠一般情况,体质量变化,检测大鼠肾功能指标、尿β2-MG、SOD、MDA以及肾组织病理学改变。于造模成功后,将模型组随机分为给药组(丹参水提液高剂量组、丹参水提液低剂量组)、阴性对照组、阳性对照组。自实验开始第4周后,给药组给予丹参水提液高剂量2.7g/(kg·d)、丹参水提液低剂量1.35 g/(kg·d)灌胃,阳性对照组给予亚硒酸钠溶液0.05 mg/(kg·d)灌胃,阴性对照组、空白对照组给予同体积生理盐水灌胃2.7 mL/(kg·d)。
1.5 标本采集与组织处理
1.5.1 尿液、血清采集:在实验进行的第14周末用代谢笼收集大鼠尿液,收集时间为24 h, 尿液收集过程中大鼠禁食禁水,收集完毕测量尿量; 次日大鼠禁食不禁水,再次收集尿液,放置-20 ℃冰箱保存,待测大鼠尿β2-MG含量; 在实验进行的第14周末,对大鼠实施腹腔麻醉,从眼底静脉丛采血,血液静置45 min后,进行离心,然后收集所有血清,标注清楚分组名称、收集时间,放置-20 ℃冰箱中保存[4]。待使用分光光度计测定 SOD、MDA、T-AOC; 采用苦味酸比色法检测血清肌酐(Cr), 血肌酐、尿素氮均采用瑞士罗氏公司的全自动生化分析仪进行检测; 使用原子吸收法分光光度计石墨炉法检测尿镉、血镉含量; 采用原子吸收光谱法进行检测血清微量元素。
1.5.2 肾脏组织处理:在实验进行的第14周末,称取各组大鼠的体质量,取血后将大鼠固定在固定板上,剪毛,从腹部解剖,暴露心尖,用镊子夹起左心室,灌流针刺入左心室0.5 cm, 并用止血钳固定。剪开右心耳,让血液流出,用生理盐水行心脏灌流,直至肠管肿胀,停止灌流[5]。迅速摘取大鼠两侧肾脏除去包膜并称重,待计算肾脏质量系数; 迅速将左侧肾脏置于超净工作台,制作肾皮质细胞悬液,用AnnexinV/PI双染法进行肾皮质细胞凋亡率检测; 右侧肾脏一部分进行HE染色,另一部分待用石墨炉法检测肾皮质镉含量[6]。
1.6 统计学方法
实验各个分组所测数据均利用统计软件SPSS 22.0进行分析,结果以平均数±标准差表示,空白对照组、阳性对照组、阴性对照组、丹参水提液低剂量组、丹参水提液高剂量组之间分析采用单因素方差分析。P<0.05或P<0.01为差异有统计学意义。
2 结 果
2.1 大鼠一般状况观察
造模后,空白对照组大鼠精神状态良好,皮毛舒展有光泽,食欲佳,活动频繁、反应敏捷灵活,体质量逐渐增加,剩余其他分组大鼠精神状态较差、嗜睡、不爱活动、皮毛粗糙杂乱、食欲不振,反应迟钝,体质量增加缓慢。治疗后,阳性对照组、丹参水提液低、高剂量组大鼠皮毛逐渐恢复光滑色泽,食欲增加、活动量增加、体质量增加的幅度变大,但阴性对照组大鼠一般状况变化不明显。
2.2 各组大鼠的体质量比较
造模型后,模型组与空白对照组相比有显著差异(P<0.05); 治疗后,阴性对照组与空白对照组相比有显著差异(P<0.05), 阳性对照组、丹参水提液低、高剂量组与阴性对照组相比有显著差异(P<0.05)。见表1。

表1 丹参水提液对镉染毒大鼠体质量的影响 g
与空白对照组比较, *P<0.05, **P<0.01; 与阴性对照组比较, #P<0.05。
2.3 各组大鼠24 h尿量及肾脏质量系数比较
造模后模型组尿量显著高于空白对照组(P<0.01); 治疗后,阴性对照组较空白对照组尿量显著增加(P<0.01); 高剂量组尿量显著低于阴性对照组(P<0.01); 阴性对照组、阳性对照组大鼠肾脏质量系数与空白对照组相比有显著差异(P<0.01); 丹参水提液低剂量组、丹参水提液高剂量组与空白对照组比较无显著差异(P>0.05), 丹参水提液低、高剂量组与阴性对照组比较有显著差异(P<0.01), 见表2。

表2 丹参水提液对镉染毒大鼠肾脏质量系数、24 h尿量的影响
与空白对照组比较, *P<0.05, **P<0.01; 与阴性对照组比较, #P<0.05, ##P<0.01。
2.4 各组血清SOD、MDA、T-AOC比较
造模后,模型组血清SOD含量显著低于空白对照组(P<0.01); 治疗后,丹参水提液低、高剂量组、阳性对照组血清SOD含量显著高于阴性对照组(P<0.05); 造模后模型组血清MDA含量显著高于空白对照组(P<0.05)。治疗后,丹参水提液低、高剂量组、阳性对照组血清MDA含量显著低于阴性对照组(P<0.01),见表3。治疗后,阳性对照组、阴性对照组、丹参水提液低剂量组血清中总抗氧化能力(T-AOC)与空白照组比较有显著降低(P<0.05); 丹参水提液高剂量组与空白对照组比较无显著变化(P>0.05), 见表4。
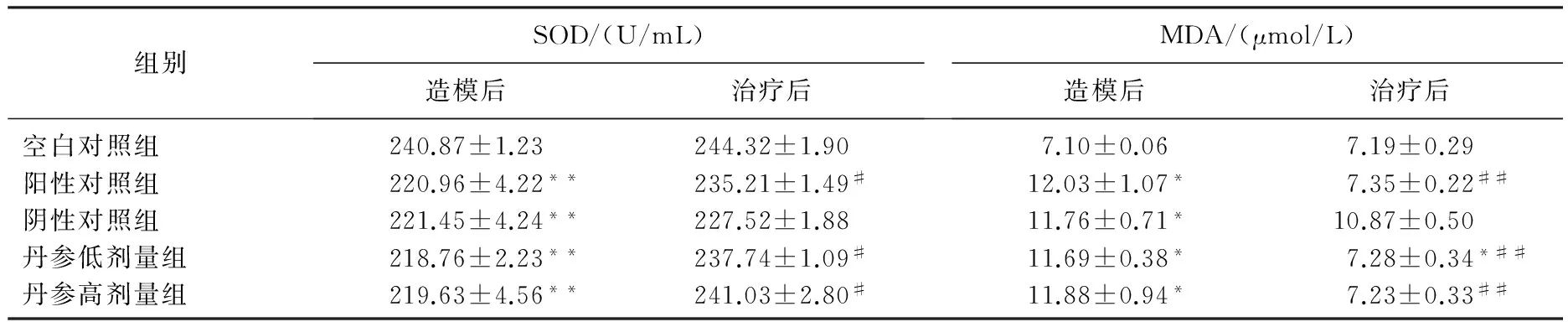
表3 丹参水提液对镉染毒大鼠SOD、MDA含量的影响
与空白对照组相比, *P<0.05, **P<0.01; 与阴性对照组相比, #P<0.05, ##P<0.01。

表4 丹参水提液对镉染毒大鼠血清 总抗氧化能力的影响 U/mL
与空白对照组比较, *P<0.05;
与阴性对照组比较, #P<0.05, ##P<0.01。
2.5 各组血尿素氮、血清肌酐、尿β2-MG比较
造模后,模型组的血尿素氮、血清肌酐、尿β2-MG含量组间无显著差异(P>0.05); 阳性对照组、丹参水提液低剂量组、丹参水提液高剂量组与空白对照组相比有显著升高(P<0.01)。分析治疗后结果显示,丹参水提液高剂量组血尿素氮、血清肌酐、尿β2-MG含量与空白组比较差异无统计学意义(P>0.05); 丹参水提液高剂量组血尿素氮、血清肌酐、尿β2-MG含量显著低于阴性对照组(P<0.05),说明利用丹参水提液高剂量进行治疗取得了一定的效果; 阳性对照组、丹参水提液低剂量组血尿素氮的结果显著低于阴性对照组(P<0.05)。见表5、图1。

表5 丹参水提液对镉染毒大鼠血尿素氮、血清肌酐含量的影响
与空白对照组比较, *P<0.05, **P<0.01; 与阴性对照组比较, #P<0.05, ##P<0.01。
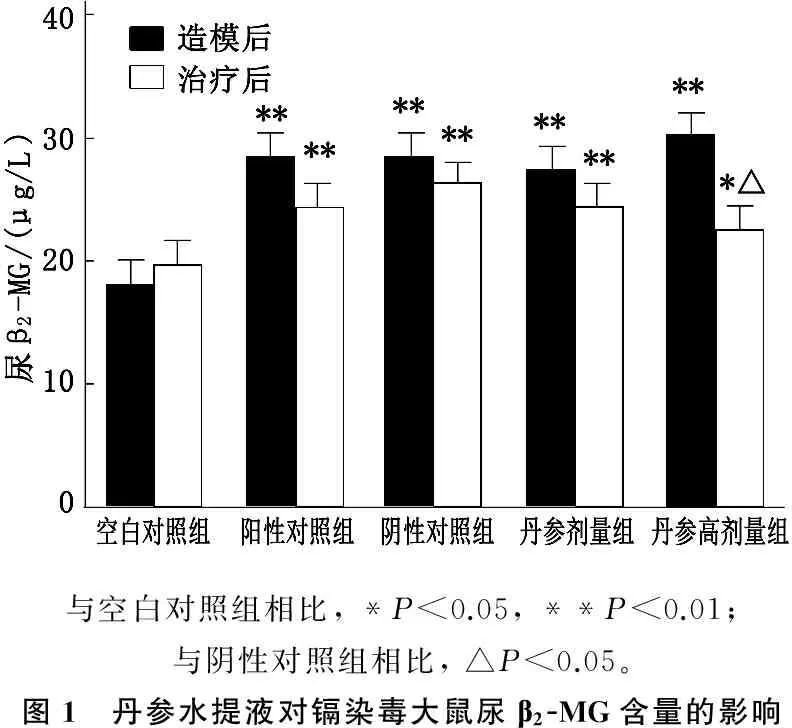
与空白对照组相比,*P<0.05,**P<0.01;与阴性对照组相比,△P<0.05。图1 丹参水提液对镉染毒大鼠尿β2-MG含量的影响
2.6 各组肾脏组织病理学观察比较
光镜下空白组肾小管管腔清晰,上皮细胞形状非常规则且排列很整齐,肾小球结构完好。阴性组上皮细胞呈现浑浊,排列凌乱,有变性、坏死,肾小管管腔狭窄,没有活性症状。阳性组可见部分肾小管腔不规则,细胞核位于上皮细胞的管腔侧,肾小球有轻微的变性症状[7]。丹参低剂量组上皮细胞稍有浑浊肿胀,也可见上皮细胞核位于细胞的最顶端,肾小球结构有轻微受损。丹参高剂量组上皮细胞结构正常,肾小球可见上皮细胞轻微浑浊,结构稍有损伤,基本属于正常。
2.7 各组肾皮质镉、尿镉及血镉含量比较
模型组肾皮质含镉量均显著高于空白对照组(P<0.05); 模型组尿镉含量均显著高于空白对照组(P<0.01); 丹参水提液低、高剂量组血镉含量与阴性对照组有显著差异(P<0.05), 见表6。

表6 丹参水提液对镉染毒大鼠肾皮质、尿及血镉含量的影响
与空白对照组比较, *P<0.05, **P<0.01; 与阴性对照组比较, #P<0.05, ##P<0.01。
2.8 各组大鼠血清中微量元素比较
造模后,模型组血清中铁、锌含量与空白照组比较均显著降低(P<0.05)。阳性对照组、阴性对照组血清中铜、钙含量比空白对照组显著减少(P<0.05); 丹参水提液低、高剂量组血清中铜、钙含量与空白对照组相比差异无统计学意义(P>0.05), 丹参水提液低、高剂量组血清中铜、铁、锌、钙含量显著高于阴性对照组(P<0.05)。见表7。
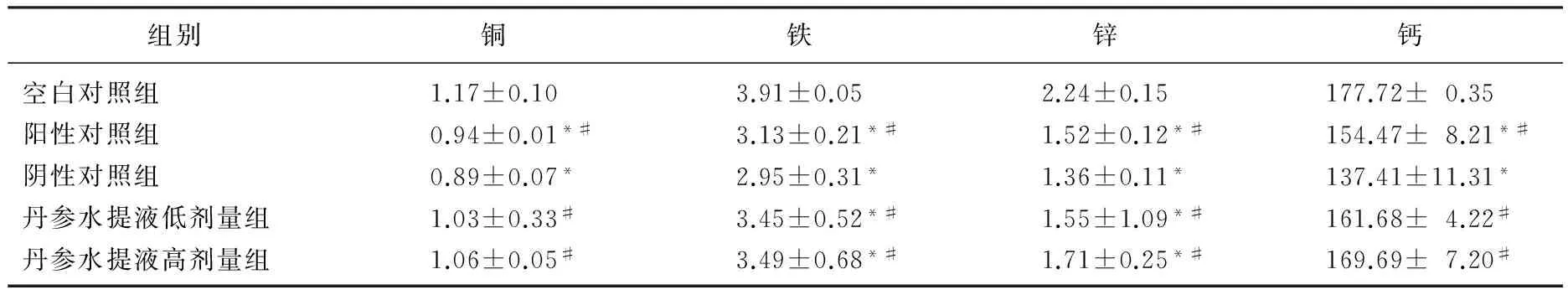
表7 丹参水提液对镉染毒大鼠血清中铜、铁、锌、钙含量的影响 mg/L
与空白对照组比较, *P<0.05; 与阴性对照组比较, #P<0.05。
2.9 各组肾皮质细胞凋亡率比较
检测结果显示,阴性对照组与空白对照组相比早期、晚期凋亡率以及总凋亡率显著升高 (P<0.01); 阳性对照组与空白组相比早期凋亡率、晚期凋亡率显著升高(P<0.05); 丹参水提液低、高剂量组与空白对照组相比早、晚、总凋亡率无显著差异(P>0.05); 丹参水提液高剂量组与阴性对照组相比早期凋亡率显著降低(P<0.05); 阳性对照组、丹参水提液低、高剂量组晚期和总凋亡率与阴性对照组相比均显著降低(P<0.01)。见表8。
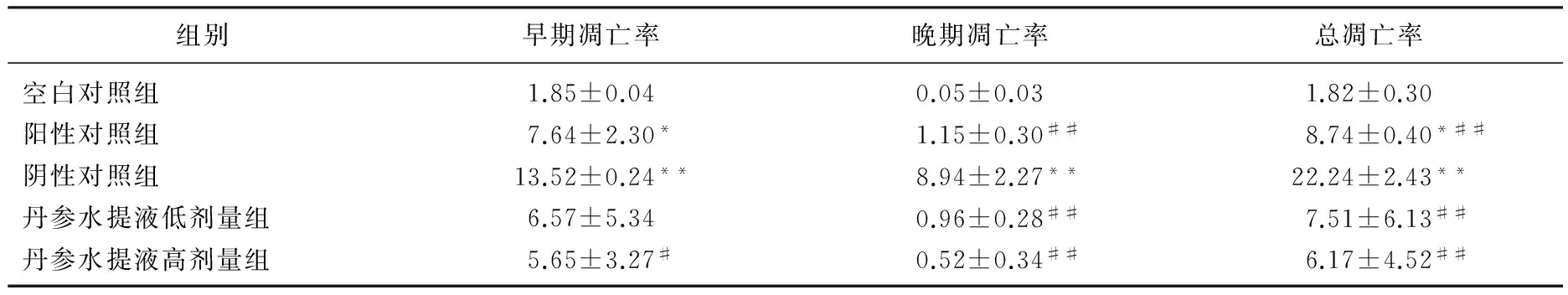
表8 丹参水提液对镉染毒大鼠肾皮质细胞凋亡率的影响 %
与空白对照组比较, *P<0.05, **P<0.01; 与阴性对照组比较, #P<0.05, ##P<0.01。
3 讨 论
3.1 亚硒酸钠液对隔致肾损伤的作用机制
亚硒酸钠液中的硒为人体必需的微量元素之一,具有抑制癌细胞生长,阻断癌细胞的能量供应,有抗癌发生的作用; 具有调节维生素A、C、E、K的吸收与利用的作用,可预防近视、白内障等缺硒类疾病的发生,提高抗病能力; 具有调节蛋白质的合成的功能,可预防由于人体中硒含量不足导致的遗传染色体损伤及蛋白质能量缺乏。硒在体内发挥着重要的生理功能,是不可或缺的微量元素,而肾脏是硒代谢和储存的重要器官,是动物或者人体内的一个大“硒”库,肾内硒含量非常高。本实验选择亚硒酸钠液作为阳性对照组,其对隔致肾损伤的作用机制有以下几个方面。
3.1.1 亚硒酸钠液可提高肾小球滤过率,减轻炎症发生:肾脏是一个重要的耗氧器官,当机体受重金属污染而患肾脏病时,肾内慢性缺氧导致肾脏内产生大量氧自由基,从而可导致肾脏发生损伤,并最后导致肾小球硬化、肾小管萎缩及肾间质纤维化。亚硒酸钠液中的硒是谷胱甘肽过氧化物酶(GPx)的合成成份,具有清除体内自由基,减少脂质过氧化物氧化反应,降低机体的氧化损伤的作用; 硒还有拮抗一些重金属毒性的作用,一方面硒是体内抗氧化系统的重要组成成分,能明显改善重金属诱导的脂质过氧化反应,减轻重金属元素对人体的毒害; 另一方面硒与金属有很强的亲和力,可在体内与重金属结合成金属硒蛋白复合物,从而可降低重金属的毒性作用。
3.1.2 亚硒酸钠液对肾脏有保护作用,减轻毒素对肾侵害:亚硒酸钠液中的硒具有良好的解毒功能,能促使一些重金属从肾脏排泄,拮抗这些重金属引起的肾脏损害。LIU Yang等[9]动物实验研究表明,硒能够抑制隔导致的c-Jun氨基末端激酶(JNK)通路的活化及细胞凋亡,硒作为一种抗氧化微量元素在镉引起JNK通路的激活及诱导细胞凋亡中起到一定的干预作用。 用硒预处理镉染毒的肾细胞能减少活性氧的出现,干预线粒体膜电位的异常下降、细胞色素C的释放以及caspase的激活,从而抑制镉诱导的肾细胞凋亡。此外,根据对相关实验数据的分析研究,在锌、硒共同作用对镉毒性拮抗作用比单独给予锌、硒效果更好。所以给机体增加摄入微量元素硒,可提高机体免疫力,排出体内有毒、有害物质,降低镉毒性对机体组织的损伤,能修复受损肾细胞,起到对肾脏的保护作用,减轻镉毒素对肾侵害。
3.1.3 亚硒酸钠液能提高机体免疫力,维持机体活化免疫应答:镉致慢性肾脏病患者免疫功能往往是受抑制的,易发生感染。亚硒酸钠液中硒是一种免疫调节剂,对人或动物免疫功能的影响是多方面的和复杂的。当活化的免疫细胞代谢增加时,产生活性氧的机会便会增多,这种活性氧过度产生又会损害免疫活性细胞,降低免疫力,因此需要有一个强有力的系统使活性氧的量保持在一定范围内[10]。实验中通过用亚硒酸钠液灌胃补硒后,肾脏细胞及其他部分硒水平升高,其抗氧化性增强,通过谷胱甘肽过氧化物酶及其同功酶和硒的其它化合物清除自由基,减少脂质过氧化物的产生,从而保护细胞膜免受过氧化物的损害,从而促进免疫应答。
3.2 丹参水提液对镉致肾损伤的作用机制
3.2.1 丹参水提液清除自由基:在慢性镉中毒的情况下,镉可通过对线粒体的损伤、抗氧化活性降低或丧失、激发产生超氧化自由基、引起炎症反应等途径引起肾脏的氧化损伤。本实验的结果表明,受丹参水提液干预治疗后,丹参水提液低、高剂量组增强了大鼠SOD活性、降低了MDA含量,且在降低MDA含量方面表现更加明显。这是丹参水提液防病治病作用机制的重要特征,其作用机制可能是通过阻断自由基产生的连锁反应,修复肾脏组织细胞,以保持内环境的稳定。证实丹参水提液具有较强的清除氧自由基的能力,有效减缓、遏制镉致肾脏的氧化损伤,对镉致肾脏组织损伤干预作用明显[8]。
3.2.2 丹参水提液降低肾脏皮质、血镉含量:实验肾脏皮质镉浓度测定的结果表明,丹参水提液有明显的驱镉效应。实验中丹参水提液低、高剂量组镉含量也较少,这说明丹参能够改善肾脏微循环,加快血液流速,加快镉在体内代谢的过程[11]。
3.2.3 丹参水提液降低尿蛋白:尿蛋白超过正常量可使肾脏受损。实验证明丹参水提液一定程度上能够减轻镉对肾小球和肾小管的损伤程度,能够增强损伤细胞结构修复和功能恢复的能力[12-13]。
3.2.4 丹参水提液抗细胞凋亡:实验[11-14]表明,丹参水提液对慢性镉中毒引起肾脏损伤而导致的TEC凋亡有明显的抑制作用,意味着丹参水提液能有效降低镉对组织细胞的影响。
[1] 罗春霞. 湖南凤凰铅锌矿区居民重金属污染健康风险认知及卫生系统的应对研究[D]. 昆明医科大学, 2013.
[2] 曾东宏. 橡胶类垃圾焚烧过程中典型重金属污染物的迁移特性研究[D]. 华南理工大学, 2012.
[3] 丁青龙, 卢恒清. 丹参生药颗粒饮片及饮片提取颗粒中原儿茶醛含量的比较[J]. 解放军药学学报, 2000, 16(1): 34-36.
[4] 史旭芹, 唐于平. 大鼠慢性失血性血虚模型造模方法的研究与评价[J]. 中国药理学通报, 2013, 29(3). 437-44.
[5] Jarup L, Persson B, Elinder C G. Decreased glomerular filtration rate in solderers exposed to cadmium[J]. Occup Environ Med, 1995, 52(12): 818-822.
[6] 胡艳, 吴立红. 慢性肾病综合征患者血清微量元素检测的临床意义[J]. 中国热学, 2006, 6 (7): 1217-1219.
[7] 杨敬华, 徐兆发, 徐斌, 等. 镉致大鼠肾脏毒性机制研究[J]. 中国公共卫生, 2007, 23(7): 887-888.
[8] Yang H, Shu Y. Cadmium transporters in the kidney and cadmium-induced nephrotoxicity[J].Int J Mol Sci, 2015, 16(1): 1484-1494.
[9] 常虹, 刘萍. 丹参对微循环的影响[J]. 中国药物应用与监测, 2006, 3(4): 21-22.
[10] Bharavi K, Reddy A G, Rao G S, et al. Prevention of cadmium bioaccumulation by herbal adaptogens[J]. Indian J Pharmacol, 2011, 43(1): 45-49.
[11] 江励华. 中药对镉致肾脏慢性损伤的保护作用的理论及实验研究[D]. 南京中医药大学, 2005.
[12] SU Chun-Yan, MING Qian-Liang, HAN Ting, et al. Salvia miltiorrhiza: Traditional medicinal uses, chemistry, and pharmacology[J]. Chinese Journal of Natural Medicines, 2015, 13(3): 0163-0182.
[13] 任香梅, 蔡云清. 镉引起肾细胞凋亡的研究进展[J]. 国家医学卫生学分册, 2004, 31(1): 28-32.
[14] Zhang H, Li L. Changes of c-fos, Malondialdehyde and Lactate in Brain Tissue after Global Cerebral Ischemia under Different Brain Temperatures[J]. J Huazhong Univ Sci Technol, 2014, 34(3): 354-358.
Effects of water extract of radix salviae miltiorrhizae on renal injury in rats exposed to cadmium
ZHANG Qianqian1, HE Ling2, TENGYulian3, LYU Xiaoyun4
(1.SecondHospitalofLanzhouUniversity,Lanzhou,Gansu, 730030; 2.ZhuhaiSecondPeople′sHospital,Zhuhai,Guangdong, 519000; 3.LanzhouUniversityHospital,Lanzhou,Gansu, 730030; 4.InstituteofIntegratedTraditionalChineseandWesternMedicineofLanzhouUniversity,Lanzhou,Gansu, 730030)
Objective To explore effects of water extract of radix salviae miltiorrhizae on renal injury in rats exposed to cadmium and its possible mechanism. Methods Twenty male and female healthy Wistar rats, respectively, at age of 6 weeks were randomly divided into blank group (n=8), and model group (n=32) after adaptive feeding for 1 week, given intraperitoneal injection of saline for 5 mL/(kg·d) and intraperitoneal injection of cadmium chloride solution for 2.8 mg/(kg·d). Continuously building for 4 weeks, the general situation of rats was observed, and the rat kidney function and kidney tissue pathological changes were detected. After successful molding, the model group was randomly divided into medicine group, negative and positive and blank control groups. The medicine group was given Salvia miltiorrhiza water extract of high dose of 2.7g/(kg·d), Danshen aqueous extract of low dose 1.35 g/(kg·d) by gavage, positive control group was given sodium selenite for 0.05 mg/kg·d by gavage, the negative and blank control groups were given the same mount of saline for 2.7 mL/(kg·d). After 10 weeks of treatment, serum and urine was collected, and kidney tissue was to be detected. Results Salvia miltiorrhiza water extraction liquid of low and high dose group had less 24 h urine volume than negative control group, and serum superoxide dismutases (SOD) increased significantly, Malondialdehyde (MDA) decreased significantly, total antioxidant capacity (T-AOC) increased significantly, blood urea nitrogen, urinary beta β2-MG content and serum creatinine levels was decreased. Pathological section revealed that renal proximal convoluted tubules epithelial cells was turbid, swelling, degeneration and necrosis in the negative control group. Salvia miltiorrhiza water extraction liquid of low and high dose group had lower serum cortical cadmium content than the negative control group, Salvia miltiorrhiza water extraction liquid of low and high dose group had lower apoptosis rate than the negative control group. Conclusion The salvia miltiorrhiza water solution can accelerate the metabolism of cadmium, and effectively interfere with cadmium induced renal injury, delay chronic renal failure, and protect the kidney.
aqueous extract of Salvia miltiorrhiza; cadmium; renal injury; oxidative damage; cell apoptosis
2016-10-26
广东省珠海市科技计划项目(2015A0014)
滕玉莲, E-mail: tengyl@lzu.edu.cn
R 692
A
1672-2353(2017)05-005-06
10.7619/jcmp.201705002

