缺血后处理增加脊髓miR-125b表达减轻大鼠脊髓缺血-再灌注损伤后神经元凋亡
李晓倩,陈凤收,张再莉,马 虹
·论著·
缺血后处理增加脊髓miR-125b表达减轻大鼠脊髓缺血-再灌注损伤后神经元凋亡
李晓倩,陈凤收,张再莉,马 虹*
目的 观察缺血后处理(Ischemic postconditioning,IPC)对大鼠脊髓缺血再灌注损伤(Spinal cord ischemia reperfusion injury,SCIRI)后microRNA(miRNA,miR)-125b表达及下肢运动功能的影响。方法 45只SD大鼠平均随机分为3组:假手术组(Sham组)、缺血-再灌注组(IR组)和缺血后处理组(IPC组)。Sham组仅暴露主动脉弓而不夹闭,其他各组夹闭主动脉弓14 min后再开放建立SCIRI模型。IPC组于再灌注5 min后给予5循环缺血后适应。再灌注后24 h,处死大鼠,提取脊髓组织,分别检测脊髓组织湿/干重比(Wet-dry ratio,W/D)和总含水量(Total water content,TWC),HE染色观察脊髓组织病理学变化,qRT-PCR测定脊髓组织中miR-125b表达,TUNEL法检测神经元凋亡数量(Apoptotic quantitiy,AQ)。结果 术后24 h,与Sham组比较,IR组大鼠脊髓W/D、TWC、AQ升高,脊髓组织中miR-125b表达下调(P<0.05);与IR组比较,IPC组脊髓W/D、TWC、AQ降低,脊髓组织中miR-125b表达上调(P<0.05)。HE染色显示,Sham组脊髓前角结构完好,可见大量胞核完整的运动神经元,IR组脊髓前角内大量空泡形成,神经元结构缺失,胞质呈嗜酸性,而IPC组脊髓前角存在部分结构正常的神经元。结论 缺血后处理可能通过上调脊髓组织中miR-125b的表达,减少脊髓组织前角运动神经元凋亡,从而改善大鼠SCIRI损伤。
凋亡;脊髓缺血-再灌注损伤;缺血后处理;microRNA
0 引言
胸心血管外科手术因术中需要短时阻断腹主动脉、腰动脉等,可导致脊髓缺血再灌注损伤(Spinal cord ischemia reperfusion injury,SCIRI),引起损伤平面以下感觉缺失和运动功能障碍,造成巨大的经济和社会负担[1]。研究表明,SCIRI后运动功能障碍的发生与前角运动神经元凋亡密切相关,减少神经元凋亡对改善SCIRI预后有重要意义[2-3]。microRNA (miRNA,miR)是约22 bp长的非编码小分子RNA,广泛存在于真核生物中,调控多种生物学功能。其中miR-125b是一种具有缺氧诱导活性的miRNA,在缺血、缺氧等条件下异常表达,调节细胞凋亡和炎性反应[4]。缺血后处理(Ischemic postconditioning,IPC)是应用于再灌注早期的机械性干预措施,具有预知性和可控制性强的特点,临床应用简单、方便。IPC作用机制复杂,可通过抗炎、抗凋亡等多种途径,在心、肝、肾等重要器官缺血再灌注损伤过程中发挥保护作用[5-6]。目前,关于IPC能否在基因水平上特异性减轻SCIRI的研究甚少,因此,深入研究IPC对脊髓组织中miR表达的影响,对防治SCIRI有重要意义。故本研究以IPC对大鼠SCIRI模型进行干预,观察脊髓组织中miR-125b表达的变化,以探讨IPC的作用机制。
1 材料与方法
1.1 材料 SPF级SD成年大鼠45只,雄性,鼠龄6~8周,体重(200±20) g,由中国医科大学实验动物中心提供。RWD407小动物呼吸机(深圳市瑞沃德生命科技有限公司);PCR反应仪(日本Bioer公司);电热恒温鼓风干燥箱(上海圣科仪器设备有限公司);光学显微镜(日本奥林巴斯公司);PrimeScriptTM反转录试剂盒;组织细胞凋亡荧光原位试剂盒(上海润成生物科技有限公司);其余均为市售分析纯。
1.2 动物模型制备和分组 随机数字表法随机分为假手术组(Sham组)、IR组和缺血后处理组(IPC组),每组15只。按照文献[7]报道制备模型。水合氯醛腹腔注射麻醉,常规消毒,右侧卧位,沿肋缘切口暴露心包,分离主动脉至与左锁骨上动脉发出处上无创动脉夹夹闭14 min,即为缺血期;之后撤除动脉夹,形成再灌注期。逐层缝合伤口,腹腔注射0.3 mL氨苄青霉素(100 mg/mL)。Sham组只开胸不夹闭主动脉弓,IPC组再灌注5 min后,给予5循环缺血后适应(阻断腹主动脉1 min/开放1 min为1个循环),远端血压控制在45~55 mmHg,其余步骤同IR组。术后24 h注射过量麻醉药处死大鼠,留取L4~6节段脊髓组织。
1.3 大鼠脊髓组织湿/干重比(Wet-dry ratio,W/D)和总脊髓含水量(Total water content,TWC) 留取的脊髓组织用生理盐水充分漂洗,滤纸吸干多余水分,称重为湿重(W);70 ℃下24 h烘干后称重为干重(D),两者之比为W/D;TWC(%)=(W-D)/D×100%。
1.4 光镜检测大鼠脊髓前角运动神经元形态和数量变化 取 0.5 cm×0.5 cm×0.5 cm大小脊髓组织,经4%甲醛固定,常规石蜡包埋切片,HE染色后,采用光学显微镜观察(100×,400×),计数脊髓前角正常神经元数目。
1.5 大鼠脊髓组织细胞凋亡荧光原位检测 采用原位缺口末端标记法(TUNEL),按照试剂盒说明操作。荧光显微镜下细胞核中有绿色荧光者为阳性细胞。计数5个高倍镜视野(100×)下的凋亡细胞数量(Apoptotic quantitiy,AQ)。
1.6 qRT-PCR法检测大鼠脊髓组织miR-125b的表达变化 用miRNeasy mini试剂盒提取IR组和IPC组的脊髓组织miRNA。按照说明书将miR-125b反转录后行FQ-PCR。miR-125b检测系统为StepOneTMSoftware v2.0,内参为U6。反应条件:94 ℃ 30 s;94 ℃ 5 s;60 ℃ 30 s;循环数为40次。Sham组脊髓组织作为对照,ΔΔCt=[Ct实验组-Ct实验组U6]-[Ct对照组-Ct对照组U6]。以2-ΔΔCt值表示miR-125b的相对表达量。
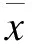
2 结果
2.1 各组大鼠脊髓组织湿/干重比(W/D)和总脊髓含水量(TWC)比较 损伤后24 h,与Sham组比较,IR组脊髓组织W/D、TWC均升高(P<0.05)。与IR组比较,IPC组脊髓组织W/D、TWC均降低(P<0.05),见表1。
2.2 各组大鼠脊髓组织形态学的比较 光镜下,Sham组大鼠脊髓前角结构完好,可见大量结构正常,胞质内含颗粒状尼氏体,胞核完整的运动神经元;与Sham组比较,IR组脊髓前角内神经元结构缺失,灰质内有大量空泡形成,胞质呈嗜酸性,而IPC组脊髓灰质结构相对完好,前角存在部分结构正常的神经元。见图1。
同时,计数脊髓灰质前角内健存运动神经元数量显示,损伤后24 h,与Sham组比较,IR组前角内健存运动神经元数量(Number,N)明显减少(P<0.05);与IR组相比,IPC组前角内健存运动神经元数量明显增多(P<0.05)。见表1。

表1 再灌注后24 h各组脊髓组织湿/干重比(W/D)、总脊髓含水量(TWC)、正常(N)和凋亡 神经元(AQ)数量和miR-125b表达的变化(n=15)
注:*与Sham组比较,P<0.05;#与IPC组比较,P<0.05

图1 再灌注后24 h各组大鼠脊髓组织形态学变化(100×,400×)
2.3 TUNEL法检测大鼠脊髓组织神经元凋亡数量的比较 TUNEL法荧光染色时,可以在515~565 nm激发波长下荧光显微镜观察出鲜艳光亮的绿色荧光。损伤后24 h,Sham组几乎没有绿色荧光;IR组可见脊髓前角灰质内有大量绿色并呈神经元样细胞形态的荧光团,即TUNEL阳性细胞;与IR组相比,IPC组损伤后绿色的荧光强度和数量明显减少(P<0.05)。见图2、表1。

图2 再灌注后24 h后TUNEL法观察各组大鼠脊髓组织 神经元凋亡变化(100×)
2.4 各组大鼠脊髓组织miR-125b表达的比较 qRT-PCR结果显示,损伤后24 h,与Sham组比较,IR组脊髓组织miR-125b表达明显下调(P<0.05);与IR组比较,IPC组脊髓组织miR-125b表达明显上调(P<0.05)。见表1。
3 讨论
SCIRI后运动功能障碍是最难以预测和最为严重的并发症之一[1],其机制复杂,探寻能够有效用于临床预防和治疗SCIRI的药物或措施已成为该领域的热门课题[7]。IPC即在缺血后立即给予几个短暂的灌注再缺血的循环处理,最先在心脏的缺血再灌注损伤中被证明有保护作用[5-6]。随着认识的不断深入,学者对IPC的研究已不局限于心肌保护,发现IPC可能通过抗炎、抗凋亡等多途径发挥神经保护作用,并确定再灌注开始的数分钟是保护作用的关键,具有更好的临床应用前景[6,8-9]。
miRNA通过与靶基因mRNA特异性结合,对细胞内多种基因进行负性调控,严格调控神经细胞的分化,影响神经系统的发育和功能,成为近年来研究的热点[2,10]。越来越多的研究发现,在缺血缺氧等病理状态下,一些miRNAs表达也迅速发生变化,其不仅在上游对神经元凋亡、自噬等相关分子信号途径进行调控,对中下游炎症反应、胶质细胞增殖也产生了广泛的影响[11-12]。miR-125b作为心肌缺血调控网络的重要成员之一,上调其表达,可以有效抑制心肌细胞凋亡、NF-κB激活以及下游炎性因子释放[4]。同时,miR-125b在脊髓中呈特异性表达或高度分布[13]。本研究结果显示,损伤后24 h,与Sham组比较,IR组大鼠脊髓组织miR-125b表达明显下降,而IPC处理后,大鼠脊髓组织中的miR-125b表达上调,提示miR-125b参与调节SCIRI,与Chawla等[4,14]的研究结果一致。
SCIRI后脊髓水肿、运动神经元凋亡,是临床出现损伤平面以下运动缺失为主的神经功能障碍的重要原因[8]。本研究结果证实,SCIRI模型中,损伤后24 h与Sham组相比,IR组大鼠脊髓组织明显肿胀,W/D、TLW含量增加,病理学检查可见损伤区脊髓前角正常运动神经元数目明显下降,TUNEL提示凋亡神经元数目上升;而给予IPC处理后,脊髓组织中W/D、TLW下降,病理学检查提示脊髓损伤形态减轻,凋亡神经元数量明显减少。上述变化与SCIRI后脊髓组织中miR-125b的变化趋势一致,其机制可能与SCIRI后抑制氧化应激、激活炎性反应所诱发的miR-125b表达下调有关,而IPC可对抗上述病理变化、增加miR-125b表达,从多种途径综合减轻脊髓水肿和神经元凋亡[4,9-10]。因此,IPC在miRNA水平上对SCIRI的保护机制仅是其中一个环节,综合多因素进行干预才能获得最佳的SCIRI治疗效果。
[1] Simon F,Oberhuber A.Ischemia and reperfusion injury of the spinal cord:experimental strategies to examine postischemic paraplegia[J].Neural Regen Res,2016,11(3):414-415.
[2] Xu M,Wang HF,Zhang YY,et al.Protection of rats spinal cord ischemia-reperfusion injury by inhibition of MiR-497 on inflammation and apoptosis:possible role in pediatrics[J].Biomed Pharmacother,2016,81:337-344.
[3] Gong S,Peng L,Yan B,et al.Bosentan reduces neuronal apoptosis following spinal cord ischemic reperfusion injury[J].Spinal Cord,2014,52(3):181-185.
[4] Wang X,Ha T,Zou J,et al.MicroRNA-125b protects against myocardial ischaemia/reperfusion injury via targeting p53-mediated apoptotic signalling and TRAF6[J].Cardiovasc Res,2014,102(3):385-395.
[5] Ekström K,Dalsgaard M,Iversen K,et al.Effects of liraglutide and ischemic postconditioning on myocardial salvage after I/R injury in pigs[J].Scand Cardiovasc J,2017,51(1):8-14.
[6] Hu L,Wang J,Zhu H,et al.Ischemic postconditioning protects the heart against ischemia-reperfusion injury via neuronal nitric oxide synthase in the sarcoplasmic reticulum and mitochondria[J].Cell Death Dis,2016,7:e2222.
[7] 余奇劲,解立杰,胡霁.脊髓缺血再灌注损伤与血脊髓屏障关系的研究进展[J].中国医药,2016,32(12):2066-2068.
[8] Li XQ,Cao XZ,Wang J,et al.Sevoflurane preconditioning ameliorates neuronal deficits by inhibiting microglial MMP-9 expression after spinal cord ischemia/reperfusion in rats[J].Mol Brain,2014,7:69.
[9] Mahi N,Kumar A,Jaggi AS,et al.Possible role of pannexin 1/P2x7 purinoceptor in neuroprotective mechanism of ischemic postconditioning in mice[J].J Surg Res,2015,196(1):190-199.
[10]Hu JR,Lv GH,Yin BL.Altered microRNA expression in the ischemic-reperfusion spinal cord with atorvastatin therapy[J].J Pharmacol Sci,2013,121(4):343-346.
[11]Abdul-Muneer PM.MicroRNA in the Pathophysiology of CNS injury:implication in neuroregenerative medicine[J].CNS Neurosci Ther,2016,22(7):543-545.
[12]Ouyang YB,Stary CM,White RE,et al.The use of microRNAs to modulate redox and immune response to stroke[J].Antioxid Redox Signal,2015,22(2):187-202.
[13]左乔,许家军.MicroRNA在神经系统不同部位特异分布及其在神经损伤再生中的变化和作用[J].生理科学进展,2011,42(4):261-268.
[14]Chawla G,Deosthale P,Childress S,et al.A let-7-to-miR-125 microrna switch regulates neuronal integrity and lifespan in drosophila[J].PLoS Genet,2016,12(8):e1006247.
Ischemic postconditioning alleviates neuronal apoptosis after spinal cord ischemia reperfusion injury by increasing spinal microRNA-125b expression in rats
LI Xiao-qian,CHEN Feng-shou,ZHANG Zai-li,MA Hong*
(Department of Anesthesiology,the First Affiliated Hospital of China Medical University,Shenyang 110001,China)
Objective To observe the effects of ischemic postconditioning (IPC) on expressions of microRNA (miRNA,miR)-125b and lower limb motor function after spinal cord ischemia reperfusion injury (SCIRI) in rats.Methods Forty-five rats were divided into three groups:sham group (n=15),IR group (n=15),and IPC group (n=15).Aortic arch was only exposed but not occluded in rats of sham group.SCIRI was established by aortic arch occlusion for 14 min.IPC was induced by 5 cycles of ischemic adaptation at 5 min after reperfusion.At 24 h after reperfusion,spinal cord was extracted to determine the spinal wet-dry ratio (W/D) and total water content (TWC).Changes of spinal morphology and neuronal apoptotic quantitiy (AQ) were detected by HE and TUNEL staining,respectively.miR-125b expression was assessed by qRT-PCR.Results Compared with sham group,rats in IR group and IPC group had significantly higher W/D,TWC and AQ,but lower miR-125b expression at 24 h after SCIRI (P<0.05).Compared with IR group,rats in IPC group had lower W/D,TWC and AQ,but higher miR-125b expression (P<0.05).As showed in represented HE staining,the neuronal morphologies in sham group were intact with integrated nucleus.But in IR group,a large number of vacuoles and absent of structure were formed in neurons of anterior horn,and the cytoplasm was eosinophilic.There were still some neurons with normal structure left in IPC group.Conclusion Ischemic postconditioning can decrease the neuronal apoptosis in anterior horn and further alleviate SCIRI by increasing the spinal miR-125b expression
Apoptosis;Spinal cord ischemia reperfusion injury;Ischemic postconditioning;microRNA
2016-10-12
中国医科大学附属第一医院麻醉科,沈阳 110001
国家自然科学基金项目(81601053、81401000);辽宁省教育厅科学技术研究项目(LK201636);辽宁省博士科研启动基金项目(20141035)
10.14053/j.cnki.ppcr.201704001
*通信作者

