基因芯片检测乙肝病毒分型和耐药突变的准确度灵敏度分析
程瑞斌+刘静
(咸宁市中心医院湖北科技学院附属第一医院 检验科,湖北咸宁 437100)
[摘 要] 目的:分析基因芯片检测乙肝病毒(Hepatitis B virus,HBV)分型和耐药突变的准确度灵敏度,探讨其临床应用价值。方法:以我院2014年5月至2016年9月确诊且符合入组标准的351例乙型病毒性肝炎患者为研究对象,采用基因芯片法检测其血清标本HBV基因分型及核苷酸类药物突变情况,以DNA直接测序法为金标准,计算基因芯片检测HBV分型和耐药突变的准确度灵敏度。结果:基因芯片与基因测序检测HBV分型、耐药突变结果完全一致。以基因测序检测结果为金标准,基因芯片检测HBV分型和耐药突变的准确度为100%;基因芯片检测HBV分型和耐药的最低检出限为103 copies/mL。结论:基因芯片技术在HBV分型和耐药突变的检测中具有较高的准确度及灵敏度,能够为临床抗病毒药物的选择提供可靠的参考。
[关键词] 基因芯片;乙肝病毒分型;耐药突变;准确度;灵敏度
中图分类号:R446.1 文献标识码:A 文章编号:2095-5200(2017)04-062-03
DOI:10.11876/mimt201704025
安全、有效的抗病毒治疗对于延缓乙型病毒性肝炎病情进展具有重要意义[1]。然而,HBV包括多种基因型,不同基因型耐药特点存在差异,耐药严重影响了抗病毒治疗效果[2]。当前临床明确HBV耐药突变检测的金标准为DNA直接测序法,但存在成本高、耗时久等弊端,无法满足快速诊断、大规模推广要求[3]。本研究就基因芯片检测HBV分型及耐药突变的准确度及灵敏度进行分析,旨在评估该技术的临床应用价值。
1 资料与方法
1.1 一般资料
以我院2014年5月—2016年9月参照2010年全国传染病与寄生虫病学术会议拟定的《病毒性肝炎防治方案》确诊的乙型病毒性肝炎患者为研究对象。入组患者乙肝表面抗原(HBsAg)及HBV DNA检测均为阳性(HBV DNA≥1×103 IU/mL),排除合并其他类型肝炎及免疫性肝病、胆汁型肝硬化患者及基因芯片检测无信号者[4]共351例入选。其中男189例,女162例,年龄17~71岁,平均年龄(48.42±10.58)岁。351例患者均有长期(≥48周)核苷类抗病毒药物使用史,其中208例接受拉米夫定治疗,143例接受阿德福韦酯治疗。本研究已征得我院医学伦理委员会批准,患者均知情同意并签署知情同意书。
1.2 研究方法
1.2.1 标本采集 抽取患者入组次日空腹静脉血4 mL,分装于4支抗凝管内,分别用于基因芯片法HBV基因分型、耐药突变检测及基因测序法HBV基因分型、耐药突变检测。
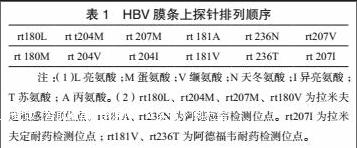
1.2.2 标本检测 基因芯片:HBV基因分型及耐药突变检测试剂均购自深圳亚能生物技术有限公司,使用Biomctra基因扩增仪及FYY-3型分子杂交仪(兴化市分析仪器厂),操作均严格按照试剂使用说明书。扩增循环条件:95℃ 10 min→94℃ 34 s→56℃ 30 s→72℃ 30 s,重复循环50次。结果分析使用光学扫描仪[5]。HBV膜条探针排列顺序设计见表1。基因测序:取第二次聚合酶链反应(PCR)扩增产物,委托华大基因公司完成基因测序。
1.2.3 结果分析 根据基因芯片、基因测序检测结果,分析患者HBV分型及耐药突变,以基因测序检测结果为金标准,计算基因芯片检测HBV分型及耐药突变的准确度、灵敏度及特异性[6]。此外,为验证基因芯片对HBV分型和耐药检测的准确性,应用实时定量PCR法确认标本载量并制成104、103、102 copies/mL浓度,分析基因芯片的最低检出限[7]。
2 结果
基因芯片与基因测序检测HBV分型结果完全一致,均为B型211例、C型53例、B+C型87例。基因芯片准确度100%。
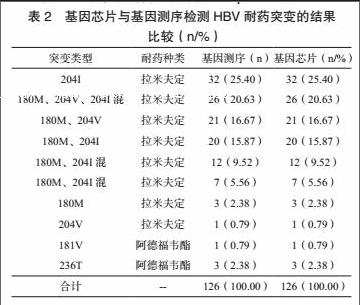
351例患者中有126例患者耐药基因突变耐药,基因芯片与基因测序检测HBV耐药突变结果相同,具体见表2,准确度为100%。
以基因测序检测结果为金标准,基因芯片检测HBV分型和耐药突变的灵敏度及特异性均为100%;基因芯片检测HBV分型和耐药的最低检出限为103 copies/mL。
3 讨论
核苷类似物是临床治疗病毒性乙型肝炎的常用方案,其口服给药方便、病毒抑制作用较强等优势已得到广泛认可,且可用于肝功能失代偿者,但该类抗病毒药物HBeAg转换率偏低,疗效持久性不足,会导致部分患者出现耐药现象[8-9]。HBV耐药突变的发生,可造成HBV DNA再次升高、转氨酶反弹等,对治疗效果造成不良影响 [10]。与此同时,不同HBV基因型对干扰素的应答、疾病进程的影响存在差异[11],因此,在明确HBV耐药突变的同时,了解HBV分型对于指导治疗方案的选择亦有着重要意义。
当前临床判断HBV分型与耐药突变主要依据基因测序技术,目前该技术耗时久、操作烦琐且成本高昂 [12]。作为一种新型生物芯片技术,基因芯片检测主要根据分子间特异性相互作用的原理,通過集成于硅芯片或玻璃芯片内微型生化分析系统,全面了解基因及其他生物组分信息,具有准确、快速、信息量大的优势[13]。与传统检测手段相比,基因芯片技术具有无污染、成本低、自动化、微型化等特点,且可检测已知突变位点,故在HBV分型和耐药突变方面有着良好的应用前景[14]。
为明确基因芯片技术检测HBV分型与耐药突变的价值,本研究结果表明,基因芯片与测序在HBV分型和耐药突变的检测准确度方面具有一致性,这主要得益于HBV耐药变异基本为单碱基变异,而寡核苷酸基因芯片技术在单次检测中即可明确与HBV耐药性相关的单碱基变异,一般不会导致误判或漏检[15-16]。
本研究筛选过程中8例患者因基因芯片无信号而未入组,无信号的原因可能是由于DNA拷贝数低于基因芯片的最低极限。在灵敏度的分析中,最低检出限亦为重要指标。本研究制成不同阶梯浓度的标本,就基因芯片技术的最低检出限进行了分析,结果表明,该技术最低检出限可达103 copies/mL,显现出其在检测灵敏度方面较高的价值。
需要注意的是,由于基因芯片技术仅可检测已知位点的耐药变异,无法发现新的变异位点并针对性设计引物与探针,故在了解易突变区域完整序列、发现新的耐药突变位点方面存在不足[18]。随着临床对于HBV耐药突变研究的不断深入,以及更多新的耐药位点的探索,基因芯片技术在HBV耐药突变检测环节的应用价值有望得到显著提高,但仍无法完全取代基因测序技术。
参 考 文 献
[1] Honda M, Shirasaki T, Terashima T, et al. Hepatitis B Virus (HBV) Core-Related Antigen During Nucleos (t) ide Analog Therapy Is Related to Intra-hepatic HBV Replication and Development of Hepatocellular Carcinoma[J]. J Infect Dis, 2016, 213(7): 1096-1106.
[2] Lei P, Li Y, Zhang J, et al. Gene Chip-based Screening of Differentially Expressed Genes in Human Injured Cerebral Cortex[J]. Neurosurg Q, 2015, 25(1): 41-45.
[3] 王运照, 胡文忠, 李婷婷, 等. 基因芯片在微生物检测中的应用及发展概况[J]. 食品工业科技, 2015, 36(15): 396-400.
[4] 唐向荣. 乙型肝炎病毒基因检测芯片的研制及临床研究[D].上海:中国科学院上海微系统与信息技术研究所, 2008.
[5] Bard-Chapeau E A, Nguyen A T, Rust A G, et al. Transposon mutagenesis identifies genes driving hepatocellular carcinoma in a chronic hepatitis B mouse model[J]. Nat Genet, 2014, 46(1): 24-32.
[6] Mimura I, Kanki Y, Kodama T, et al. Revolution of nephrology research by deep sequencing: ChIP-seq and RNA-seq[J]. Kidney Int, 2014, 85(1): 31-38.
[7] 蒋贝, 戴晨阳, 李秀梅, 等. 基于PCR测序技术的HBV感染者耐药突变临床分析[J]. 中华肝脏病杂志, 2016, 24(1): 36-39.
[8] Su I J, Wang L H C, Hsieh W C, et al. The emerging role of hepatitis B virus pre-S2 deletion mutant proteins in HBV tumorigenesis[J]. J Biomed Sci, 2014, 21(1): 1.
[9] Wang D Y, Zou L P, Liu X J, et al. Hepatitis B virus X protein induces the histone H3 lysine 9 trimethylation on the promoter of p16 gene in hepatocarcinogenesis[J]. Exp Mol Pathol, 2015, 99(3): 399-408.
[10] Niu J X, Meng X K, Ren J J. Studied microRNA gene expression in human hepatocellular carcinoma by microRNA microarray techniques[J]. World J Gastroenterol, 2015, 21(44): 12605.
[11] 张玉华. 干扰素对不同基因型HBV抗病毒疗效的差异[D]. 哈尔滨:哈尔滨医科大学, 2013.
[12] Qu L S, Jin F, Guo Y M, et al. Nine susceptibility loci for hepatitis B virus-related hepatocellular carcinoma identified by a pilot two-stage genome-wide association study[J]. Oncol Lett, 2016, 11(1): 624-632.
[13] 胡婷婷, 陈宇明, 关明, 等. 乙型肝炎病毒耐药基因测序检测性能验证[J]. 中华检验医学杂志, 2014, 37(10): 776-779.
[14] Kohno T, Tsuge M, Murakami E, et al. Human microRNA hsa‐miR‐1231 suppresses hepatitis B virus replication by targeting core mRNA[J]. J Viral Hepat, 2014, 21(9): 89-97.
[15] 曾勇彬, 刘灿, 欧启水, 等. 建设HBV耐药突变和基因分型实验诊断平台[J]. 中华检验医学杂志, 2014, 37(2): 87-89.
[16] Pourkarim M R, Amini-Bavil-Olyaee S, Kurbanov F, et al. Molecular identification of hepatitis B virus genotypes/subgenotypes: revised classification hurdles and updated resolutions[J]. World J Gastroenterol, 2014, 20(23): 7152-7168.
[17] Chai X, Han Y, Yang J, et al. Identification of the transcriptional regulators by expression profiling infected with hepatitis B virus[J]. Clin Res Hepatol Gastroenterol, 2016, 40(1): 57-72.
[18] Rodrigues R M, Sachinidis A, De Boe V, et al. Identification of potential biomarkers of hepatitis B-induced acute liver failure using hepatic cells derived from human skin precursors[J]. Toxicol In Vitro, 2015, 29(6): 1231-1239.
第一作者:程瑞斌,大專,检验主管技师,研究方向:检验临床,Email:chengruibin@sina.com。

