牛蛙背皮抗菌肽粗提物的抑菌活性
夏一赫,杭柏林,黄东明,张冰清,徐彦召,胡建和
牛蛙背皮抗菌肽粗提物的抑菌活性
夏一赫,杭柏林,黄东明,张冰清,徐彦召,胡建和
(河南科技学院动物科技学院,河南新乡453003)
研究旨在分析牛蛙背皮抗菌肽粗提物的抑菌活性.通过甲醇浸提法制备了牛蛙背部皮肤的抗菌肽粗提物,以琼脂糖扩散法检测粗提物的抑菌活性,用倍比稀释法测定粗提物的最小抑菌浓度(MIC),通过测定生长曲线和杀菌动力学曲线分析粗提物的抑菌特性,借助显微镜观察菌体形态和染色变化,用pH计测定细菌培养基的pH值.结果表明:牛蛙背皮抗菌肽粗提物对大肠杆菌和金黄色葡萄球菌具有抑菌活性,MIC分别为62.5μg/mL和31.25μg/mL,但对白色念珠菌没有抑菌活性;在低质量浓度(1×MIC)时,在迟缓期没有抑菌活性,但从对数期开始发挥抑菌活性;在高质量浓度(3×MIC)时,10 min内即开始发挥抑菌活性;粗提物作用后的大肠杆菌和金黄色葡萄球菌呈现相反的革兰染色结果,菌体形态从杆状或球状变为丝状;培养2 h后,粗提物可提高大肠杆菌培养液的pH值,但对金黄色葡萄球菌培养液的pH值没有影响.结果提示,牛蛙背皮抗菌肽粗提物对大肠杆菌和金黄色葡萄球菌有较好的抗菌活性,为后续研究和临床应用奠定了基础.
牛蛙背皮;抗菌肽粗提物;最小抑菌浓度;抑菌活性;细菌形态;生长曲线
我国是动物养殖大国,但在养殖过程中,众多动物疫病时常发生,不仅给养殖业造成了巨大的经济损失,也影响了人们的日常生活[1].动物发生疫病后一般使用药物进行治疗,其中抗生素的用量较大.但是,随着抗生素的大量使用或滥用,病原的耐药性问题日益突出,某些病原甚至出现了超级耐药现象[2-3].同时,抗生素残留对环境和人类健康造成的危害日益严重[4].因此,寻找安全、高效、低耐药、无残留的抗生素或抗生素替代物已经成为药物研究领域的热点[5].生物机体中存在许多天然抗病原微生物的活性成分,如抗菌肽、干扰素、天然抗体、酸性物质、活性酶、细菌素等.针对这些天然活性成分的研究是寻找抗生素替代物的有效途径[6-7].许多两栖类动物的皮肤和内脏有抗微生物、抗肿瘤、镇痛、局部麻醉、免疫调节等多种功能的活性物质[8-9].以两栖类动物为来源的制剂的传统中药已经在临床上得到了广泛应用.牛蛙是一种两栖类动物,生存环境中存在着各种微生物,其主要通过产生各种活性物质来抗病原、保健康.如牛蛙皮肤中存在的活性物质能够杀灭假单胞细菌及清除其他炎症细菌,比常用抗菌素的效力还高[9-10].牛蛙体内存在着许多抗菌肽类物质[7],对保护牛蛙健康具有重要作用.因此,从牛蛙皮肤中获取抗菌活性物质对寻找抗生素替代物具有重要意义.本研究制备了牛蛙背部皮肤抗菌肽粗提物,并对其抑菌特性进行了初步分析,为后续深入研究和临床应用奠定基础.
1 材料与方法
1.1 牛蛙与供试菌株
成年健康虎纹蛙购自河南省新乡市某大型超市.受试菌株为大肠杆菌ATCC8099、金黄色葡萄球菌ATCC6538和白色念珠菌ATCC10231,由河南科技学院预防兽医学实验室保存.
1.2 主要试剂和仪器
蛋白胨、牛肉膏、营养琼脂、LB培养基、无水乙醇、革兰染色试剂、甲醇等均为实验室常规试剂.生物显微镜(淄博森源电气有限公司),高压蒸馏灭菌器(Hirayama公司),电子天平(sartorius公司),微量移液器(eppendorf公司),超低温冰箱、高速冷冻离心机、纯水仪、酶标仪均为Thermo Scientific公司生产,制冰机(SANYO公司),组织匀浆机(T18 basic公司),超微量蛋白核酸分析仪(BioDrop公司),pH计(上海雷磁).
1.3 牛蛙背皮抗菌肽粗提物的制备
牛蛙背皮抗菌肽粗提物的制备参照文献[11]中的方法进行.制备过程简述如下:将活体牛蛙用蒸馏水清洗干净,用体积分数为75%的乙醇棉球擦拭,用灭菌去离子水充分冲洗,毁髓,迅速剥离背部皮肤,用灭菌去离子水冲洗3次,用灭菌手术剪将背部皮肤剪成小块,浸于体积分数为80%的甲醇溶液中,冰上匀浆、超声破碎,4℃浸提60 h,10 000 r/min离心10 min,收集上清,将沉淀置通风厨内继续浸提,重复3次,将所有上清混合后置冰上于通风橱中使甲醇挥发,冷冻干燥,-80℃保存.使用时,用灭菌去离子水溶解粗提物粉末,立即使用或4℃保存备用.
1.4 种子菌的制备
将3种受试菌株分别接种于LB液体培养基,37℃培养(180 r/min)约12 h,4℃保存,备用.
1.5 粗提物抗菌活性的检测
采用双层琼脂扩散法[12-13]检测牛蛙背皮粗提物的抗菌活性.将种子菌株接种于LB培养基中,37℃培养(180 r/min)3~6 h,调整菌液OD600值为0.5~0.6.取50μL菌悬液加入50℃左右的20 mL底层培养基(TSB)中,混匀,倒入培养皿(Ф为10 cm)中,冷却,打孔(Ф为4 mm).阳性对照孔中加20μL卡那霉素(62.5μg/mL),阴性对照孔加20μL灭菌去离子水,其余孔加入20μL粗提物(8 mg/mL),倒置,37℃培养3 h,取出,倒入50℃左右的10 mL上层TSB培养基,凝固后,倒置,37℃培养过夜或48 h,测量抑菌圈直径.
1.6 粗提物最小抑菌浓度(MIC)的测定
采用二倍稀释法[14]测定MIC.用LB液体培养基将粗提物(8 mg/mL)进行0、2、4、8、16、32、64、128和256倍稀释,取200μL稀释液加入96孔酶标板中,每个稀释度4个重复,每孔中加入10μL受试菌悬液(OD600值为0.5~0.6).同时设阳性对照(LB液体培养基+受试菌)、阴性对照(仅为LB液体培养基), 37℃培养24 h,从每孔中取培养液测定OD600值.以OD值突然变化对应的质量浓度为粗提物的MIC.
1.7 粗提物抑菌特性的测定
一种方法是采用低质量浓度(1×MIC)的粗提物进行长时抑菌特性分析,即生长曲线测定法[15].在酶标板的每孔中加入200μL的LB液体培养基,4排孔的每孔加入10μL受试菌悬液(OD600值为0.5~0.6)和10μL的LB液体培养基,4排孔的每孔加入10μL粗提物(1×MIC)和10μL受试菌悬液(OD600值为0.5~0.6),37℃培养(180 r/min)16 h,每2 h取每列孔中的液体悬液测定OD600值.另一种方法是采用高质量浓度(3×MIC)的粗提物进行短时抑菌特性分析,即杀菌动力学测定法[14].取200μL菌液(OD600值为0.5~0.6)加入10列孔中,4排孔的每孔中加入30μL的LB液体培养基和30μL粗提物(3×MIC),作用0、10、20、30、40、50、60、70、110和150 min,混匀,每孔取10μL加入到200μL的LB液体培养基中,37℃培养24 h,测定OD600值.以时间为横坐标,以OD600值为纵坐标,绘制受试菌的生长曲线.比较生长曲线特征,分析粗提物的抑菌特性.
1.8 受试菌的形态观察
取粗提物长时抑菌特性试验中培养4 h的菌悬液进行涂片、革兰染色,用油镜观察细菌的形态变化.
1.9 培养液p H值的测定
在5 mL的LB液体培养基中加入0.25 mL的菌液(OD600值为0.5~0.6),4个试管中加入0.25 mL的粗提物(1×MIC),4个试管中加入0.25 mL的LB液体培养基,分别于培养(37℃)后0、2、5、9 h测定pH值.
2 结果与分析
2.1 粗提物的抑菌活性
通过琼脂糖扩散法检测牛蛙背皮抗菌肽粗提物的抑菌活性,其结果如表1所示.牛蛙背皮抗菌肽粗提物具有抗革兰阳性菌和抗革兰阴性菌的活性,其中对大肠杆菌的抑菌活性较高,但不具有抗真菌活性.

表1 牛蛙背皮抗菌肽粗提物的抑菌活性Tab.1 Antibacterialactivity ofantimicrobialpeptide crude extractfrom bullfrog skin ofback
2.2 粗提物的最小抑菌浓度(MIC)
以二倍稀释法测定粗提物的MIC.以粗提物质量浓度为横坐标,以对应菌液的OD值为纵坐标进行折线图绘制,结果如图1所示.粗提物对大肠杆菌和金黄色葡萄球菌的MIC分别为62.5μg/mL和31.25μg/mL.
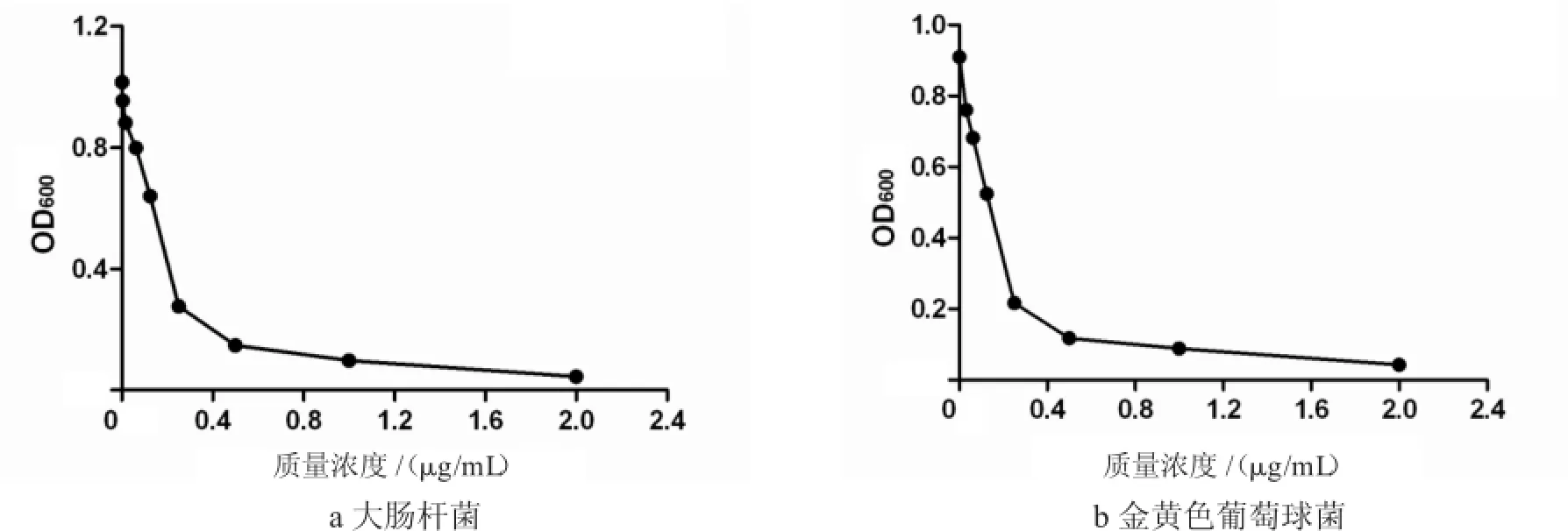
图1 牛蛙背皮抗菌肽粗提物的MICFig.2 MICofanimicrobialpeptide crude extractfrom bullfrog skin ofback
2.3 粗提物(1×MIC)的长时抑菌特性
通过测定细菌生长曲线的方法观察牛蛙背皮抗菌肽粗提物对大肠杆菌和金黄色葡萄球菌的抑菌效果,如图2所示.从图2可以看出,在2 h内,试验组和对照组的OD值是基本一致的;对照组的细菌在2 h后进入对数期,到14 h基本到达稳定期;而大肠杆菌试验组的细菌在2 h后OD值基本没有变化,金黄色葡萄球菌试验组的细菌在4 h后OD值基本没有变化.这表明,牛蛙背皮抗菌肽粗提物中的活性物质抑制了大肠杆菌和金黄色葡萄球菌的生长与繁殖.
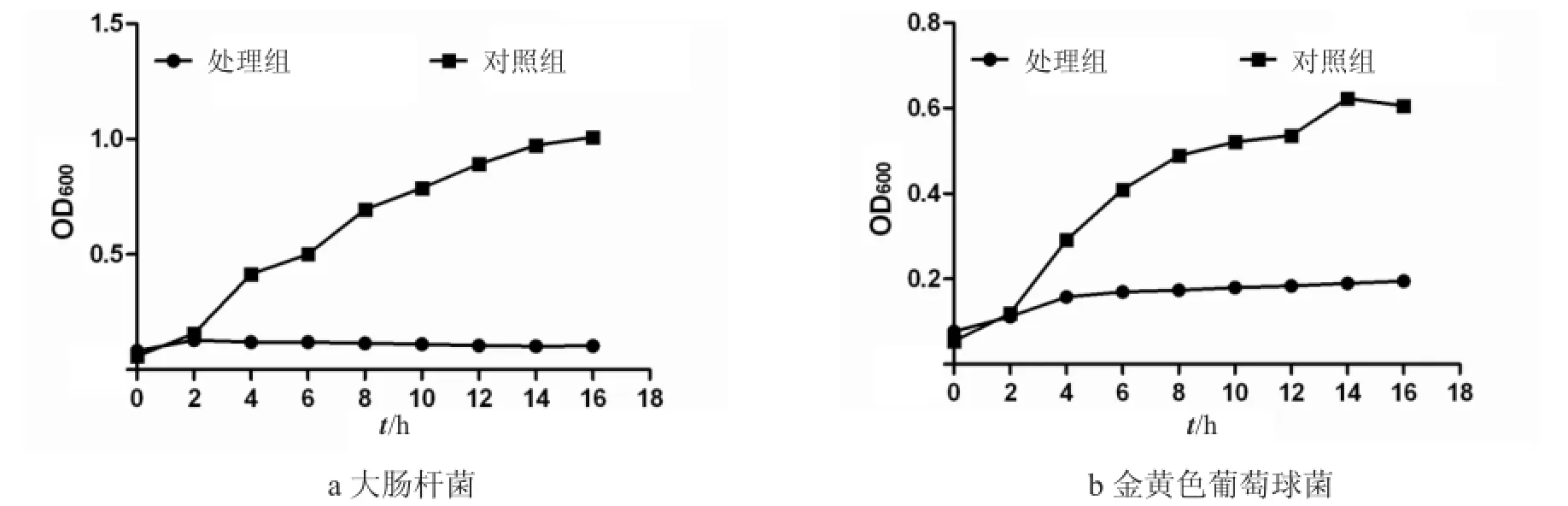
图2 牛蛙背皮抗菌肽粗提物(1×MIC)的抑菌效果Fig.2 Effects ofantimicrobialpeptide crude extractfrom bullfrog skin ofback with the dose of1×MIC
2.4 粗提物(3×MIC)的短时抑菌特性分析
分析牛蛙背皮抗菌肽粗提物对大肠杆菌和金黄色葡萄球菌的杀菌动力学特征可知,粗提物对大肠杆菌和金黄色葡萄球菌的杀灭率达到最高值所需要的时间分别是110 min和150 min(见图3).这表明,牛蛙背皮抗菌肽粗提物的杀菌作用具有一定的时间依赖性.
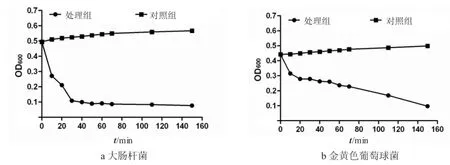
图3 牛蛙背皮抗菌肽粗提物(3×MIC)的杀菌动力学特征Fig.3 The kiling kinetics ofantimicrobialpeptide crude extractfrom bullfrog skin ofback with the dose of3×MIC
2.5 粗提物对细菌形态与染色的影响
将正常培养的和粗提物处理的大肠杆菌和金黄色葡萄球菌通过革兰染色法染色,于油镜下观察,结果如图4所示.从图4中可以看出,正常的大肠杆菌呈红色,为革兰阴性,细菌呈杆状,大小正常,而粗提物处理的大肠杆菌呈紫色,为革兰阳性,细菌体积变大或呈长丝状;正常的金黄色葡萄球菌呈紫色,为革兰阳性,呈典型的葡萄球菌的形态,而粗提物处理的金黄色葡萄球菌呈红色或红紫色,为革兰阴性,出现细丝状的细菌形态.这表明,牛蛙背皮抗菌肽粗提物可以改变细菌的染色结果和形态特征.
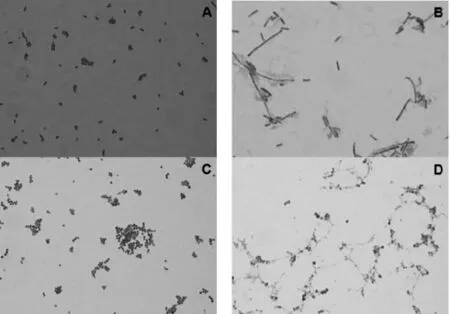
图4 牛蛙背皮抗菌肽粗提物细菌形态的影响(1 000×)Fig.4 Effects ofantimicrobialpeptide crude extractfrom bullfrog skin ofback on morphology(1 000×)
2.6 粗提物对细菌培养液p H值的影响
分析牛蛙背皮抗菌肽粗提物对大肠杆菌和金黄色葡萄球菌培养液pH的影响,结果见图5.在2 h内,细菌培养液的pH值没有产生显著变化.2 h后,粗提物作用组大肠杆菌培养基的pH值高于对照组(图5-a),但在9 h内,粗提物对金黄色葡萄球菌培养液的pH却没有产生显著影响(图5-b).这表明,牛蛙背皮抗菌肽粗提物可以影响大肠杆菌培养液的pH值,但对金黄色葡萄球菌培养液的pH值没有影响.
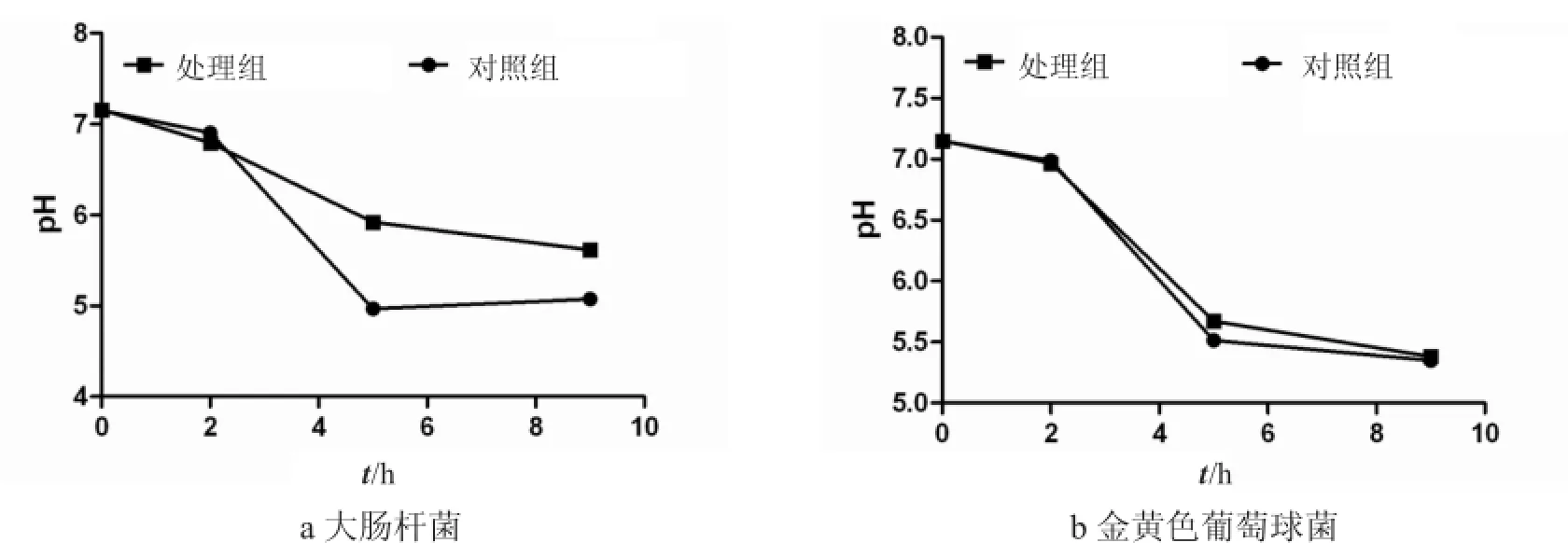
图5 牛蛙背皮抗菌肽粗提物对培养液p H值的影响Fig.5 Effects ofantimicrobialpeptide crude extractfrom bullfrog skin ofback on pH
3 结论与讨论
牛蛙是一种两栖类动物,其生存环境比较复杂,在生活过程中常受到多种微生物的侵袭.皮肤是抵挡微生物侵入机体的第一道天然防线[16].皮肤由表皮层、真皮层和皮下组织构成,其中含有巨噬细胞、淋巴细胞、中性粒细胞、浆细胞、肥大细胞等与免疫有关的免疫细胞,通过不同的分子发挥抗病原微生物的作用[17].因此,牛蛙皮肤中存在着很多的抗菌活性物质,如抗菌肽类物质.在抗生素应用泛滥、耐药性菌株不断出现的情况下,对牛蛙皮肤中的抗菌活性物质进行研究具有重要的意义.本研究证明了牛蛙背皮抗菌肽粗提物对大肠杆菌和金黄色葡萄球菌具有较好的抗菌活性.
抗菌活性物质与细菌作用后,细菌的生长会受到抑制或被杀死[7].牛蛙背皮抗菌肽粗提物对大肠杆菌和金黄色葡萄球菌的生长抑制效应主要出现在对数期.通过光学显微镜的观察,粗提物作用4 h后,菌体形态和染色特性发生变化,从而影响了大肠杆菌和金黄色葡萄球菌的生长.粗提物作用于大肠杆菌后,菌液的OD值在作用2 h时有微弱增加,而后一直很低,几乎不变.而粗提物作用于金黄色葡萄球菌后,菌液的OD值却随着时间延长仍有微弱的增加,这种微弱增加可能是残留的金黄色葡萄球菌(如图4-d中,呈紫色球形的菌体)在生长.在杀菌动力学试验中,金黄色葡萄球菌菌液的OD值下降速度比大肠杆菌缓慢.pH值变化可以综合反映细菌在生长繁殖过程中的代谢活动[18].在2 h内,牛蛙背皮抗菌肽粗提物对大肠杆菌和金黄色葡萄球菌培养基的pH值没有产生影响,这与生长曲线方法的检测结果(2 h内没有变化)基本一致.2 h后,粗提物对大肠杆菌培养过程中的pH值产生了影响,但对金黄色葡萄球菌的pH值没有影响.由此可以推测,粗提物对大肠杆菌和金黄色葡萄球菌的作用机制是不同的.
抗菌肽是生物体抵御外来病原入侵时诱导合成的一系列具有抗菌活性的小分子多肽,以独特的作用机制提高动植物的抗病能力,并有望解决抗生素耐药性问题[19].蛙的皮肤中有多种类型的抗菌肽,如brevinin-1~2、esculentin-1~2、ranatuerin-1~2、temporin、palustrin-1~3、tigerinin、japonicin-1~2、nigrocin-2等[7].牛蛙背皮抗菌肽粗提物是一种混合物质,其中含有较多的抗菌多肽,但哪种抗菌肽发挥了主要作用,还需要进行抗菌物质的分离、鉴定等后续研究.
牛蛙背皮抗菌肽粗提物对大肠杆菌和金黄色葡萄球菌有较好的抗菌活性,可影响细菌的形态和染色特性,表现出成为抗生素替代物的应用潜力.对于牛蛙背皮抗菌肽粗提物的具体抗菌机制还需要进行深入研究,以期为其临床应用提供理论依据.
[1]朱中平.不可漠视动物群亚健康的存在:为畜牧业管理决策层提出的警示与建言[J].中国动物保健,2007(10):44-45.
[2]刘伟.浅谈滥用药物带来的危害[J].中国医药指南,2011,9(17):335-336.
[3]孟玲玲.浅谈畜禽养殖中抗生素的合理应用[J].畜牧兽医科技信息,2013(1):18-19.
[4]张国强,蒋建林.细菌耐药性与抗生素的合理应用[J].国外畜牧学:猪与禽,2001(5):36-39.
[5]蓝天,高玉云,凌宝明,等.抗生素替代产品的研究进展[J].饲料研究,2013(6):27-30.
[6]汪以真.动物源抗菌肽的研究现状和展望[J].动物营养学报,2014,26(10):2934-2941.
[7]胡建和,杭柏林,徐彦召,等.动物源抗菌肽[M].北京:科学出版社,2015:119-124.
[8]王美娟.棕点湍蛙(Amolops loloensis)皮肤抗菌肽的分离纯化及其分子多样性与活性研究[D].南京:南京农业大学,2009:9-12.
[9]侯峰.光滑爪蟾(Xenopus laevis)皮肤抗菌肽的筛选及其相关研究[D].北京:中国人民解放军军事医学科学院,2010:19-20.
[10]苗慧敏.虹彩病毒胁迫下东北林蛙皮肤抗菌肽表达及其生物学活性分析[D].哈尔滨:东北林业大学,2012:1-9.
[11]赵瑞利,韩文瑜,韩俊友,等.牛蛙皮肤抗菌肽的分离纯化与活性测定[J].中国生物制品学杂志,2008,21(8):694-697.
[12]HUJ H,XUML,HANGBL,et al.Isolation and characterization ofan antimicrobialpeptide from bovine hemoglobin a-subunit[J]. World J Microbiol Biotechnol,2011,27(4):767-771.
[13]张庆华,王青,尚田田,等.新型血红蛋白抗菌肽抑菌活性及溶血性研究[J].动物医学进展,2014,35(9):54-57.
[14]ZHANG Q H,XU Y Z,WANG Q,et al.Potential of novel antimicrobial peptide P3 from bovine erythrocytes and its analogs to disrupt bacterial membranes in vitro and display activity against drug-resistant bacteria in a mouse model[J].Antimicrobial Agents and Chemotherapy,2015,59(5):2835-2841.
[15]孟素香,曹健,张慧茹,等.绞股蓝内生真菌对金黄色葡萄球菌的抗菌机制[J].中国抗生素杂志,2015,40(4):268-273.
[16]于洪川,魏智清,张书起,等.蟾蜍和牛蛙皮肤肥大细胞的形态学研究[J].宁夏大学学报(自然科学版),2005,26(3):268-270.
[17]李洋.三种蛙皮肤组织结构、生物活性物质的定位及其提取物的抑菌比较研究[D].芜湖:安徽师范大学,2010:1-9.
[18]柳迎春.抑制阴道加德纳菌的乳酸菌的筛选及其生物学特性[D].哈尔滨:东北农业大学,2014:41.
[19]董肇楠,梅家松,何正权,等.抗菌肽在水稻抗病研究中的应用[J].河南农业科学,2015,44(5):1-6.
(责任编辑:卢奇)
Bacteriostatic activity of antimicrobial peptide crude extract from bullfrog skin of back
XIA Yihe,HANG Bolin,HUANG Dongming,ZHANG Bingqing,XU Yanzhao,HU Jianhe
(SchoolofAnimalScience and Veterinary Medicine,Henan Institution of Science and Technology, Xinxiang 453003,China)
The bacteriostatic activity of antimicrobial peptide crude extract from bullfrog skin of back was analyzed in this paper.Antimicrobial peptide crude extract was prepared with methanol extraction.Antibacterial activity of crude extract was detected with agarose diffusion method.Minimal inhibition concentration of crude extract was measured with double dilution method.Antibacterial property of crude extract was assayed with growth curve and killing kinetics of bacterium.Morphological and color changes of bacteria treated with crude extract were observed with microscope.The pH value of bacterial cultural liquid was determined with pH meter.The results showed that antimicrobial peptide crude extract from bullfrog skin of back had antibacterial activity against Escherichia coli and Staphylococcus aureus with the MIC of 62.5μg/mL and 31.25μg/mL respectively,but had no activity against Candida albicans.Crude extract with low concentration(1×MIC)had no activity in lag phase,but had activity from logarithmic phase.While crude extract with high concentration(3×MIC)had activity within 10 min.Compared with normal bacteria,the Gram stained results of E.coli and S.aureus treated with crude extract were opposite,and the morphology were changed from rhabditiform or sphericity to filiform.And the pH value of cultural liquid of E.coli treated with crude extract was high than control group,while there were no changes significantly on the pH value of cultural liquid of S.aureus.These findings indicated that antimicrobial peptide crude extract from bullfrog skin ofback had bacteriostatic activity against E.coli and S.Aureus,which lay a good foundation for following research and clinical practice.
bullfrog skin of back;antimicrobial peptide crude extract;minimum inhibition concentration;bacteriostatic activity;bacterial form;growth curve
S852.4
A
1008-7516(2017)02-0043-07
10.3969/j.issn.1008-7516.2017.02.010
2016-09-26
河南省高校科技创新团队支持计划(15IRTSTHN);河南科技学院高层次人才启动项目(2014020);河南科技学院2016年大学生创新训练计划项目(2016CX045)
夏一赫(1988―),男,河南商丘人,硕士生.主要从事动物病原的研究.
胡建和(1968―),男,河南辉县人,博士,教授.主要从事动物病原与新兽药的研究.

