哮喘患者外周血调节性T细胞和Th1/Th2的变化及与病情的相关性分析
程 思, 邵天波, 郭晓静
(1.武警云南省总队医院检验科, 云南 昆明 6501112.昆明医科大学第一附属医院检验科, 云南 昆明 650032)
哮喘患者外周血调节性T细胞和Th1/Th2的变化及与病情的相关性分析
程 思1, 邵天波2, 郭晓静1
(1.武警云南省总队医院检验科, 云南 昆明 6501112.昆明医科大学第一附属医院检验科, 云南 昆明 650032)
目的::研究并分析哮喘患者外周血调节性T细胞和Th1/Th2的变化及与病情的相关性。方法:选取2013年1月至2016年6月我院收治的哮喘患者100例记为观察组。另取同期100例健康体检者为对照组。分别比较两组人员的外周血调节性T细胞和Th1/Th2水平。此外,根据病情严重程度的不同,将哮喘患者分为急性期组(57例)与缓解期组(43例),对比两组患者的外周血调节性T细胞和Th1/Th2水平。并进行相关性分析。结果:观察组的外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平分别为(1.6±0.6)%、(6.3±1.1)%,均低于对照组的(2.3±0.7)%、(11.5±0.9)%,具有显著性差异(P<0.05)。急性期组外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平分别为(1.2±0.5)%、(4.5±1.0)%,均低于对照组的(1.9±0.6)%、(9.0±1.2)%,具有显著性差异(P<0.05)。经Spearman相关分析可得,哮喘患者外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平与病情均呈显著负相关(r=-0.583,P<0.001;r=-0.632,P<0.001)。结论:临床上通过检测哮喘患者的外周血Treg水平与Th1/Th2水平可有效评估病情严重程度。
哮 喘; 调节性T细胞; 辅助性T细胞
本文通过研究哮喘患者外周血调节性T细胞和Th1/Th2的变化及与病情的相关性并进行分析,目的在于为临床哮喘患者的诊断、治疗及预后评估提供参考依据,现报道如下。
1 资料与方法
1.1 临床资料:选取2013年1月至2016年6月我院收治的哮喘患者100例记为观察组。纳入标准[1]:诊断标准:①所有患者均符合2003年中华医学会呼吸病学分会制定的哮喘诊断标准。②不伴有感染性疾病;③入院7d前未接受免疫抑制剂治疗;④无慢性病史。其中男58例,女42例,年龄35~62岁,平均年龄41.4±3.5岁。另取同期100例健康体检者为对照组。其中男56例,女44例,年龄33~60岁,平均年龄41.2±3.4岁。两组人员的年龄、性别等资料比较无显著性差异(P>0.05),存在可比性。本研究所有患者均签署了知情同意书,且经医院伦理委员会批准。
在下一代交换组网中,软交换和IMS技术是两个重要的阶段,但是在实现目标方面却表现出明显的一致性,都是通过构建下一代交换组网,并且下一代交换组网要体现出分组、层次分明的特征,能实现对控制和承载的分离。
1.2 研究方法:①Treg检测:所有患者均抽取清晨空腹静脉血3mL,并取全血100μL,分别加入CD25-PE cocktail以及CD4-FITC各10μL,放置于4℃条件下进行孵育30min。加入1mL红细胞裂解置10min,同时采用生理盐水进行反复冲洗3次。随后加入Fixation/Perm缓冲液1mL进行破膜固定45min,利用洗涤缓冲液反复洗涤2次。然后取10mL鼠抗人Foxp3-PC单克隆抗体(购自美国贝克曼公司)加入其中,并于4℃条件下孵育30min,再次洗涤缓冲液反复洗涤2次。最后用flow cytimetry staining buffer重悬,并利用流式细胞仪(购自美国BD公司)进行检测。②Th1/Th2检测:取所有患者全血100μL,加入RPMI 1640中稀释,稀释比为1∶1。随后在各管中加入10μL的刺激剂(购自美国BD PharMingen公司),在室温条件下,放置于5%CO2培养箱中培养5h,混匀。加入CD3-PC5以及CD8-PC7各10μL,在室温、避光条件下孵育15min。各管加入固定液100μL,继续在室温、避光条件下孵育15min。各管分别加入PBS 3mL,以1200r/min,离心5min,去除上清液。然后取100μL的破膜与溶血液加入其中,同时加入10μL的IFN-γ、IL-4-PE,在室温、避光条件下孵育15min。各管分别加入PBS 3mL,以1200r/min,离心5min,去除上清液,以0.5mL PBS重悬,上机检测。
综上,采用复方丹参滴丸联合阿司匹林治疗老年不稳定型心绞痛相比阿司匹林单独用药,可有效提升治疗效果,可考虑作为此类患者的备选方案之一。
2.2 急性期组与缓解期组的外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平对比:急性期组外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平分别为(1.2±0.5)%、(4.5±1.0)%,均低于对照组的(1.9±0.6)%、(9.0±1.2)%,差异均有统计学意义(P<0.05)。见表2。
2.3 哮喘患者外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平与病情的相关性分析:经Spearman相关分析可得,哮喘患者外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平与病情均呈负相关。见表3。
2 结 果
2.1 观察组及对照组的外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平对比:观察组的外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平分别为(1.6±0.6)%、(6.3±1.1)%,均低于对照组的(2.3±0.7)%、(11.5±0.9)%,差异均有统计学意义(P<0.05)。见表1。
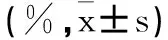
表1 观察组及对照组的外周血调节性Treg细胞和Th1/Th2水平对比
1.3 观察指标:分别比较不同组别的外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平。
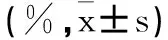
表2 急性期组与缓解期组的外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平对比
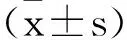

表3 哮喘患者外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平与病情的相关性分析
3 讨 论
支气管哮喘主要是发生于儿童时期的一种慢性疾病,其主要病理学特征是气道重塑以及呼吸道炎性反应[2]。有研究报道显示,哮喘的发生于机体免疫功能紊乱存在密切相关[3]。而T淋巴细胞及其分泌的多种细胞因子均在哮喘的气道慢性变应性炎症中发挥着重要作用[4]。其中Treg属于一种免疫调节性T细胞,与Th1及Th2细胞存在本质的区别。其主要是通过分泌THF-β、IL-10,从而对Th2细胞分泌IL4,IL-5产生抑制作用,进一步组织了IgE的生成及分泌,最终对嗜碱性粒细胞、嗜酸性粒细胞以及肥大细胞所介导的炎症反应产生抑制作用,直接抑制了变态反应性疾病的发生。随着近年来相关研究的不断深入,辅助性T细胞在哮喘中的作用也日益受到重视,已成为临床上研究哮喘发病机制的热点。
建立完善的食品安全监督管理体系。建立健全食品安全监测制度是提升食品安全检测水平的关键所在,政府部门必须要设立从食品原材料到最后食品上市的全过程监督管理机制,利用法律来规范各个环节的质量审查,以此来降低食品安全问题出现的概率,进而提升我国食品的安全性。
本文研究发现:观察组的外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平均显著低于对照组。这提示了哮喘患者体内存在Treg细胞免疫功能障碍,且Th亚群之间的平衡发生了失衡。而Treg与Th1/Th2水平的变化可能直接参与了哮喘的发生、发展过程,并在其中具有极其重要的作用。孙德彬等的研究报道显示[5],Th1所分泌的IFN-γ以及Th2所分泌的IL-4等细胞因子均在哮喘中起着至关重要作用。Treg水平的变化则会对Th1/Th2细胞因子水平造成影响。与此同时,急性期组外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平分别为(1.2±0.5)%、(4.5±1.0)%,均显著低于对照组的(1.9±0.6)%、(9.0±1.2)%。这表明可随着患者病情的不断加重,其外周血的Treg水平以及Th1/Th2水平均显著下降,且在此过程中具有较强的一致性。由此我们可初步判断,哮喘的发病机制可能是伴随着病情的不断加重,机体遭受的过敏原刺激程度增加,从而使得患者的外周血中Treg水平下降,免疫调节功能出现障碍。同时,Th2细胞的活性增强,Th1细胞活性则遭受抑制,进一步导致了Th1/Th2失衡,从而使得大量的抑炎因子生成,最终导致了哮喘的发生。其中袁颖志等通过研究也证实了上述观点[6]:CD4+CD5+Foxp3+Treg细胞在小鼠哮喘模型的脾脏中表达低于正常术,且抑制功能存在明显的下降,由此认为Treg数量以及抑制功能的降低可能是哮喘发病的主要机制。另有研究报道显示[7],Treg细胞可能会对Th2细胞所分泌的一系列细胞因子产生抑制作用,进一步有效降低了多种致炎因子的活性,从而达到降低变态反应性疾病发生的目的。此外,经Spearman相关分析可得,哮喘患者外周血CD4+CD5+Foxp3+Treg和Th1/Th2水平与病情均呈显著负相关关系。这提示了我们在临床上对外周血Treg以及Th细胞亚群进行研究,有利于临床上对哮喘患者进行诊断以及预后评估,同时也可为临床治疗提供指导作用。
[1] 李俊.孟鲁斯特治疗对支气管哮喘患者肺功能及Th1、Treg平衡的调节作用[J].临床肺科杂志,2017,22(1):105~107.
[2] Massoud AH,Charbonnier LM,Lopez D,et al.An asthma-associated IL4R variant exacerbates airway inflammation by promoting conversion of regulatory T cells to TH17-like cells[J].Nat Med,2016,22(9):1013~1022.
[3] 孙美.调节性T细胞在哮喘中的研究进展[J].国际儿科学杂志,2014,41(1):22~25.
[4] 裴复阳,柳明坤,宋晓萍,等.金水宝对支气管哮喘患者免疫功能的影响[J].航空航天医学杂志,2016,27(11):1349~1350.
[5] 孙德彬,熊雪芳,周家峰,等.哮喘患者外周血调节性T细胞和Th1/Th2的变化及其与哮喘病情的关系[J].中国现代医生,2016,54(16):6~9.
[6] Ruan G,Tao B,Wang D,et al.Chinese herbal medicine formula Gu-Ben-Fang-Xiao-Tang attenuates airway inflammation by modulating Th17/Treg balance in an ovalbumin-induced murine asthma model[J].Exp Ther Med,2016,12(3):1428~1434.
[7] 田祖慧,左凤琼,张魏,等.哮喘患儿诱导痰中T细胞亚群和细胞因子的变化及意义[J].海南医学院学报,2016,22(1):72~74.
1006-6233(2017)04-0699-04
云南省卫生科技计划项目,(编号:2015NS32954)
A 【doi】10.3969/j.issn.1006-6233.2017.04.050

