穿心莲染色体制片优化及核型分析
马婷玉+李明+吴燕燕+段修冉+潘丽萍

摘要:采用常规压片法进行穿心莲染色体制片方法及其染色体数量和核型分析的研究。结果表明,08:00—8:30取材较佳,以0.10%秋水仙素溶液作为预处理液,预处理2 h,在1.0 mol/L盐酸溶液中于60 ℃恒温解离8 min,低渗 15 min 后,卡宝品红溶液染色25 min压片镜检,所得穿心莲染色体制片效果良好。穿心莲体细胞染色体数量为2n=2x=48。首次报道了穿心莲核型公式为2n=2x=48=14m+22sm+12st,其中中部染色体(m)为7对,近中部着色点染色体(sm)为11对,近端部着色点染色体(st)为6对,核型不对称系数为67.61%,核型属3B型。
关键词:穿心莲;染色体;制片技术;核型分析
中图分类号: S567.21+9.02文献标志码: A文章编号:1002-1302(2017)07-0033-04
穿心莲[Andrographis paniculata (Burm.F.) Nees]属爵床科穿心莲属一年生草本植物,具有抗病毒、抗肿瘤等作用,在国内外有广阔的市场和开发前景。我国穿心莲最早在广东省和福建省南部引种栽培,目前主产地为广东、广西、海南、福建等省(区)[1]。穿心莲主要以田间栽培为主,我国野生资源较少,而在穿心莲长期人工栽培生产中存在品种退化、产量和质量下降等问题,亟须进行新品种选育研究[2-3]。
目前,国内外对穿心莲的研究主要为种质资源调查与质量评价[2-3]、组织培养与栽培[4-5]、药用成分分析[6]、分子标记技术[7]等,对穿心莲细胞遗传学方面的研究较少。本研究进行染色体制片方法优化及核型分析,旨在为穿心莲遗传资源保护、优良种质选育和利用提供依据。
1材料与方法
1.1材料
供试穿心莲[Andrographis paniculata (Burm.F.) Nees]种子由广东省清远市穿心莲中藥材生产质量管理规范(GAP)基地提供,染色体凭证玻片存放于广东药科大学中药资源系植物细胞与组织培养实验室。
1.2方法
1.2.1种子萌发试验参照李玲梅等的方法[8],择颗粒饱满的穿心莲种子,用清水冲洗后用0.1% KMnO4溶液浸泡 30 min 取出,用无菌水冲洗,置于铺好的装有灭菌滤纸的培养皿中,在 25 ℃ 恒温培养箱中进行暗培养,胚根长至0.5~0.8 cm时切取根尖。
1.2.2不同取材时间的有丝分裂中期分裂相数比较于07:30—11:00每隔30 min取穿心莲胚根根尖,以0.05%秋水仙素处理3 h,并对不同视野下单位面积内的中期分裂相进行计数,以确定穿心莲胚根根尖的中期分裂高峰期和适宜的取材时间。
1.2.3预处理与固定取穿心莲胚根根尖区域,置于4种预处理液中进行不同时间预处理:(1)0.05%秋水仙素溶液;(2)0.10%秋水仙素溶液;(3)0.002 mol/L 8-羟基喹啉溶液;(4)0.10%秋水仙素和0.002 mol/L 8-羟基喹啉混合溶液(体积比1 ∶1)分别在避光条件下处理1、2、3 h。取出经预处理的根尖,用蒸馏水冲洗2~3次,然后转入卡诺固定液(无水乙醇 ∶冰醋酸体积比=3 ∶1)中固定24 h。
1.2.4解离取固定后的根尖,于60 ℃恒温水浴中用 1.0 mol/L HCl解离5、8、9、10、11、15 min,取出经解离的根尖,冲洗2~3次后转移至蒸馏水中,室温下低渗处理15 min,然后经85%乙醇处理2~3 min,4 ℃保存备用。
1.2.5染色与压片取出根尖,只保留分生区,置于清洁的载玻片上,滴加2滴20%卡宝品红溶液,染色25 min,吸去染液,滴加稀甘油,采用常规压片法制片。
1.2.6染色体核型分析常规法压片后,选取分散较好的染色体装片于ZEISS Axioplan 2显微镜,在AxioVision 4.6图像分析系统下镜检与拍照,采用MetaSystems Ikaros软件系统进行染色体长臂和短臂测量,并进行染色体配对和核型分析。
筛选出最佳染色体制片方法,从最优的染色体制片中选取50个以上可准确计数的根尖有丝分裂中期相细胞,其中85%以上的细胞具有恒定一致的染色体数,即可认为是穿心莲的染色体数[9-10]。核型取5个典型中期细胞的平均值,参照Kuo等提出的方法[11]计算染色体相对长度指数(I.R.L);根据Levan等提出的方法[12]进行染色体类型分析;参照Stebbins提出的方法[13]进行染色体核型分析和相关参数计算;核型不对称系数(As.K)按Arano提出的方法[14]计算。
2结果与分析
2.1不同取材时间对穿心莲根尖细胞中期分裂相的影响
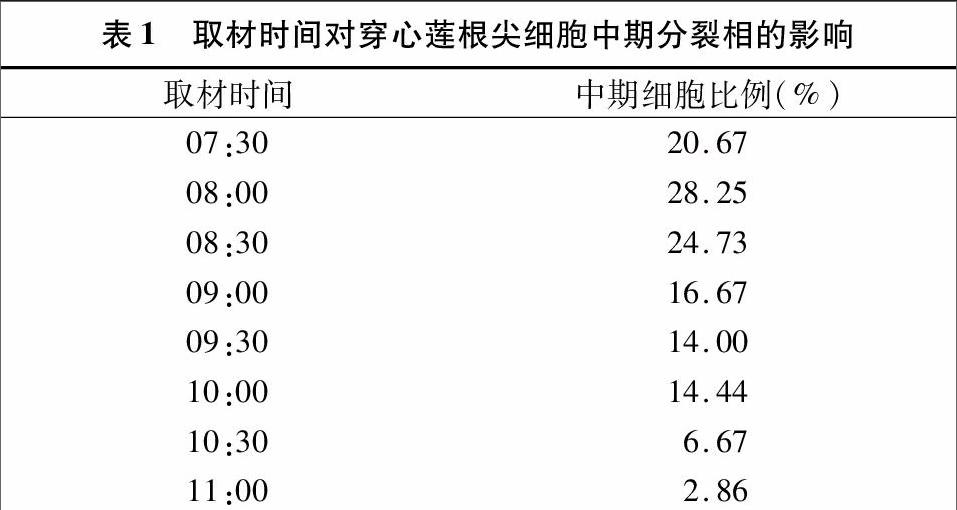
表1结果显示,穿心莲有丝分裂中期分裂相高峰期在 08:00—08:30,可观察到约24%~28%的中期细胞;其他时间也能观察到中期分裂相细胞,但所占比例较小,说明穿心莲根尖细胞分裂有周期性,因此08:00—08:30的穿心莲根尖细胞处于有丝分裂中期的比例较高,该时间点适于取材。
2.2不同预处理方法对染色体制片的影响
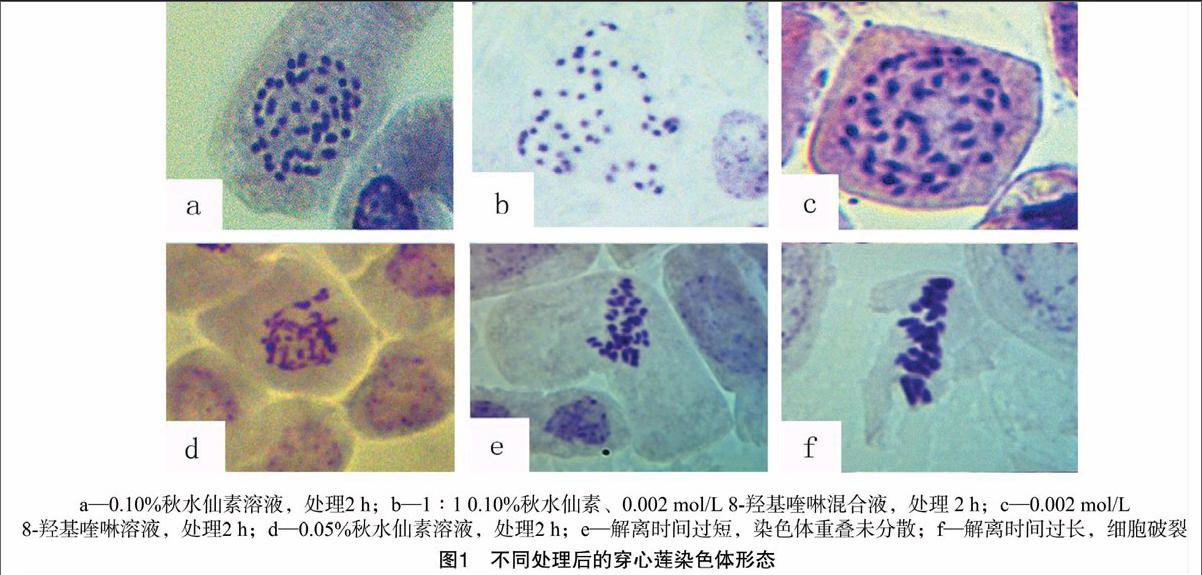
由表2和图1可知,随处理时间延长,同一预处理单位视野中的中期分裂相数量随处理时间先增加后减少,染色体长度逐渐聚缩,说明预处理液对染色体长度的影响随时间延长而加剧。其中,以 0.10% 秋水仙素处理2 h后处于中期分裂相的细胞数量最多,染色体聚缩适中,分辨程度清晰,适合作核型分析(表2、图1-a);材料经0.10%秋水仙素、0.002 mol/L 8-羟基喹啉1 ∶1混合液处理2 h后,染色体呈点状,形态模糊(图1-b);经0.002 mol/L 8-羟基喹啉处理2 h后,染色体聚缩不足,大部分有拖尾现象(图1-c);而经0.05%秋水仙素处理2 h后,染色体虽然较为分散,但有部分拖尾现象,因观察到较多中期分裂相细胞,只适合用于计数(图1-d)。4种预处理液的整体效果为010%秋水仙素溶液>0.05%秋水仙素溶液>0.10%秋水仙素、0.002 mol/L 8-羟基喹啉1 ∶1混合液>0.002 mol/L 8-羟基喹啉溶液。比较40×10倍视野中中期分裂相细胞平均数量和染色体的聚缩程度发现,0.10%秋水仙素溶液预处理2 h可得到理想的穿心莲染色体制片效果。
2.3不同解离时间对染色体制片的影响
由表3、图1可知,1.0 mol/L盐酸溶液60 ℃恒温水浴中解离8 min细胞胞壁完全脱落,压片时细胞分散性最好;解离时间过短的胚根根尖软化程度不够,细胞排列较紧密,染色体过度聚集,压片时不易使细胞处于同一平面上,给后期镜检和计数带来困难(图1-e);解离时间过长的细胞,过度软化不易染色,且细胞易破裂,染色体分散过度,不利于统计,影响核型分析的精确度(图1-f)。
2.4染色体数量分析
通过统计50个有效的穿心莲中期分裂相细胞,其染色体数量有46、47、48条,其中86%的细胞具恒定一致的染色体数48条,根据李懋学等提出的标准[10],确定穿心莲的染色体数量为48条,将48条染色体配对成24对,核型和核型模式见图2、图3。
2.5染色体相对长度及核型分析
对5个有效细胞的核型进行分析,取平均值,穿心莲染色体分为4组:1~4号为长染色体(L),5~7号为中长染色体(M2),8~21号为中短染色体(M1),22~24号为短染色体(S);其中1、2、4、5、6、7、10号为中部着丝粒染色体(m),3、8、11、13、14、15、16、17、18、19、24号为近中部着丝粒染色体(sm),9、12、20、21、22、23号为近端部着丝粒染色体(st),详见表4。核型公式为2n=2x=14m+22sm+12st,染色体相对长度在2.959%~7.101%之间,平均相对长度为4.17%,染色体长度比为2.40,臂比大于2 ∶1的染色体占66.7%,按照STEBBINS的核型分类标准,穿心莲的核型属3B型,是不对称性较高的染色体组,核型不对称系数为67.61%,染色体核型分析参数见表4。
3结论与讨论
植物中具有分生能力的部位都可作为观察细胞染色体的材料,如根尖、茎尖、愈伤、嫩叶、花粉母细胞等[15]。不同植物的分裂旺盛部位应视植物自身生长特性而定,在选取材料时间的对照试验中,因外界环境、植物自身生长调控等因素影响,取材时间也不同,如翠芦莉(Ruellia brittoniana Leonard)和大花芦莉(Ruellia elegans Poir.)的幼根于8:00—10:00取材中期分裂相细胞最多[16];木薯(Plumbago auriculata)嫩叶在08:30—10:00取材效果最佳[17]。为保证植物细胞处于较旺盛的中期分裂相,本研究选08:00—8:30取穿心莲胚根根尖,可能是因为穿心莲种子根尖在该时间段分裂较旺盛。
要获得准确的结果,合适的预处理浓度和处理时间是制片的关键。有学者认为小染色体植物的染色体用秋水仙素溶液作预处理效果较佳[18]。李懋学等提出了多种小染色体植物的制片方法,如大豆(Glycine max)、水稻(Oryza sativa)等宜用0.002 mol/L 8-羥基喹啉水溶液作预处理液[10]。本试验对比不同预处理液和处理时间的制片效果后认为,选用穿透力较强的0.10%秋水仙素溶液处理2 h后,穿心莲染色体聚缩程度适中,着丝粒位置适中,而处理3 h的染色体过度收缩,很难进行染色体的形态分析。0.05%秋水仙素溶液可能是因浓度较低而影响其穿透力,只适合用于计数不适合作核型分析。而使用0.002 mol/L 8-羟基喹啉溶液预处理穿心莲根尖细胞,得到的染色体聚缩程度不足,染色体形态有拖尾不易分辨,推断其原因为穿心莲的染色体较小(1~4 μm),但是细胞壁较厚且细胞质较浓,当使用0.002 mol/L 8-羟基喹啉溶液预处理时,难以有效穿透较厚的细胞壁。0.1%秋水仙素和0.002 mol/L 8-羟基喹啉溶液(体积比1 ∶1)混合液处理下染色体聚缩过度,其可能原因是2种预处理液对纺锤丝的抑制效果不同,而造成抑制作用叠加使染色体过度聚缩。解离常用酶解法和酸解法,酶解法成本较高且混合酶液浓度视不同植物而定,酸解法通常在60 ℃盐酸中恒温水浴,成本低且易操作。最终本试验确定8:00—8:30为较宜的取材时间,穿心莲根尖以0.10%秋水仙素溶液预处理2 h,卡诺氏液固定24 h,1.0 mol/L 盐酸溶液60 ℃下解离8 min后低渗 15 min,卡宝品红染色25 min,显微镜视野内观察到较清晰的穿心莲染色体。
穿心莲染色体数量目前国内外仅有陈爱葵等报道,为 2n=12,关于所用广东省云浮市栽培种穿心莲的来源有待于进一步探讨[19]。陈瑞阳报道采自中国医学科学院药用植物研究所云南分所的穿心莲染色体为2n=50[20]。本研究中采自广东省清远市的穿心莲染色体数量经过反复统计和验证后,确定为2n=48,与陈瑞阳的结果[20]略有差异。自然环境和气候条件可能是造成植物形态学和细胞学差异的主要原因,从而使染色体数量存在一定差异。在一定的生存环境中,植物的染色体是恒定的,但生存环境的差异会增加物种的遗传多样性。
在染色体核型方面,穿心莲的核型不对称系数为 67.61%,核型分类为3B型,Stebbins认为系统演化中较原始的植物通常具有较对称的核型,而较进化或特化的植物往往出现不对称的核型,核型不对称系数越大,染色体长短臂越不对称,其进化程度越高[13]。按Stebbins提出的核型分类标准,穿心莲在爵床科穿心莲属植物的系统演化中进化程度较高。
本研究确定了穿心莲的染色体数量,并对其进行了核型分析,为进一步研究穿心莲属植物的进化、植物分类、遗传育种、优良品种选育提供了细胞学资料。
参考文献:
[1]中国科学院中国植物志编辑委员会.中国植物志[M]. 北京:科学出版社,2002:204-205.
[2]陈元生,罗战勇,郭尚志,等. 穿心莲种质资源的评价与利用初报[J]. 广东农业科学,2005,12(1):5-7.
[3]邓乔华,徐友阳,李淑苑,等. 影响穿心莲药材质量因素的调查和研究[J]. 现代中药研究与实践,2009,23(5):5-7.
[4]贺红,黄昌杰,刘昌辉,等. 穿心莲不同外植体离体培养的研究[J]. 广州中医药大学学报,2004,21(6):470-472.
[5]黄海波,徐鸿华. 穿心莲规范化栽培技术[M]. 广州:广东科技出版社,2010:2-9.
[6]曾令杰,梁晖,林蔚兰. 穿心莲生长過程中内酯类成分的积累动态及其相关性研究[J]. 中国现代应用药学,2007,24(6):464-467.
[7]陈蓉,王晓云,宋毓宁,等. 基于SRAP和SNP分子标记的国内穿心莲遗传多样性分析[J]. 中国中药杂志,2014,39(23):4559-4565.
[8]李玲梅,李明. 不同处理方法对穿心莲种子萌发影响的初步研究[J]. 广东药学院学报,2011,27(4):371-374.
[9]李国珍. 染色体及其研究方法[M]. 北京:科学出版社,1985:23-35.
[10]李懋学,张赞平. 作物染色体及其研究技术[M]. 北京:中国农业出版社,1996:1-40.
[11]Kuo S T,Wang T T,Huang T C. Karyotype analysis of some Formosan gymnosperms[J]. Taiwania,1972,17(1):66-80.
[12]Levan A,Fredga K,Sandberg A A.Nomenclacture forcentromeric position on chromosomes [J]. Hereditas,1964,52(2):197-201.
[13]Stebbins G L. Chromosome evolution in hingher plants[M]. London:Edward Arnoldy Ltd,1971:85-104.
[14]Arano H L.Cytological studies in subfamily Carduoideae(Compositae) of Japan Ⅸ[J]. Botanical Magazine (Tokyo),1963,76:32-39.
[15]赵晨宇. 蓝花丹染色体核型分析研究[D]. 雅安:四川农业大学,2013:13-14.
[16]蔡文燕,周桃凤. 翠芦莉与大花芦莉染色体核型分析[J]. 江苏农业科学,2012,40(5):134-137.
[17]张健,郭军辉,陈雄庭,等. 木薯叶片染色体制片技术研究[J]. 热带作物学报,2012,33(1):20-23.
[18]刘永安,冯海生,陈志国,等. 植物染色体核型分析常用方法概述[J]. 贵州农业科学,2006,34(1):98-102.
[19]陈爱葵,沈育君,廖红云. 穿心莲的染色体核型分析初报[J]. 广东第二师范学院学报,2002,22(2):57-58.
[20]陈瑞阳. 中国主要经济植物基因组染色体图谱(第五册)[M]. 北京:科学出版社,2005:4-5.

