中成药上市后再评价的现状、挑战与展望
摘要 本文检索近十年中成药上市后进行的临床研究,尤其是在SCI杂志上发表的高质量临床研究,回顾目前注册中成药中进行上市后再评价现状及与国际接轨的情况。列出目前中成药进入国际市场存在的问题,并以FDA、加拿大及欧盟对于植物药及草药的注册要求来详细陈述,指出中成药上市后再评价的必要性及未来的发展趋势。
关键词 中成药;上市后再评价;注册制度
Abstract This study has reviewed the post market clinical trials of Proprietary Chinese Medicine, especially those which have published high quality SCI papers to assess the current situation and challenges faced in this area. At the same time, we also listed the registration differences between Food and Drug Administration (FDA), European Medicine Agency and Health Canada. This study further analyzed the necessity and trend of post marketing evaluation of Proprietary Chinese Medicines.
Key Words Proprietary Chinese Medicines; Post marketing evaluation; Registration regulations
中圖分类号:R2-03文献标识码:Adoi:10.3969/j.issn.1673-7202.2017.06.003
药品上市后再评价是根据医药学的最新水平,从药理学,药剂学,临床医学,药物流行病学,药物经济学及药物政策等方面,对已批准上市的药品在社会人群中的疗效,不良反应,用药方案,稳定性及费用等是否符合安全,有效,经济的合理用药原则做出科学评价和估计[1]。近10年来,针对中药,主要是中成药的上市后再评价逐步引起学界和業界的关注,有关中成药的安全性、有效性的疑虑不时见诸媒体,对现有中成药品种全面进行上市后再评价成为公众和制药企业的共同心声。而与此同时,2015年开始的药物临床数据核查风暴仍在震慑整个医药行业,许多正在申请中的中成药悄然落幕。一方面中成药在上市前的临床研究纳入的试验病例较少,研究时间偏短,人群范围相对较窄,用药条件控制苛刻,疗效及安全性指标局限,使得中药上市前的有效性和安全性评价内容并不充分[2]。这些都直接阻碍了中成药精确定位适应证及展示真正的疗效,尤其是寻求进入海外市场时,需要进行植物药(Botanical Drug)或者天然健康产品(Natural Health Products)等注册,均面临着困境。本文将就中成药上市后进行的临床研究现状做一回顾,指出研究设计中存在的问题,并展望未来中成药上市后在评价的发展趋势。
1 中成药上市后再评价的现状与问题
作者检索英文数据库The Cochrane Library,MEDLINE (OVID),EMBASE,中文数据库CNKI、万方数据库近十年中成药上市后的临床文献,发现中成药上市后在评价的临床研究发表的质量不高,且重复研究及与其他药物合并研究为主。以几个中成药口服药大品种为例,复方丹参滴丸上市后临床报告为2 076个,而上市后再评价的临床研究仅为85个,其中大部分是联合用药及扩大适应证的研究,且样本量绝大部分在60~200之间,其中高质量的SCI文章有四篇;通心络胶囊上市后临床报告为1 529个,上市后再评价的临床研究为62个,其中Cochrane review 1篇,高质量临床研究论文是与针刺同用,难以评估疗效;麝香保心丸上市后临床报告为1 257个,其中临床研究43个,1篇SCI的系统综述,4篇SCI临床研究文章;这些情况与国际上进行的上市后临床研究(IV期临床),如FDA要求的为数千人以上的研究相去甚远,而且适应证的扩大也五花八门,且大多为联合用药(其他西药或者其他中成药等)[3-4]。综合我们的检索结果和比较国际上市后再评价的临床研究要求,目前,中成药上市后再评价存在的主要问题为以下4个方面。
1.1 缺乏大样本、多中心、设计良好的临床研究 以销售市值超过十个亿的中成药大品种为例,大量的研究都是单个中心,且样本量少,这样做既浪费了大量的临床资源,又得不到有力的临床疗效证据[5]。若是能够有高质量的临床研究方案,明确的纳入和排除标准,统一的评价指标,具体的内容可以参考目前国际上通行的临床研究方案的设计和报告标准,“规范临床研究方案内容”(Standard Protocol Items:Recommendations for Interventional Trials 2013,SPIRIT 2013)[6-7],是由加拿大多伦多大学陈安文博士领导的由115位临床研究相关专家组成的SPIRIT工作小组,自2007年开始,通过多次会议和调研,经过反复修改,就临床研究设计的基本条目内容反复讨论后形成的一份声明,说明了临床研究方案报告条目的内容和要求,旨在提高临床研究设计的质量。而自2013年该规范出版以来,中医药上市后再评价临床研究方案也逐步开始采纳SPIRIT2013的标准[8]。
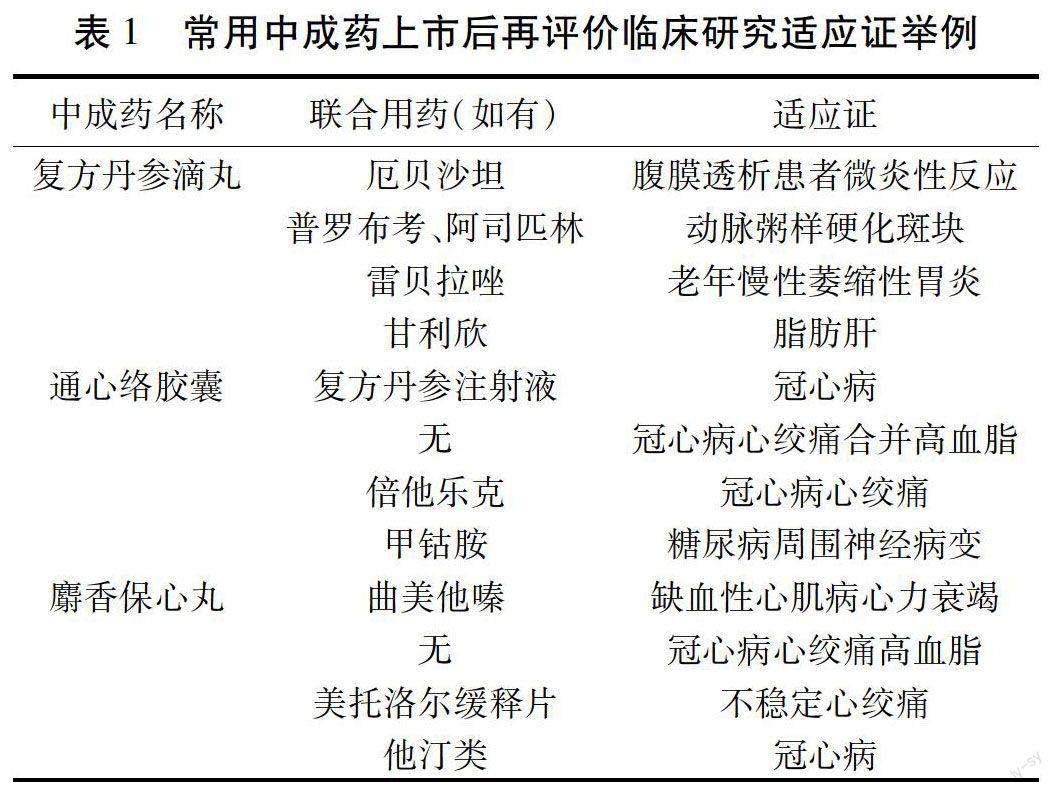
1.2 适应证以西医病名为主,且病种多样不规范 粗略总结上述3个中成药大品牌的临床观察研究或随机对照研究的适应证,列举如下表。见表1。
从上表可以看出,大部分的临床研究没有考虑中医诊断及证候的因素,“证候”是中医药干预手段的基石[9],但是目前中药的疗效评价指标依然套用的是化学药品的疗效评价体系,即以理化指标或问卷、量表为主要疗效指标,“证候”相关疗效指标有的仅会作为次要疗效指标进行评估,甚至有些直接省略,这不仅导致忽略了中药临床作用优势,并且将导致中医药特色的丢失[10-11]。从加拿大天然健康产品注册的要求也提到作为传统中医理论下开发的中成药,如遵循传统功效申请,可以用中医术语描述天然健康产品的功效和主治[12]。而适应证太多,“包治百病”却缺乏详细的界定和临床证据,使得中成药在海外注册时受到挑战,往往需要重新补做高质量的临床研究。另外,很多研究都是与一个具有活性的中药或西药联合使用来与另一个药物进行对照研究,在疗效评价和安全性评价上难以剔除。
1.3 缺乏中成药质量控制的数据
无论是美国FDA还是加拿大卫生局,乃至香港卫生署,他们对于中成药注册的质量控制均有非常严格的要求。FDA的《植物药研制指南》明确要求对多种成分组成的复方制剂进行多批次的一致性质控[13]。《植物药研制指南》2015修订稿新增的新药上市申请(New Drug Application,NDA)部分,针对临床相关问题,重点提出“确保疗效一致性的证据”的问题[9]。为确保治疗的一致性,植物药产品的质量控制应考虑以下3个方面:1)植物原料的控制;2)通过化学测试和生产控制的质量控制;3)生物测定和临床资料。申请人应提供上述3个质量控制方面的综合评估,以证明上市销售的不同批次植物药同临床研究用药具有相同的临床治疗效果,也即具有药效的一致性[13]。
2006年,美国FDA批准了Veregen作为第一个以绿茶混合物为有效成分的植物新处方药在美国上市,FDA的评审意见中指出:“植物药治疗作用可能是多种活性成分的共同作用,且这些活性组分并非完全知晓,在这种情况下,如何选择质控的化学组分,并且对多少化学组分进行质控是另一个值得深思的问题”[14]。这是对我国中成药质量控制体系的一个重要提示,即应选择合适且恰当的化学组分进行中药的质控。2012年FDA批准的口服植物药Fulyzaq,也是单方制剂,成分来源单一,成分分析及定性、定量检测比较稳定[15]。而我国目前上市后再评价的临床研究中,从文献来看,大多回避中成药质量控制这一块。可喜的是,2016年12月中成药产品胆宁片,获得加拿大卫生部天然药品和非处方药局的上市许可证,成为第一个“功能主治”被欧美国家政府认可的复方中药[16]。胆宁片本身在国内是率先建立起中药“指纹”图谱库,用“全成分”来进行分析的拳头产品。并且为了弄清一味中药究竟是哪一成分起效,开展了体内代谢研究,引入蛋白质组为主的系统生物学方法,深入研究了该中药的作用机制[17]。并且在上市后进行多中心的随机双盲及阳性对照的临床研究[18]。这一切的前期国内的研究成果,直接搬到加拿大天然药物注册处申请,不用另行再做质控研究。
2 未来上市后再评价的要点与趋势
FDA药品评价和研究中心(Center for Drug Evaluation and Research,CDER)于2015年8月17日在网上发布了修订版的《植物药研发工业指南》(Botanical Drug Development Guidance for Industry),这是指南正式公开生效11年后的首次更新[13]。随着复方丹参滴丸、扶正化瘀片、血脂康胶囊、桂枝茯苓丸等陆续在美国开始临床II、III期的临床研究,为新药注册做准备,胆宁片、乐脉颗粒等在加拿大的成功注册,再次印证只要国内的上市后再评价质量高,证据充分,是不需要投入大量的人力和物力重新再补充研究数据的。
虽然至今没有一个中成药在美国以植物药注册成功,但复方丹参滴丸完成临床III期研究[19],麝香保心丸大规模随机、双盲、多中心、安慰剂2 700例临床研究进入收官阶段[20]。这些均为未来的上市注册打下良好基础。FDA针对植物药的特点,将临床研究分为2个阶段,并將初期临床前的技术要求适当降低标准,这是FDA对植物药审批采取务实和灵活态度的一个缩影,极大地降低了新药研究前期风险。所以在设计临床研究方案时,应该有前期的先导研究(Pilot Study)作为支撑,而先导研究的所有主要指标,如纳入、排除标准,主要、次要疗效指标等。在疗效的评价指标方面,必须要做好充分的文献研究和前期临床研究,举例来说,复方丹参滴丸在国内的疗效评价指标是心绞痛缓解时间和缓解率,但是通过多个临床研究的Meta分析[21-23]发现目前的研究质量不高影响了证据的级别。所以在美国申请临床试验时,将最大耐受时间变化作为主要疗效指标,以每周心绞痛的发作次数、每周硝酸甘油服用量、运动耐量试验中出现ST段下降的时间、运动耐量试验中出现心绞痛时间、生命质量评分以及生化标记物B型利钠肽等作为次要疗效指标[24]。
对于药物的质量,要从源头抓起。以胆宁片为例,药材的质量标准、中间产物及最后成品,均需有跟踪的主要指标,且批次之间的差异控制在很小的范围内。研究团队对3种大黄、4种郁金进行了深入研究。结果发现,《中华人民共和国药典》记载的3种大黄中,药用大黄的保肝利胆效果最好,安全性最高;而4种郁金中,无论是姜黄素的含量,还是利胆作用,都以古代《本草綱目》记载的黄丝郁金为最优[25]。在这些研究的基础上,为每一味药都建立了质量控制点和指标成分定量控制区间,从源头上确保胆宁片质量的稳定可控,比如各种成分的控制区间不但有下限,还有上限,达到了欧美国家对天然药品的质量控制要求。
在适应证选择上,必须要选择现有西药无效或者疗效不佳,或者治疗不良反应大的病种或症状,同时要把中医的适应证说清楚,能够让没有中医背景的审核人员清晰了解[26]。如乐脉颗粒在《中国药典》的功能主治为“行气活血、化瘀通脉。用于气滞血瘀所致的头疼、眩晕、胸痛、心悸、冠心病心绞痛、多发性脑梗死见上述证候者。”在加拿大注册天然健康产品的功能主治则精确定位为“用于气滞血瘀所致的头疼、眩晕、胸痛、心悸[27]。
综上所述,我们相信未来在中成药上市后再评价的临床设计、质量控制及适应证把握上与国际上植物药的注册要求相结合,将会既有利于药物走向海外市场,同时对于该药的产业升级及节约开发研究成本起到十分重要的作用。
参考文献
[1]颜敏,吴晔.药品上市后再评价工作的现状与思考[J].中国新药杂志,1999,8(7):433-436.
[2]郭晓昕,颜敏.如何认识中药上市后的再评价[J].中国新药杂志,2000,9(8):513-515.
[3]Bourgeois FT,Kim JM,Mandl KD (2014) Premarket Safety and Efficacy Studies for ADHD Medications in Children[J].PLoS ONE,2014,9(7):e102249.
[4]U.S.Department of Health and Human Services.FDA Regulatory Information.Available:http://www.fda.gov/RegulatoryInformation/Guidances/ucm122049.htm.Accessed 2017 May 20.
[5]Chan A W,Tetzlaff J M,Altman D G,et al.SPIRIT 2013 statement:defining standard protocol items for clinical trials[J].Annals of Internal Medicine,2013,158(3):200-207.
[6]Chan A W,Tetzlaff J M,Gtzsche P C,et al.SPIRIT 2013 explanation and elaboration:guidance for protocols of clinical trials[J].BMJ,2013(346):e7586.
[7]王勇,张伯礼,高秀梅,等.中成药大品种的内涵及特点分析[J].天津中医药,2014,31(1):61-64.
[8]钟丽丹,郑颂华,吴泰相,等.SPIRIT 2013声明:定义临床研究方案的标准条目[J].中国循证医学杂志,2013,13(12):1501-1507.
[9]Scheid V.Convergent lines of descent:symptoms,patterns,constellations,and the emergent interface of systems biology and Chinese medicine[J].East Asian science,technology and society,2014,8(1):107-139.
[10]Bian ZX,Moher D,Li YP,et al.Appropriately selecting and concisely reporting the outcome measures of randomized controlled trials of traditional Chinese medicine[J].Journal of Chinese integrative medicine,2008,6(8):771-775.
[11]Zhang L,Zhang J,Chen J,et al.Clinical research of Traditional Chinese Medicine needs to develop its own system of core outcome sets[J].Evidence-Based Complementary and Alternative Medicine,2013,2013(2013):202703.
[12]翁新愚.加拿大《天然健康产品管理办法》简要分析[J].国外医学:中医中药分册,2005,27(2):67-70.
[13]Food and Drug Administration.Botanical Drug Development Guidance for Industry.2016 Dec 27th.Available from:https://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm458484.pdf.
[14]周華.美国第一个植物药VeregenTM简介及其对中药研发的启示[J].中药新药与临床药理,2008,19(4):326-328.
[15]敬志刚,陈永法,叶正良,等.FDA批准的第一例口服植物药Fulyzaq情况及启示[J].现代药物与临床,2013,28(3):421-423.
[16]宋琼芳.胆宁片走出国门有启示[N].健康报,2017-02-16(2).
[17]Liu R,Zhang J,Liang M,et al.Simultaneous analysis of eight bioactive compounds in Danning tablet by HPLC-ESI-MS and HPLC-UV[J].J Pharm Biomed Anal,2007,43(3):1007-1012.
[18]Ji G,Fan JG,Chen JJ,et al.Effectiveness of Danning Tablet in Patients with non-alcoholic fatty liver of damp-heat syndrome type:a multicenter randomized controlled trial[J].Journal of Chinese Integrative Medicine,2008,6(2):128-133.
[19]冯国梧,李颖.复方丹参滴丸完成美国FDA三期临床试验[N].科技日报,2016-12-24(1).
[20]上海和黄药业.麝香保心丸大规模循证医学研究项目进入收官阶段[EB/OL].2015.Available from:http://www.shpl.com.cn/hh/News/News_View.asp?NewsId=1721.
[21]龙铟,龙梅,宋联进,等.益气活血复方治疗心绞痛患者1499例疗效评价[J].中国中医急症,2009,18(4):603-604.
[22]樊涛,王刚,王蕾,等.复方丹参滴丸治疗冠心病心绞痛随机对照试验的质量评价[J].中国循证医学杂志,2007,7(6):641-646.
[23]张俊华,商洪才,高秀梅,等.复方丹参方制剂治疗稳定型心绞痛随机对照试验的系统评价[J].天津中医药,2007,24(3):195-200.
[24]寧田海.复方丹参滴丸治疗慢性稳定性心绞痛美国Ⅱ期临床试验报告学术研讨会纪要[J].中华心血管病杂志,2010,38(9):780.
[25]国家药典委员会.中华人民共和国药典(一部)[S].北京:人民卫生出版社,2015:附录ⅥB.
[26]刘炳林.从临床角度看中药新药适应症的定位[J].中药新药与临床药理,2011,22(2):226-227.
[27]中华心血管杂志编委会心血管药物对策专题组.心血管药物临床试验评价方法的建议[J].中华心血管病杂志,2011,26(6):405-413.
(2017-05-10收稿 责任编辑:徐颖)

