Th17/Treg细胞在健脾方防治克罗恩大鼠中的作用机制
吴璐一 翁志军 季光
摘要 目的:觀察Th17/Treg細胞平衡在健脾方防治TNBS诱导的克罗恩大鼠中的作用机制;方法:24只清洁级雄性SD大鼠随机分为:1)正常对照组NG(n=8):从造模第2周起双蒸水灌胃,1次/d,灌胃量按1 mL/100 g,共3周;2)TNBS模型组MG(n=8):从第1周开始TNBS灌肠,灌肠剂量(mL)=体重(g)×0.003 mL/g,1次/周,造模持续共4周;3)模型+健脾方防治组JP(n=8):从造模第2周开始,在TNBS灌肠后的第2天新增中药健脾方灌胃治疗,灌胃量按1 mL/100 g,1次/d,灌胃持续3周;采用ELISA、免疫组织化学、real-time PCR等技术观察各组大鼠血液、结肠黏膜中与Th17、Treg分化和功能密切相关的IFN-γ、IL-17、RORγt、FoxP3蛋白与基因的表达差异;结果:健脾方能通过下调Th1细胞释放的IFN-γ,进而来调节Th1/Th2的平衡,同时也能通过下调Th17细胞分泌IL-17、RORγt炎性反应因子的分泌和促进Treg细胞分泌的抗炎因子FoxP3来调节Th17/Treg的平衡,进而达到防治TNBS诱导的大鼠克罗恩病的作用。结论:健脾方能够通过调节Th17/Treg细胞平衡中多个关键细胞因子和转录因子的方式,达到预防和治疗TNBS诱导的大鼠克罗恩病炎性反应程度之目的。
关键词 克罗恩病;健脾方;IFN-γ;IL-17;RORγt;FoxP3
Abstract Objective:To observe the mechanism of TH17/Treg cells in the prevention and treatment for trinitrobenzene sulfonic acid (TNBS)-induced rats with Crohn′s disease using a spleen-invigorating prescription (SIP). Methods:A total of 24 SPF grade male Sprague–Dawley (SD) rats were randomly divided into 3 groups: (1) the normal rat control group (NG; n=8) received intragastrically administered double-distilled water once daily at 1 mL/100 g for 3 weeks; (2) the TNBS model group (MG; n=8) received enemas with TNBS once weekly at a dosage of body weight (g)×0.003 ml/g for 4 weeks; and (3) the TNBS model + SIP and treatment group (JP; n=8) was treated with an additional Chinese SIP 1 week after undergoing TNBS enema. The Chinese medicine was administrated intragastrically once daily for another 3 weeks at a dosage of 1 mL/100 g. Multiple techniques, including enzyme-linked immunosorbent assay(ELISA), immunohistochemistry, and real-time PCR, were used to observe the differential expression of particular genes and proteins in blood and colonic mucosa of rats which belong to different groups. This study focused on genes and proteins that are highly associated with Th17 and Treg cell differentiation and function, including interferon (INF)-γ, IL-17, retinoid-related orphan nuclear receptor (ROR) γt, and FoxP3. Results:SIP effectively adjusted Th1/Th2 homeostasis by downregulating the Th1-secreted cytokines INF-γ. By downregulating Th17-secreted inflammatory factors, IL-17 as well as RORγt and suppressing the secretion of FoxP3, SIP also promoted Th17/Treg homeostasis. Then, the symptoms of TNBS-induced rat colonitis were successfully prevented and treated.Conclusion:SIP prevented and treated inflammation associated with TNBS-induced rat with Crohn′s disease by regulating multiple key cytokines and transcription factors related to Th1/Th2 and Th17/Treg cell homeostasis.
Key Words Colonitis;Spleen-invigorating;IFN-γ;IL-17;RORγt;FoxP3
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2017.06.049
T细胞介导的免疫反应在IBD组织破坏的发病机制中发挥重要的作用[1-2],目前研究发现,幼稚CD4+T淋巴细胞可分为Th1、Th2、Th17和Treg,4个主要功能成熟的亚群,分别通过不同的转录途径和特征性的细胞因子执行不同的生物学功能[3]。如Th1细胞主要分泌干扰素-γ(IFN-γ)、白介素-2(IL-2)等细胞因子,具有抗细胞内细菌、病毒感染等作用[4-5]。而Th2型细胞則分泌IL-4、IL-5和IL-13等细胞因子,参与介导体液免疫和变态反应[6]。Th17细胞是一类不同于Th1和Th2细胞的CD4+T细胞,Th17特异性分泌白介素17(IL-17)效应因子,IL-17A是IL-17家族的原型,其主要介导炎性反应,IL-17启动了其下游NF-κB、p38MAPK等信号转导途径,通过协同及负调控等信号转导机制影响众多炎性因子的转录和表达[5]。同时维甲酸相关孤核受体γt(Retinoid-related Orphan Nuclear Receptor γt,RORγt)是Th17细胞特异性转录因子,参与自身免疫性疾病、感染和肿瘤等多种病理过程,在自身免疫性疾病和机体防御反应中具有重要的意义[7]。Treg依赖特异性转录因子叉头蛋白P3(FoxP3)以维持稳定表达,释放IL-10、转化生长因子-β(TGF-β)等细胞因子来抑制自身反应性T细胞的增殖活化,维持自身免疫耐受[8]。CD4+T细胞的亚群各自发挥不同的功能,并相互制约并且在一定的条件下可以互相转化[9]。研究发现,与Th1和Th2相关的细胞因子IFN-γ和IL-4能够抑制Th17亚群的分化,而Treg对Th1、Th2和Th17 3种效应细胞均有抑制作用[10]。同时,Treg和Th17在不同的环境下也可以相互转化,说明了这些亚群之间存在非常复杂的关系[11-12]。
肠道初始Th细胞活化后会向不同的亚型细胞分化如Th1、Th2、Th17和Treg细胞,并各自在调控免疫反应中发挥了不同的作用。它们参与了免疫炎性反应级联反应中抗原的识别,细胞信号通路的激活,炎性反应效应的放大,下游炎性反应因子的释放等诸多环节。研究表明miRNA作为Th细胞分化的重要调控因素,课题组前期研究结果提示,CD患者结肠黏膜存在较多的miRNAs表达异常,参与免疫系统的调节[13-14]。因此,干预其中任何一个必要环节都可能起到缓解病情的作用[15]。中医药治疗IBD的特点是多途径、多层次、多靶点并且可以长期维持用药治疗[16-17],不良反应较少。实验研究发现,健脾方成分治疗CD效应显著[18-19],且具有一定的免疫调节作用,但以往针对健脾方预防和治疗CD的机制研究有待于逐步揭示和阐明,有必要对此进行深入探讨。本实验是以CD中Th17/Treg细胞平衡为切入点。初步揭示健脾方在预防和治疗CD的可能作用机制,为推广健脾方在临床预防和治疗CD方面的应用提供实验的证据。
1 材料与方法
1.1 材料
1.1.1 动物 24只SPF级雄性SD大鼠,重(160±10) g,购于上海斯莱克实验动物有限责任公司[生产许可证号:SCXK(沪)2012-0002],饲养于上海中医药大学附属龙华医院实验动物中心,所有大鼠均自由饮水(药)、摄食,饲养室内温度为(24±2)℃,湿度为(55±10)%,光照时间为12 h(8:00-20:00)。适应性饲养后,大鼠无不良反应、饮食饮水正常者,大鼠按体重由小到大编号,采用完全随机法分组并纳入实验。所有实验对动物的处理符合中国科学技术部指导建议。
1.1.2 药物 健脾方由以下中药(补骨脂15 g、白头翁15 g、马齿苋30 g、茯苓9 g、白术9 g、藿香9 g)组成,根据《中药药理学研究方法学》标准,将中药加入蒸馏水中,煎煮2次,合并2次药液,4层纱布过滤,水浴锅95 ℃浓缩体积为555.5 mL的药液。置4 ℃冰箱保存备用。根据《中药药理学》(全国高等中医药院校教材《中药药理学》陈长勋主编,上海科学技术出版社,2006年10月第1版,191页,表22-3)用药剂量按人鼠等效剂量灌胃,大鼠为1 mL/100 g。
1.1.3 试剂与仪器 TNBS(Sigma公司)、EnVision试剂盒(Rabbit/mouse,Dako公司)、兔抗大鼠一抗IL-17A、RoRγt、Foxp3(Sigma公司)、SYBRGreen PCR试剂盒(上海捷瑞生物工程公司)、c DNA合成试剂盒(Fermentas)、Trizol(Invitrogen)、DAB(Biobastic,Inc,美国)、PCR仪(eppendorf公司)、全自动组织脱水机SAKURA-PB-150(日本樱花检验仪器株式会社)、StepOneTM plus实时荧光定量PCR(Applied Biosystems公司)、ABI-7500型Real-time检测仪(美国应用生物仪器公司)。
1.2 方法
1.2.1 分组与模型制备
1.2.1.1 分组 24只清洁级雄性SD大鼠随机分为:1)正常对照组;2)TNBS模型组;3)模型+健脾方防治组。
1.2.1.2 模型制备 按照Morris[20]等方法制备CD大鼠模型,5%TNBS与50%的乙醇按2∶1比例混合而成,3%戊巴比妥鈉麻醉大鼠(按体重计,0.1 mL/100 g),使其身体垂直,处于倒立位,每次灌肠剂量:灌肠液(mL)=体重(g)×0.003 mL/g,5 mL注射器连接灌肠针顺大鼠直结肠生理曲度缓缓从肛门插入约6~9 cm,注入灌肠液。灌肠后将大鼠倒立体位约5 min。每周第1天灌肠1次,共4次,持续4周。
1.2.2 给药方法 24只清洁级雄性SD大鼠随机分为:1)正常对照组NG(n=8):从造模第2周起双蒸水灌胃,1次/d,灌胃量按1 mL/100 g,共3周;2)TNBS模型组MG(n=8):从第1周开始TNBS灌肠,灌肠剂量(mL)=体重(g)×0.003 mL/g,1次/周,造模持续共4周;3)模型+健脾方防治组JP(n=8):从造模第2周开始,在TNBS灌肠后的第2天新增中药健脾方灌胃治疗,灌胃量按1 mL/100 g,1次/d,灌胃持续3周。
1.2.3 检测指标与方法 以3%戊巴比妥钠麻醉大鼠(按体重计,0.1 mL/100 g),腹主动脉取血,静置约0.5 h后离心分离血清,-80 ℃冰箱保存用于ELISA检测。截取距离肛门6~9 cm处病变明显结肠,沿肠系膜纵行剖开,用预冷的4 ℃生理盐水冲洗后,肉眼观察并记录黏膜损伤情况。每只大鼠结肠标本分3份,其中2份液氮保存用于Real-time PCR检测。另一份用10%的中性缓冲甲醛溶液固定,石蠟包埋组织,切片厚度为4 μm,用于Masson染色和免疫组化实验检测。所有实验对动物的处理符合中国科学技术部指导建议。
1.2.3.1 结肠组织病理观察(HE染色) 切片常规脱蜡至水、苏木素核染、盐酸酒精分化、伊红胞质染色、梯度酒精脱水及二甲苯透明,中性树胶封片干燥后经Olympus-BX53显微镜进行图像采集(×400)。
ELISA技术检测健脾方对克罗恩病大鼠血清INF-γ表达的影响:本试剂盒应用双抗体夹心法测定标本中大鼠IFN-γ(Sigma,USA)水平。用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中大鼠大鼠IFN-γ浓度。
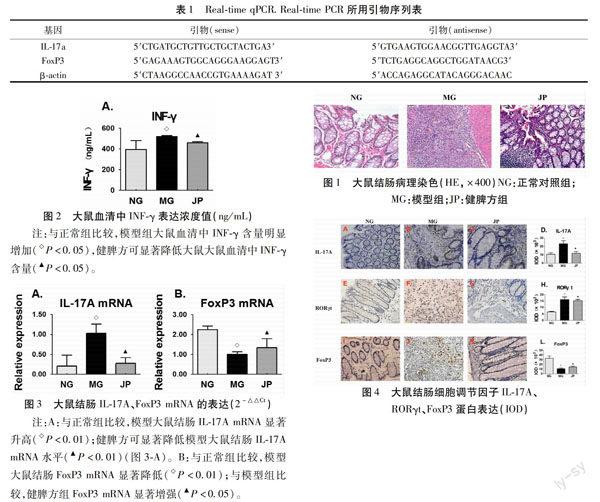
1.2.3.2 Real-time PCR法检测 大鼠结肠组织L-17A、FoxP3 mRNA:组织总RNA的抽提,组织匀浆,采用Trizol法提取总RNA,检测浓度、纯度、完整性。取相等量的总RNA,采用SYBRGreen PCR试剂盒(上海捷瑞生物工程公司)逆转录cDNA,用于Real-time qPCR.Real-time PCR所用引物序列。见表1。
1.2.3.3 免疫组化检测大鼠结肠组织IL-17A、RORγt、FoxP3蛋白水平 切片0.3%H2O2抑制内源性过氧化物酶20 min;20%正常羊血清室温孵育30 min;滴加一抗在37 ℃下孵育2 h,IL-17A、RORγt、FoxP3一抗(sigma,USA);EnVision试剂(HRP/R)加入后保留30 min;DAB显色1~2 min;苏木素衬染色,树脂封片;采用Olympus-BX53显微镜进行图像采集(×400),数据分析采用Image-Pro PLUS软件。
1.3 统计学方法 数据分析采用SPSS 18.0统计软件进行统计学处理。对数据作正态分布检验。数据若符合正态分布,组间差异采用单因素方差分析(One-way ANOVA),方差齐时采用最小显著差法(Least significant difference,LSD)比较组间差异性,方差不齐时用Games-Howell比较组间差异性,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠结肠组织病理HE染色 大鼠结肠HE染色结果如图1所示。正常组大鼠结肠组织肉眼观察结肠肠管粗细均匀,结肠壁厚薄一致,柔软有弹性,肠黏膜面光滑整齐,黏膜皱襞完整,无出血点、糜烂及溃疡。HE染色镜下显示结肠黏膜上皮无缺损,腺体排列整齐,黏膜及黏膜下层无充血、水肿、炎性细胞浸润等异常改变,结构完好。模型组:大鼠结肠黏膜上皮细胞坏死、脱落,肠壁全层大量炎性反应细胞浸润,肉芽肿形成,纤维组织增生。健脾方组:清热健脾方干预后,HE染色镜下显示结肠黏膜腺体排列较整齐,上皮修复中,黏膜下有少量水肿与炎性细胞。显示清热健脾方可有效改善克罗恩病大鼠结肠组织结构,减轻结肠组织损伤,具有良好的修复大鼠克罗恩病受损结肠组织的作用。
2.2 CD大鼠血清INF-γ浓度 我们选择检测与Th1细胞功能和分化密切相关的细胞因子IFN-γ来观察健脾方对TNBS诱导的CD大鼠结肠炎性反应预防和治疗作用,用ELISA检测大鼠血清INF-γ浓度的变化,结果如下图2。TNBS诱导的CD大鼠血清中INF-γ的浓度为(519.3±9.8)ng/mL,比正常组(395.2±85.2)ng/mL升高,健脾方能够抑制TNBS诱导炎性反应过程中血清中INF-γ的升高的程度(458.9±10.6)ng/mL。
2.3 CD大鼠结肠组织Th17/Treg细胞调节因子IL-17A、FoxP3 mRNA的表达 采用Real-time PCR法观察TNBS诱导的CD大鼠结肠组织中Th17/Treg细胞调节因子IL-17A、FoxP3 mRNA表达的变化,从基因层面证实Th17/Treg细胞平衡紊乱在TNBS诱导CD病理机制中的作用,并揭示Th17/Treg细胞平衡在健脾方对CD结肠炎性反应形成初期防治中的作用机制。实验结果如图3,图A为各组大鼠结肠组织IL-17A mRNA表达,正常组IL-17A mRNA为(0.206 7±0.270 6),模型组(1.025±0.235 4),高于正常组(P<0.01),健脾方能够抑制CD大鼠结肠炎性反应形成初期这种增高的趋势,为(0.274±0.139 8)(P<0.01)。图B为各组大鼠结肠组织FoxP3 mRNA表达,正常组FoxP3 mRNA为(2.241±0.185),模型组(1.006±0.121 6),表达低于正常组(P<0.01),健脾方组能够上调FoxP3 mRNA表达,为(1.334±0.456 4)(P<0.01)。
2.4 CD大鼠结肠组织Th17/Treg细胞调节因子IL-17A、RORγt、FoxP3蛋白的表达 基于上述Th17/Treg细胞调节因子IL-17A、FoxP3 mRNA在TNBS诱导的CD大鼠结肠组织表达的变化,以及健脾方在炎性反应初期能够起到对各个因子的基因发生调节作用的实验结果,继续观察相应调节IL-17A、RORγt、FoxP3蛋白在CD大鼠结肠组织中表达变化情况及健脾方对这些细胞调节因子的影响,采用免疫组织化学法来观察3个蛋白的表达结果如下:(图4 A-L,×400倍图像采集)。IL-17A主要表达于大鼠结肠黏膜上皮细胞和结肠黏膜上皮间质非上皮细胞。正常组结肠黏膜上皮结构完整、腺体排列规则有序,肠黏膜IL-17A呈弱阳性表达(10.69±5.16),如图4,A。模型组结肠黏膜上皮有脱落,炎性反应细胞显著增生,肠黏膜IL-17A表达高于正常组(23.26±9.91)(P<0.01),如图4,B。健脾方对结肠黏膜上皮结构较紊乱和炎性反应细胞增生具有防治作用,肠黏膜IL-17A呈中度-阳性表达(14.83±5.94)(P<0.01),如图4,C。组间比较结果见图D。RORγt主要表达于大鼠结肠黏膜上皮细胞。正常组结肠黏膜上皮结构完整、排列整齐,肠黏膜RORγt呈弱阳性表达(6.62±1.39),如图4,E。模型组结肠黏膜上皮大量脱落,腺体结构紊乱,肠黏膜RORγt呈强阳性表达(16.34±5.69)(P<0.01),如图4,F。健脾方能够在CD克罗恩病症形成期间,改善结肠黏膜上皮结构较紊乱和炎性反应细胞增生的程度,肠黏膜RORγt呈中度-阳性表达(15.35±3.11)(P<0.05),如图4,G。組间比较结果见图H。FoxP3主要表达于大鼠结肠黏膜上皮细胞和结肠黏膜间质非上皮细胞。正常组结肠黏膜上皮结构完整、排列整齐,肠黏膜FoxP3呈强阳性表达(32.92±15.53)如图4,I。模型组结肠黏膜上皮有脱落,结构紊乱,肠黏膜FoxP3呈弱阳性表达(10.54±5.40)(P<0.01),如图4,J。健脾方防治组结肠黏膜上皮结构较整齐,肠黏膜呈弱阳性表达(14.83±3.39)(P<0.05),如图4,K。组间比较结果见图L。
3 討论
目前,临床常用的治疗CD的药物主要有氨基水杨酸类、糖皮质激素、免疫抑制剂、炎性递质抑制剂、靶向生物免疫治疗、抗生素[21]等。中医药治疗CD的特点是多途径、多层次、多靶点并且可以长期维持用药治疗,不良反应较少[16-17]。实验研究发现健脾方中的中药组份治疗IBD疗效肯定且具有一定的免疫调节作用[18-19],但健脾方治疗IBD的相关免疫机制研究很少,因此,有必要对此进行深入探讨。在我们的研究中,证实了健脾方能够抑制CD结肠炎性反应形成初期的炎性反应程度,模型制作过程中应用健脾方能够起到很好的防治作用。本研究以CD4+T细胞亚群为突破点,研究Th17/Treg平衡在健脾方防治CD中的作用,探讨健脾方治疗CD的免疫机制。
3.1 Th1/Th2失衡与健脾方防治IBD Th1和Th2都参与了免疫炎性反应级联反应中抗原的识别、细胞信号通路的激活、炎性反应效应的放大以及下游炎性因子的释放等诸多环节,干预其中任何一个必要环节都可能起到缓解病情的作用[22],因此,对Th1和Th2平衡的干预,成为IBD研究的热点和治疗的思路。基于这种思路,我们设计此实验初步探索健脾方治疗CD的作用机制。Th1细胞主要分泌IL-2、IL-12、IFN-γ等细胞因子,IL-12和IFN-γ还能通过促进Th1分化和抑制Th2分化使Th1细胞处于优势。Th2细胞主要分泌IL-4、IL-5和IL-13等细胞因子,其中IL-4和IL-13能够通过促进Th2分化和抑制Th1分化使Th2细胞占优势[23],Neunath等研究认为TNBS诱导的CD大鼠是呈现Th1细胞优势状态而Th2细胞应答相对降低的克罗恩病症[24-25],因此,通过抑制Th1的优势状态来调节Th1/Th2的失衡状态能降低其炎性反应并使病情得到缓解。我們的实验结果表明,在CD大鼠模型中,血清中Th1细胞因子IFN-γ含量升高,与正常对照组比较具有显著性差异,表现出了炎性反应过程中Th1细胞处于优势的状态,同时,增加的IFN-γ也可能进一步促进了这一优势状态,对CD大鼠施加健脾方干预,血清中的IFN-γ含量有所降低,使IFN-γ的促炎失衡的状态有所缓解。
3.2 Th17/Treg失衡与健脾方防治IBD 目前,恢复体内的Th17/Treg平衡对动物实验和IBD患者的疗效均已得到不断的验证[26-30]。多种疗法进一步的研究证实,ThI7/Treg转化平衡是维持肠道免疫稳态的重要因素,这可能成为人类导致IBD的原因之一[31]。除Th17细胞外,多种T细胞亚群均可分泌IL-17A[32],临床研究发现IBD患者肠黏膜组织和外周血中IL-17含量明显升高[33]。在我们的CD大鼠结肠组织中发现了IL-17A基因和蛋白都出现表达的上调,结肠组织HE染色也发现也出现大量的炎性细胞因子浸润,应用健脾方干预后,能够对IL-17A起到下调的作用。表明健脾方在缓解IL-17A相关炎性反应方面起到了积极的调节作用。RORγt是Th17分化的特异性转录因子已经得到业界的认可[34-35]。实验发现,CD大鼠的结肠组织中RORγt蛋白表达上调,从模型制作的第2周开始进行健脾方的干预,能够下调RORγt,进而抑制T细胞向Th17细胞方向分化这个趋势,所以可以推断健脾方在防治CD过程中涉及可能涉及了Th17细胞分化的重要的细胞因子和转录因子,而且在恢复Th17/Treg细胞平衡方面发挥了积极的调节作用。
FoxP3是Treg亚群分化的特异性核转录因子,在调控其分化发育和功能上起很重要的作用,FoxP3的缺乏导致CD4+、CD25+Treg细胞的缺失[36]。健脾方在CD结肠组织炎性反应初期的及早干预是否能够抑制FoxP3的降低?我们的实验中发现,大鼠结肠黏膜FoxP3 mRNA及其蛋白在经过TNBS刺激后都出现了下调,病理损伤可能和FoxP3的下调有关,健脾方灌胃3周后,对FoxP3基因和蛋白具有正向调节作用,出现的结肠组织病理损伤的程度减轻可能与健脾方干预调节有关,可上调FoxP3的表达,抑制RORγt的产生,从而抑制初始CD4+T细胞分
化为Th17细胞[37-38],表明RORγt/FoxP3平衡决定了初始CD4+T细胞受抗原刺激后向Th17细胞或Treg方向分化。
综上所述,Th17/Treg相互转化的调控机制研究深化了对IBD免疫机制的认识,并且可能为治疗IBD的研究提供新的策略。通过对细胞因子IL-17、转录因子F0XP3、RORγt的影响,健脾方能够调节Th1/Th2和Th17/Treg的平衡而恢复肠道免疫失衡状态,这可能是健脾方防治IBD的免疫调节机制之一。
参考文献
[1]Fina D,Caruso R,Pallone F,et al.Interleukin-21 (IL-21) controls inflammatory pathways in the gut[J].Endocr Metab Immune Disord Drug Targets,2007,7(4):288-291.
[2]Sartor RB,Muehlbauer M.Microbial host interactions in IBD:implications for pathogenesis and therapy[J].Curr Gastroenterol Rep,2007,9(6):497-507.
[3]Zenewicz LA,Antov A,Flavell RA.CD4 T-cell differentiation and inflammatory bowel disease[J].Trends Mol Med,2009,15(5):199-207.
[4]Ravindran R,Foley J,Stoklasek T,et al.Expression of T-bet by CD4 T cells is essential for resistance to Salmonella infection[J].J Immunol,2005,175(7):4603-4610.
[5]Globig AM,Hennecke N,Martin B,et al.Comprehensive intestinal T helper cell profiling reveals specific accumulation of IFN-γ+IL-17+coproducing CD4+ T cells in active inflammatory bowel disease[J].Inflamm Bowel Dis,2014,20(12):2321-2329.
[6]Maizels RM,Pearce EJ,Artis D,et al.Regulation of pathogenesis and immunity in helminth infections[J].J Exp Med,2009,206(10):2059-2066.
[7]Harrington LE,Hatton RD,Mangan PR,et al.Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J].Nat Immunol,2005,6(11):1123-1132.
[8]Hori S,Nomura T,Sakaguchi S.Pillars Article: Control of Regulatory T Cell Development by the Transcription Factor Foxp3[J].J Immunol,2017,198(3):981-985.
[9]Ueno A,Jijon H,Chan R,et al.Increased prevalence of circulating novel IL-17 secreting Foxp3 expressing CD4+ T cells and defective suppressive function of circulating Foxp3+ regulatory cells support plasticity between Th17 and regulatory T cells in inflammatory bowel disease patients[J].Inflamm Bowel Dis,2013,19(12):2522-2534.
[10]Zhou L,Chong MM,Littman DR.Plasticity of CD4+ T cell lineage differentiation[J].Immunity,2009,30(5):646-655.
[11]Zhou L,Lopes JE,Chong MM,et al.TGF-beta-induced Foxp3 inhibits T(H)17 cell differentiation by antagonizing RORgammat function[J].Nature,2008,453(7192):236-240.
[12]Mucida D,Park Y,Kim G,et al.Reciprocal TH17 and regulatory T cell differentiation mediated by retinoic acid[J].Science,2007,317(5835):256-260.
[13]吳婷,陳广洁. miRNA调控Th细胞分化的研究进展[J].现代免疫学,2015,35(4):334-337.
[14]Wu LY,Ma XP,Shi Y,et al.Alterations in microRNA expression profiles in inflamed and non-inflamed ascending colon mucosae of patients with active Crohn′s disease[J].J Gastroenterol Hepatol,2017,150(4):S572.
[15]Fitzpatrick LR.Inhibition of IL-17 as a pharmacological approach for IBD[J].Int Rev Immunol,2013,32(5-6):544-555.
[16]Ng SC,Lam YT,Tsoi KK,et al.Systematic review: the efficacy of herbal therapy in inflammatory bowel disease[J].Aliment Pharmacol Ther,2013,38(8):854-863.
[17]Rahimi R,Nikfar S,Abdollahi M.Induction of clinical response and remission of inflammatory bowel disease by use of herbal medicines:a meta-analysis[J].World J Gastroenterol,2013,19(34):5738-5749.
[18]Yu Z,Liu HJ,Dun HH,et al.Effect of Pulsatilla Decoction on the expression of proinflammatory cytokines in inflammatory bowel disease[J].Chinese Journal of Applied Physiology,2011,27(4):416-419.
[19]Lu SW,Liu HJ,Zhao W,et al.Molecular mechanisms involved in the treatment of inflammatory bowel disease by Pulsatilla decoction[J].Chinese Journal of Applied Physiology,2011,27(1):106-109.
[20]Morris GP,Beck PL,Herridge MS,et al.Hapten-induced model of chronic inflammation and ulceration in the rat colon[J].Gastroenterology,1989,96(3):795-803.
[21]Gomollón F.Developments in the treatment of inflammatory bowel disease: 2014 overview[J].Gastroenterol Hepatol,2014,37(3):14-21.
[22]Yue WJ,Liu Y.Research Progress of T-helper cell in the Immune Pathogenesis of Inflammatory bowel disease[J].International Journal of Digestive Diseases,2009,29(4):238-240.
[23]Fuss IJ.Is the Th1/Th2 paradigm of immune regulation applicable to IBD?[J].Inflamm Bowel Dis,2008,14(2):S110-112.
[24]Shi XZ,Winston JH,Sarna SK.Differential immune and genetic responses in rat models of Crohn′s colitis and ulcerative colitis[J].Am J Physiol Gastrointest Liver Physiol,2011,300(1):G41-51.
[25]Brand S.Crohn′s disease: Th1,Th17 or both? The change of a paradigm: new immunological and genetic insights implicate Th17 cells in the pathogenesis of Crohn′s disease[J].Gut,2009,58(8):1152-1167.
[26]Ogino H,Nakamura K,Ihara E,et al.CD4+CD25+ regulatory T cells suppress Th17-responses in an experimental colitis model[J].Dig Dis Sci,2011,56(2):376-386.
[27]Kitani A,Xu L.Regulatory T cells and the induction of IL-17[J].Mucosal Immunol,2008,1(1):S43-46.
[28]Spadoni I,Iliev ID,Rossi G,et al.Dendritic cells produce TSLP that limits the differentiation of Th17 cells,fosters Treg development,and protects against colitis[J].Mucosal Immunol,2012,5(2):184-193.
[29]Zhang H,Hu X,Liu X,et al.The Treg/Th17 imbalance in Toxoplasma gondii-infected pregnant mice[J].Am J Reprod Immunol,2012,67(2):112-121.
[30]Wang W,Shao S,Jiao Z,et al.The Th17/Treg imbalance and cytokine environment in peripheral blood of patients with rheumatoid arthritis[J].Rheumatol Int,2012,32(4):887-893.
[31]Xu J,Yang Y,Qiu G,et al.Stat4 is critical for the balance between Th17 cells and regulatory T cells in colitis[J].J Immunol,2011,186(11):6597-6606.
[32]Cua DJ,Tato CM.Innate IL-17-producing cells: the sentinels of the immune system[J].Nat Rev Immunol,2010,10(7):479-489.
[33]Sugihara T,Kobori A,Imaeda H,et al.The increased mucosal mRNA expressions of complement C3 and interleukin-17 in inflammatory bowel disease[J].Clin Exp Immunol,2010,160(3):386-393.
[34]Ivanov II,McKenzie BS,Zhou L,et al.The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper cells[J].Cell,2006,126(6):1121-1133.
[35]Huang Z,Xie H,Wang R,et al.Retinoid-related orphan receptor gamma t is a potential therapeutic target for controlling inflammatory autoimmunity[J].Expert Opin Ther Targets,2007,11(6):737-743.
[36]Hori S,Nomura T,Sakaguchi S.Control of regulatory T cell development by the transcription factor Foxp3[J].Science,2003,299(5609):1057-1061.
[37]Beissert S,Schwarz A,Schwarz T.Regulatory T cells[J].J Invest Dermatol,2006,126(1):15-24.
[38]Hatton RD.TGF-β in Th17 cell development: the truth is out there[J].Immunity,2011,34(3):288-290.
(2017-05-03收稿 責任編辑:王明)

