濒危华石斛种子活力测定方法研究
边子星 颜彩燕 姚肖健 杨福孙

摘 要 华石斛(Dendrobium sinense)为濒危附生兰,具有重要的观赏和药用价值。因其种子细小,仅具未分化的原胚,造成种子难以保存,活力丧失较快。因此,筛选出快速、准确的种子活力检测方法,是兰科种子有效保存方法探讨的重要前提。本试验通过文献查询筛选后,采用四氮石坐法(TTC)和紫外分光光度计法(UVS)进行研究,通过测定染色率以及吸光值来反映种子活力,比较其检测方法的可靠性、准确性及操作难易度。结果表明:TTC法测定保存1~30 d的种子活力比实际萌发率高0.60%,变化幅度小,最高仅为0.4%,可信度大,但实验操作较繁琐;UVS法测定的种子活力比实際萌发率高0.04%,但变动幅度相对较大,高达3.09%,精确度相对TTC法较低,但实验操作简单。
关键词 华石斛;种子活力;四氮唑法(TTC);紫外分光光度计法(UVS);吸光度
中图分类号 R282.2 文献标识码 A
Abstract Dendrobium sinense is an endangered orchid species, which has an important ornamental and medicinal value. The seed is tiny and with an undifferentiated embryo, which making it difficult to store and loss its vitality rapidly. Therefore screening of a fast, accurate methods for detecting seed viability is an important prerequisite to explore the effective preservation method of orchid seeds. An experiment using 2, 3, 5-triphenyltetrazolium chloride(TTC)and ultraviolet spectrophotometer(UVS)was studied through determined the staining rate and absorbance. The results show that: In the preservation of 1 d to 30 d, the seed viability determined using TTC had an average germination rate of 0.6% higher than the control, with a change range less than 0.4%, but the operation is complicated. However, the seed viability using UVS had an average germination rate of 0.04% higher than the control, with a large change range as high as 3.09%, but the experimental operation is simple. Conclusion: The method of TTC could accurately measure the seed viability of D. sinense, but time-consuming, and the method of UVS is simple and rapid, while the accuracy was slightly lower than that of TTC.
Key words Dendrobium sinense; seed viability; triphenyltetrazolium chloride(TTC); ultraviolet spectrophotometer(UVS); absorbance
doi 10.3969/j.issn.1000-2561.2017.03.003
种子质量的好坏直接关系到种群的发展,而种子活力又是检测种子质量的最可靠指标之一[1]。自1953年国际种子协会(ISTA)设立种子活力委员会以来,世界各国都以测定种子活力来作为检测种子质量的主要指标之一。中国郑光华把种子活力定义为种子的健壮度,包括迅速萌发的发芽潜力、生长潜力及生产潜力[2],且已被我国研究者所认可。目前种子活力主要采用四氮石坐法(TTC)、紫色分光光度计法、荧光染色法(FDA)、酸性品红(Ac)染色法、电导率法(EC)测定,而兰科植物种子以四石坐法[3-4]为主。电导率法以测定种子浸出液中可溶物浓度大小来反映种子活力强弱,该方法简便快捷[5-6],但水温、种子质量、水质等因素的影响较大,且准确性受到标准参照物的限制,因而误差较大[7]。酸性品红测定种子活力是根据种子胚细胞的原生质膜是否具有活性而判定种子活力,不易于体积小的种子[8]。荧光染色法利用荧光粉,因其能透过种皮,测定出染色种子程度,但以吸水种子且种子保存在62 ℃的条件下效果明显[9]。Gale和Yamazaki[10]研究台湾芋兰种子发现,荧光染色法测定种子活力准确度比四石坐法更好,而Batty[11]和田伟莉[8]研究澳大利亚地生兰以及腊梅植物种子得出四石坐法测定种子活力方法比荧光染色法效果更佳。在实际生产试验中,因种子种类不同,荧光特点就不同,尤其在生活力微弱与生活力丧失的两类种子之间通常由于荧光物质在量的差异上不够明显,容易造成错误的判断。四氮石坐法是国际种子协会公认的测定种子活力的标准方法[12],紫外分光光度计法(UVS)是在电导率测定法的基础上改进的方法,既避免了电导率测定法的不足且操作简便,邓娜娜[13]和鲁黎明[14]研究黑麦种子和烟草种子分别得出,UVS法测定种子活力方法简便快捷,且准确度较高,基本上不受参照物的限制,能够在很大程度上反映种子活力。
华石斛(Dendrobium sinense)是海南特有的兰科植物,具有很高的观赏价值和药用价值,同时也是我国最重要的保护植物[15]。其种子细小,种子只具有未分化的原胚,种子保存困难,不当保存,其种子活力下降较快,因此均不适合采用荧光染色、电导率以及酸性品红方法测定其种子活力。本研究通过采用TTC法和UVS法2种方法测定华石斛种子活力,以种子组织培养的发芽率为参照,比较两种方法测定结果,为准确、迅速地测定华石斛种子活力提供依据,促进兰科种子有效保存,为兰科种子保育及生产服务,也有助于华石斛后续研究。
1 材料与方法
1.1 材料
华石斛种子,于5~7月份采自五指山,海拔1 200~1 400 m,转黄将裂的成熟果荚,于室内将成熟果荚置于装有硅胶的广口瓶中于4 ℃冰箱中脱水5 d。
1.2 方法
1.2.1 种子处理 取用5~6颗脱水后的华石斛果荚,取出种子混匀,分装于4个5 mL的离心管中,离心管上口塞入脱脂棉,置于4个装有50 g硅胶的广口瓶中,并将广口瓶分别在4 ℃冰箱中保存1、10、20、30 d。
1.2.2 发芽率测定 分别称取约2 mg保存的种子放入5%次氯酸钠溶液内进行灭菌30 min,无菌水清洗3遍后配成种子悬浮液,吸取0.5 mL种子悬浮液播种。播种培养基为MS+10%椰子汁+0.5 mg/L NAA+20 g/L蔗糖+8.0 g/L琼脂,置于光照为2 000~3 000 lx,周期为14/10 h/d,温度为(25±1)℃的光照培养箱中培养[16]。每个处理3次重复,于播种20 d后每10 d时镜检,以播种50 d计算种子发芽率。
1.2.3 TTC法染色率测定 分别称取约2 mg保存的种子于5%次氯酸钙浸泡120 min,无菌水洗3次,蒸馏水浸泡24 h。去掉蒸馏水,换上1% TTC溶液黑暗浸泡24~48 h,无菌水清洗3次,最后1次留1 mL水制成悬浮液。吸0.1 mL种子悬浮液于载玻片上,在显微镜下随意观察3个视野,记录每个视野的种子总数以及胚染成红色的种子数,胚染成红色的为具有活力的种子,计算染色率[17],重复3次。
1.2.4 UVS法吸光值测定 分别称取约2 mg保存的种子,用超纯水清洗3次,然后用超纯水浸泡4、8、12、24 h,分别取其浸提液在260 nm的紫外线下进行吸光值测量,每个处理重复3次。最后,将吸光值通过回归模拟转换成相应的萌发率[14]。紫外吸光值测定所用仪器为北京产T600型紫外分光光度计。
1.2.5 数据处理 采用Excel软件及Spss软件对种子发芽率,染色率,吸光值作方差分析以及回归分析。
2 结果与分析
2.1 发芽率
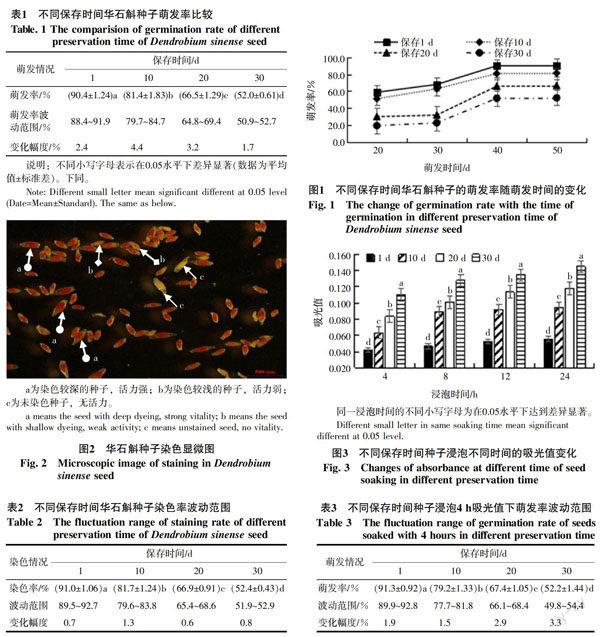
通过室内组织培养萌发试驗发现,保存1~30 d的种子平均萌发率差异显著,且随着保存时间的延长,其发芽率逐渐降低。此外,保存1 d和10 d的华石斛种子在萌发初期就表现出很高的发芽势,且在萌发40 d左右趋于稳定,而保存20 d和30 d的种子萌发初期的萌发率较小,在30 d到40 d萌发较快,与前期相比,发芽率分别增加了108.2%和129.5%,且萌发40 d后趋于稳定(图1)。同时,通过统计3次试验萌发50 d时的萌发率发现,采用室内组织培养萌发试验测得的种子活力较稳定,3次测得的种子活力变化幅度较小,且随着保存时间的延长而活力降低,表现较强的规律性(表1)。
2.2 染色率
TTC法测华石斛种子活力,活力越大,种子染色越深,保存时间越短的华石斛种子染色越深,表现出较强的活力(图2)。通过方差分析得出,保存1~30 d的华石斛种子染色率差异显著,随着保存时间的延长,染色率逐渐降低。保存1~10 d的种子染色率较高,显著高于保存20~30 d的染色率(表2)。且TTC法测定种子染色率较为稳定,染色率变化幅度小,误差仅在2%以内,结果可靠。通过与萌发率对比发现,染色率值与萌发率值接近,活力基本上在同一范围。
2.3 吸光值
UVS法测定不同浸泡时间的华石斛种子活力发现,在同一保存时间内,随着浸泡时间的延长,种子吸光值逐渐增大;同时在同一浸泡时间内,随着保存时间的延长,种子吸光值也逐渐增大,且不同保存时间种子吸光值差异显著(图3)。从紫外吸光值及变化趋势可知,UVS法测得的吸光值符合不同保存时间华石斛种子发芽率的变化规律,即华石斛种子保存时间越长,紫外吸光值越大,发芽率越低。由此通过对吸光值与萌发率进行回归模拟,将吸光值转换为相应的活力指标萌发率值,得出一个最佳模拟方程为浸泡4 h的回归方程:Y=-5.808X+1.160(Y为萌发率,X为吸光值,R=0.992),即浸泡4 h的华石斛种子紫外吸光值与萌发率之间具有较高的拟合系数,为0.992,即通过此方程将吸光值求算得出的萌发率值具有很高的可信度。将浸泡4 h的吸光值全部转换成相应的萌发率值后,统计发现浸泡4 h的华石斛种子的紫外吸光值转换后的萌发率值比较稳定,变化幅度较小,且保存1~30 d下吸光值相应的萌发率与染色率和发芽率基本上都在同一活力范围,也随着保存时间的延长,种子活力逐渐降低(表3)。
2.4 TTC法和UVS法测定种子活力的比较
为了进一步分析TTC法和UVS法在活力测定方面的优劣,通过对比各试验相应的活力指标,结果发现,TTC法测定保存1~30 d种子活力分别比发芽率试验高0.67%、0.37%、0.60%和0.77%,平均高0.60%,基本在0.6%左右,波动幅度小,误差小,结果较为可靠。而UVS法测定的种子活力比发芽率试验分别高1.00%、-2.70%、1.35%和0.39%,平均高0.04%,但波动幅度较大,误差达3.09%,即在测定不同保存时间华石斛种子活力中,UVS法比TTC法精确度低。然而,在实验操作时间上,TTC法测定种子活力耗时52 h以上,步骤繁琐,UVS法测定种子活力耗时只需4.5 h,操作简单,在活力要求不严格的情况下,采用UVS法更理想(表4)。
3 讨论
大量研究证明,萌发率及活力指数等生理指标是反映种子萌发速度、幼苗发育潜力和植株品质,能够成为判定种子活力高低的可信指标[18-19],萌发率多作为其他活力测定方法的参照标准。一般情况下,华石斛种子培养30 d左右才开始萌发,45 d左右时基本上萌发完全,在本试验中发现,不同保存时间种子在萌发40~50 d后其萌发率基本上保持不变,故取萌发50 d后的种子萌发率作为种子活力指标,且3次试验萌发率误差在4.4%以内,具有较高的准确性。利用发芽率测定种子活力准确性高,但测定时间较长。此外,在本试验中不同保存时间种子萌发率差异较大,种子活力丧失较快,说明本试验所取种子的保存方法需要进一步改进,以便能够在较长时间内保持其较高活力。
TTC法测定种子活力的原理是有活性的种胚细胞具有较高活性的脱氢酶,在呼吸作用过程中产生还原态的氢,TTC跨膜进入细胞,接收还原态的氢并与之反应生成稳定、红色的1,3,5-三苯甲酯,种胚变成红色,红色越深,种子活力越高,根据染色的位置和深浅可以确定种子活力水平[4]。所以,TTC法只会将胚染成红色,并不会将胚乳染色,因此更易于观察胚是否着色。华石斛种子体积小,无胚乳,只具有胚,采用TTC法较为合适。在本试验中,TTC法测定的不同保存时间的华石斛种子活力比实验室条件下的发芽率高0.60%,变化幅度较小,误差小,具有较高的可靠性,但在实验过程中,次氯酸钙溶度以及处理时间长短对种子活力测定会产生影响,造成染色率与发芽率产生误差,从何明高[17]测得的五唇兰结果也得到印证。通过镜检试验发现,华石斛种子保存时间越短,染色越深。本试验染色率统计按照何明高[17]对兰科种子染色计数方法,此方法受兰科种子大小及观测视野等影响,统计的染色率与实际种子发芽率间存在误差。
UVS法测定种子活力的原理为通过测定种子浸提液的紫外吸收值,判定浸提液中氨基酸等有机物的含量,从而间接地推断出种子的活力。此方法是最近几年才用于测定植物种子活力的,目前在这方面的研究还很少,研究表明,烟草种子[14]浸泡4 h,黑麦种子[13]和杜鹃花属种子[20]浸泡8 h时吸光值与发芽率有较高的相关性,具准确性高,结果稳定,操作简便快捷。在本试验中,UVS法测得的种子活力比发芽率高0.04%,变化幅度高达3.09%。华石斛种子种皮致密,难以确定其吸胀所需时间,种子达到饱和,浸出可溶物,试验发现浸泡4 h的华石斛种子吸光值与发芽率相关性最高,而8~24 h相关性较低,说明华石斛种子浸泡4 h左右时吸胀达到饱和,8~24 h后为过饱和,种子无氧呼吸对其产生毒害,使得浸出液吸光值与发芽率产生误差。因此,在对活力精度要求不严格的情况下,采用UVS法测定种子活力比TTC法更快捷,且具有一定的可靠性。但目前为止还未见到将UVS法用于兰科植物种子活力测定的研究,关于吸收值与华石斛种子活力相关性仍需要進一步研究验证。
TTC法测定华石斛种子活力具有更高的准确度、可信度,可作为精确测定种子活力的优选方法,但实验操作比UVS法繁杂,同时,为缩小其活力测定误差,筛选出合适的次氯酸钙溶度以及处理时间的研究亟待解决。UVS法测定华石斛活力误差相对TTC法较高,但方法简便,操作易行,在精度要求不严格的情况下,可作为快速测定种子活力的优选方法,同时,合适的浸泡时间对降低活力测定误差的相关研究也很有必要。
参考文献
[1] 郑光华, 顾增辉, 徐本美. 测定种子活力方法之探讨(Ⅱ)发芽的生理测定法[J]. 种子, 1982, 18(3): 11-17.
[2] 郑光华. 我国种子生理研究的概况[J]. 植物学通报, 1983, 01: 14-19.
[3] Hirano T, Godo T, Miyoshi K, et al. Cryopreservation and low-temperature storage of seeds of Phaius tankervilleae[J]. Plant Biotechnology Reports, 2009, 3(1): 103-109.
[4] Yamazaki J, Miyoshi K. In vitro asymbiotic germination of immature seed and formation of protocorm by Cephalanthera falcata (Orchidaceae)[J]. Annals of Botany, 2006, 98(6): 1 197-1 206.
[5] Silva S S, Vieira R D, Grzybowski C R S, et al. Electrical conductivity of different common bean seeds genotypes[J]. Journal of Seed Science, 2013, 35(2): 216-224.
[6] Moncaleano-Escandon J, Silva B C F, Silva S R S, et al. Germination responses of Jatropha curcas L. seeds to storage and aging[J]. Industrial Crops and Products, 2013, 44: 684-690.
[7] 石亚萍, 蔡静平. 种子发芽率快速测定方法的研究进展[J]. 中国种业, 2008, 02: 13-14.
[8] 田伟莉, 吴家森, 金水虎, 等. 3种蜡梅属植物种子活力测定方法的比较[J]. 种子, 2008, 27(4): 21-23.
[9] Pritchard H W. Determination of orchid seed viability using fluorescein diacetate[J]. PlantCell & Environment, 1985, 8(9): 727-730.
[10] Gale S W, Yamazaki J, Hutchings M J, et al. Constraints on establishment in an endangered terrestrial orchid: a comparative study of in vitro and in situ seed germinability and seedling development in Nervilia nipponica[J]. Botanical Journal of the Linnean Society, 2010, 163(2): 166-180.
[11] Batty A L, Dixon K W, Brundrett M, et al. Long-term storage of mycorrhizal fungi and seed as a tool for the conservation of endangered Western Australian terrestrial orchids[J]. Australian Journal of Botany, 2001, 49(5): 619-628.
[12] Vujanovic V, St-Arnaud M, Barabé D, et al. Viability testing of orchid seed and the promotion of colouration and germination[J]. Annals of Botany, 2000, 86(1): 79-86.
[13] 邓娜娜, 杜康兮, 周志鵬, 等. 3种方法测定黑麦种子活力的比较研究[J]. 安徽农业科学, 2012, 25: 12 410-12 411, 12 433.
[14]鲁黎明, 叶科媛, 安 影, 等. 一种快速测定烟草种子活力的方法——紫外吸收分光光度法[J]. 种子, 2009, 08: 115-117.
[15] 罗毅波, 贾建生, 王春玲. 中国兰科植物保育的现状和展望[J]. 生物多样性, 2003, 11(1): 70-77.
[16] 姜昊颖. 海南特有兰科植物华石斛共生萌发技术研究[D]. 海口: 海南大学, 2011.
[17] 何明高. 海南兰科植物种子生物学初步研究[D]. 海口: 海南大学, 2010.
[18] Sharma A D, Rathore S V S, Srinivasan K, et al. Comparison of various seed priming methods for seed germination, seedling vigour and fruit yield in okra (Abelmoschus esculentus L. Moench)[J]. Scientia Horticulturae, 2014, 165: 75-81.
[19] Wang W Q, Liu S J, Song S Q, et al. Proteomics of seed development, desiccation tolerance, germination and vigor[J]. Plant Physiology and Biochemistry, 2015, 86: 1-15.
[20] 岳 媛. 杜鹃花属植物种子育苗技术及耐热性研究[D]. 南京: 南京林业大学, 2013.

