六月雪提取物及其单体成分对LPS刺激RAW 264.7巨噬细胞分泌NO和IL—6的影响
郭培++柳航++朱怀军++丛友权++葛卫红

[摘要] 目的 研究六月雪提取物及单体对脂多糖(LPS)诱导RAW 264.7巨噬细胞的抗炎作用,确定六月雪抗炎作用活性成分。 方法 体外细胞毒性试验建立调零组、对照组、给药组,采用噻唑蓝(MTT)法检测终浓度为10、20、40、80、100、200、300、400 μg/mL的六月雪水提物,70%乙醇提取物及单体化合物对RAW 264.7细胞活性的影响;依据体外细胞毒性实验结果确定后续实验给药浓度,建立对照组、模型组、给药组,采用一氧化氮(NO)试剂盒法、酶联免疫吸附法(ELISA)检测六月雪提取物及其单体对LPS诱导RAW 264.7细胞分泌一氧化氮(NO)以及白细胞介素-6(IL-6)的影响。结果 相较于对照组,模型组RAW 264.7细胞NO表达显著升高(P < 0.05);与模型组相比,六月雪70%乙醇提取物及lyx-1、lyx-4~5能抑制NO、IL-6的分泌(P < 0.05)。结论 六月雪抗炎活性成分主要存在于70%乙醇提取物中,主要抗炎成分是丁香树脂酚、(7′S,8S,8′R)-4,4′-二羟基-3,3′,5,5′-四甲氧基-7′,9-环氧木脂烷-9′-醇-7-酮、(7R,7′R,7′R,8S,8′S,8′S)-4′,4′-二羟基-3,3′,3′,5-四甲氧基-7,9′:7′,9-双氧环-4,8′-氧-8,8′-倍半新木脂烷-7′,9′-二醇。
[关键词] 六月雪;抗炎活性;一氧化氮;白细胞介素-6
[中图分类号] R961 [文献标识码] A [文章编号] 1673-7210(2017)04(a)-0043-05
[Abstract] Objective To study the protective effect of extract from Serissa japonica on the lipopolysaccharides (LPS)-inflammatory response of macrophage cell line RAW 264.7 in mice, and to determine the anti-inflammatory active components from Serissa japonica. Methods In vitro cytotoxicity test, the block group, the control group and the medicine group were set up, the effect of aqueous extract, 70% ethanol extract and major monomer components (10, 20, 40, 80, 100, 200, 300, 400 μg/mL) on RAW 264.7 cell viability was examined by MTT assay. According to the results of in vitro cytotoxicity test, the control group, the model group and the medicine group were determined, the NO kit assay and the enzyme linked immunosorbent assay (ELISA) were adopted to detect the NO and interleukin-6 (IL-6) release of extract and major monomer components on LPS-stimulated RAW 264.7 cells. Results Compared with the control group, the expressions of NO were significantly increased in LPS-induced RAW 264.7 cells of model group (P < 0.05). Compared with the model group, 70% ethanol extract and lyx-1, lyx-4,lyx-5 could inhibit the increase of NO and IL-6(P < 0.05). Conclusion Active anti-inflammatory compositions of the Serissa japonica mainly exist in 70% ethanol extract, episyringaresinol, (7′S,8S,8′R)-4,4′-dihydroxy-3,3′,5,5′-tetramethoxy-7′,9-epoxylignan-9′-ol-7-one, (7R,7′R,7′R,8S,8′S,8′S)-4′,4′-dihydroxy-3′,3′,3′,5-tetramethoxy-7,9′:7′,9-diepoxy-4,8′-oxy-8,8′-sesquineolignan-7′,9′-diol are the major anti-inflammatory components.
[Key words] Serissa japonica; Anti-inflammatory activity; Nitric oxide; Interleukin-6
六月雪Serissa japonica (Thunb.) Thunb.是茜草科白馬骨属植物,《安徽药材》载:“与老母鸡同煮,能治慢性肾炎水肿。”《湖南药物志》载:“主治小儿惊风,腹痛,目翳,齿痛,肾炎。”《福建药物志》载:“主治久泻,水肿,颈淋巴结核,肾盂肾炎。”贵州一带民间医生用其治疗胃肠炎、肾盂肾炎、水肿、疳积、痢疾等疾病[1-2]。南京鼓楼医院制剂由荔枝草、车前草、六月雪、紫花地丁4味中药组成,用于治疗泌尿系统感染、肾盂肾炎等[3-4]。目前国内外多研究复方六月雪药的抗炎效果[5-7],对单味中药六月雪及其中单体化合物研究尚少。本研究通过LPS刺激小鼠巨噬细胞RAW 264.7构建炎症模型[8-9],探究六月雪水提物、70%醇提物及其单体的抗炎效果,考察单味药六月雪及其中单体化合物的抗炎活性,为六月雪抗炎作用提供理论基础。
1 仪器与材料
1.1试剂
DMEM高糖培养基(E500003)、胎牛血清FBS(E600001)、胰蛋白酶细胞消化液(E607001)、PBS(E607008)、青霉素-链霉素溶液(E607011)、四甲基偶氮唑盐MTT(A100793)、二甲基亚砜DMSO(A100231)购自生工生物工程(上海)股份有限公司;脂多糖LPS B5:O55(Sigma 公司,110M4086V);一氧化氮检测试剂盒(S0021)购自碧云天生物研究所;IL-6(E0049Mo)购自伯乐生命医学产品(上海)有限公司。
1.2仪器
2424-2型二氧化碳培养箱(SHELLAB);SH03014低温高速离心机(美国科俊仪器公司);CKX41SF型显微镜(日本奥林巴斯公司);SW-CJ-2D型双人单面净化工作台(苏州净化);YXQ.SG41.280型手提式压力蒸气灭菌器(上海华线医用核子仪器有限公司);ELx800光吸收酶标仪(Bio Kit);AG-245型1/万电子分析天平(METTLER TOLEDO);HY-4多用脱色摇床(江苏金坛市正基仪器厂);DW-86L626型超低温冰箱(青岛海尔特种电器有限公司)。
1.3 药材
六月雪购自南京药业股份有限公司,经南京中医药大学陈建伟教授鉴定为茜草科白马骨属六月雪Serissa japonica (Thunb.) Thunb.全草。样本保存于鼓楼医院药学部,编号:gl201410002。
2 方法与结果
2.1 六月雪的提取分离
六月雪全草100 g,用70%乙醇回流2次,每次2 h,60℃减压浓缩得到浸膏后冻干得3.0815 g[10]。取六月雪全草100 g,纯水回流2次,每次2 h,60℃减压浓缩得到浸膏后冻干得2.780 g[11]。单体化合物为70%乙醇提取物浓缩后浸膏采用高效液相提取分离,分别为丁香树脂酚、8-羟基杜仲树脂酚、8-羟基松脂酚、(7′S,8S,8′R)-4,4′-二羟基-3,3′,5,5′-四甲氧基-7′,9-环氧木脂烷-9′-醇-7-酮、(7R,7′R,7′R,8S,8′S,8′S)-4′,4′-二羟基-3,3′,3′,5-四甲氧基-7,9′:7′,9-双氧环-4,8′-氧-8,8′-倍半新木脂烷-7′′,9′-二醇,依次记做lyx-1~5。
2.2 细胞培养
采用含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM高糖培养基,将小鼠RAW 264.7细胞在37℃、5%CO2培养箱中培养,实验选用对数生长期细胞[12]。
2.3 细胞毒活性实验
胰酶消化细胞2 min后充分吹打混悬细胞,细胞密度为6×104个/mL,200 μL/孔接种于96孔板。设置调零组(培养基)、对照组(细胞+培养基)、给药组(终质量浓度为10、20、40、80、100、200、300、400 μg/mL),每组设5个复孔。将96孔板置于37 ℃、5%CO2培养箱中培养过夜,弃去原培养液,每孔加入100 μL含1 mg/mL MTT的PBS,37℃下孵化4 h,吸除MTT,每孔加入150 μL DMSO,搖床振荡10 min,490 nm处测定吸光度值,计算细胞存活率。细胞存活率(%)= (药物孔测定值-调零孔测定值)/(对照孔测定值-调零孔测定值)×100%。
2.4 一氧化氮含量测定
给药组浓度根据“2.3”实验结果确定,以细胞80%存活率浓度为实验最高浓度,逐级降低,试图得到最小有效抗炎浓度[14-16]。将RAW 264.7细胞悬液接种于48孔板,细胞密度为1×105个/mL,每孔500 μL,培养箱中培养过夜,设对照组(只加入培养液),模型组(LPS终浓度为1 μg/mL),给药组(分别为终浓度1 μg/mL的LPS+终浓度为2、10、25、50、100、200、300 μg/mL的lyx-3;终浓度1 μg/mL的LPS+终浓度为2、10、25、50、100、200 μg/mL的六月雪水提物、70%乙醇提取物、lyx-5;终浓度1 μg/mL的LPS+终浓度为2、10、25、50、100 μg/mL的lyx-1~2、lyx-4),每组4个复孔。将48孔板置于37℃、5%CO2培养箱中培养过夜后取出,吸取细胞上清液,按照NO试剂盒步骤操作,于酶标仪540 nm处测定OD值,计算NO的含量。
2.5 IL-6含量测定
RAW264.7细胞密度及加药处理方法同“2.4”。培养板放入37℃、5%CO2的细胞培养箱内培养24 h后,取培养液上清液,ELISA 法测定细胞培养上清液中细胞分泌的IL-6含量。以检测波长为450 nm在多功能微孔板分析仪上测定吸光度值。
2.6 数据统计分析
应用SPSS12.0软件进行统计学分析,实验数据以x±s表示,组间比较采用单因素方差分析,P < 0.05 认为差异具有统计学意义。
3 结果
3.1 提取分离化合物
从六月雪70%乙醇提取物中分离得到5种单体化合物[17],结构见图1。
3.2对细胞活性的影响
考察不同浓度的六月雪水提取物、70%乙醇提取物及单体成分对RAW264.7细胞增殖的影响。与对照组比较,lyx-3浓度低于300 μg/mL,水提物、70%乙醇提取物、lyx-5浓度低于200 μg/mL,lyx-1~2、lyx-4浓度低于100 μg/mL时对细胞增殖没有显著抑制或促进作用。因而,lyx-3以浓度2、10、25、50、100、200、300 μg/mL,水提物、70%乙醇提取物、lyx-5以浓度2、10、25、50、100、200 μg/mL,lyx-1~2、lyx-4以浓度2、10、25、50、100 μg/mL作为后续实验的给药浓度。
3.3六月雪提取物及单体化合物对LPS诱导细胞NO分泌的影响
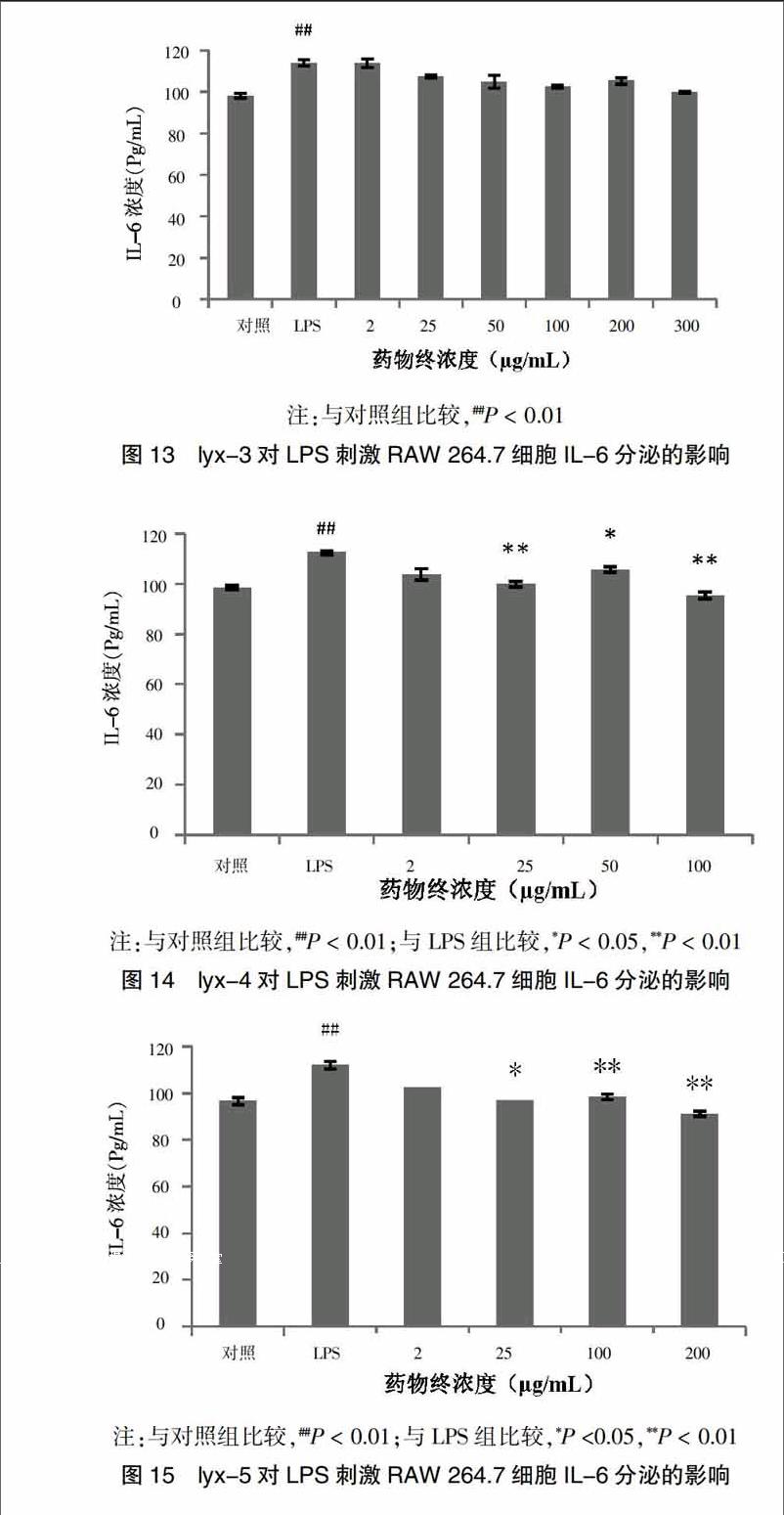
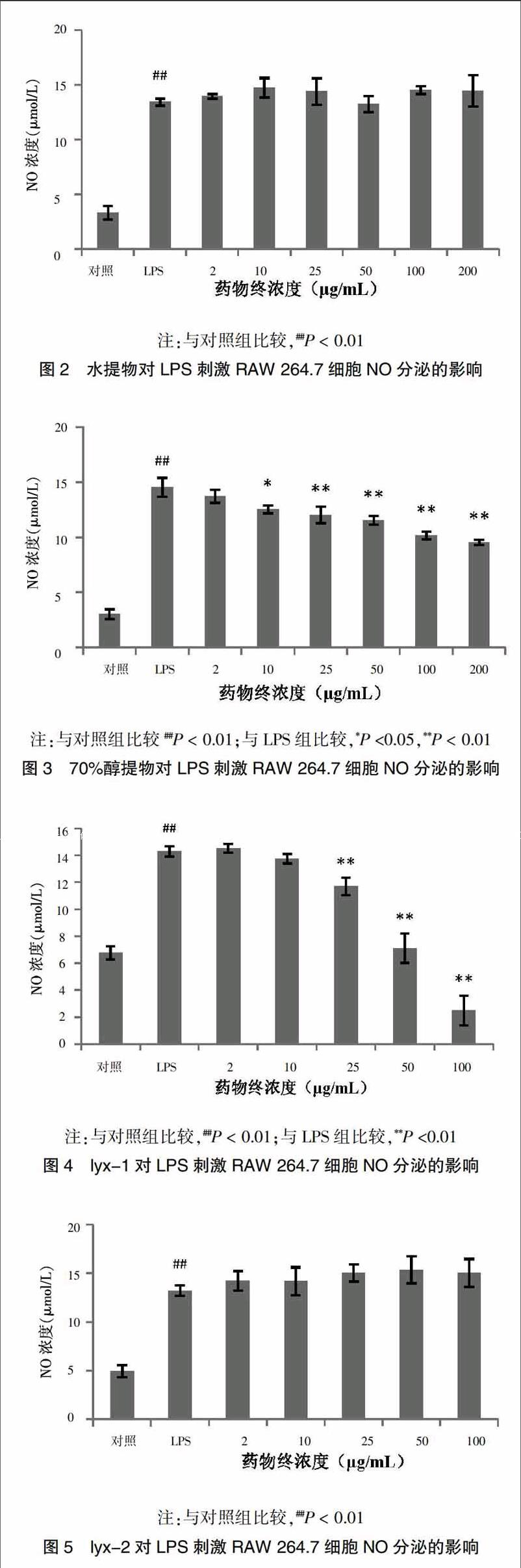
采用Griess试剂法测定六月雪提取物及单体对LPS诱导RAW 264.7细胞上清液中NO分泌的影响。与对照组比较,模型组细胞上清液NO分泌增加。相较于模型组,给予六月雪70%乙醇提取物后,25、50、100、200 μg/mL剂量组均可明显降低NO的表达(P < 0.01),六月雪水提物对NO的表达并无影响。5种单体中,仅lyx-1、lyx-4~5能抑制NO分泌,具有抗炎效果。单体化合物浓度亦会影响其抗炎效果,不同浓度各提取物及单体化合物对细胞分泌NO的影响见图2~8。
3.4 对LPS诱导细胞IL-6分泌的影响
与对照组比较,模型组细胞上清液中IL-6分泌量显著上调(P < 0.01)。与模型组比较,200 μg/mL六月雪70%乙醇提取物能显著抑制IL-6分泌(P < 0.05);而六月雪水提取物组对IL-6分泌无显著影响;lyx-1、lyx-4~5均对RAW 264.7细胞分泌IL-6有不同程度的抑制作用,而lyx-2、lyx-3对RAW 264.7细胞分泌IL-6无影响。见图9~15。
4 讨论
观察单体化合物結构发现,lyx-2~3、lyx-5基本母核一致,与lyx-1区别于8位的-OH,仅lyx-1对NO、
IL-6的分泌具有显著的抑制作用,表明8位-OH可能对药物与受体结合存在位阻,从而不能有效抗炎。由此发现取代基位置可能会直接影响单体化合物的药理活性,可以尝试结构修饰达到改善药理作用的目的。
综上,本实验从六月雪70%乙醇提取物得到5种单体化合物,并借助1H-NMR,13C-NMR等解析结构并对照文献[18-20],确定化学结构,使用LPS诱导RAW 264.7细胞建立体外炎症模型,对六月雪提取物及单体进行活性筛选。结果表明,六月雪70%乙醇提取物、丁香树脂酚、(7′S,8S,8′R)-4,4′-二羟基-3,3′,5,5′-四甲氧基-7′,9-环氧木脂烷-9′-醇-7-酮、(7R,7′R,7′R,8S,8′S,8′S)-4′,4′-二羟基-3,3′,3′,5-四甲氧基-7,9′:7′,9-双氧环-4,8′-氧-8,8′-倍半新木脂烷-7′,9′-二醇。
[参考文献]
[1] 孙响波,于妮娜. 六月雪治疗肾脏疾病探源[J].中医药导报,2013,19(10):127-128.
[2] 朱秋萍,李洪亮,范小娜. 六月雪提取物对小鼠免疫作用的影响 [J]. 赣南医学院学报,2007,27(1):11-12.
[3] Peng MM, Fang Y, Hu W, et al. The pharmacological activities of Compound Salvia Plebeia Granules on treating urinary tract infection [J].J Ethnopharmacol, 2010, 129(1): 59-63.
[4] 胡巍,方芸,彭苗苗. 雪荔复方中高车前苷在大鼠各组织中的分布研究[J]. 中国实验方剂学杂志,2013,19(10): 156-160.
[5] 张士军.复方六月雪抗乙型肝炎病毒的体内外实验研究[D].南宁:广西医科大学,2005.
[6] 欧灿纯,张士军,付书婕,等.复方六月雪对鸭乙型肝炎的保护作用研究 [J]. 时珍国医国药,2010,21(10):2528-2529.
[7] 张士军,林军,焦杨,等.复方六月雪含药血清对HepG2.2.15细胞HBV DNA的抑制作用[J].中药材,2006,29(12):1338-1339.
[8] 冯其帅,王贵芳,王强松,等.痹祺胶囊水提取物及其单体成分抗炎活性比较[J].中国实验方剂学杂志,2016, 22(3):89-93.
[9] 徐婧,崔圆圆,牛艳芬,等.木竹果树皮化学成分及其抗炎活性的研究[J].中成药,2016,38(3):579-583.
[10] 韩晶晶,柳航,郭培,等.六月雪全草的化学成分研究[J]. 中药材,2016,39(1):94-97.
[11] 马毅敏,李娜,刘承伟,等.板蓝根不同提取部位抗炎镇痛活性比较研究[J].中草药,2014,45(17):2517-2521.
[12] 许晨霞.姜黄素衍生物FM0818抗氧化及抗炎活性研究[D].福州:福建医科大学,2010.
[13] 李开莹.多枝雾水葛抗炎药效物质及作用机制研究[D]. 广州:广东药学院,2014.
[14] 朱蕴玮.复方牛黄丸的药效学研究[D]. 杭州:浙江中医药大学,2006.
[15] 郭培,柳航,朱怀军,等.六月雪木脂素成分的研究[J]. 中成药,2016,38(10):2192-2197.
[16] Quyang MA, Wein YS, Zhang ZK, et al. Inhibitory activity against tobacco mosaic virus (TMV) replication of pin?鄄oresinol and syringaresinol lignans and their glycosides from the roots of Rhus javanica var. roxburghiana [J]. Journal of Agricultural & Food Chemistry, 2007, 55(16): 6460-6465.
[17] 左月明,张忠立,李于益.杜仲叶木脂素类化学成分研究[J].时珍国医国药,2014,25(6):1317-1319.
[18] 董芬,范田运,张建新,等.杜仲叶的化学成分研究[J]. 天然产物研究与开发,2014,26(5):679-683.
[19] Hao Q, Saito Y, Matsuo Y, et al. Chalcane-stilbene conjugates and oligomeric flavonoids from Chinese Dragon′s Blood produced from Dracaena cochinchinensis[J]. Phytochemistry,?2015, 119: 76-82.
[20] Xiong L, Zhu C, Li Y, et al. Lignans and neolignans from Sinocalamus affinis and their absolute configurations[J]. J Nat Prod, 2011, 74(5): 1188-1200.
(收稿日期:2017-01-05 本文编辑:王 丽)

