红曲不同溶剂提取物的抗氧化活性
倪爱新,岳倩倩,周礼红*
(1.贵州大学 药学院,贵州 贵阳 550025;2.贵州大学 生命科学学院,贵州 贵阳 550025)
红曲不同溶剂提取物的抗氧化活性
倪爱新1,岳倩倩2,周礼红2*
(1.贵州大学 药学院,贵州 贵阳 550025;2.贵州大学 生命科学学院,贵州 贵阳 550025)
为了研究红曲霉发酵产物提取物不同极性部位的体外抗氧化活性,分别用纯水、30%乙醇对红曲进行提取,采用有机溶剂萃取法将30%乙醇提取物分为石油醚相、乙酸乙酯相和2个水相等不同极性部位,考察其ABTS自由基、DPPH自由基和脂质过氧化产物丙二醛(MDA)的清除效果,比较红曲提取物不同极性部位的抗氧化作用。结果表明,红曲的纯水、30%乙醇提取物及其不同极性部位均有抗氧化活性,且与剂量有关。不同极性部位的抗氧化活性有差异。相同浓度时,30%乙醇提取物的抗氧化性大于纯水提取物的抗氧化性,在浓度10 mg/mL时,石油醚萃取后的水相的抗脂质过氧化性最强,为57.18%,且与其他极性部位具有显著性差异(P<0.05),乙酸乙酯相的DPPH自由基清除率最高,为20.66%,乙酸乙酯萃取后水相的ABTS自由基清除率最高,为86.16%,且与其他极性部位具有显著性差异(P<0.05)。
红曲;极性;抗氧化活性;提取物;自由基
自由基是需氧细胞的正常代谢产物,大部分以活性氧(ROS)的形式存在。当机体内的活性氧与抗氧化机制处于不平衡状态时称为氧化应激。氧化应激与癌症、心血管疾病、神经退行性疾病、糖尿病和炎性疾病等有关[1]。对此可以摄取一些抗氧化物质帮助人体减少这种损伤。开发利用天然抗氧化剂已成为当今食品科学发展的趋势,如天然抗氧化剂在食用油中的应用[2]。抗氧化剂的来源有多种,蔡旋等[3]研究发现微生物源性抗氧化剂与常见抗氧化剂相比,对氧自由基及氮自由基都有较好的清除自由基作用。韩伟等[4]对5株微生物进行了体外抗氧化研究,表明具有很好的抗氧化效果。而且单一的微生物如乳酸菌本身就是有效的抗氧化物质[5]。微生物所产生的酶系物,如超氧化歧化酶、谷胱甘肽过氧化酶、NADH氧化酶等[6],具有很高的抗氧化活性,将是替代合成抗氧化剂的最佳选择之一。
红曲(Monascus)被用于传统医学、天然食用色素、食品防腐剂和膳食补充剂已有几个世纪[7]。目前,在此领域的研究主要集中在新的次级代谢产物的分离和鉴定,以及其生物活性的测定[8-10]。研究发现红曲中的酚类、色素、他汀类等都表现了较强的抗氧化活性,如从安卡红曲霉发酵分离出的Dimerumic acid具有清除自由基的能力[11]。现已有很多学者考虑如何进一步提高红曲的抗氧化能力,如在红曲发酵中添加大蒜,其发酵提取物具有抗氧化性和抗肿瘤活性[12]。侯素媛等[13]发现红曲与金钗石斛(DendrobiumnobileLindl)双向发酵产物具有较好的抗脂质过氧化活性。为此,本实验采用实验室保藏的红曲霉在一定条件下发酵并对其粗提物的抗氧化活性进行了研究。
1 材料与方法
1.1 材料与试剂
菌种红曲霉菌株3.4777由贵州大学真菌实验室选育保藏,药材金钗石斛茎购自贵州赤水金钗石斛种植基地;抗坏血酸、2-硫代巴比妥酸、七水硫酸亚铁、乙酸、十二烷基硫酸钠、正丁醇均为分析纯。DPPH(Sigma 公司),ABTS(Sigma公司)。
1.2 方法
1.2.1 培养基的制备 斜面培养基:麦芽糖5 g,蛋白胨10 g,酵母膏5 g,琼脂20 g,葡萄糖20 g,水1 000 mL,pH自然。用于培养红曲霉菌株。
种子液培养基的制备:麦芽糖5 g,蛋白胨10 g,酵母膏5 g,葡萄糖20 g,水1 000 mL,pH自然。
发酵培养基的制备。将烘干好的金钗石斛粉碎,取50 g粉碎石斛加到800 g米粉中,加入适量水混匀后装入500 mL三角瓶中,121℃灭菌20 min,用于红曲霉固体培养。
1.2.2 发酵培养方法 斜面培养:将红曲霉菌株3.457 7接种并在28℃培养7~11 d。
发酵培养:将斜面上培养好的红曲霉菌株用无菌吐温生理盐水洗下孢子,用4层无菌擦镜纸过滤除去菌丝转入带有玻璃珠的无菌三角瓶中,振荡,充分打散孢子,制成浓度为106个/mL的均一孢子悬液,吸取5 mL孢子悬液接种到种子液培养基上。在30℃、230 r/min的旋转式摇床上培养3 d得到种子液。将培养好的种子液按10%(v/v)接种到发酵组培养基上,在30℃恒温培养箱中培养10 d。
1.2.3 发酵红曲米的粗提取 纯水粗提取:取12 g发酵样品,加180 mL纯水至于250 mL三角瓶中,密封,60℃水浴提取12 h。次日对提取液进行抽滤、减压旋蒸。自然挥干后得到粗提物A。
30%乙醇提取:按纯水粗提取方法以30%乙醇为提取剂进行提取,得到自然挥干产物B。
粗提取物的萃取:溶剂石油醚萃取粗提物:发酵红曲米按30%乙醇提取提取抽滤,取抽滤液用石油醚进行3次萃取,3次上层的萃取液与3次下层的浸提液分别合并后在低于60℃下减压旋干,使溶剂自然挥干,得到剩余浸提物C和石油醚萃取物D。
溶剂乙酸乙酯萃取粗提物:取上述石油醚萃取得到的下层浸提液用溶剂乙酸乙酯进行3次萃取,3次上层的萃取液与3次下层的浸提液分别合并后在低于60℃下减压旋干,自然挥干,得到剩余浸提物E和乙酸乙酯萃取物F。
1.2.4 抗氧化活性检测样品的制备 红曲米检测样品的制备:分别称取上述样品A、B、C、D、E、F 0.25 g,用相应的溶剂溶解后定容至25 mL,此溶液的质量浓度为10 mg/mL。吸取适量10 mg/mL的溶液分别用相应溶剂稀释一倍得到质量浓度为5 mg/mL的溶液。将各溶液12 000 r/min,离心15 min,取上清液。将上清液过微孔滤膜,得到待检测液。
VC组检测样品的制备:称取0.125 g VC用蒸馏水溶解,定容至25 mL,得质量浓度为5 mg/mL的对照组。
1.2.5 抗脂质过氧化能力的测定 采用曾维才等[14]的方法测定各样品的抗脂质过氧化率。
脂质过氧化抑制率(%)=(1-实验组吸光度/空白组吸光度)×100%
式中:A空白组指以0.1 mL相应溶剂代替样品测得的吸光度。
1.2.6 清除DPPH自由基活性的测定[15]量取50 μL试样分别加入1 ml的DPPH(1 mmol/L,乙醇为溶剂),0.95 mL Tris-Hcl缓冲液(0.05 mol/L,PH为7.4),1 mL乙醇混合后避光反应30 min,在波长517 nm处测定吸光度。
清除率(%)=(A空白组-A实验组)/A空白组×100%
式中:A空白组指以50 μL相应溶剂代替样品测得的吸光度值。
1.2.7 ABTS+自由基清除实验的测定 根据肖翔等[16]的方法并稍作修改。将5 mL的ABTS(7 mmol/L)和5 mL的K2S2O8(2.45 mmol/L)溶液充分混合,在室温、避光条件下静置过夜(12~16 h),得到ABTS+储备液。将ABTS+储备液用无水乙醇稀释,用紫外分光光度计测量,使其在波长734 nm处的吸光度值为0.700±0.002,得到ABTS+工作液。取30 μL样品与3.0 mL ABTS+工作液混合,充分反应15 min,常温条件下在波长734 nm处测定吸光度值。
清除率(%)=(A空白组-A实验组)/A空白组×100%
式中:A空白组指以30 μL相应溶剂代替样品测得的吸光度。
2 结果与分析
2.1 红曲霉发酵产物提取物各极性部分的抗脂质过氧化作用
抗脂质过氧化实验模型是向反应体系中加入抗氧化物质,抑制脂质过氧化的发生,氧化分解的丙二醛及其类似物与硫代巴比妥酸反应生成粉红色产物减少,反应溶液吸光度发生改变。吸光度降低越多,抑制率越高,表明受试物的抗氧化活性越强。由图1可以看出红曲霉发酵产物提取物不同极性部位均表现出不同程度的抗脂质过氧化的能力。在相同的浓度,以30%乙醇提取物的脂质抗氧化能力最强为62.36%(10 mg/mL)、49.42%(5 mg/mL),与其他的抗脂质过氧化率均具有显著差异(P<0.05),石油醚相的最小为18.96%(10 mg/mL)、8.62%(5 mg/mL)。并且每一相的抗脂质过氧化的能力与加入的提取物的浓度有关,浓度增加,抑制率提高,如图1所示。
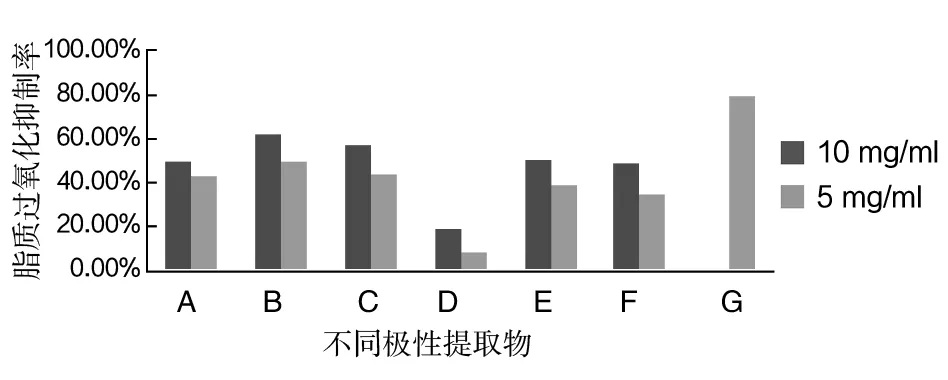
图1 不同极性提取物的抗脂质过氧化Fig.1 Inhibiting lipid peroxidation of different polar extracts
A:纯水提取物;B:30%乙醇提取物; C:石油醚提取后的水相(水相1);D:石油醚相; E:乙酸乙酯提取后的水相(水相2) ;F:乙酸乙酯相; G:维生素C
2.2 红曲霉发酵产物提取物中各极性部分对DPPH自由基的清除能力
DPPH自由基是一种稳定的以氮为中心的自由基,当DPPH溶液中加入自由基清除剂时,导致溶液颜色变浅,在517 nm处的吸光度变小则表明受试物具有降低羟自由基、烷基自由基或过氧化自由基的有效浓度和打断脂质过氧化链的作用[17]。
如图2所示红曲霉发酵产物不同极性部位对DPPH自由基均有清除能力,但是都不高,且与提取物的浓度有关,浓度增加,清除率提高。在浓度为10 mg/mL时,它们的DPPH自由基清除能力大小依次为30%乙醇>乙酸乙酯相>水相1>水相2>纯水>石油醚相,且30%乙醇与乙酸乙酯相之间差异显著性(P>0.05),如图2所示。
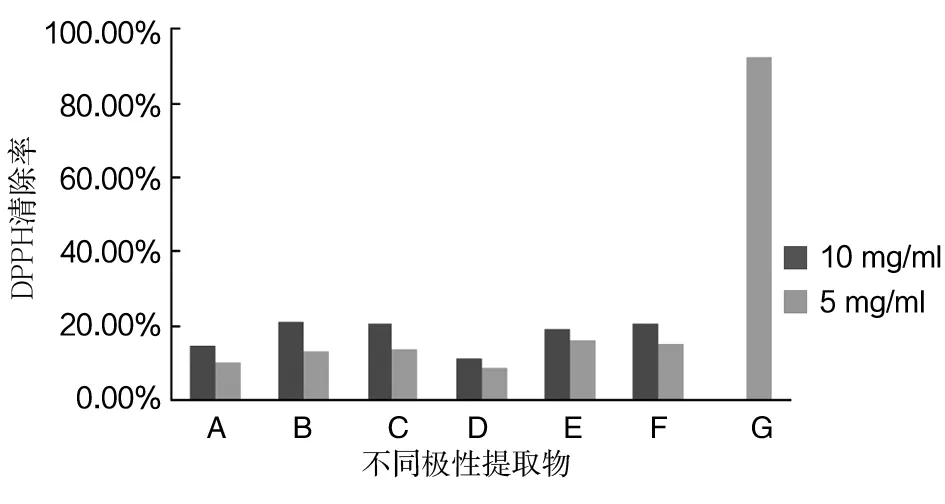
图2 不同极性提取物的DPPH清除活性Fig.2 Scavenging DPPH radical activities of different polar extracts
A:纯水提取物;B:30%乙醇提取物;C:石油醚提取后的(水相1);D:石油醚相; E:乙酸乙酯提取后的水相(水相2); F:乙酸乙酯相;G:维生素C
2.3 红曲霉发酵产物提取物中不同极性部分对ABTS自由基清除率的测定
ABTS与一定浓度的过硫酸钾避光反应12~16 h,经活性氧氧化后生成稳定的蓝绿色阳离子自由基ABTS+·。若提取物具有抗氧化活性,则会与ABTS+·发生反应而使反应体系褪色[17]。由图3可以看出,6种不同极性萃取物均具有清除ABTS+·能力且有差异,为其清除自由基或发挥抗氧化作用奠定了基础。各极性部位的ABTS+·清除力大小依次为:水相2>水相1>30%乙醇>纯水>乙酸乙酯相>石油醚相。水相2与水相1的ABTS+·清除力较大且显著大于其他相的(P<0.05)。
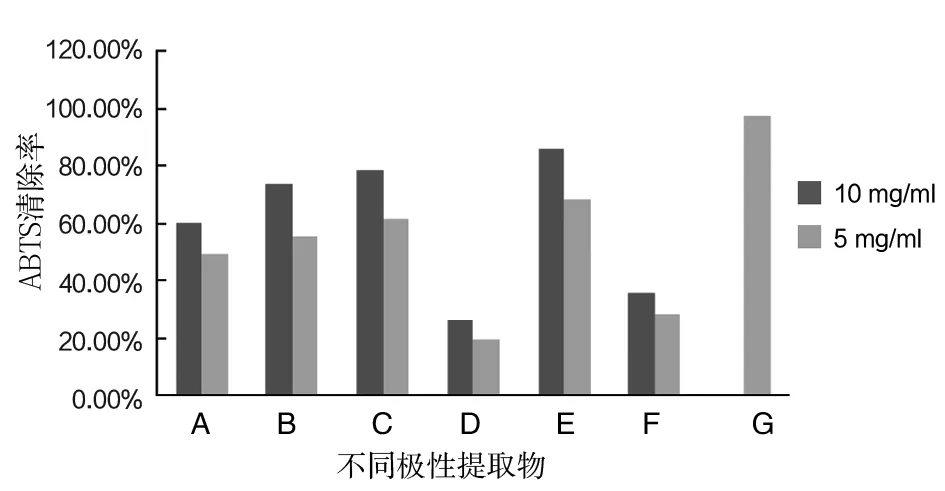
图3 不同极性提取物的ABTS自由基清除活性Fig.3 Scavenging ABTS radical activities of different polar extracts
A:纯水提取物;B:30%乙醇提取物;C:石油醚提取后的水相(水相1);D:石油醚相;E:乙酸乙酯提取后的水相(水相2);F:乙酸乙酯相;G:维生素C
3 结论与讨论
红曲霉发酵产物提取物中各极性部分均有一定的抗氧化性表明各极性部分均有一定量的抗氧化活性物,这为红曲作为抗氧化物质应用于食品来帮助人们减少氧化损伤和微生物源抗氧化物的开发利用提供了一定的依据。石油醚萃取后的水相抗脂质过氧化性最强,乙酸乙酯相的DPPH自由基清除率最高,乙酸乙酯萃取后水相的ABTS自由基清除率最高,这与所含活性物质的含量有关。
浓度为10 mg/mL时,在抑制脂质过氧化实验中,脂质抗氧化活性能力为:30%乙醇>水相1>水相2>纯水>乙酸乙酯相>石油醚相,在DPPH自由基的清除能力实验中,抗氧化活性次序为:30%乙醇>乙酸乙酯相>水相1>水相2>纯水>石油醚相,在对ABTS自由基清除率的测定中,抗氧化能力为:水相2>水相1>30%乙醇>纯水>乙酸乙酯相>石油醚相,表明相同极性部位的提取物,在不同的抗氧化体系中,其抗氧化能力也不同,在相同的抗氧化体系中,相同极性部位的提取物的抗氧化能力也存在不同,这与提取物的不同极性部位中所含主要抗氧化成分的含量、种类和结构有关,在不同的抗氧化体系中,提取物的不同极性部位的抗氧化作用不同,其对不同类型的自由基有选择性作用。在本实验中石油醚相与水相1的抗氧化性总和大于30%乙醇提取物的抗氧化活性,乙酸乙酯相与水相2的抗氧化性总和大于水相2的,可能是在总物质浓度相同时,30%乙醇与水相1中抗氧化活性物质纯度低,从而降低了抗氧化活性。在本实验中可以看出红曲霉发酵产物提取物中各极性部分的抗氧化性与浓度有关,但未做深入探索,还需进一步研究。
[1] Pisoschi A M, Pop A. The role of antioxidants in the chemistry of oxidative stress: A review[J].EuropeanJournalofMedicinalChemistry,2015(97):55-74.
[2] 李 杰, 赵声兰, 陈朝银. 食用油天然抗氧化剂的研究与开发[J]. 食品工业科技,2015,36(02):373-378.
[3] 蔡 旋, 陈小连, 杨 帆, 等. 微生物源性抗氧化剂体外抗氧化能力的初步研究[J]. 生物技术,2011,21(6):84-87.
[4] 韩 伟, 刘文群, 黄丽婵, 等. 5株微生物抗氧化作用的初步研究[J]. 食品与机械,2008,4(25):45-47.
[5] Ito M, Ohishi K, Yoshida Y,etal. Antioxidative effects of lactic acid bacteria on the colonic mucosa of iron-overloaded mice [J].JournalofAgriculturalandFoodChemistry,2003,51(15):4456-4460.
[6] Talwalkar A, Kailasapathy K, Hourigan J,etal. An improved method for the determination of NADH oxidase in the presence of NADH peroxidase in lactic acid bacteria[J].JournalofMicrobiologicalMethods, 2003,52(3):333-339.
[7] Patakova P. Monascus secondary metabolites: production and biological activity[J].JIndMicrobiolBiotechnol,2013(40):169-181.
[8] Mukherjee G, Singh S K. Purification and characterization of a new red pigment from Monascus purpureus in submerged fermentation[J].ProcessBiochemistry,2011(46):188-192.
[9] Cheng M-J, Wu M-D, Chen I-S,etal. Chemical constituents from the fungus Monascus purpureus and their antifungal activity[J].PhytochemistryLetters,2011(4):372-376.
[10] Knecht A, Humpf H-U. Cytotoxic and antimitotic effects of N-containing Monascus metabolites studied using immortalized human kidney epithelial cells[J]. Mol.NutrFoodRes,2006(50):406-412.
[11] Aniya Y, Ohtani II, Higa T,etal. Dimerumic acid as an antioxidant of the mold, Monascus anka[J].Medicine,2000(28):999-1004.
[12] Park H-J, Kim I-S. Antioxidant Activities and Anticancer Effects of Red Yeast Rice Grown in the Medium Containing Garlic[J].FoodSci.Biotechnol,2011,20(2): 297-302.
[13] 侯素媛, 周礼红, 刘 磊. 红曲金钗石斛双向发酵产品抗氧化活性的研究[J]. 安徽农业大学学报, 2015, 42(4): 600-603.
[14] 曾维才, 石 碧. 天然产物抗氧化活性的常见评价方法[J]. 化工进展, 2013, 32(6): 1205-1212.
[15] Wang B-S, Li B-S, Zeng Q-X,etal. Antioxidant and free radical scavenging activities of pigments extracted from molasses alcohol wastewater [J].FoodChemistry,2008(107):1198-1204.
[16] 肖 翔, 周立平, 马 新. 红曲菌发酵中添加紫苏叶提取物对其抗氧化活性的影响[J]. 中国酿造, 2011, 232(7): 50- 53.
[17] 杜国荣. 猕猴桃、柿和苹果果实的抗氧化能力及其抗氧化活性成分的分析[D].西安:西北农林科技大学, 2009.
Antioxidant activity of different solvent extracts fromMonascus
NIAi-xin1,YUEQian-qian2,ZHOULi-hong2*
(1.CollegeofPharmaceuticalSciences,GuizhouUniversity,Guiyang,Guizhou550025,China; 2.CollegeofLifeSciences,GuizhouUniversity,Guiyang,Guizhou550025,China)
In order to investigate the in vitro antioxidant activity of different polarity parts of extract fromMonascus, the yeast was extracted with pure water and 30% ethanol respectively. Extracts from 30% ethanol were divided by organic solvents into petroleum ether phase, ethyl acetate phase and two aqueous phases of different polarity parts. The removal effects of ABTS free radical, DPPH free radical and lipid peroxidation product, the malondialdehyde (MDA), were investigated. The antioxidant effects of different polarity parts of Monascus extracts were compared. The results showed that extracts of pure water, 30% ethanol and different polarity parts from Monascus were all observed to have antioxidant activities, and the activities are related to the extract concentration. The antioxidant activity of different polar parts is different. Under the same concentration, the antioxidant activities of 30% ethanol extract are greater than pure water extract. Under the concentration of 10 mg/mL, the extracts of aqueous phase extracted by petroleum ether had the strongest anti-lipoperoxidation inhibition ratio of 57.18%, and is significantly different from other polarity parts (P<0.05); the extracts of ethyl acetate phase had the strongest DPPH free radical ratio of 20.66%; the extracts of aqueous phase extracted by ethyl acetate had the strongest ABTS free radical ratio of 86.16% and is significantly different from other polarity parts (P<0.05).
Monascus;polarity; antioxidant activity; extract; free radical
2016-09-28;
2016-12-28
国家科技支撑计划课题(2012BAD331306)。
Q939.9
A
1008-0457(2017)01-0082-04 国际
10.15958/j.cnki.sdnyswxb.2017.01.016
*通讯作者:周礼红(1976-),女,博士,副教授,主要研究方向:微生物应用;E-mail:lhzhou33@126.com。

