EGFR,PDCD4,TGF-β1,Smad3,Smad7在中国地鼠口腔颊囊黏膜癌变过程中的表达研究
李莉红,皇甫冰,高继萍,常 凯,陈朝阳,庞文彪,宋国华
(山西医科大学实验动物中心,实验动物与人类疾病动物模型山西省重点实验室,太原 030001)
研究报告
EGFR,PDCD4,TGF-β1,Smad3,Smad7在中国地鼠口腔颊囊黏膜癌变过程中的表达研究
李莉红,皇甫冰,高继萍,常 凯,陈朝阳,庞文彪,宋国华*
(山西医科大学实验动物中心,实验动物与人类疾病动物模型山西省重点实验室,太原 030001)
目的 探讨EGFR,PDCD4,TGF-β1,Smad3,Smad7在口腔正常黏膜、上皮单纯增生、上皮异常增生和鳞状细胞癌组织中的表达及意义。方法 采用ELISA对中国地鼠口腔黏膜癌变过程中血清EGFR,PDCD4水平进行检测;采用免疫组织化学法检测正常口腔黏膜上皮,单纯增生上皮、异常增生上皮和鳞癌组织中TGF-β1,Smad3,Smad7的表达。结果 在口腔黏膜癌变过程中血清EGFR蛋白呈升高趋势,血清PDCD4的表达呈降低趋势,呈负相关。鳞癌组织中TGF-β1、Smad7表达明显高于口腔正常黏膜、上皮单纯增生、上皮异常增生(P< 0.05),而Smad3作用减弱。相关性分析显示,口腔异常增生上皮、口腔鳞癌组织中TGF-β1表达与Smad7呈正相关(P< 0.05)。结论 EGFR,PDCD4,TGF-β1,Smad3,Smad7表达与口腔鳞癌的生物学行为关系密切,本实验为研究口腔鳞癌机理研究提供了理论依据,对口腔鳞癌的发展与预后有重要意义。
口腔鳞状细胞癌;免疫组织化学;癌前病变
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC) 是一种常发生于舌、牙龈、颊部等部位的上皮源性恶性肿瘤,与其它肿瘤相似是一种多因素调节、多阶段发生和多基因参与的复杂性疾病。近年来,口腔鳞状细胞癌的发病率呈现逐年上升的趋势,同时,癌症患者的发病年龄也逐渐年轻化[1]。在我国,口腔鳞状细胞癌能够占到口腔癌的 80%以上[2]。肿块、结节、白色斑块、溃疡等是OSCC 患者中主要出现的症状[3],给患者日常生活带来了许多不便,同时对患者的心理健康造成了一定的伤害。近些年以来,在口腔鳞状细胞癌的治疗方面虽然取得了很大的突破,但是,口腔鳞状细胞癌的生存率仍然低于 50%[4],因此对其机制以及治疗的研究非常重要。
研究表明,肿瘤的形成是肿瘤细胞凋亡和增殖失去平衡的结果[5],也是原癌基因与抑癌基因表达异常的疾病。表皮生长因子受体(EGFR)的高表达和程序性细胞凋亡因子4(PDCD4)的低表达对肿瘤的增殖、预后、转移具有重要意义,并与细胞凋亡行为密切相关[6]。TGF -β信号通路的异常与肿瘤发生、发展紧密相关,在许多肿瘤中已得到证实[7-9]。Smads蛋白能使TGF -β信号从细胞外传递到细胞核,Smads缺失使TGF -β信号传导通路中断引起肿瘤发生[10]。本文将采用ELISA、免疫组化检测EGRF、PDCD4、TGF-β1、Smad3、Smad7在中国地鼠正常口腔黏膜组织、单纯增生组织、异常增生组织及口腔鳞状细胞癌组织中的表达情况,探讨其在口腔鳞状细胞癌早期诊断和治疗中所起的重要作用,为口腔癌的发展及靶向治疗的可能性、寻找新的更好的肿瘤标志物提供实验依据。
1 材料和方法
1.1 实验动物
清洁级雄性中国地鼠60只,8~10周龄,体重 24~26 g,由山西医科大学实验动物中心提供[SCXK(晋)2015-0001]。动物实验期间,动物饲养于屏障环境[SYXK(晋)2015-0001],温度控制在25℃左右,相对湿度40%~70%,12 h/12 h光暗循环条件下饲养,适应性饲养1 周后进行正式实验,严格按照山西医科大学实验动物管理委员会制定的操作规程来进行动物实验,并遵守国际惯例。
1.2 主要试剂
兔抗人、大鼠、小鼠、兔TGF-β1多克隆抗体,兔抗大鼠、小鼠Smad3、Smad7多克隆抗体,SABC免疫组化染色试剂盒,DAB显色试剂盒和3%H2O2,均购自武汉博士德生物公司;EGFR、PDCD4 ELISA检测试剂盒均购自武汉贝茵莱生物科技有限公司。
1.3 实验方法
1.3.1 口腔癌前病变和鳞癌动物模型制备
将60只雄性中国地鼠随机分为三个组:模型组(24只)、溶剂对照组(12只)、空白对照组(24只)。每周一、三、五上午9∶00将0.5%DMBA丙酮液用小头棉签涂擦在模型组中国地鼠双侧颊囊,洗耳球吹干禁食禁水2 h;溶剂对照组只涂丙酮液,涂抹方式同模型组;空白对照组不做任何处理。持续15周,最终建模成功,建模过程将颊囊病理改变按WHO标准的12项分级记录进行判定[11]。试验过程中按实验动物使用的“3R”原则给以人道主义关怀,实验处理结束后,采用符合实验动物福利的处死方法进行处理,尽量缩短处死的时间减少对实验动物的伤害。
1.3.2 酶联免疫吸附法测定所有标本血清中EGFR、PDCD4的含量
空腹地鼠眼眶静脉丛采血,血清分离后-20℃低温冰箱冻存待检,试剂盒购自武汉贝茵莱生物科技有限公司提供,均严格按说明书进行操作。酶标仪读取 450 nm 处OD 值。
1.3.3 免疫组织化学法检测颊囊组织中TGF-β1、Smad3、Smad7蛋白的表达
根据病理鉴定结果挑选口腔正常黏膜组织、上皮单纯增生组织、上皮异常增生组织及鳞癌组织用于免疫组化检测。按SABC试剂盒说明书进行操作,切片脱蜡至水,3%H2O2灭活内源性酶,微波修复抗原,5%BSA 封闭,一抗、二抗处理后,DAB 显色,苏木素轻度复染、脱水、透明、封片。显微镜观察免疫组化切片TGF-β1、Smad3、Smad7的蛋白表达情况,阳性细胞以细胞浆和/或细胞膜和/或细胞核呈棕黄色、棕褐色或弥漫性着色为准。每组3个重复,采用Image Pro Plus(IPP)图像分析软件进行半定量分析,每张切片随机选取5个完整而不重叠的高倍镜视野(×200),测定每个视野下阳性反应的平均光密度,以每例5个视野的平均光密度的平均值作为该例的测量值。平均光密度值越高说明表达越强,反映组织内含量越多。
1.4 统计分析
采用SPSS 16.0软件进行统计学分析,实验数据均用均数±标准差(±s)表示。多组均数之间比较采用单因素方差分析,方差分析中均数的两两比较选用 LSD 法,两组均数之间比较采用独立样本的t检验,相关性分析运用Pearson积差相关分析。以P< 0.05为差异有显著性。
2 结果
2.1 病理鉴定结果
空白对照组、溶剂对照组与模型组标本病理鉴定结果如表1所示。
2.2 ELISA检测中国地鼠口腔颊囊黏膜癌变过程中蛋白表达及统计分析
2.2.1 EGFR、PDCD4蛋白表达
中国地鼠血清EGFR在正常黏膜组织、单纯增生组织、异常增生组织及鳞癌组织的组间比较差异有显著性(F=27.54,P< 0.001)(见表2,图1)。鳞癌组织表达明显升高,与正常黏膜组织、单纯增生组织、异常增生组织比较差异有显著性(P< 0.001)。异常增生表达高于正常黏膜(P< 0.01)、单纯增生(P< 0.05),差异有显著性。单纯增生表达略高于正常黏膜,差异无显著性(P> 0.05)。实验结果表明,在口腔颊囊黏膜癌变过程中血清EGFR蛋白呈升高趋势。
经单因素方差分析,在正常口腔黏膜、单纯增生、异常增生及鳞癌中血清PDCD4的表达/浓度差异有显著性(F=87.75,P< 0.001)(如表2,图1所示)。正常黏膜组PDCD4水平显著高于单纯增生、异常增生及鳞癌组,正常黏膜与单纯增生之间差异有显著性(P< 0.05),其余各组两两比较差异有显著性(P< 0.001)。实验结果显示,在口腔颊囊黏膜癌变过程中血清PDCD4的表达呈降低趋势。
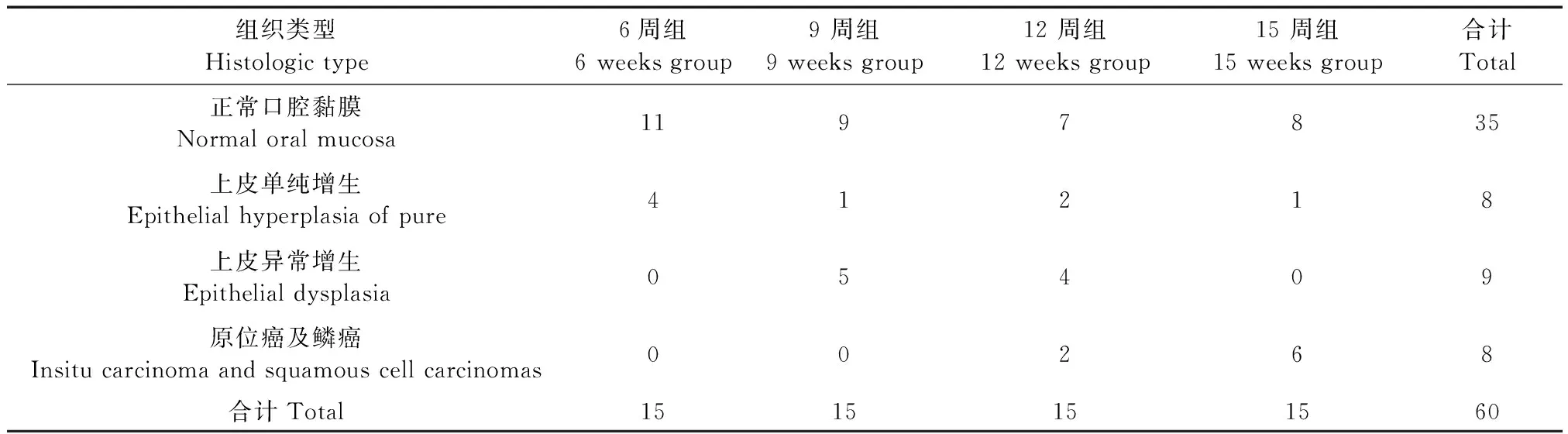
表1 各组标本病理鉴定结果
表2 口腔黏膜癌变各阶段血清EGFR、PDCD4浓度比较(±s)
Tab.2 Comparison of serum EGFR、PDCD4 in different stages of the oral mucosa carcinoma

表2 口腔黏膜癌变各阶段血清EGFR、PDCD4浓度比较(±s)
组织类型Histologictype例数NumberEGFR/ng/mLPDCD4/pg/mL正常口腔黏膜Normaloralmucosa60.57±0.08219.72±12.76上皮单纯增生Epithelialhyperplasiaofpure60.65±0.12205.37±7.45*上皮异常增生Epithelialdysplasia60.77±0.04**△182.70±6.67***☆原位癌及鳞癌Insitucarcinomaandsquamouscellcarcinomas60.98±0.07***☆★138.97±8.81***☆★
注:与对照组比较*P<0.05,**P<0.01,***P<0.001; 与单纯增生组比较△P<0.05,○P<0.01,☆P<0.001;与异常增生组比较▲P<0.05,●P<0.01,★P<0.001。
Note.Compared with the control group,*P<0.05,**P<0.01,***P<0.001; Compared with the simple hyperplasia group,△P<0.05,○P<0.01,☆P<0.001;Compared with the epithelial dysplasia group,▲P<0.05,●P<0.01,★P<0.001.
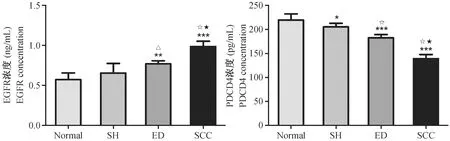
注:与对照组比较*P<0.05, **P<0.01, ***P<0.001; 与单纯增生组比较△P<0.05,○P<0.01,☆P<0.001;与异常增生组比较▲P<0.05,●P<0.01,★P<0.001。图1 口腔黏膜癌变各阶段血清EGFR、PDCD4的变化Note. Compared with the control group,*P<0.05, **P<0.01, ***P<0.001; Compared with the simple hyperplasia group,△P<0.05,○P<0.01,☆P<0.001;Compared with the epithelial dysplasia group,▲P<0.05,●P<0.01,★P<0.001.Fig.1 Changes of serum EGFR and PDCD4 of in different stages of the oral mucosa carcinoma

组织类型Histologictype例数NumberTGF-β1Smad7Smad3正常口腔黏膜Normaloralmucosa60.11±0.020.23±0.010.23±0.01上皮单纯增生Epithelialhyperplasiaofpure60.16±0.02***0.24±0.01*0.29±0.02***上皮异常增生Epithelialdysplasia60.23±0.02***☆0.29±0.01***☆0.26±0.02*○原位癌及鳞癌Insitucarcinomaandsquamouscellcarcinomas60.28±0.01***☆★0.33±0.02***☆★0.20±0.02**☆★
注:与对照组比较*P<0.05,**P<0.01,***P<0.001; 与单纯增生组比较△P<0.05,○P<0.01,☆P<0.001;与异常增生组比较▲P<0.05,●P<0.01,★P<0.001.
Note.Compared with the control group,*P<0.05,**P<0.01,***P<0.001; Compared with the simple hyperplasia group,△P<0.05,○P<0.01,☆P<0.001; Compared with the epithelial dysplasia group,▲P<0.05,●P<0.01,★P<0.001.
2.2.2 EGFR和PDCD4蛋白在口腔黏膜癌变过程中表达相关性分析
为了了解EGFR和PDCD4在口腔黏膜癌变过程中的相关关系,进一步对EGFR和PDCD4进行Pearson积差相关分析。研究表明,EGFR和PDCD4在口腔异常增生组织(r=-0.72,P< 0.05)、颊囊黏膜鳞癌组织(r=-0.92,P< 0.05)中的表达呈负相关,在单纯增生组织中无明显相关(r=-0.22,P> 0.05)。
2.3 免疫组织化学检测肿瘤相关基因在中国地鼠口腔颊囊黏膜癌变各阶段的蛋白表达
2.3.1 TGF-β1、Smad3、Smad7蛋白表达
免疫组化结果显示,TGF-β1、Smad3、Smad7蛋白阳性染色表现为不同程度的棕色或棕黄色颗粒状着色,TGF-β1阳性产物定位于上皮细胞的细胞浆中,Smad3、Smad7阳性产物弥漫表达于细胞核与细胞浆中。TGF-β1在中国地鼠正常口腔黏膜、单纯增生组织、异常增生组织和鳞癌组织中均可见阳性表达,呈逐渐上升趋势,组间比较差异有显著性(F=135.08,P< 0.001)。在中国地鼠鳞癌组织中,TGF-β1主要定位于上皮基底层、癌巢中央,着色不均匀(如图2所示),相对于少量均匀染色于上皮全层的正常口腔黏膜差异有显著性(P< 0.001)。Smad7在口腔鳞癌组织中呈强阳性表达,OD值为0.33±0.02,与Smad3正好相反。Smad3阳性细胞在正常口腔黏膜中表达最强,后缓慢下降,鳞癌组织中呈弱阳性表达,二者相比差异显著,差异有显著性(P< 0.01)(如表3,图3所示)。
2.3.2 三种蛋白表达的相关性分析
实验结果显示口腔黏膜癌变过程中TGF-β1、Smad3、Smad7均存在显著的变动趋势,我们猜想基因之间可能存在着一定的关系,共同参与了肿瘤的发生发展。进一步的相关性分析揭示在鳞癌组织中,TGF-β1表达与Smad7呈正相关(r=0.96,P< 0.05),与Smad3表达呈负相关(r=-0.65,P< 0.05)。三个基因在鳞癌组织中存在相关关系(P< 0.05)。
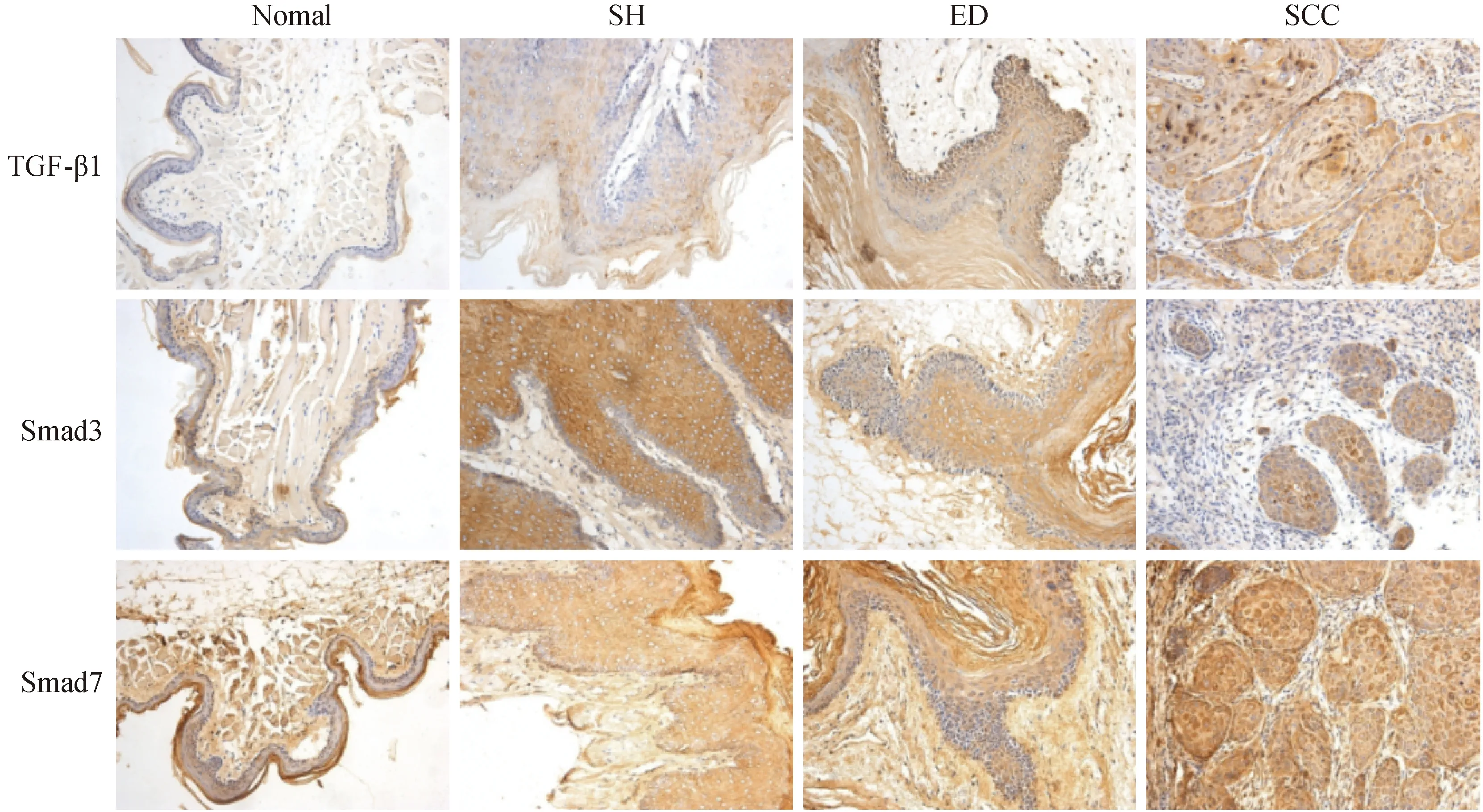
注:Normal:对照组;SH:单纯增生组;ED:异常增生组;SCC:鳞癌组。图2 TGF-β1、Smad3、Smad7的免疫组化结果(IHC×200)Note. Normal:the control group; SH:the simple hyperplasia group;ED:the epithelial dysplasia group;SCC:the squamous cell carcinoma group.Fig.2 Results of TGF-β1、Smad3、Smad7 in different stages of the carcinogenesis immunohistochemical
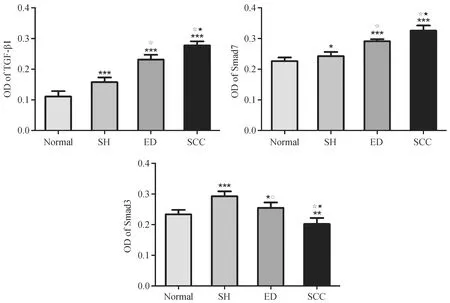
注:与对照组比较*P<0.05,**P<0.01,***P<0.001; 与单纯增生组比较△P<0.05,○P<0.01,☆P<0.001;与异常增生组比较▲P<0.05,●P<0.01,★P<0.001。图3 口腔黏膜癌变各阶段TGF-β1、Smad3、Smad7的蛋白表达Note. Compared with the control group,*P<0.05, **P<0.01, ***P<0.001;Compared with the simple hyperplasia group,△P<0.05, ○P<0.01,☆P<0.001; Compared with the epithelial dysplasia group,▲P<0.05,●P<0.01,★P<0.001.Fig.3 Expression of TGF-β1、Smad3、Smad7 in different stages of the oral mucosa carcinoma
3 讨论
口腔癌是头颈部较常见的肿瘤之一,综合治疗效果和预后较差,五年生存率低,是目前困扰临床工作者的难题之一,早期诊断和早期治疗是提高患者生存率和生存质量的关键[12]。
在肿瘤的发生和发展过程中,癌基因和抑癌基因的变化一直是研究的重点,因为各种肿瘤中都基本上能发现癌基因和抑癌基因的改变。肿瘤启动基因EGFR是一种重要的跨膜受体,是细胞传递过程中的重要物质,与肿瘤的生长、浸润、转移和预后等具有相关性[13]。EGFR表达激活会导致正常细胞增殖失控,有研究证实在多种实体肿瘤如肺癌、乳腺癌、前列腺癌、肾癌、脑胶质细胞瘤等中存在高表达或异常表达[14]。Chan KK1等研究发现在口腔癌中有EGFR过表达,认为其参与了口腔癌的发生发展[15]。冯晓宇等通过酶联免疫吸附法测定了口腔颌面部恶性肿瘤患者血清中EGFR的含量,与本研究结果一致,均发现鳞癌组血清EGFR含量明显高于正常组,提示EGFR与肿瘤增殖密切相关,对其有促进作用[16]。但研究发现,EGFR在参与肿瘤的形成过程中并不是独立完成的,是与多种细胞因子共同作用导致的。本研究联合检测了血清EGFR和PDCD4的表达水平,结果表明,二者呈负相关(r=-0.92,P<0.05)。PDCD4基因是近年发现的一种新的与细胞凋亡相关的抑癌基因,不仅调节细胞的程序性死亡,而且通过抑制蛋白转录和翻译过程抑制肿瘤细胞的生长,目前研究表明,多种肿瘤中均存在 PDCD4 表达的缺失或低表达[17]。我们猜想EGFR一方面促进肿瘤细胞增殖,另一方面通过抑制PDCD4的表达来抑制细胞凋亡,促进了肿瘤的形成。联合检测EGFR与PDCD4可提高对口腔癌早期诊断的灵敏度、特异性和准确性,具有一定辅助诊断价值。
维持口腔黏膜上皮的正常结构依赖于口腔黏膜细胞的丧失与更新的动态平衡,口腔癌产生过程中,癌细胞过度增殖或细胞凋亡受阻,癌细胞不断积累而产生癌症。转化生长因子TGF-β1是一种多功能细胞因子,参与细胞分化增殖、免疫调节、细胞凋亡、肿瘤发生及侵袭转移等多种生物学效应[18]。许多研究表明:癌细胞可抵抗TGF -β1的生长抑制,同时出现TGF-β1表达水平的增高,并与肿瘤侵袭转移有关[19]。Smads 蛋白作为 TGF-β 超家族信号从膜受体到胞核的细胞内转导分子,一旦发生异常时,阻止信号传导,导致肿瘤的发生[20]。正常生理情况下,TGF -β1信号传导中,TGF -β1与受体结合,形成二聚体,激活TGF -β1,激活的TGF -β1磷酸化Smad2和Smad3,与Smad4结合转至细胞核内,Smad3基因对原癌基因 c-myc 的转录和表达进行抑制,上调 P15 和 P21 的表达,通过P15阻止 CDK4 和 CDK6 与 cyclin D 的结合,抑制周期素 E2 以及周期素依赖激酶 2 复合物的活性,从而抑制细胞周期[21,22]。而Smad7以负反馈调节因子形式竞争性的与TGF -β1结合,阻断Smad2和Smad3磷酸化,未磷酸化的Smad2、Smad3不能与Smad4结合形成异源复合物,不能转移到细胞核内调控靶基因的转录, TGF-β 超家族信号通路被阻断,失去生长抑制的作用,最终导致肿瘤的发生、发展,可见Smad7表达的紊乱,影响细胞对TGF-β1的应答,促进细胞的恶性化进展[23]。所以Smad7具有维护TGF -β1信号通路平衡的作用。本实验显示,口腔鳞癌组织中TGF -β1表达明显高于口腔正常黏膜、单纯增生组织、异常增生组织,统计学上有显著性差异,提示TGF -β1的表达与口腔癌进展密切相关;在鳞癌组织中Smad3蛋白的表达水平低于口腔黏膜、单纯增生组织、异常增生组织,而Smad7在鳞癌组织中表达升高,二者呈负相关。Huang GW及其他学者研究发现Smad7在皮肤癌、子宫内膜癌及甲状腺癌、胃癌中呈现出高表达,Smad3表达下调[24-26]。以上结论与本研究结果相似。Smad3基因、Smad7基因作为Smad 家族的重要成员,在口腔癌组织中的异常表达都能促使TGF-β1失去抑制肿瘤细胞增殖的生物学效应,促进了肿瘤的进程。
肿瘤分子遗传学研究表明,肿瘤的发生发展是多种基因同时或先后协同作用的结果。我们进一步的分析显示,鳞癌组织中TGF-β1、Smad3、Smad7基因之间均具有一定的相关性,提示共同参与了OSCC的发生发展,为口腔癌的发病机制研究提供科学依据。
[1] Kim, E.S, W.K,etal. Chemopreben of aero digestive tract cancers [J]. Annu Rev Med, 2002, 53(9):223-243.
[2] 邱蔚六.口腔颌面外科学[M].北京:人民卫生出版社. 2010: 274.
[3] 廖汶晓, 闫怡轩, 黄艳青,等.塞来昔布增强口腔癌化疗敏感性与阻滞周期进程的相关性[J]. 南方医科大学学报, 2013, 33(6): 885-888.
[4] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013 [J]. CA Cancer J Clin, 2013, 63(1):11-30.
[5] Nayyar AS. Novel biochemical markers: early detection and prevention of malignant transformation a pilot study [J]. Acta Med Iran, 2012, 50(9): 597-602.
[6] 姚华,吴葆萱,吴求亮. EGFR在口腔粘膜鳞癌和癌前病变中的表达及意义[J]. 口腔医学, 1999, 19(1): 1-3.
[7] Katz LH, Likhter M, Jogunoori W,etal. TGF-β signaling in liver and gastrointestinal cancers[J]. Cancer Lett, 2016, 379(2):166-172.
[8] Yokokura S,Kanaji N,Tadokoro A,etal. Confluence-dependent resistance to cisplatin in lung cancer cells is regulated by transforming growth factor-beta[J]. Exp Lung Res, 2016, 26(4): 175-181.
[9] Zhu H, Luo H, Shen Z,etal. Transforming growth factor-β1 in carcinogenesis, progression, and therapy in cervical cancer[J]. Tumour Biol, 2016, 37(6): 7075-7083.
[10] 王海霞, 朱大海. Smad及其结合蛋白在TGFβ信号传导中的功能[J]. 遗传, 2003, 25(4): 479-483.
[11] WHO Collaborating Centre for Oral Precancerous Lesions. Definition of leukoplakia and related lesions; an aid to studies on oral precancer[J]. Oral Surg, 1978, 46(4): 518-539.
[12] 钟来平, 郑家伟, 张陈平,等. 口腔癌早期诊断的研究现状[J]. 中国口腔颌面外科杂志, 2007, 5 (4): 243-247.
[13] 刘士霞. p53、RAR-β2、Ki-67和EGFR在口腔鳞癌化疗前后的变化及临床意义[J]. 中国临床研究, 2015, 28 (7): 929-931.
[14] 刘祥伟,陈德滇, 周绍强. IGF-1、EGFR、Caspase-3在青年女性乳腺癌患者的表达及相关性研究[D]. 昆明医科大学, 2012.
[15] Chan KK, Glenny AM, Weldon JC,etal. Interventions for the treatment of oral and oropharyngeal cancers: targeted therapy and immunotherapy[J]. Cochrane Database Syst Rev, 2015, (12):CD010341.
[16] 冯晓宇, 邢汝东,鲁大鹏,等. 口腔颌面部恶性肿瘤患者血清中SCCA、Cyfra21-1、EGFR、CyclinD1含量的检测[J]. 北京口腔医学, 2009, 17 (6): 309-313.
[17] 孔海丽, 刘传芳. PDCD4、TGF-β1在急性髓系白血病患者骨髓中的表达及意义[D]. 山东大学, 2011.
[18] 孙维克, 戚向敏. TGF-β1在口腔扁平苔藓及鳞癌中的表达[J]. 滨州医学院学报,2011,34(6):410-413.
[19] 蔡传宝, 陶学金, 朱声荣,等. TGF-β1、Smad4和CyclinD1在口腔鳞癌中的表达和意义[J]. 口腔医学研究, 2007, 23(1): 14-16.
[20] 王秀梅, 刘成敏, 张成仁,等. 信号传导通路与肿瘤关系的研究[J]. 现代肿瘤医学, 2009, 17(8): 1568-1570.
[21] Derynck R, Zhang YE. Smad-dependent and Smad-independent pathways in TGF-beta family signalling[J]. Nature, 2003, 425(6958): 577-584.
[22] Baughn LB,Di Liberto M,Niesvizky R,etal. CDK2 phosphorylation of Smad2 disrupts TGF-beta transcriptional regulation in resistant pri-mary bone marrow myeloma cells [J]. J Immunol, 2009, 182(4): 1810-1817.
[23] Kleeff J, Ishiwata T, Maruyama H,etal. The TGF-β signaling inhibitor Smad7 enhances tumorigencity in pancreatic cancer[J]. Oncogene, 1999, 18(39): 5363-5372.
[24] Huang GW, Mo WN, Kuang GQ,etal. Expression of p16, nm23-HI, E-cadherin and CD44 gene products and their significance in nasopharyngeal carcinoma[J]. Laryngoscope, 2001, 111(8): 1465-1471.
[25] 范晓军, 赵瑞力, 胡俊兰. 喉鳞癌组织中TGF-β1、TβRⅠ、TβRⅡ和Smad7表达及相关研究[D]. 河北医科大学, 2010.
[26] 马速佳, 周志强, 吴成稳等. 人体胃癌组织中Smad3基因与Smad7基因的相关性表达及其临床意义[J]. 重庆医科大学学报, 2014, 39 (3): 378-382.
The expression of EGFR,PDCD4,TGF-β1,Smad3 and Smad7 during oral buccal mucosa carcinogenesis in chinese hamster
LI Li-hong, HUANG Fu-bing, Gao Ji-ping, CHANG-kai, CHEN Zhao-yang, PANG Wen-biao, SONG Guo-hua*
(Shanxi Medical University, Laboratory Animal Center, Shanxi Key Laboratory of Experimental Animal Science and Human Disease Animal Model, Taiyuan 030001,China)
Objective To study the expression and significance of EGFR, PDCD4, TGF-β1, Smad3, Smad7 in oral normal mucosa, oral simple hyperplasia, oral epithelial dysplasia and oral squamous cell carcinomas(OSCC). Methods Serum levels of EGFR, PDCD4 were measeured with ELISA in Chinese hamster during the oral mucosa carcinogenesis; The expressions of TGF-β1, Smad3, Smad7 in oral normal mucosa, oral simple hyperplasia, oral epithelial dysplasia and OSCC tissues were examined by immunohistochemistry. Results In the process of oral carcinogenesis,the expression level of EGFR increased significantly,while the expression of PDCD4 was decreased, the negatively correlation was evident between expression of these two proteins in ED and SCC. The expression of TGF-β1, Smad7 was higher in OSCC than in oral normal mucosa, oral simple hyperplasia, oral epithelial dysplasia(P< 0.05), while the expression of Smad3 was decreased. Further analysis showed the expression of TGF-β1 was correlated with the expression of Smad7. Conclusions The expressions of EGFR, PDCD4, TGF-β1, Smad3, Smad7 are closely related with the biological behaviors of oral squamous cell cancinoma.This experiment provides a theoretical basis for the study of oral squamous cell carcinomas mechanism research. So it has important significance for the development and prognosis of oral squamous carcinomaare.
Oral squamous cell carcinomas(OSCC); Immunohistochemistry; Drecancerous lesion
山西省实验动物专项(2014k08、2015k03)。
李莉红(1988-),女,硕士研究生,研究方向:人类疾病动物模型。E-mail: 1179407927@qq.com; 皇甫冰(1990-),女,硕士研究生,研究方向:人类疾病动物模型。E-mail: bhuangfu@hotmail.com
宋国华(1973-),女,博士,研究方向:人类疾病动物模型。E-mail: ghsongg@hotmail.com
R-33
A
1671-7856(2017) 05-0064-07
10.3969.j.issn.1671-7856. 2017.05.015
2016-09-27

