一种新型的利用DSS交联剂避免重链轻链干扰的免疫沉淀技术
张婉+陈健+陈恒玲
摘 要 抗体是含有4条多肽链的对称结构,其中两条较长的相对分子量较大的为重链,大小为55KDa,另外两条较短的相对分子量较小的为轻链,大小25KDa。在免疫沉淀技术中如果目的条带大小和重链轻链的大小一样或接近将影响实验结果的判断。本文章通过DSS 使抗体和蛋白A/G磁珠紧密交联,即使高温或还原剂作用下也不会破坏交联的结构,而高温或还原剂可以使抗体和抗原分开,从而达到SDS-PAGE 检测到的条带都是蛋白条带而没有重链轻链条带的干扰的目的。
关键词 DSS 重链 轻链 免疫沉淀
当抗原或抗原类似物侵入机体将诱导淋巴细胞尤其是浆细胞,分泌免疫球蛋白即抗体。本实验用的是实验室自制的多克隆抗体以及纯化蛋白,并且把蛋白用针剂注射至兔子身体内部,兔子在出现免疫之后会产生抗体。抗体的结构决定了抗体能够与抗原的特异性相结合。通过观察可以看出,抗体的结构图形与“Y”字母相似,分子量大小为150KDa,重链和轻链结构是由抗体在高温或还原剂作用下分解而来,在两条比较长的相对分子量中较大的是重链即H链,其分子量的具体大小是55KDa,而两条相对较短的中较小是轻链即L链,其分子量的具体大小是25KDa,“Y”两个分支的顶端含抗原的特异性结合位点,由重链和轻链共同决定。抗体具有较强而稳定的氨基酸结构,能够特异结合到抗原上,被应用到免疫沉淀,免疫荧光,免疫组化等免疫学实验技术中。
进行蛋白质与蛋白质亦或是蛋白质同遗传物质之间互补作用的方法之一就是免疫沉淀。抗体具有能够同抗原进行特异性结合的特点,灵敏度高等优点,达到确定蛋白质机在体内的完整生理特性的效果。抗体通过捕获抗原达到富集,纯化,目的蛋白或和目的蛋白相互作用的蛋白的目的。但传统的实验中如果目的蛋白与抗体的重链轻链的大小一致或接近时,将会影响实验者对结果的判断。因为传统的实验中,抗原-抗体-蛋白A/G磁珠复合物在高温或还原剂作用下分裂为抗原-抗体复合物和蛋白A/G磁珠,所以在后续的SDS-PAGE检测中的上样液含有抗体,结果中会出现抗体的重链和轻链有可能遮蔽目的蛋白条带,影响实验者对结果的判断。本实验中使用DSS交联剂使抗体和蛋白A/G磁珠紧密交联,在高温或还原剂作用下抗原-抗体-蛋白A/G磁珠复合物分裂为抗原和抗体-蛋白A/G磁珠复合物,在后续的SDS-PAGE检测中的上样液将不含有抗体,凝胶结果中避免了抗体的重链和轻链的干扰,有利于实验者对实验结果进行精确分析。
1 实验材料
1.1 主要仪器和试剂
DSS(Thermo scientific),抗体(实验室自制),蛋白A/G磁珠(Roche),NP-40蛋白裂解液(Biosharp),苯甲基磺酰(PMSF), SDS-PAGE凝胶试剂盒(博士德生物),4度超高速离心机(Thermo scientific),垂直混合仪(其林贝尔仪器公司),bio-rad蛋白电泳仪
1.2 动物材料
成熟昆明白小鼠(雄性)。
2 实验方法
2.1 提总蛋白
实验之前充分准备好各种实验用品,包括手术器械、5ml玻璃军均浆器、1.5mlEP管、1ml枪头、200ul枪头、10ul枪头实行高压灭菌,同时放在烘箱里面备用。4度离心机预冷,匀浆器放入冰盒中冰镇,配蛋白裂解液(用120mM氯化钠溶液配0.5%NP-40),1ml蛋白裂解液中加10ul,0.1mM的苯甲基磺酰,混匀,放入冰盒中。断髓法处死小鼠,取小鼠睾丸组织100mg,称量时用吸水纸尽量吸干组织表面的水分,之后转存在冰镇的里面,同时放入具有的蛋白裂解液来进行均浆,所有的操作过程都在冰上进行,把均浆全部转移至管中1.5mlEP、4度、1000*g,离心10min。同时把清至转移到新型的EP管里面,放在冰块上面备用。
2.2 蛋白A/G磁珠与抗体结合
准备实验试剂,配置溶液Ⅰ (0.01M中性磷酸盐溶液)。对蛋白A/G进行震荡,使得磁珠能够完全混到液体内部,便于液体的吸取,并且吸取混匀的50ul液体至1.5mlEP里。1000*g、4度、离心1min,去除上清。使用200ul溶液进行磁珠的清洗,1000*g、4度、离心1min,之后进行磁珠两次的重复清洗振荡蛋白A/G磁珠瓶子,使磁珠充分混匀到。去除上清,往EP管内加入90ul溶液Ⅰ 和10ul一抗溶液。将EP管固定在垂直混合仪上,以合适的转速使溶液混匀,在室温状态下孵育一个小时。在孵育之后,1000*g、4度、离心1min。弃去上清,EP管内加入200ul溶液Ⅰ清洗磁珠,此时抗体已和磁珠结合,1000*g、4度、离心1min。再次对磁珠进行两次的清洗。
2.3 DSS交联蛋白A/G磁珠和抗体
准备实验试剂,配置2.5mM的DSS溶液,溶液Ⅱ0.1M,ph2.0。除去上述EP管内的上清,加入32ul溶液Ⅰ和18ul 2.5mM的DSS溶液,將EP管固定在垂直混合仪上以合适的转速使溶液混匀,是室温状态下孵育一个小时。在结束相关交联之后,1000*g、4度、离心1min。弃去上清,用50ul溶液清洗珠子,1000*g、4度、离心1min。之后对磁珠进行两次清洗。除去上清,运用蛋白解液进行磁珠的清洗,1000*g、4度、离心1min。在结束清洗之后,除去上清,EP管放在冰上备用。
2.4 蛋白和一抗孵育
将2.1中提取的蛋白即上清加入到含有已经交联一抗的蛋白A/G磁珠的EP管中即2.3的EP管中。将EP管固定于垂直混合仪上,以合适的速度旋转,4度,过夜。
2.5 10%SDS-PAG凝胶检测
实验之前充分准备好实验过程中需要的试剂,并进行电泳液的配置,tris-base 3.03g、18.77g氨基酸、1g sds,在充分溶解之后,使用蒸馏水对其。同时进行配置,0.25g的(R250)、50ml甲醇50ml,10ml的冰醋酸,在完全溶解之后,使用蒸馏水进行定容达到100ml。配置10%分离胶,蒸馏水2.7毫升,30%丙烯酰胺(29:1)3.3毫升,3.8ml的1MTris-hcl PH8.8、100微升的浓度为10%的SDS ,以及100微升的浓度为10%的过硫酸铵,在混匀之后添加4微升的TMEMD ,混匀,灌入已测漏的垂直玻璃板内,用蒸馏水液封。室温聚合30分钟。把上面运用在液封方面的蒸馏水倒去。同时配置浓度为5%的浓缩胶、2.7ml的、0.67ml浓度为30%的丙烯酰胺,0.5ml的1Mtris-hclPH6.8、40微升浓度为10%的SDS,在与40微升的浓度为10%的过硫酸铵搅匀之后,加入TMEMD 4微升,混匀,灌入垂直玻璃板内,在整个玻璃板被灌满直至溢出的时候插入数字,室温状态下聚合半小时。
将上述样品即2.4中蛋白抗体蛋白A/G磁珠复合物进行离心,1000*g、4度、离心1min。去上清液,加入200ul的蛋白裂解液往EP管中清洗磁珠,所进行的离心条件是1000*g、4度、离心1min。之后对磁珠进行两次的重复清洗。去除上清,加入40ul溶液Ⅱ洗脱抗原,在室温保持五分钟。1000*g、4度、离心1min,收集上清,加入20ul溶液Ⅱ洗脱抗原,室温5分钟。将收集的洗脱液12000*g 4度 离心10min。将洗脱液转移至新的EP管内(尽量不要吸到珠子)。往60ul洗脱液中加入15ul的5*loading buffer,混匀备用,往含有40ul磁珠的EP管中加入10ul的5*loading buffer混匀备用。将两个EP管在沸水中煮8分钟。含洗脱液的EP管12000*g,4度,离心2分钟,收集上清备用。
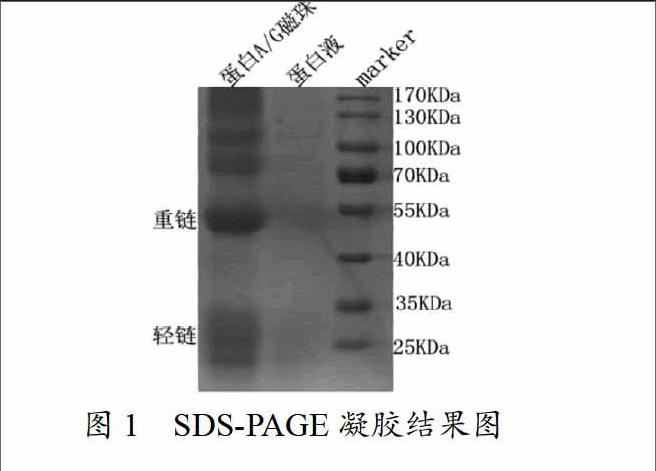
把放电泳槽内部,同时倒进去电泳液,轻轻拔下梳子,进行点样,点样顺序marker,煮沸的洗脱液即蛋白液,蛋白A/G磁珠。电泳条件,30v,60分钟后电压调至80v,保持2.5个小时。在结束电泳之后,把凝胶取出并放在玻璃皿里面,并把其倒入溶液里面进行染色,将玻璃皿转移到摇床上,合适的转速染色,时间40分钟。在染色之后把染色液收回,运用凝胶脱色:将凝胶放在打的玻璃器皿中并加入自来水,之后放进微波炉里进行高温加热,七分钟之后换水,再次依据上面的条件进行脱色,直到凝胶上面出现清晰的条带。在结束脱色之后,对其进行拍照,实现实验结果的保存(图1)。切下的目的条带可以进行后续质谱鉴定。
从图1中可以看出抗体的重链轻链出现在蛋白A/G磁珠泳道,蛋白A/G磁珠和抗体在DSS作用下紧密交联,蛋白液泳道是没有重链和轻链的,说明DSS交联剂成功避免了重链轻链对目的蛋白条带的干扰。
3 结果与讨论
从实验结果中看出,抗体的重链和轻链出现在蛋白A/G磁珠泳道中而未出现在抗原液泳道中,说明DSS交联剂可以有效避免抗体的重链轻链对实验结果的干扰。免疫沉淀是以抗体与抗原特意性结合为基础研究蛋白相互作用的经典方法。研究蛋白质间的相互作用对解释疾病的机制如肿瘤异质性和药物的研发如抗体药具有重要意义。DSS交联的免疫沉淀方法能够避免重链轻链干扰,希望能为科研学者提供一个新思路。综上所述,本实验的优点可以分为以下三点:DSS交联剂能够成功避免免疫沉淀中抗体的重链轻链对实验结果的干扰;DSS交联剂与其他方功法如使用试剂盒(pierce)相比较,样品可以进行后续的质谱鉴定,为开展功能试验打下基础;DSS交联剂溶液配置方便,使用简单,与使用实验盒相比较极大地降低了实验成本。
*通讯作者:陈恒玲
参考文献
[1] 贾慧娜,罗海玲.多克隆抗体制备方法的研究进展[J].中国草食动物科学,2012:66-69.
[2] Mierendorf R C,Morris B B,Hammer B,et al.Expression and purification of recombinant proteins using the pET system[J].Methods in Molecular Medicine,1998.13:257-292.
[3] 郭曉强.埃德尔曼:发现抗体结构的科学家[J].科学源流,2014.66(6):49-52.
[4] Domenico Ribatti.Edelmans view on the discovery of antibodies[J].ELSEVIER,2015(164):72-75.
[5] 张春舒.抗原化抗体在免疫学中的应用[J].广州医学院学报,2014.32(1):93-95.
[6] 郭纯.免疫共沉淀技术的研究进展[J].中医药导报,2007.13(12):87-89.
[7] 翟曜耀,刘晓霞,魏秀芳.免疫沉淀技术的最新进展[J].现代生物医学进展,2010.10(10):1997-2000.
[8] 于莉娜,钟雪云,陈运贤,刘致中,秦艳芳,王冰,杜彬.免疫共沉淀法用于肿瘤异质性研究的可行性分析[J].免疫学杂志,2004.20(1):58-61.

