复发性阿弗他溃疡患者可溶性程序性死亡受体1及可溶性程序性死亡配体1表达与免疫功能的相关性
江南 罗亮 刘莉 孙小琴 姜星 蔡扬
贵州医科大学附属口腔医院牙周黏膜科,贵阳 550004
复发性阿弗他溃疡患者可溶性程序性死亡受体1及可溶性程序性死亡配体1表达与免疫功能的相关性
江南 罗亮 刘莉 孙小琴 姜星 蔡扬
贵州医科大学附属口腔医院牙周黏膜科,贵阳 550004
目的 了解复发性阿弗他溃疡(RAU)患者血清中可溶性程序性死亡受体-1(sPD-1)、可溶性程序性死亡配体-1(sPD-L1)蛋白表达与患者免疫功能状态的相关性,探讨sPD-1/sPD-L1在RAU免疫发病机制中的作用及意义。方法 研究对象为30例RAU患者(轻型18例,重型5例,疱疹型7例)及18例健康人(对照组)。采用流式细胞术检测RAU患者外周血细胞免疫指标(CD3+、CD4+、CD8+、CD19+、CD16++56+),散射比浊法检测RAU患者体液免疫指标(IgG、IgA、IgM、C3、C4),酶联免疫吸附测定RAU患者及健康人血清中sPD-1、sPD-L1蛋白表达,并对sPD-1、sPD-L1表达水平与RAU患者免疫功能状况及临床特征的相关性进行分析。结果 与正常值相比,RAU患者CD4+水平降低,IgM水平增高,差异有统计学意义(P<0.05)。RAU患者的sPD-1及sPD-L1蛋白表达水平高于对照组(P<0.05);进一步分析表明,轻型、重型RAU患者的sPD-1及sPD-L1蛋白表达水平高于对照组(P<0.05),而疱疹型RAU患者与对照组无统计学差异(P>0.05)。RAU患者sPD-1表达量与CD19+、C4存在正相关关系(r1= 0.389,P1=0.034;r2=0.382,P2=0.037)。结论 RAU患者以细胞免疫功能低下为主,同时伴有体液免疫功能的紊乱;RAU患者sPD-1、sPD-L1蛋白高表达在一定程度上通过影响PD-1/PD-L1信号通路参与RAU免疫机制的调节,可能在RAU的免疫发病机制中起着一定作用。
复发性阿弗他溃疡; 可溶性程序性死亡受体1; 可溶性程序性死亡配体1; 免疫
复发性阿弗他溃疡(recurrent aphthous ulcer,RAU)是最常见的口腔黏膜疾病,临床表现为口腔黏膜上周期性复发性的溃疡性损害。RAU的发病与遗传、免疫、环境、感染等多种因素有关,其中免疫因素被认为与该病的发生尤为密切[1],但具体发病机制目前仍不清楚。程序性死亡受体1(programmed death-1,PD-1)为免疫抑制分子,属于CD28家族成员的Ⅰ型跨膜蛋白,主要表达于外周CD4+、CD8+T细胞、自然杀伤细胞(natural killer cell,NK)、巨噬细胞、B细胞及其树突状细胞表面,PD-1在无功能的T细胞上也呈高表达[2]。PD-1可抑制B细胞受体的刺激性信号,从而降低B细胞活化[3]。程序性死亡配体1(programmed death ligand 1,PD-L1)是PD-1的配体,属于B7超家族成员,广泛表达于活化的T细胞、B细胞,以及树突状细胞、巨噬细胞、间充质干细胞和培养的骨髓来源的肥大细胞[4]。PD-L1的生物学作用为通过与PD-1分子结合,并活化其胞内段ITIM基序,传递正向信号,负性调节T细胞的活化和功能。PD-1/PD-L1是目前免疫学分子领域研究的热点,其可以协助激活T细胞,又可以通过负性协同刺激信号下调免疫反应。近期研究表明,PD-1、PD-L1除了膜结合型外,还存在可溶性形式,即:可溶性PD-1(soluble programmed death-1,sPD-1)和可溶性PD-L1(soluble programmed death ligand 1,sPD-L1)。研究发现,sPD-1能高亲和力结合PD-L1,阻断PD-L1/PD-1的相互作用,从而增强T细胞的免疫效应[5];sPD-L1则可与T细胞表面PD-1受体相结合负性调控T淋巴细胞免疫应答,抑制T细胞增殖[6]。它们在多种免疫性疾病发生、发展中发挥重要的调节作用。目前已有新药CT-011和MDX-1106通过阻断PD-1而实现了对PD-L1/PD-1相互作用的抑制,从而增强T细胞的免疫效应来达到抗肿瘤的效果[7]。
本研究通过了解RAU患者血清中sPD-1、sPD-L1蛋白表达情况,并分析其与RAU患者免疫功能状态的相关性,探讨sPD-1/sPD-L1在RAU免疫发病机制中的作用及意义。
1 材料和方法
1.1 研究对象
病例选自2012年9月—2013年9月间就诊于贵州医科大学附属医院口腔内科黏膜病专科门诊初诊为RAU的患者30例(RAU组)。其中,男性14例,女性16例;年龄16~72岁,平均年龄(44.03±1.58)岁。按RAU的临床分型标准[1],其中轻型18例,重型5例,疱疹型7例。纳入标准:1)符合RAU临床诊断(参考卫生部规划教材《口腔黏膜病学》 第 4 版);2)溃疡频繁发作病史半年以上(溃疡复发频率每月至少 1 次);3)本次溃疡发作不超过 72 h,并未进行过局部及全身治疗。排除标准:1)患者1 个月内使用过抗生素,3个月内使用过免疫制剂;2)伴有全身系统性疾病(糖尿病、心血管疾病、肝炎、精神病等)或免疫性疾病者;3)有牙龈炎、牙周炎或其他口腔黏膜疾病者;4)月经期、妊娠期妇女。
对照组18例,均为来自于贵州医科大学附属医院体检中心的年龄、性别与RAU组匹配的健康人。
所有的研究对象均被告知研究内容并签署知情同意书。
1.2 主要设备及试剂
流式细胞仪、6色TBNK检测试剂盒(BD公司,美国),特定蛋白分析系统(Beckman Coulter公司,美国),酶标仪(BIO-RAD公司,美国 ),免疫球蛋白G/A/M检测试剂盒、补体C3/C4 检测试剂盒(贝克曼库尔特实验系统苏州有限公司),人sPD-1、sPD-L1酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(上海创祥生物科技有限公司)。
1.3 实验方法
1.3.1 免疫检测 采集RAU组患者空腹状态下清晨9点前外周静脉血两管,一管抗凝血(3 m L)送至贵州医科大学附属医院中心实验室,采用流式细胞术检测患者外周血细胞免疫指标(CD3+、CD4+、CD8+、CD19+、CD16++56+);另一管非抗凝血(5 m L)送至贵州医科大学附属医院微生物免疫实验室,采用散射比浊法检测患者体液免疫指标(IgG、IgA、IgM、C3、C4),收集上清夜-80 ℃冻存备用,都由相应实验室完成。以实验室标准值为正常对照。1.3.2 sPD-1、sPD-L1蛋白表达 采用ELISA检测RAU组患者及对照组健康人血清中sPD-1和sPD-L1水平,按照说明书进行操作。sPD-1、sPD-L1标准品的浓度依次为0、15、30、60、120、240 pg·m L-1。以空白孔调零,利用酶标仪读取450 nm吸光度(A)值,根据绘制的标准曲线计算待测血清中sPD-1和sPD-L1的浓度。
1.4 统计学处理
采用SPSS 19.0软件进行统计学分析,资料统计描述用均数±标准差或中位数(四分位间距)表示,两组之间差异比较采用独立样本t检验或秩和检验,sPD-1、sPD-L1表达水平与RAU患者免疫功能状况及临床特征的相关性分析采用Pearson或Spearman相关分析,P<0.05认为差异有统计学意义。
2 结果
2.1 免疫检测结果
流式细胞术检测结果表明,RAU组患者CD4+水平低于正常值,差异具有统计学意义(P<0.05)(表1);散射比浊法检测结果表明,RAU患者IgM水平高于正常值,差异具有统计学意义(P<0.05)(表2)。
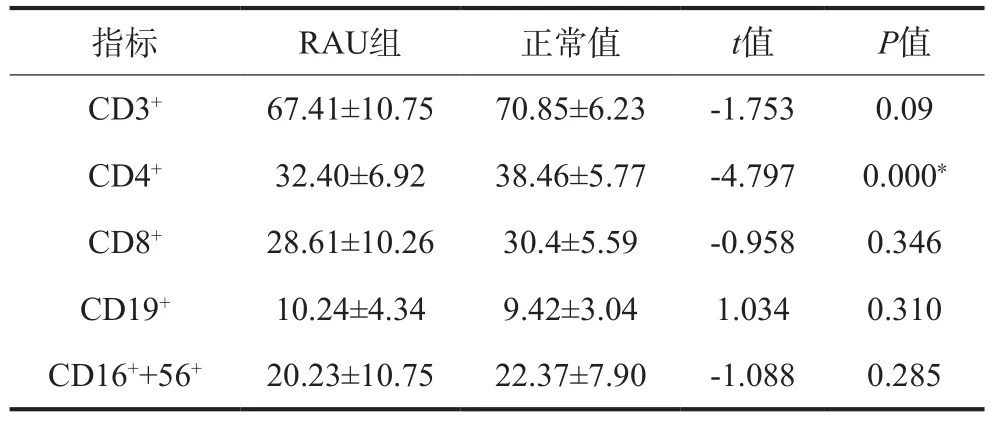
表 1 RAU患者细胞免疫检测结果Tab 1 Cellular immune test results in patients with RAU
2.2 sPD-1、sPD-L1蛋白的表达情况
ELISA检测结果(图1)表明,对照组sPD-1、sPD-L1分布较为集中,未见极端值,整体呈正态性分布趋势;RAU组sPD-1、sPD-L1整体呈非正态性分布,其中30例中有3例(2例轻型、1例疱疹型)升高趋势较为明显,RAU患者外周血血清中sPD-1、sPD-L1表达水平较对照组总体上表现为升高趋势,但个体之间存在着差异。秩和检验分析表明,RAU患者的sPD-1及sPD-L1蛋白表达水平高于对照组,差异有统计学意义(Z1=-2.794,P1=0.005;Z2=-2.834,P2=0.005)。
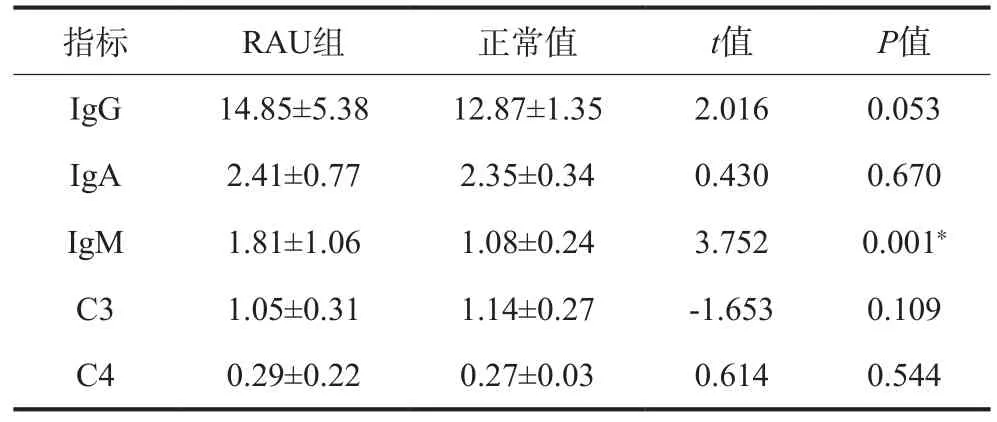
表 2 RAU患者体液免疫检测结果Tab 2 Humoral immune test results in patients with RAU
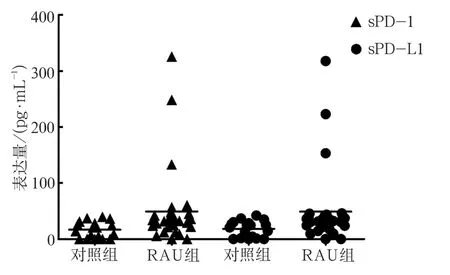
图 1 RAU患者血清中sPD-1、sPD-L1蛋白的表达Fig 1 Expression of sPD-1, sPD-L1 protein in patients with RAU
进一步分析RAU不同临床类型间的sPD-1及sPDL1的表达,结果显示轻型、重型RAU患者的sPD-1及sPD-L1蛋白表达水平高于对照组,差异具有统计学意义(P<0.05),而疱疹型RAU患者与对照组无统计学差异(P>0.05)(表3)。
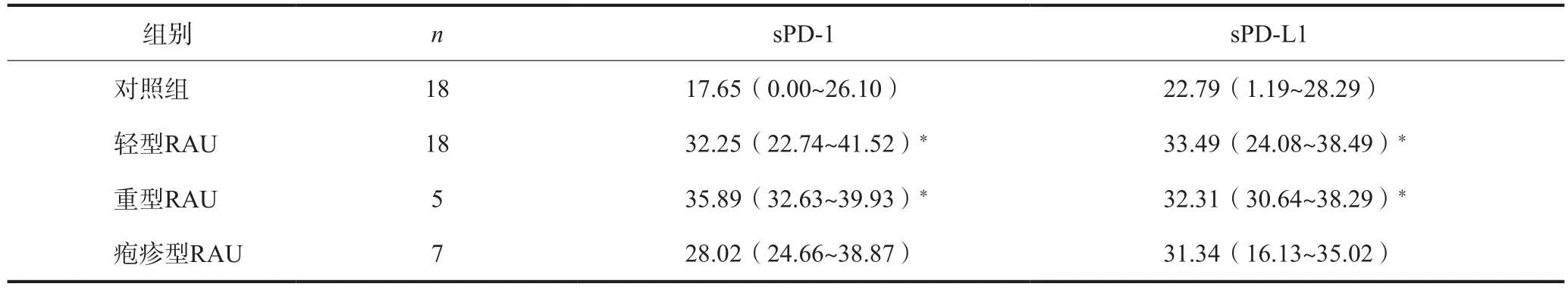
表 3 不同临床类型RAU患者血清中sPD-1及sPD-L1蛋白的表达水平Tab 3 Expression level of sPD-1, sPD-L1 protein in RAU patients with different clinical features pg·m L-1
2.3 RAU患者sPD-1、sPD-L1表达量与免疫指标的相关性分析
Spearman相关分析表明,RAU患者sPD-1表达量与CD19+、C4存在正相关关系(r1=0.389,P1=0.034;r2=0.382,P2=0.037);但sPD-L1表达量与细胞免疫和体液免疫指标均无相关关系(表4)。
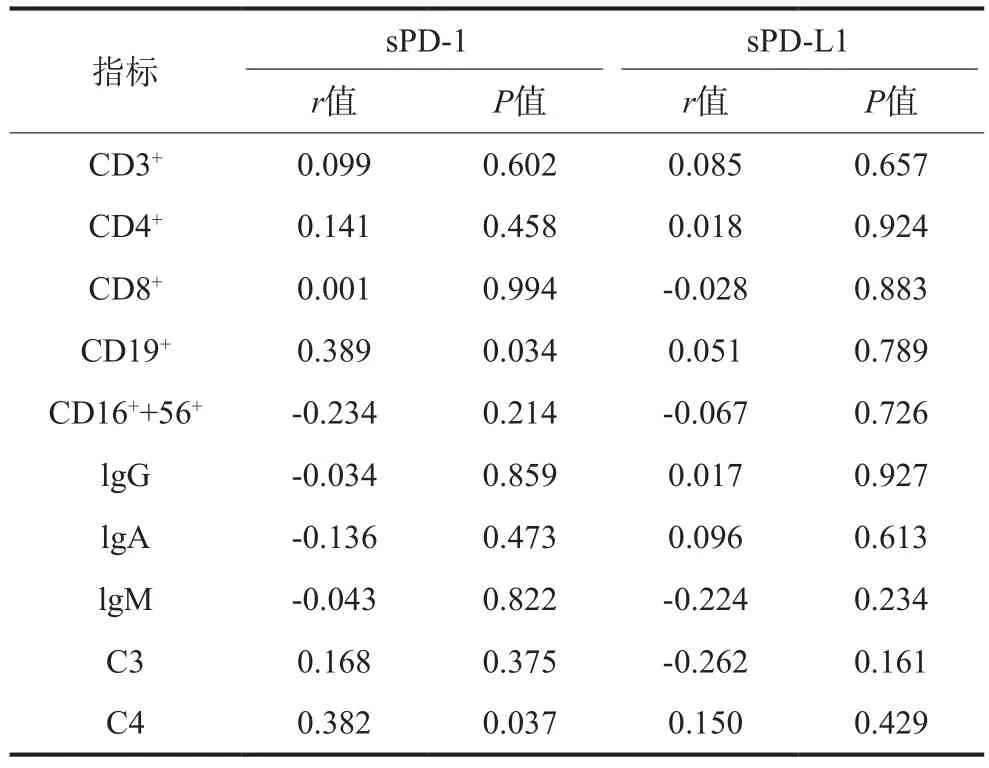
表 4 RAU患者sPD-1、sPD-L1与免疫指标的相关性分析T ab 4 The correlate analysis between the expression of sPD-1, sPD-L1 and the immune system of RAU patients
3 讨论
RAU是最常见的口腔黏膜疾病,是一种局限口腔黏膜的溃疡性损害,患病率20%左右[1]。RAU具有周期性、复发性、自限性、灼痛明显等特点,给患者带来了很大的痛苦。RAU的病因及发病机制不明,推测其发生可能是机体在受到各种可疑致病因素如细菌、病毒或精神心理因素、激素的改变、生活不规律等的刺激下引发的异常免疫反应,致使口腔黏膜上皮局部发生免疫性的损伤、坏死而形成溃疡。目前认为RAU患者免疫调节失衡是其发生的重要原因。机体免疫中,T淋巴细胞亚群主管细胞免疫,是细胞免疫的主力军[8],其功能主要取决于T淋巴细胞总值(CD3+)及其亚群(CD4+、CD8+)的相对组成。在本研究中RAU患者以CD4+降低最为明显,提示在RAU的发作期,患者的细胞免疫功能处于低下状态,这与其他学者[9]的研究结果一致。免疫功能低下很可能会导致机体对外来致RAU的抗原或者是超抗原的抵御能力变弱。体液免疫是通过B淋巴细胞产生的特异性免疫球蛋白来实现的,免疫球蛋白(Ig)可分为五类,即IgG、IgA、IgM、IgD、IgE。其中,IgM在免疫球蛋白中相对分子质量最大,是初次体液免疫应答中抗感染的“先锋部队”,通过与补体结合,可起到溶解细菌和溶解血细胞的作用。C3、C4是补体系统中含量最多、最重要的一个组分。在本研究中,与正常值相比,RAU患者IgM升高,提示患者体液免疫功能处于增强状态。以上结果提示RAU发作期机体免疫状态是不正常的,不仅有细胞免疫的低下,而且还有体液免疫功能的增强。
协同刺激分子家族的新成员PD-1/PD-L1是目前免疫学分子领域中研究的热点,PD-1/PD-L1共刺激信号通过抑制下游细胞信号转导通路,导致细胞周期停滞在G0/G1期,抑制T细胞增殖和细胞因子分泌,负性调控免疫应答,在维持免疫耐受中起重要作用[10-11]。正常生理调节下适量的PD-1/PD-L1信号通路能抑制T细胞增殖及细胞因子产生,从而调节T、B细胞的相互作用,限制自身反应性T细胞效应功能和靶器官的损害[12],保护外周组织不受自身免疫对机体的攻击;但如果PD-1/PD-L1通路提供的负信号强度过强,又会过度地抑制T细胞的增殖、活化,从而导致细胞免疫功能缺陷。sPD-1与PD-L1或者sPD-L1与PD-1结合都能够影响PD-1/PD-L1信号通路,发挥免疫抑制作用。本研究结果显示,RAU患者血清中sPD-1、sPD-L1水平均高于正常。推测,一方面可能由于RAU患者体内异常升高的sPD-1过多的与PD-L1结合阻断了T淋巴细胞表面的PD-1与单核细胞、组织细胞等表面的PD-L1的结合,进而活化的CD4+T细胞逃避了PD-1/PD-L1的负性调控信号,导致T细胞持续活化、增殖,对自身抗原产生持续的免疫应答,发生自身组织损伤。另一方面可能由于RAU患者体内sPD-L1的异常增多与PD-1发生结合,使得抗原提呈细胞(antigen presenting cell,APC)细胞膜表面的PD-L1与T、B细胞表面的PD-1发生相互作用的频率、概率显著降低,进而活化T细胞不能及时获得足够强度的负性调控信号,导致T细胞过度活化增殖,对自身抗原引起持续的免疫反应,发生自身组织损伤[13]。本研究还进一步分析了RAU不同临床类型间的sPD-1及sPD-L1的表达,结果显示,轻型、重型RAU的sPD-1及sPD-L1蛋白表达水平都高于对照组(P<0.05),而RAU疱疹型与对照组差异无统计学意义,这可能与本研究疱疹型样本量小有关。对RAU患者细胞免疫和体液免疫与sPD-1水平的相关性进行分析,结果显示,sPD-1蛋白的高表达与RAU细胞免疫中CD19+、体液免疫中C4存在正相关关系(P<0.05)。加之上述免疫结果已经表明,RAU细胞免疫中CD4+细胞减少,RAU患者处于细胞免疫功能低下状态。这提示:sPD-1的高表达可能促使RAU患者的体液免疫功能增强。其原因可能是sPD-1能够参与血液循环,它们既能够影响邻近细胞又能够和远端细胞表面的受体相互结合,其发挥作用的广度和深度甚至超过了细胞膜表面的分子。研究[14-15]表明sPD-L1促使细胞周期停滞于G1期并促进T淋巴细胞的凋亡,这与本研究中RAU患者的实际免疫结果相符合。因此,sPD-1、sPD-L1分子可能都参与了RAU疾病的发生。
综上所述,本研究中RAU患者以细胞免疫功能低下为主,同时还伴有体液免疫功能的增强,且外周血中sPD-1和sPD-L1蛋白表达水平增高。sPD-1的高表达与CD19+、C4存在正相关关系,说明sPD-1蛋白的表达异常,其可能在一定程度上通过影响PD-1/ PD-L1信号通路抑制RAU的细胞免疫,同时诱发RAU的体液免疫增强,在RAU免疫发病机制中起着一定的作用,但其具体的作用机制尚有待进一步的研究证实。
[1] 陈谦明. 口腔黏膜病学[M]. 北京: 人民卫生出版社, 2012: 64-67.
Chen QM. Oral mucosal diseases[M]. Beijig: People’s Medical Publishing House, 2012:64-67.
[2] Freeman GJ, Wherry EJ, Ahmed R, et al. Reinvigorating exhausted HIV-specific T cells via PD-1-PD-1 ligand blockade[J]. J Exp Med, 2006, 203(10):2223-2227.
[3] Okazaki T, Maeda A, Nishimura H, et al. PD-1 immunoreceptor inhibits B cell receptor-mediated signaling by recruiting src homology 2-domain-containing tyrosine phosphatase 2 to phosphotyrosine[J]. Proceed Natl Acad Sci, 2001, 98(24): 13866-13871.
[4] Keir ME, Butte MJ, Freeman GJ, et al. PD-1 and its ligands in tolerance and immunity[J]. Annu Rev Immunol, 2008, 26:677-704.
[5] 贺兰湘, 张桂梅, 贺宇飞, 等. sPD-1封闭PD-L促进抗肿瘤免疫的机制研究[J]. 中华微生物学和免疫学杂志, 2006, 26(5):463-467.
He LX, Zhang GM, He YF, et al. Mechanism of antitumor immunity of PD-L blockade with sPD-1[J]. Chin J M icrobiol Immunol, 2006, 26(5):463-467.
[6] Shi B, Du X, Wang Q, et al. Increased PD-1 on CD4+CD28-T cell and soluble PD-1 ligand-1 in patients with T2DM: association with atherosclerotic macrovascular diseases[J]. Metabolism, 2013, 62(6):778-785.
[7] 季枚. PD-L1在非小细胞肺癌中表达的生物学作用及临床意义[D]. 苏州: 苏州大学, 2016.
Ji M. Clinical significance of PD-L1 expression in human non- small-cell lung cancer and the study of its biological function[D]. Suzhou: Suzhou University, 2016.
[8] Momin S, Flores S, Angel BB, et al. Interactions between programmed death 1 (PD-1) and cytotoxic T lymphocyte antigen 4 (CTLA-4) gene polymorphisms in type 1 diabetes [J]. Diabetes Res Clin Pract, 2009, 83(3):289-294.
[9] 张华昌, 范小平, 向学熔, 等. 复发性阿弗他溃疡患者的T淋巴细胞免疫因素的研究[J]. 重庆医学, 2010, 39(10): 1239-1240.
Zhang HC, Fan XP, Xiang XR, et al. Relationship between recurrent aphthous ulcer and immune factor of T lymphocyte [J]. Chongqing Med, 2010, 39(10):1239-1240.
[10] Nurieva RI, Liu X, Dong C. Yin-Yang of costimulation: crucial controls of immune tolerance and function[J]. Immunol Rev, 2009, 229(1):88-100.
[11] Keir ME, Liang SC, Guleria I, et al. Tissue expression of PD-L1 mediates peripheral T cell tolerance[J]. J Exper Med, 2006, 203(4):883-895.
[12] Bhadra R, Gigley JP, Khan IA. PD-1-mediated attrition of polyfunctional memory CD8+T cells in chronic toxoplasma infection[J]. J Infect Dis, 2012, 206(1):125-134.
[13] Okazaki T, Wang J. PD-1/PD-L pathway and autoimmunity [J]. Autoimmunity, 2005, 38(5):353-357.
[14] 赵瑾. 可溶性PD-L1分子对T淋巴细胞功能的影响及其机制[D]. 苏州: 苏州大学, 2015.
Zhao J. Effect of soluble programmed death ligand 1 on regulating the function of T lymphocytes and its mechanism [D]. Suzhou: Suzhou University, 2015.
[15] 王师, 罗龙龙, 吕明, 等. PD-1/PD-L1信号通路及其在肿瘤中的应用[J]. 国际药学研究杂志, 2015, 42(2):143-147.
Wang S, Luo LL, Lü M, et al. PD-1/PD-L1 signaling pathway and its application in tumor[J]. J Int Pharm Res, 2015, 42(2):143-147.
(本文编辑 李彩)
Soluble programmed death-1 and soluble programmed death ligand 1 protein expression and immune status in patients
with recurrent aphthous ulcer
Jiang Nan, Luo Liang, Liu Li, Sun Xiaoqin, Jiang Xing, Cai Yang. (Dept. of Periodontal and Oral Mucosal Diseases, The Affiliated Stomatological Hospital of Guizhou Medical University, Guiyang 550004, China)
Supported by: The National Natural Science Foundation of China (81460104). Correspondence: Cai Yang, E-mail: caiyang85 @163.com.
ObjectiveThis study aims to investigate the possible role and significance of soluble programmed death-1 (sPD-1) /soluble programmed death ligand 1 (sPD-L1) in the immune pathogeneses of recurrent aphthous ulcer (RAU). Methods A total of 30 RAU cases (18 cases of m inor RAU, 5 cases of major RAU, and 7 cases of herpetiform ulcers) were enrolled in this study. A total of 18 healthy people served as controls. Lymphocyte subsets (CD3+, CD4+, CD8+, CD19+, and CD16++56+) were investigated by flow cytometric analysis. Humoral immunity (IgG, IgA, IgM, C3, and C4) was explored by nephelometry immunoassay. The sPD-1 and sPD-L1 protein levels in the sera of RAU patients were investigated by enzyme-linked immunosorbent assay. The correlations of the sPD-1 and sPD-L1 protein levels with the immune status and clinical characteristics of the RAU patients were analyzed by SPSS 19.0.ResultsThe number of CD4+T cells decreased and the levels of IgM antibodies increased in the RAU patients relative to those in the normal controls (P<0.05). The sPD-1 and sPD-L1 protein levels in the RAU patients were significantly higher than those in the control group (P<0.05). Meanwhile, the sPD-1 and sPD-L1 protein levels in the patients with minor and major RAU were significantly higher than those in the control group (P<0.05). By contrast, no significant difference was found in the patients with herpetiform RAU (P>0.05). Positive correlations were noted between the sPD-1 protein level and the CD19+cell frequency or C4 level (r1=0.389, P1=0.034;
r2=0.382, P2=0.037).ConclusionCellular immune hypofunction and humoral immunity disorders were found in the RAU patients. The PD-1/PD-L1 signaling pathway, which m ight be influenced by the involvement of sPD-1 and sPD-L1 proteins to a certain extent, may play some roles in the immune pathogenesis of RAU.
recurrent aphthous ulcer; soluble programmed death-1; soluble programmed death ligand 1; immune
R 781.5
A
10.7518/hxkq.2017.03.011
2016-09-11;
2016-12-09
国家自然科学基金(81460104)
江南,硕士,E-mail:344248851@qq.com
蔡扬,教授,博士,E-mail:caiyang85@163.com

