饲料中亮氨酸和异亮氨酸交互作用对牙鲆消化酶及免疫相关酶活力的影响
王莉苹,姜志强,孙梦蕾,司滨,韩雨哲,陈飞,暴宁(大连海洋大学水产与生命学院,农业部北方海水增养殖重点实验室,辽宁省北方鱼类应用生物学与增养殖重点实验室,辽宁大连116023)
饲料中亮氨酸和异亮氨酸交互作用对牙鲆消化酶及免疫相关酶活力的影响
王莉苹,姜志强,孙梦蕾,司滨,韩雨哲,陈飞,暴宁
(大连海洋大学水产与生命学院,农业部北方海水增养殖重点实验室,辽宁省北方鱼类应用生物学与增养殖重点实验室,辽宁大连116023)
为研究饲料中亮氨酸(Leucine,Leu)和异亮氨酸(Isoleucine,Ile)的交互作用对牙鲆Paralichthys olivaceus肠道消化酶及肝脏免疫相关酶活力的影响,以含50%全鱼蛋白牙鲆幼鱼饲料中氨基酸组成为参考,设2个Leu水平(分别占饲料干物质的2.58%和5.08%),并将其分别与3个Ile水平(分别占饲料干物质的1.44%、2.21%和4.44%)交互制成6种试验饲料(LL-LI、LL-MI、LL-HI、HL-LI、HL-MI、HLHI);以初始体质量为(2.69依0.04)g的牙鲆为研究对象,将其随机分为6个组,每个处理组设3个重复,分别投喂含不同Leu和Ile水平的上述6种试验饲料;60 d的流水养殖试验结束后,测定牙鲆肠道消化酶(蛋白酶和脂肪酶)及肝脏免疫相关酶(总抗氧化能力T-AOC、过氧化氢酶CAT、超氧化物歧化酶SOD、酸性磷酸酶ACP、碱性磷酸酶AKP)活力。结果表明:高Ile饲料组肠道消化酶活力显著高于中间水平Ile饲料组(P<0.05),且饲料中高水平的Leu可降低肠道消化酶活力(LI组除外);在低Leu处理组,当Ile逸2.21%时,随着饲料中Ile含量的增加,肝脏中CAT、SOD、ACP和AKP活力显著提高(P<0.05);但在高Leu处理组,当Ile逸2.21%时,CAT、SOD和AKP活力随饲料中Ile水平的升高显著降低(P< 0.05)。研究表明,Leu和Ile间存在交互作用,并显著影响牙鲆肠道消化酶及部分肝脏免疫相关酶活力,且在低Leu(2.58%)水平与高Ile(4.44%)水平(LL-HI饲料组)交互作用下,牙鲆肠道消化酶及肝脏免疫相关酶活力均为最高。
亮氨酸;异亮氨酸;交互作用;牙鲆;消化酶
亮氨酸(Leucine,Leu)和异亮氨酸(Isoleu-cine,Ile)作为鱼类必需的两种支链氨基酸(Branched chain amino acid,BCAA),具有调节蛋白质代谢、增强免疫力等生理功能[1]。Leu是BCAA中唯一的生酮氨基酸,对调节内分泌、免疫机能和增强营养等方面发挥着至关重要的生物学作用[2]。作为生糖兼生酮氨基酸,Ile是合成动物体激素和酶类的原料,具有促进蛋白质合成和抑制其分解之功效[3],在生命活动中发挥着重要作用。
牙鲆Paralichthys olivaceus隶属于蝶形目、鲆科、牙鲆属,是远东地区(包括中国、日本和韩国[4-5])重要的养殖品种。作为中国重要的海水经济鱼类[6],对其与BCAA关系的研究却非常有限[7-8]。水产动物可以通过摄取食物来调节体内消化酶及免疫酶活力。孙玉轩[9]发现,饲料中适宜的Leu及Ile水平可显著提高吉富罗非鱼胃蛋白酶、脂肪酶等消化酶活力及非特异性免疫能力。石亚庆等[10]研究表明,在饲料中添加适宜的Leu可提高罗非鱼的消化酶活性。这表明在饲料中添加一定水平的BCAA可以影响水产动物消化及免疫酶的活性。目前,对牙鲆体内消化酶及非特异性免疫酶活性的探讨并不充分[11-12],BCAA的交互作用对牙鲆体内消化酶及免疫相关酶活性的研究尚未见报道。饲料中适宜含量的BCAA可提高牙鲆的生长性能[7],因此,探讨BCAA交互作用对牙鲆体内酶活性的影响具有重要意义。本试验中,以牙鲆为研究对象,通过在饲料中添加不同水平的Leu和Ile,研究了这两种氨基酸间的交互作用对牙鲆体内消化酶及部分免疫相关酶活力的影响,旨在为深入研究BCAA及其在饲料中的科学利用提供理论依据。
1 材料与方法
1.1 材料
试验用牙鲆鱼苗购于大连鹤圣丰养殖场。
1.2 方法
1.2.1 试验饲料试验饲料以酪蛋白、明胶、鱼粉、晶体氨基酸(CAA)为蛋白源,以鱼油和大豆卵磷脂为脂肪源,配制成6种包含不同Leu和Ile水平的饲料(表1)。根据配方以2个Leu水平(分别占干物质的2.58%和5.08%)与3个Ile水平(分别占干物质的1.44%、2.21%和4.44%)交互(6种饲料中的Leu与Ile水平是参考含50%全鱼蛋白质饲料中的氨基酸比例而配制[7])制成6组试验饲料:低水平Leu分别与低水平Ile(LLLI)、中间水平Ile(LL-MI)和高水平Ile(LLHI)组合,高水平Leu分别与低水平Ile(HLLI)、中间Ile(HL-MI)和高水平Ile(HL-HI)组合。饲料中CAA混合物的添加是为了提供符合牙鲆50%全鱼蛋白饲料中(表2)的最适氨基酸含量[7-8](除Leu和Ile),其添加量参考已知牙鲆对氨基酸需求量研究[7,13-14]配制,并采用双包被技术防止CAA溶失[4,7,14-16]。饲料中天冬氨酸和谷氨酸的含量以保持各处理组的饲料等氮[7,14]为前提,随饲料中Leu和Ile含量的变化而变化。所有的饲料原料在搅拌器中混合均匀,用小型颗粒饲料制粒机将每组饲料挤压成两种规格(椎=1.8mm和椎= 0.9 mm),制得的饲料颗粒在烘箱(40益)中烘干,于冰箱(-20益)中保存待用。试验饲料的氨基酸组成见表3。
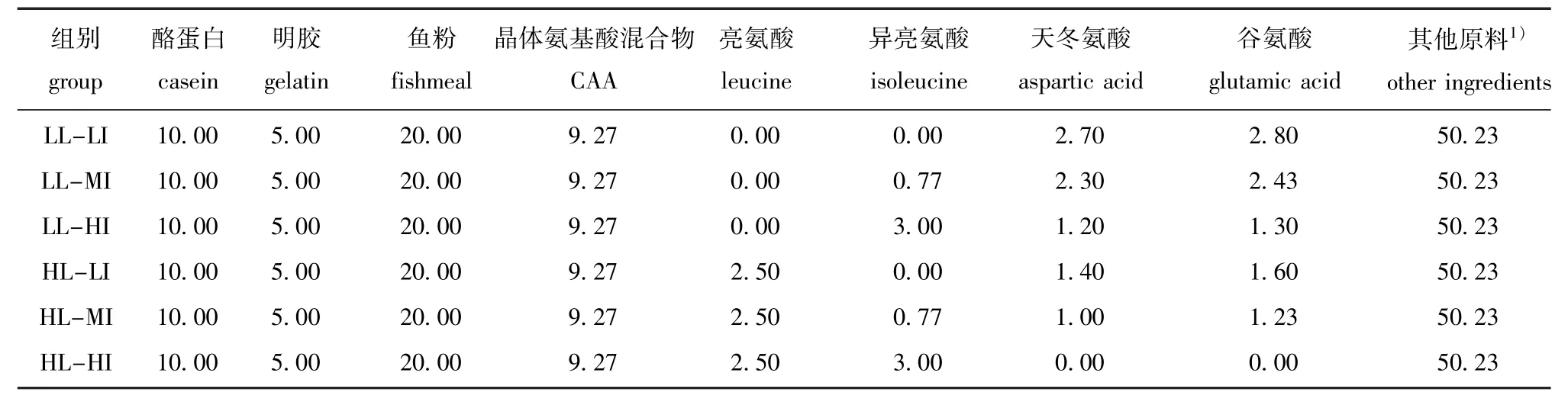
表1 试验饲料组成(干物质基础)Tab.1Com position of the experimental diets(dry matter basis)w/%
注:1)其他原料(g/100 g饲料)包括鱼油5.00、大豆卵磷脂5.00、琢-淀粉14.80、琢-纤维素16.03、羧甲基纤维素4.40、卡拉胶2.50、维生素混合物0.75、矿物质混合物0.75、诱食剂1.00。其中,维生素混合物为每千克预混料提供:维生素A 1 000 000 IU、维生素D3300 000 IU、维生素E 4000 IU、维生素K31000 mg、维生素B12000 mg、维生素B21500 mg、维生素B61000 mg、维生素B125 mg、烟酸1000 mg、维生素C 5000mg、泛酸钙5000 mg、叶酸100 mg、肌醇10 000 mg、载体葡萄糖及水臆10%;矿物质混合物为0.025 mg/g预混料提供:氯化钠107.79、七水硫酸镁380.02、二水磷酸氢钠241.91、磷酸二氢钾665.20、二水磷酸钙376.70、柠檬酸铁82.38、乳酸钙907.10、氢氧化铝0.52、七水硫酸锌9.90、硫酸铜0.28、七水硫酸锰2.22、碘酸钙0.42、一水硫酸钴2.77;诱食剂为牛磺酸和甜菜碱,按1颐1构成,购自上海生物工程有限公司
Note:1)other ingredients(g/100 g diet):fish oil 5.00,soybean lechithing 5.00,琢-starch 14.80,琢-cellulose 16.03,CMC 4.40,资-carrageenan 2.50,vitamin mixture 0.75,mineral mixture 0.75,attractants 1.00.And meanwhile,vitamin mixture provides the following per kg premix:VA 1 000 000 IU,VD3300 000 IU,VE 4000 IU,VK31000 mg,VB12000 mg,VB21500 mg,VB61000 mg,VB125 mg,nicotinic acid 1000 mg,VC 5000 mg,calcium pantothenate 5000 mg,folic acid 100 mg,inositol10 000 mg,carrier of glucose and water臆10%.Mineralmixture provided the fol-lowing(0.025 mg/g of premix):NaCl 107.79,MgSO4·7H2O 380.02,Na2HPO4·2H2O 241.91,KH2PO4665.20,CaHPO4·2H2O 376.70, FeC6H5O782.38,CH3CHOHCOO2Ca·5H2O 907.10,Al(OH)30.52,ZnSO4·7H2O 9.90,CuSO40.28,MnSO4·7H2O 2.22,Ca(IO3)20.42,CoSO4·H2O 2.77.The attractantsweremade up of taurine and betaine 1颐1,provide by Shanghai biological engineering Co.Ltd.
1.2.2 饲养管理鱼苗运到大连海洋大学农业部北方海水增养殖重点实验室后,先在2个1 m3的水槽中暂养驯化两周以适应实验室环境,驯化期间投喂商业饲料。试验共设6组,分别记为LL-LI、LL-MI、LL-HI、HL-LI、HL-MI、HL-HI组,每组设3个重复,共用18个蓝色圆形聚乙烯水槽,所有处理组的水槽随机分配。暂养结束后,挑选外观正常、大小均一、体格健壮的试验鱼分组,每个水槽放初始体质量为(2.69依0.04)g的试验鱼30尾。投喂前从冰箱(4益)中取出分装好的6种试验饲料,每天表观饱食投喂2次(8:30和16:30),并于每天上午投喂结束1 h后吸底一次,清理粪便并收集残饵。整个试验采用流水系统,流速为3.7 L/min,24 h充气。每天定时测定水温、pH和盐度,试验期间水温为(22.5依0.97)益,pH为8.00依0.05,盐度为31.6依0.22。
1.2.3 样品的采集待60 d的饲养试验结束后,停食24 h,从每槽随机抽取5尾试验鱼,于冰盘上直接进行解剖,取肝脏和中前肠分别放入离心管中,置液氮中急速冷冻后,转入冰箱(-80益)中保存,用于相关酶活性的测定,并于24 h内完成全部测定。
1.2.4 样品的处理与测定将试验鱼组织样品在冰箱(4益)中解冻、剪碎,按质量体积比为1颐9 (g颐mL)加入预冷的生理盐水,肠样品按质量体积比为1颐4(g颐mL)加入预冷的生理盐水,用玻璃匀浆器匀浆,匀浆液经2500 r/min离心10 min (CT15RE型日立冷冻离心机),取上清液备用。肠道消化酶(蛋白酶和脂肪酶),部分肝脏免疫相关酶(CAT、T-AOC、SOD、ACP、AKP)活性以及组织匀浆蛋白含量的测定均使用南京建成生物工程研究所的相关试剂盒。使用酶标仪(ELIASA)测定SOD、ACP、AKP活力,使用722型紫外分光光度计测定消化酶、CAT和T-AOC活力。
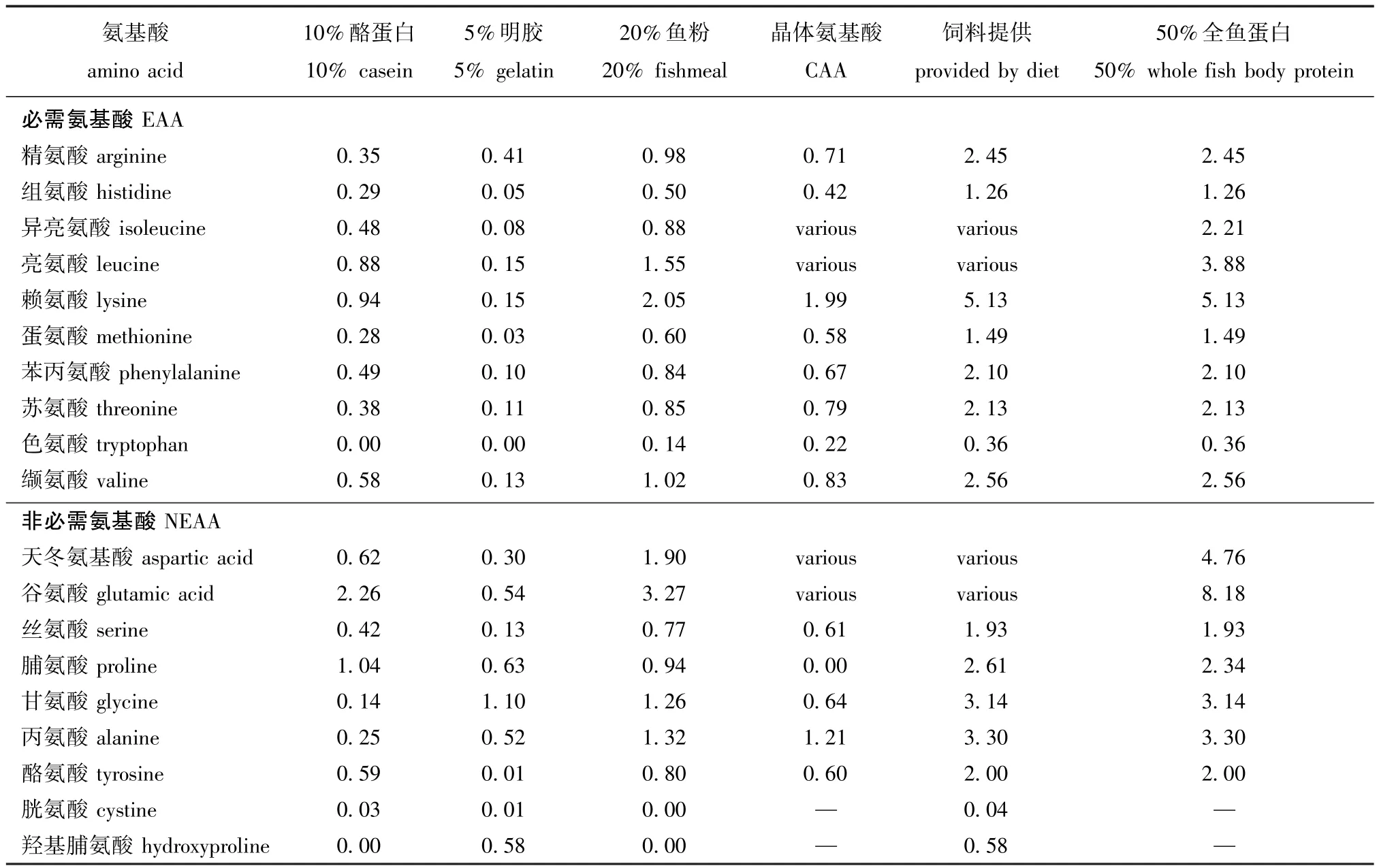
表2 饲料的氨基酸组成(干物质基础)及饲料中CAA混合物的添加量Tab.2Am ino acid com positions(dry m atter basis)of dietary ingredients and the content of dietary crystalline am ino acid (CAA)m ixture%
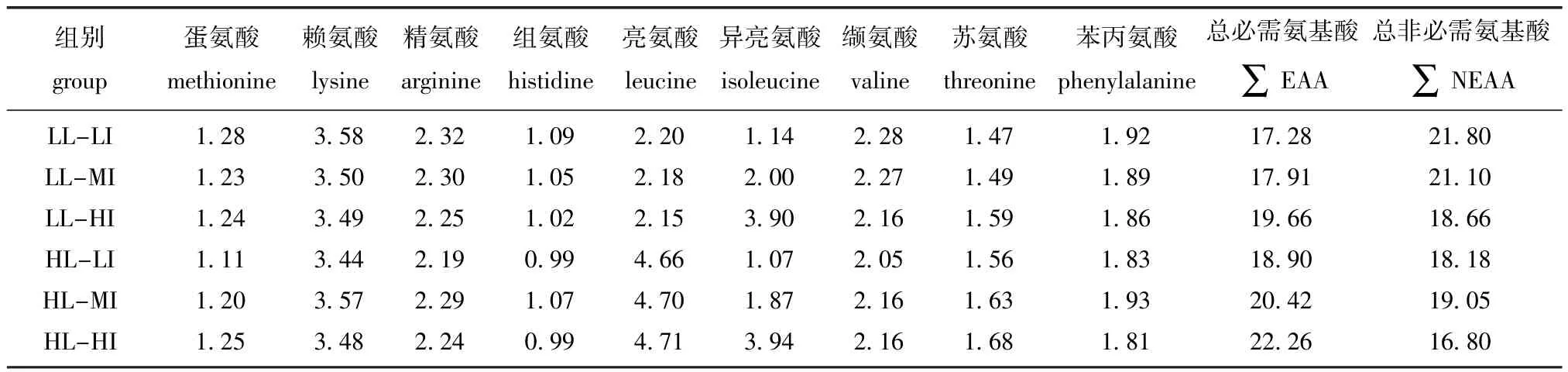
表3 各组试验饲料的氨基酸组成(干质量)(n=3)Tab.3Am ino acid profiles of the experimental diets(dry matter)(n=3)%
蛋白酶活性单位定义为:在37益条件下,每毫克组织蛋白每分钟分解蛋白生成1滋g氨基酸为1个酶活力单位(U/mg prot)。
脂肪酶活性定义为:在37益条件下,每克组织蛋白与底物反应1 min,每消耗1滋mol底物为1个酶活力单位(U/g prot)。
CAT活性单位定义为:每毫克组织蛋白每秒分解1滋mol的H2O2的量为1个活力单位(U/mg prot)。
T-AOC活性单位定义为:在37益条件下,每分钟每毫克组织蛋白使反应体系的吸光度(OD)值,每增加0.01时,为1个总抗氧化能力单位(U/mg prot)。
SOD活性单位定义为:在37益条件下,每毫克组织蛋白在1mL反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位(U/mg prot)。
用微量酶板法测定ACP活性,其活性单位定义为:在37益条件下,每克组织蛋白与基质作用30 min产生1mg酚为1个金氏单位(金氏单位/g prot)。
用微量酶板法测定AKP活性,其活性单位定义为:在37益条件下,每克组织蛋白与基质作用15 min产生1mg酚为1个金氏单位(金氏单位/g prot)。
用蛋白质测定试剂盒测定组织匀浆蛋白质含量(考马斯亮蓝法)。
1.3 数据处理
试验数据以平均值依标准误表示(mean依S.E.)表示,使用SPSS 19.0软件进行数据处理,在对2个Leu水平和3个Ile水平进行2伊3的双因素方差分析(Two-way ANOVA)的基础上,所有数据用单因素方差分析(One-way ANOVA)进行处理,并采用Turkey蒺s法对各处理组数据进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同Leu和Ile水平的饲料对牙鲆肠道消化酶活力的影响
由表4可知,Leu、Ile及二者间的交互作用均对牙鲆肠道消化酶活力有显著或极显著影响(P< 0.05或P<0.01)。高Ile饲料组肠道消化酶活力显著高于中Ile饲料组(P<0.05)。HL-LI组牙鲆的蛋白酶活力最高,但与LL-HI及HL-HI组无显著性差异(P>0.05),三者均显著高于其他各组(P<0.05);LL-HI组的脂肪酶活力最高,且显著高于其他组(P<0.05)。
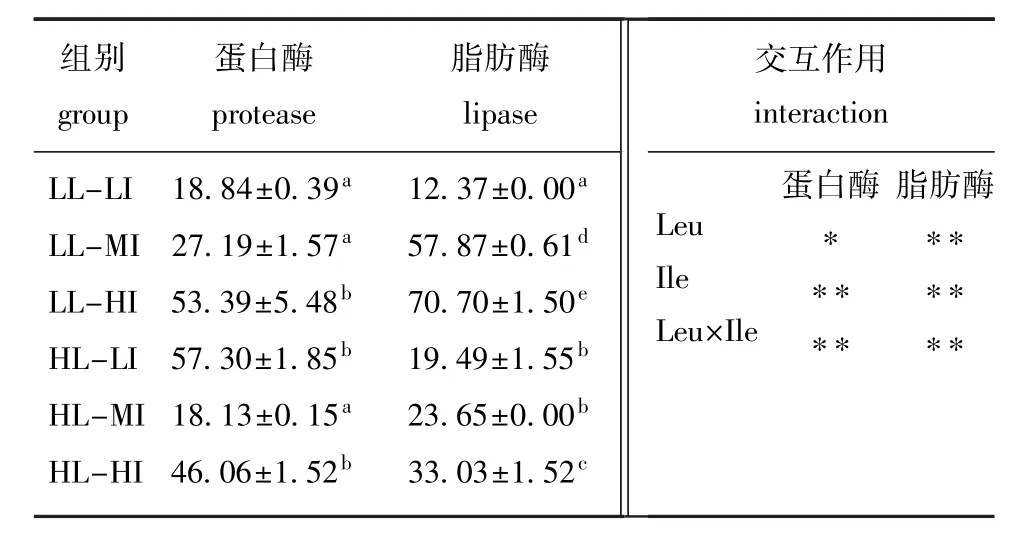
表4 不同饲料对牙鲆肠道消化酶活力的影响Tab.4Effects of different diets on activities of digestive enzymes in intestine of Japanese flounder Paralich-thys olivaceus U/mg prot
2.2 不同Leu和Ile水平的饲料对牙鲆肝脏免疫相关酶活力的影响
由表5可知,饲料中Leu和Ile对牙鲆肝脏TAOC、CAT、SOD活力的影响存在交互作用,饲料中Leu和Ile水平极显著影响牙鲆肝脏CAT及SOD活力(P<0.01)。在低Leu水平处理组,当饲料中Ile水平达到一定程度后,肝脏CAT及SOD活力随Ile含量的增加而显著增强(P<0.05);而在高Leu处理组,当Ile逸2.21%时,肝脏CAT及SOD活力随饲料中Ile含量的增加而显著降低(P<0.05),即在高Leu水平处理组,饲料中的Ile水平与牙鲆肝脏免疫酶活力呈负相关;LL-HI组牙鲆肝脏抗氧化酶活力最高。
由表6可知,Leu与Ile间存在交互作用,且肝脏ACP活力受饲料中Ile水平的影响极显著(P<0.01),而Leu和Ile水平及其交互作用极显著影响牙鲆肝脏的AKP活力(P<0.01)。在低Leu水平处理组,当Ile逸2.21%时,肝脏免疫酶(ACP和AKP)活力随饲料中Ile含量的增加显著增强(P<0.05);在高Leu处理组,肝脏ACP活力不受饲料Ile水平的影响,但肝脏AKP活力随饲料中Ile水平的增加呈先升高后显著降低(P< 0.05);LL-HI组牙鲆肝脏免疫酶活力最高。
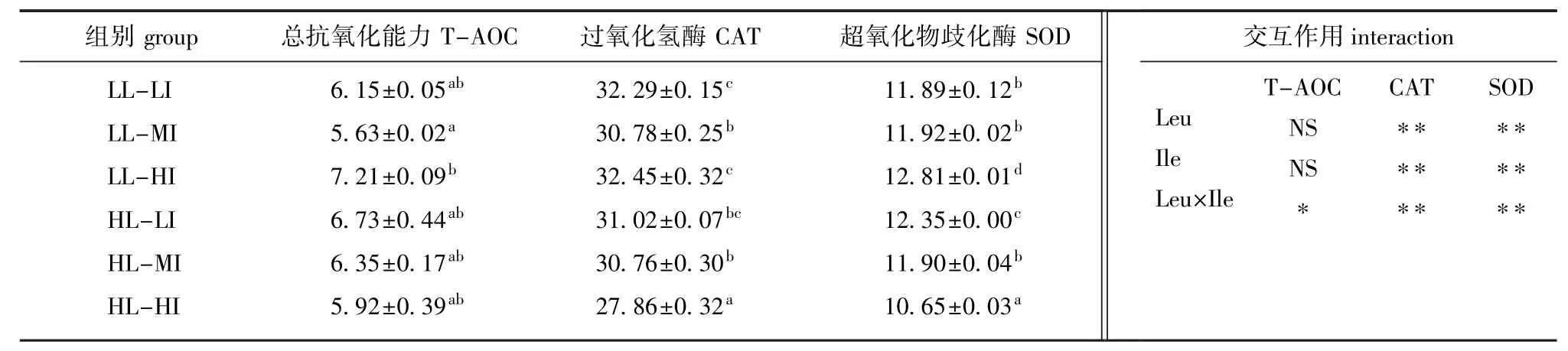
表5 不同饲料对牙鲆肝脏抗氧化酶活力的影响Tab.5Effects of different diets on activities of antioxidant enzym es in liver of Japanese flounder Paralichthys olivaceusU/mg prot
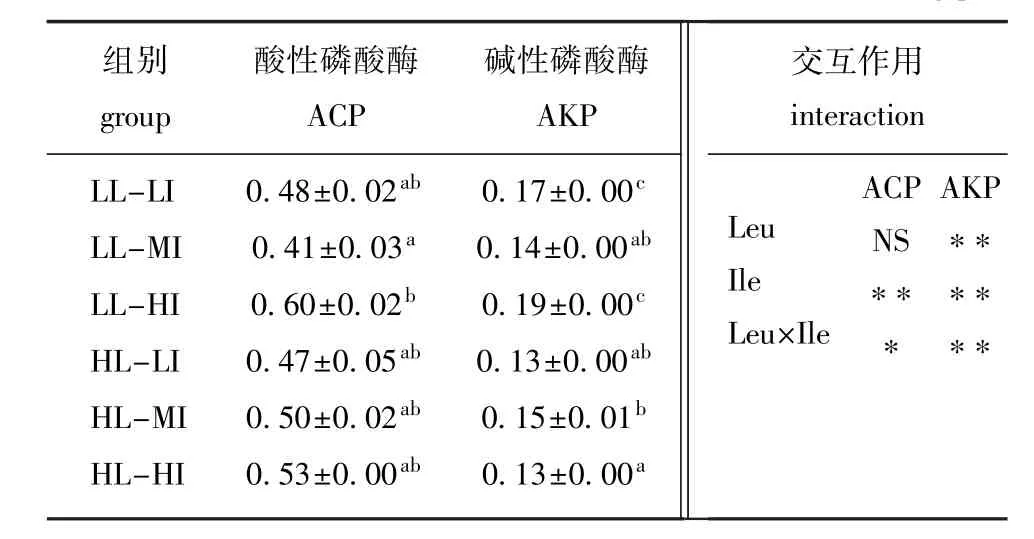
表6 不同饲料对牙鲆肝脏免疫酶活力的影响Tab.6Effects of different diets on activities of immune en-zymes in liver of Japanese flounder Paralichthys oli-vaceus金氏单位/g prot
3 讨论
3.1 饲料中不同Leu和Ile水平对牙鲆肠道消化酶活力的影响
饲料的营养成分是影响动物消化酶活性的关键因素,消化酶活力在一定程度上可反映机体对饲料的消化能力。目前,已有许多氨基酸对水生动物消化吸收能力的研究报道,王际英等[17]发现,刺参肠道蛋白酶活力随着饲料中精氨酸含量的增加而降低,但其肠道淀粉酶及脂肪酶活力却不受影响。孙玉轩[9]发现,在饲料中添加适宜含量的Leu及Ile可显著提高吉富罗非鱼胃蛋白酶、脂肪酶等消化酶活力,这与石亚庆等[10]在饲料中添加适宜含量的Leu可提高罗非鱼消化酶活性的研究一致。本试验中,从生长参数分析,在低Leu水平处理组,生长参数(终末体质量、体增重率和特定生长率)随饲料中Ile水平的提高而增大,而高Leu处理组却表现为相反趋势;且投喂LL-HI的牙鲆其生长参数最高(另文发表)。本试验中,在低Leu水平情况下,牙鲆肠道消化酶活力与其生长参数表现为相同趋势,且饲料中高水平的Leu表现为降低肠道消化酶活力(低Ile组除外)。脂肪酶活力在LL-HI组最高,并显著高于其他处理组(P<0.05),蛋白酶活力在HL-LI组最高,但与LL-HI及HL-HI组无显著性差异(P>0.05)。结果表明,Leu和Ile间存在交互作用,并显著影响牙鲆肠道消化酶活力。陈慕雁等[18]认为,水产动物肠道的消化吸收能力与肠黏膜结构的完整性和功能性密切相关。本试验中用Leu为2.58%、Ile为4.44%投喂的牙鲆(LL-HI组)其机体消化酶活力相对较高,这可能是因为Leu的代谢产物茁-羟基-茁-甲基戊二烯二酰CoA是胆固醇的前体物质,胆固醇可以保持细胞膜的流动性,进而保持了肠上皮细胞的完整性[19],从而提高了牙鲆肠道的消化吸收能力。也可能是因为饲料中Ile水平促进了BCAA的平衡,这让作为氮和碳骨架载体的BCAA为谷氨酸及谷氨酰胺的合成提供了氮源和碳源[20-21],使谷氨酰胺促进了淀粉酶、脂肪酶等消化吸收酶的分泌[22]。
3.2 饲料中不同Leu和Ile水平对牙鲆肝脏免疫相关酶活力的影响
SOD和T-AOC是机体抗氧化系统中两种较重要的酶,在清除氧自由基等方面具有重要作用。机体内SOD活性的高低可反映器官组织抗氧化保护能力的大小[23]。CAT可参与活性氧代谢,使H2O2发生歧化反应生成水和氧,并与SOD等一起共同组成生物体内的活性氧防御系统[24-25]。本试验中发现,在低Leu水平处理组,当饲料中Ile水平达到一定程度时,牙鲆肝脏T-AOC、CAT和SOD活力随着饲料中Ile含量的增加显著增强;而在高Leu处理组,Ile水平与其酶活力表现为负相关,这与牙鲆的生长参数有相似的趋势。本试验表明, Leu和Ile间存在交互作用,并可显著影响牙鲆肝脏T-AOC、CAT和SOD活力,且投喂LL-HI饲料的牙鲆肝脏T-AOC、CAT和SOD活力均最高。说明在饲料中添加适宜含量的Leu和Ile可提高牙鲆抗氧化酶活力,与孙玉轩[9]在饲料中添加适宜含量的Leu可增强吉富罗非鱼非特异性免疫力的研究结果类似。但吴俊光等[26]发现,饲料中的精氨酸水平对杂交鲟幼鱼肝脏的抗氧化能力无显著影响。这可能是因为Leu是免疫细胞主要的能源物质[27],且过量的Leu可破坏氨基酸间的平衡,进而影响了机体内酶的代谢机制。
ACP是高等动物体内巨噬细胞溶酶体的标志酶,其在体内直接参与磷酸基团的转移与代谢,主要存在于生物体各脏器、血细胞和骨骼中[28],其活性可反映机体的免疫机能状况[29]。AKP是一种能催化磷酸单酯水解酶及磷酸基团转移反应的磷酸单酯酶类,在动物体内是一种重要的解毒体系,与机体内营养物质的消化、吸收、利用和转运有关[30],一直以来AKP都被作为一个重要的免疫指标而在动物免疫学中广泛应用[31]。本试验中发现, Ile可显著影响牙鲆肝脏ACP活力,且ACP活力与Ile水平的添加趋势基本吻合(LL-MI组除外)。对AKP来说,在低Leu水平情况下,其活力随着Ile含量的增加先降低后逐渐增强;在高Leu处理组则与其相反。孙玉轩[9]对吉富罗非鱼的研究发现,日粮中的Leu和Ile水平可显著影响其体内AKP活力。AKP活性的提高,可加速牙鲆肝脏组织的物质代谢,为二磷酸腺苷磷酸化形成三磷酸腺苷提供所需的无机磷,积累更多的能量,从而促进牙鲆的生长,增强了机体免疫力。本研究表明, Leu和Ile间存在交互作用,并显著影响牙鲆肝脏ACP和AKP活力(P<0.05);且LL-HI饲料处理组的牙鲆其肝脏ACP和AKP活力最高。研究发现,酶对外界刺激产生的变化有一定的周期性,不同条件下机体适应外界刺激所需要的时间也不同[32]。LL-HI饲料组中的Leu与Ile水平可能促进了BCAA的平衡,降低了机体对外界刺激的适应时间,进而促进机体内的酶分泌。但这两种氨基酸的交互作用对牙鲆机体组织中酶的代谢机制产生的影响,有待进行更深入地探究。
氨基酸对鱼类消化酶及非特异性免疫酶的研究大多集中在单个氨基酸[33-36],且氨基酸的交互作用,尤其是BCAA的交互作用对鱼类组织酶活性的研究尚未见报道。本研究表明,饲料中Leu和Ile间存在交互作用,并可对牙鲆组织中的消化酶及部分免疫相关酶产生显著影响,且投喂低Leu (2.58%)水平与高Ile(4.44%)水平的饲料,牙鲆机体组织酶活力最高。
[1]刘春生,张大鹏,刘文宽,等.支链氨基酸在泌乳母猪营养中的研究现状[J].饲料研究,2006(2):31-32,35.
[2]葛蔚,刘汉柱.支链氨基酸的生物学作用[C]//全国氨基酸研究开发暨综合应用新技术新设备交流研讨会论文集.南京:中国高科技产业化研究会,2011.
[3]尚晓迪.草鱼幼鱼对异亮氨酸需要量的研究[D].重庆:西南大学,2009.
[4]Alam S,Teshima S I,Yaniharto D,etal.Influence of different diet-ary amino acid patterns on growth and body composition of juvenile Japanese flounder,Paralichthys olivaceus[J].Aquaculture,2002, 210(1-4):359-369.
[5]Ye Jidan,Liu Xianghe,Wang Zijia,et al.Effectof partial fishmeal replacement by soybean meal on the growth performance and bio-chemical indices of juvenile Japanese flounder Paralichthys oliva-ceus[J].Aquaculture International,2011,19(1):143-153.
[6]王荦,吴立新,李家庆,等.饥饿及再投喂对牙鲆幼鱼氮、磷排泄的影响[J].大连海洋大学学报,2011,26(2):114-118.
[7]Han Yuzhe,Han Ruzheng,Koshio S,et al.Interactive effects of di-etary valine and leucine on two sizes of Japanese flounder Paralich-thys olivaceus[J].Aquaculture,2014,432:130-138.
[8]Forster I,Ogata H Y.Lysine requirement of juvenile Japanese flounder Paralichthys olivaceus and juvenile red sea bream Pagrus major[J].Aquaculture,1998,161(1-4):131-142.
[9]孙玉轩.吉富罗非鱼亮氨酸和异亮氨酸需求量的研究[D].重庆:西南大学,2014.
[10]石亚庆,孙玉轩,萝莉,等.吉富罗非鱼亮氨酸需求量研究[J].水产学报,2014,38(10):1778-1785.
[11]王宏田,张培军.牙鲆体内消化酶活性的研究[J].海洋与湖沼,2002,33(5):472-476.
[12]郭文婷,李健,王群,等.微生态制剂对牙鲆非特异性免疫因子影响的研究[J].海洋科学进展,2006,24(1):51-58.
[13]Alam M S,Teshima S I,Ishikawa M,et al.Methionine require-ment of juvenile Japanese flounder Paralichthys olivaceus[J]. Journal of theWorld Aquaculture Society,2000,31(4):618-626.
[14]Han Yuzhe,Koshio S,Ishikawa M,et al.Interactive effects of di-etary arginine and histidine on the performances of Japanese flounder Paralichthys olivaceus juveniles[J].Aquaculture,2013, 414-415:173-182.
[15]Han Yuzhe,Koshio S,Jiang Zhiqiang,et al.Interactive effects of dietary taurine and glutamine on growth performance,blood pa-rameters and oxidative status of Japanese flounder Paralichthys olivaceus[J].Aquaculture,2014,434:348-354.
[16]Alam M S,Teshima S,Koshio S,etal.Arginine requirementof ju-venile Japanese flounder Paralichthys olivaceus estimated by growth and biochemical parameters[J].Aquaculture,2002,205 (1-2):127-140.
[17]王际英,李宝山,张德瑞,等.饲料中添加精氨酸对仿刺参幼参生长、免疫能力及消化酶活力的影响[J].水产学报,2015, 39(3):410-419.
[18]陈慕雁,张秀梅.大菱鲆仔稚幼鱼消化系统发育的组织学研究[J].水生生物学报,2006,30(2):236-240.
[19]沈同,王镜岩,赵邦悌.生物化学[M].北京:高等教育出版社,1999:233.
[20]Chen Lixiang,Li Peng,Wang Junjun,et al.Catabolism of nutri-tionally essential amino acids in developing porcine enterocytes [J].Amino Acids,2009,37(1):143-152.
[21]Bixel M G,Hutson S M,Hamprecht B.Cellular distribution of branched-chain amino acid aminotransferase isoenzymes among rat brain glial cells in culture[J].Journal of Histochemistry& Cytochemistry,1997,45(5):685-694.
[22]林燕.谷氨酰胺对幼建鲤肠道功能和免疫力的影响[D].雅安:四川农业大学,2005.
[23]方允中,李文杰.自由基与酶[M].北京:科学出版社,1989: 67-69.
[24]何南海.对虾免疫功能指标的建立及其应用[J].厦门大学学报,2004,43(3):385-388.
[25]肖克宇.水产动物免疫与应用[M].北京:科学出版社,2007: 102-138.
[26]吴俊光,王连生,王常安,等.饲料中精氨酸水平对杂交鲟幼鱼抗氧化能力及血清生化指标的影响[J].大连海洋大学学报,2016,31(3):272-279.
[27]Calder PC.Branched-chain amino acids and immunity[J].The Journal of Nutrition,2006,136(S1):288S-293S.
[28]朱忠勇.实用医学检验学[M].北京:人民军医出版社,1992: 368-378.
[29]郭伟荣,刘利平,张宗锋,等.感染鳗弧菌对花鲈非特异性免疫功能的影响[J].上海海洋大学学报,2011,20(1):89-95.
[30]贾秀英,陈志伟.镉对鲤鱼磷酸酶活性的影响[J].上海环境科学,1998,17(6):40-41.
[31]刘青,赵恒寿.鱼类常用免疫指标及其检测技术[J].渔业现代化,2007,34(3):27-30.
[32]曾端,麦康森,艾庆辉.脂肪肝病变大黄鱼肝脏脂肪酸组成、代谢酶活性及抗氧化能力的研究[J].中国海洋大学学报, 2008,38(4):542-546.
[33]伍曦.亮氨酸对幼建鲤生长性能和免疫功能的影响[D].雅安:四川农业大学,2011.
[34]帅柯.蛋氨酸对幼建鲤消化功能和免疫功能的影响[D].雅安:四川农业大学,2006.
[35]王光花.蛋氨酸对幼建鲤肠道菌群、肠道酶活力和免疫功能的影响[D].雅安:四川农业大学,2007.
[36]冯琳.苏氨酸对幼建鲤消化吸收能力和抗病力以及组织器官中蛋白质调控信号分子TOR表达的影响[D].雅安:四川农业大学,2010.
Interactive effect of dietary leucine and isoleucine on digestive and immune-related enzyme activities of Japanese flounder Paralichthys olivaceus
WANG Li-ping,JIANG Zhi-qiang,SUN Meng-lei,SIBin,HAN Yu-zhe,CHEN Fei,BAO Ning
(College of Fisheries and Life Science,Key Laboratory ofMariculture&Stock Enhancement in North China蒺s Sea,Ministry of Agriculture,Key Laborato-ry of Fish Applied Biology and Aquaculture in North China,Dalian Ocean University,Dalian 116023,China)
A feeding trailwas conducted to investigate the interactive effectof dietary leucine(Leu)and isoleucine (Ile)on activities of intestine digestive enzymes and several liver immune-related enzymes of juvenile Japanese flounder Paralichthysolivaceus.Japanese flounder juvenileswith initialweights of(2.69依0.04)gwere fed six diets (LL-LI,LL-MI,LL-HI,HL-LI,HL-MI,HL-HI)containing two levels of dietary Leu(2.58%and 5.08%in drymatter)combined with three levels of dietary Ile(1.44%,2.21%and 4.44%in drymatter)with triplicate tanks per treatment for 60 days,and then intestinal digestive enzymes(protease and Lipase)and liver immune-re-lated enzymes including catalase(CAT),superoxide dismutase(SOD),acid phosphatase(ACP),and alkaline phosphatase(AKP)activities and total antioxidant capacity(T-AOC)weremeasured in the test fish.The activi-ties of intestinal digestive enzymes in high dietary Ile were shown significantly higher than middle Ile groups(P< 0.05)and it can be decreased in high dietary Leu(except LI).In low Leu groups,the activities of liver CAT, SOD and ACP aswell as AKP was significantly increased(P<0.05)with the increasing dietary Ile at dietary Ile level逸2.21%.In high Leu groups,however,the activities of CAT,SOD and AKPwere found to be significantly decreased(P<0.05)with the increase in dietary Ile level at dietary Ile level逸2.21%.It can be concluded that significant interactive effect of dietary Leu and Ile is found in intestine digestive enzyme activities as well as liver anti-oxidant enzyme and enzyme related to immunity activities of Japanese flounder.The higher digestive and im-mune-related enzyme activitieswere observed in Japanese flounder fed diet containing low Leu(2.58%)and high Ile(4.44%).
leucine;isoleucine;interactive effect;Paralichthys olivaceus;digestive enzyme
S963.1
A
10.16535/j.cnki.dlhyxb.2017.03.006
2095-1388(2017)03-0287-07
2016-10-12
国家“十二五冶科技支撑计划项目(2011BAD13B03);辽宁省博士启动基金资助项目(201601289)
王莉苹(1990—),女,硕士研究生。E-mail:651068097@qq.com
韩雨哲(1984—),男,博士,讲师。E-mail:hanyuzhe@dlou.edu.cn

