穿山龙抗急性痛风性关节炎的肝脏代谢组学研究
刘树民+张宁+于栋华+王宇+周琦+卢芳

[摘要] 该研究通过肝脏代谢组学研究从肝论治痛风的科学性以及穿山龙提取物对急性痛风性关节炎模型大鼠的防治作用,并找到其相关的潜在生物标志物和相关代谢通路。课题组采用尿酸钠(MSU)诱导的急性痛风性关节炎模型并运用UPLC-TOF-MS结合模式识别方法探讨穿山龙提取物干预急性痛风性关节炎的潜在生物标志物及其相关代谢通路。鉴别出了11个共同的潜在生物标志物,其中穿山龙对正常大鼠的潜在干预靶点中,4个上调,4个下调;穿山龙对急性痛风性关节炎模型大鼠的潜在干预靶点中,5个代谢物在MSU诱导下被上调,5个代谢物被下调,而穿山龙提取物表现出纠正磷酸腺苷、5-甲基四氢叶酸、氧化型谷胱甘肽、次黄嘌呤、二十二碳六烯酸、谷胱甘肽、尿苷二磷酸葡萄糖、肌苷这8个代谢物异常表达的趋势,其相关性最强的代谢通路是谷胱甘肽代谢、淀粉与蔗糖代谢和嘌呤代谢。故推测穿山龙可以通过干预急性痛风性关节炎状态下和生理状态下肝脏中内源性代谢产物变化,实现防治急性痛风性关节炎作用。
[关键词] 急性痛风性关节炎; 穿山龙; 尿酸钠; 肝脏代谢组学
[Abstract] To explore the prevention and protection effect of Diosocorea nipponica (DNM)) on acute gouty arthritis (AGA) rats based on liver metabonomics, and find potential biomarkers and related pathways. AGA model rats were induced by monosodium urate crystal suspension. UPLC-TOF-MS coupled with pattern recognition technique was employed to find out the potential biomarkers and related metabolic pathways. Eleven common potential biomarkers were identified. Among the potential intervention targets in normal rats given by DNM, 4 biomarkers were up-regulated, and the other 4 targets were down regulated. Among the potential intervention targets in AGA rats given by DNM, 5 metabolites were up-regulated by MSU and 5 metabolites were down regulated. The abnormal expression levels of adenosine monophosphate, 5-methyltetrahydrofolic acid, oxidized glutathione, hypoxanthine, docosahexaenoic acid, glutathione, uridine diphosphate glucose and inosine could be corrected by DNM extract. Three pathways were founded with greatest correlation, including purine metabolism, starch and sucrose metabolism and glutathione metabolism. Therefore, it could be inferred that D. nipponica has the effect for anti-acute gouty arthritis by intervening endogenous metabolites from the liver under physiological condition and acute gouty arthritis condition.
[Key words] acute gouty arthritis; Diosocorea nipponica; monosodium urate; liver metabonomics
《醫学传灯·痛风》记载:“痛风者,遍身疼痛,昼减夜甚,痛彻筋骨…皆由肝经血少火盛,热极生风,非是外来风邪…”[1],而现代医学认为痛风的原因是尿酸含量过高,其根源与肝脏代谢异常有关[2],因此让痛风从肝脏得到根治是个亟待解决的问题,但从肝论治痛风是否具有科学性仍需要临床和实验进一步的检验。穿山龙有祛风除湿、舒筋通络、活血止痛之功,用于各种关节炎[3]。在东北物产丰富,加大对穿山龙的开发,为解除患者疼痛、扩大社会生产力、北药开发战略的实施有极其深远的意义。前期实验表明穿山龙对高尿酸血症及痛风性关节炎有良好的治疗作用[4-9],基于此运用肝脏代谢组学,预期从整体观探讨穿山龙对生理及急性痛风性关节炎状态下大鼠的影响,寻找穿山龙作用于肝脏中的潜在靶点,验证从肝论治痛风的科学性,模拟出穿山龙抗痛风性关节炎的作用通路及其作用机制。
1 材料
QI软件(Waters 3.0);UPLC-TOF-MS超高液相色谱-飞行时间-质谱仪(美国Waters公司);KDC-160HR高速冷冻离心机(科大创新有限公司中佳分公司);MassLynx V4.1工作站(美国Waters公司)。
乙腈(色谱级,美国Thermo Fisher 科技公司);甲酸(色谱级,美国Dikma 科技公司);亮氨酸脑啡肽(美国Sigma-Aldrich公司);尿酸盐(美国Sigma-Aldrich公司);蒸馏水(屈臣氏)。黑龙江中医药大学中药毒理学实验室按本课题组的前期研究方法制得穿山龙提取物,其中伪原薯蓣皂苷、原薯蓣皂苷、甲基原薯蓣皂苷的总含量达到 60%[10]。
SD大鼠,雄性,SPF级,体重(230~280) g,购自黑龙江中医药大学实验动物中心,许可证号SCXK(黑)2013-004,饲养于黑龙江中医药大学药物实验动物中心屏障系统实验室。饲养条件:12 h光照,12 h避光循环饲养,室内温度(22±1) ℃,相对湿度40%~50%,饲喂标准饲料、饮用水。
2 方法
2.1 实验动物分组及给药
将SD大鼠40只,随机分为对照组、穿山龙组、MSU模型组和穿山龙干预组,每组10只。穿山龙组和穿山龙干预组灌胃给予穿山龙提取物,剂量为480 mg·kg-1[11],每天1次,连续5 d。对照组和MSU模型组给予等体积的生理盐水,每天1次,连续5 d。
用灭菌蒸馏水配成0.025 g·mL-1的MSU混悬液,取0.2 mL一次性踝关节腔注射。第3天灌胃1 h后,将MSU模型组和穿山龙干预组大鼠仰位固定,后肢膝关节周围剃毛,然后用75%医用酒精清洗消毒,膝关节轻度弯曲,用6号注射针在大鼠膝关节上方髌上韧带进针,注射0.2 mL MSU混悬液到关节腔,以关节囊对侧鼓起为注入指標,造成实验性急性痛风关节炎模型。对照组和穿山龙组按上述方法注射等体积生理盐水。
2.2 肝脏样本的收集与制备
末次给药24 h后,将大鼠处死并取出肝脏组织,放入冰冷的生理盐水中洗去浮血,滤纸吸干后,在冰浴上剪成碎片,称取适量组织,加入10倍体积冰冷的甲醇进行匀浆,随后匀浆液于13 000 r·min-1,4 ℃离心15 min,上清液转移至另一离心管后再重复该条件离心1次,最后的上清液储存于-80 ℃中。
2.3 代谢组学样本分析方法的建立
2.3.1 UPLC条件 ACQUITY UPLC BEH C18色谱柱(2.1 mm× 50 mm,1.7 μm);进样量3 μL;流动相0.1%甲酸乙腈(A)-0.1%甲酸水溶液(B),洗脱梯度,0~2.5 min,1%~10% A,2.5~3.5 min,10%~40% A,3.5~11 min,40%~70% A,11~12 min,70%~80% A,12~13 min,80%~100% A,流速0.4 mL·min-1;柱温40 ℃。
2.3.2 MS条件 电喷雾离子源(ESI),采用正、负离子W模式检测,锁定质量溶液,采用美国Waters公司LockSprayTM校正系统进行在线质量校正。亮氨酸脑啡肽准分子离子峰m/z 556.277 1[M+H]+;m/z 554.261 5[M-H]-,锁定质量浓度为1 μg·L-1,流速为30 μL·min-1。扫描方式为全扫描,质量扫描范围为质荷比m/z 100~1 500。其质谱条件见表1。
2.4 多元数据分析及潜在干预靶点的鉴定
UPLC-TOF-MS系统为不同离子所对应的质谱峰提供了精确的相对分子质量数据,这些数据被首先用于帮助确定代谢物的相对分子质量。对肝脏样品进行检测,将数据导入QI 软件[12],联合MarkerLynx XS软件中Ezinfo 2.0软件对大鼠肝脏中代谢物组进行主成分分析(principal components analysis,PCA),绘制反映组间离散度的Scores plot,观察肝脏代谢物轨迹是否在各自组内相似度较好,在同一判别标准下不同的组别是否呈现各自聚类现象。结合各组间各离子点量的变化趋势,在S-plot图中选择潜在的生物标志物,以变量投射重要性(VIP)>1的离子作为生物标志物,根据鉴定结果联合HMDB(人类代谢组数据库)及KEGG(Kyoto encyclopedia of genes and genomes,京都基因与基因组百科全书)等数据库及大量文献对生物标志物进行生物学意义的解释,最终实现对数据的分析确定和代谢通路的分析。
3 结果
3.1 大鼠肝脏代谢数据分析
为了获得大鼠肝脏样本代谢轮廓的概况,3D-PCA被运用于随后的UPLC-TOF-MS数据分析中。结果显示空白组和穿山龙组明显分离,说明空白组和穿山龙组出现了明显的化学扰动,见图1。MSU模型组的代谢轮廓远离了空白组,表明MSU诱导后大鼠肝脏内发生了显著地生物学变化,见图2,3。穿山龙提取物干预组的代谢轮廓远离于MSU模型组,有向空白组回调趋势,说明由MSU诱导产生的偏离得到了明显改善。
在S-plots图中,绝大多数离子聚集于原点附近,只有少数离子偏离原点,即S-plots图两端的离子造成了2组组间的差异,见图4。并选定VIP>1的离子预选为潜在的生物标志物,见图5。
3.2 穿山龙对正常大鼠和急性痛风性关节炎模型大鼠潜在生物标志物
不同生理病理状态可能存在相同的代谢产物谱,这可能是机体应激出现的结果,也可能是药物作用的潜在靶点,因此通过分析发生变化的共同代谢产物有助于推测疾病的发病机制以及药物对疾病的预防和治疗作用。穿山龙对正常和急性痛风性关节炎模型大鼠的代谢变化比较,得到11个相同的生物标志物,见表2。
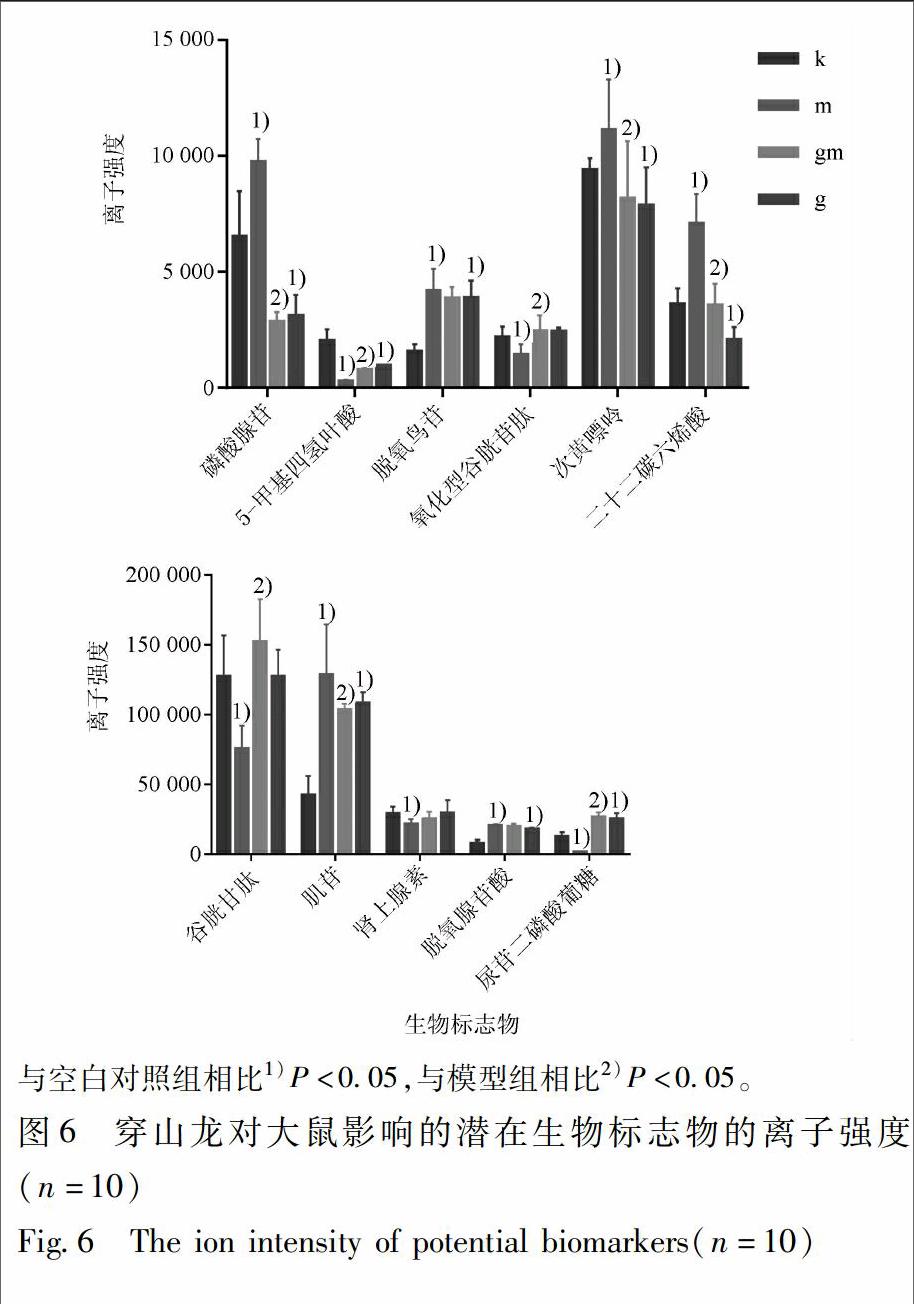
通过比对这些潜在生物标志物的离子强度,其中穿山龙对正常大鼠的潜在干预靶点中,4个上调,4个下调;穿山龙对急性痛风性关节炎模型大鼠的潜在干预靶点中,5个代谢物在MSU诱导下被上调,5个代谢物被下调,而穿山龙提取物表现出纠正磷酸腺苷、5-甲基四氢叶酸、氧化型谷胱甘肽、次黄嘌呤、二十二碳六烯酸、谷胱甘肽、尿苷二磷酸葡萄糖、肌苷这8个代谢物异常表达的趋势,见图6。
3.3 肝脏中潜在生物标志物的分类
使用HMDB对潜在生物标志物进行分类,11个潜在靶点中,大约9%属于脂类,46%为核苷、核苷酸及它们的类似物;18%为有机酸及其衍生物,9%为儿茶酚胺类及其衍生物,18%为杂环化合物。在生物功能分布中,所调节的潜在靶点中主要参与的生物过程有嘌呤代谢(9%)、谷氨酸代谢(4%)、蛋氨酸代谢组分(5%)、谷胱甘肽代谢组分(7%)、废物(11%)和其他(64%)。另外,这些代谢物主要存在于细胞外(29%)、细胞质(21%)、溶酶体(14%)和线粒体(14%)等部位。
3.4 肝脏中潜在生物标志物的通路分析
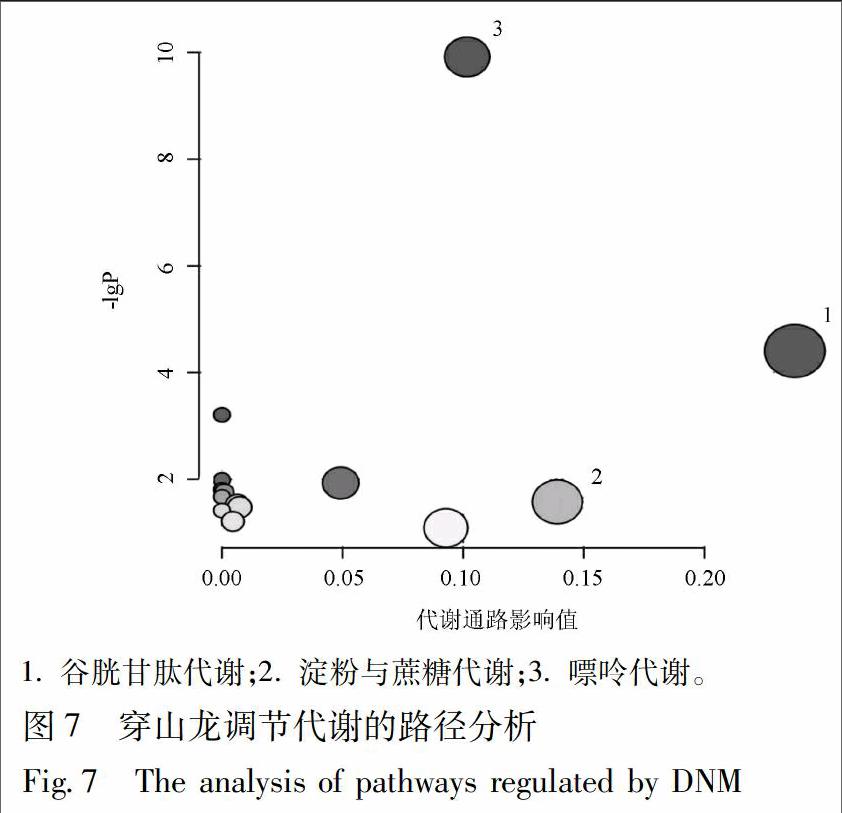
将11个共同的潜在生物标志物作为穿山龙抗急性痛风性关节炎的肝脏潜在生物标志物,并进行MetaPA识别显著富集通路分析,确定与所分析代谢物组相关性最强的代谢通路。代谢通路影响值的临界值设置为0.10,大于这个值,将选择作为潜在关键代谢通路,见图7,表3。主要富集于谷胱甘肽代谢、淀粉与蔗糖代谢和嘌呤代谢。在穿山龙干预后,代谢物的含量得到回调,代谢通路的紊乱得到改善,在代谢途径层面验证了穿山龙对由MSU诱导的急性痛风性关节炎模型有良好的预防和保护作用。
4 结论与讨论
4.1 谷胱甘肽代谢
谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)参与了谷胱甘肽代谢。在活细胞内,2分子GSH可脱氢以二硫键相连形成GSSG。GSSG在NADPH+和H+存在下,由谷胱甘肽还原酶(glutathione reductase,GR)催化,又可还原成GSH。还参与机体三羧酸循环及糖代谢,使机体获得高能量,能激活各种酶,从而促进糖、脂肪、蛋白质代谢,也能影响细胞的代谢过程,改善中毒性肝炎、感染性肝炎的症状[13],炎症免疫与急性痛风性关节炎密切相关[14],且前期研究证实穿山龙总皂苷抑制急性痛风性关节炎模型大鼠产生IL-1β 和 TNF-α 这类致炎因子,阻断其所介导和激发的炎症反应过程[11] 。此外,也能抑制脂肪肝的形成[15],脂肪肝与血脂和血尿酸的关系是并存的,且互为影响,脂肪肝形成的过程中尿酸的合成增加,使患者亦并发痛风[16]。在此研究中,MSU模型组中GSH和GSSG的浓度是明显减少的(P<0.05),且GSH的降低幅度高于GSSG,可以推测出MSU主要抑制了谷胱甘肽还原酶,致GSH的浓度在肝脏中的含量减少,而穿山龙提取物的干预有利于肝脏中GSH和GSSG转化的进行。穿山龙提取物的防治作用可能是通过调节谷胱甘肽代谢中谷胱甘肽还原酶的活性,进而调节GSH和GSSG的水平来实现的,见图8。
4.2 淀粉与蔗糖代谢
尿苷二磷酸葡萄糖参与了淀粉与蔗糖代谢,为生物体合成双糖及多糖的中间物[17]。肝脏中存在的动物性多糖为肝糖原,其在机体内的终产物为葡萄糖,为体内代谢供能。此研究中,MSU模型中尿苷二磷酸葡萄糖的含量是明显减少的(P<0.05),这表明MSU可以间接的减少机体内肝糖原的含量,而穿山龙提取物可显著增加尿苷二磷酸葡萄糖的含量(P<0.05),间接的增加机体内肝糖原的贮备量,提高机体的运动耐力[18]。因此穿山龙提取物可以通过间接增加机体内肝糖原的贮备量来改善MSU模型急性痛风性关节炎患者运动不便的困境。
4.3 嘌呤代谢
脱氧鸟苷(dG)、肌苷、次黄嘌呤、脱氧腺苷酸(dAMP)和磷酸腺苷(AMP)分别参与了嘌呤代谢。肌苷酸和腺苷是肌苷的直接前体。dG是鸟苷一磷酸的直接前体,可转化成肌苷酸,而肌苷是其部分水解的产物;腺苷是由dAMP间接转换而来,肌苷由AMP在腺苷脱氨酶催化下生成,在有关酶作用下可形成次黄嘌呤,它是核酸中嘌呤碱基的代谢中间物。经黄嘌呤氧化酶催化作用可形成黄嘌呤,进一步代谢形成尿酸[19]。痛风患者一般都有尿酸代谢紊乱,出现尿酸高的现象[20],在此研究中,MSU模型中的dG,肌苷,次黄嘌呤,dAMP和AMP的浓度均明显增加(P<0.05),可以推测MSU促进并诱导了机体内尿酸的合成,而穿山龙提取物的干预均抑制尿酸的合成,推测穿山龙提取物的防治作用可能是通过调节嘌呤代谢中dG,肌苷,次黄嘌呤,dAMP和AMP与尿酸的水平来实现的。
本研究共发现了11个共同的潜在生物标志物,分别为磷酸腺苷、肾上腺素、次黄嘌呤、5-甲基四氢叶酸、谷胱甘肽、脱氧鸟苷、氧化型谷胱甘肽、肌苷、二十二碳六烯酸、脱氧腺苷酸、尿苷二磷酸葡糖,相关性最强的通路有谷胱甘肽代谢、淀粉与蔗糖代谢和嘌呤代谢。值得注意的是穿山龙提取物对dG、肌苷、次黄嘌呤、dAMP和AMP的下调和尿苷二磷酸葡萄糖、GSH和GSSG的上调均具有显著的逆转趋势,能够使得它们的表达恢复平衡。这些结果可能表明了穿山龙提取物对MSU诱导的急性痛风性关节炎的防治作用,可以通过多个代谢物靶点的干预来实现。MSU介导的急性痛风性关节炎模型大鼠以及生理状态下穿山龙组大鼠体内发生了内源性代谢物的扰动。鉴别的潜在生物标志物参与了急性痛风性关节炎相关的代谢通路,而穿山龙提取物对相关靶点具有干预作用,从而找到穿山龙防治急性痛风性关节炎的作用机制。
课题组的创新之处在于通过肝脏代谢组学间接验证了从肝论治痛风的科学性,并探讨了由MSU诱导的急性痛风性关节炎模型和生理状态给予穿山龙后共同的潜在生物标志物及其相关性最强的代谢通路,力求寻找穿山龙可干预的与生理病理(急性痛风性关节炎)变化的小分子代谢物,同时监测其整个代谢网络的变化,有助于表征急性痛风性关节炎的病理状态,并为穿山龙的预防和治疗急性痛风性關节炎提供诊断信息。同时,为疾病和药物的生物化学作用机制提供新的见解。肝脏代谢组学在中医药研究中有利于理解急性痛风性关节炎这种疾病的本质及评估穿山龙的防治作用。
[参考文献]
[1] 朱婉华, 张爱红, 顾冬梅, 等. 痛风性关节炎中医证候分布规律探讨[J]. 中医杂志,2012,53(19):1667.
[2] Irondi E A, Oboh G, Agboola S O, et al. Phenolics extract of Tetrapleura tetraptera fruit inhibits xanthine oxidase and Fe2+-induced lipid peroxidation in the kidney, liver, and lungs tissues of rats in vitro[J]. Food Sci Hum Well, 2016, 5(1): 17.
[3] 张宁, 于栋华, 周琦, 等. 穿山龙药理作用的研究进展[J]. 中国药房, 2015,26(4):547.
[4] 周琦, 张翀, 于栋华, 等. 穿山龙总皂苷对高尿酸血症的降尿酸及细胞抗炎作用研究[J]. 中华中医药杂志, 2013, 28(5):1444.
[5] 姚丽, 刘树民. 穿山龙治疗急性痛风性关节炎有效部位的实验研究[J]. 中华中医药学刊, 2010, 28(8):1724.
[6] 周琦, 张宁, 卢芳, 等. 穿山龙总皂苷对痛风性关节炎大鼠关节炎滑膜IL-1β及其信号转导通路的影响[J]. 中药药理与临床, 2013, 29(6):52.
[7] 周琦, 张宁, 卢芳, 等. 穿山龙总皂苷对白介素-1β诱导的成纤维样滑膜细胞基质细胞衍生因子-1及IκB激酶表达的影响[J]. 中国中西医结合杂志, 2015, 35(2):234.
[8] 卢芳, 周琦, 张颖, 等. 基于痛风性关节炎ABCG2尿酸转运靶点的穿山龙调控机制研究[J]. 中华中医药学刊, 2016, 34(5):1057.
[9] Zhou Q, Liu S M, Yu D H, et al. Therapeutic effect of total saponins from Dioscorea nipponica Makino on gouty arthritis based on the NF-κB signal pathway: an in vitro study[J]. Pharmacogn Mag, 2016, 12(47):235.
[10] 刘颖,刘树民,于栋华, 等. 大孔树脂纯化穿山龙总皂苷的工艺优化[J]. 医药导报,2011,30(5):635.
[11] 刘树民,张宁,周琦, 等. 药理效应法测定穿山龙总皂苷的药动学参数[J]. 中国实验方剂学杂志,2016,22(16):75.
[12] Zhang J, Yang W, Li S, et al. An intelligentized strategy for endogenous small molecules characterization and quality evaluation of earthworm from two geographic origins by ultra-high performance HILIC/QTOF MS(E) and Progenesis QI[J]. Anal Bioanal Chem, 2016, 408(14): 3881.
[13] Ibáez-Samaniego L, Salcedo M, Vaquero J, et al. De novo autoimmune hepatitis after liver transplantation: a focus on glutathione S-transferase theta 1[J]. Liver Transpl, 2017, 23(1): 75.
[14] Zhang N, Gong X, Lu M, et al. Crystal structures of Apo and GMP bound hypoxanthine-guanine phosphoribosyltransferase from Legionella pneumophila and the implications in gouty arthritis[J]. J Struct Biol, 2016, 194(3): 311.
[15] Misako T, Nobuko M, Chizuru I, et al. Elevation of glucose 6-phosphate dehydrogenase activity induced by amplified insulin response in low glutathione levels in rat liver[J]. Scientific World J, 2016, 2016:1.
[16] Johnson R J. Why focus on uric acid[J]. Curr Med Res Opin, 2015, 31(sup2):3.
[17] Schmlzer, Katharina, Lemmerer, et al. Integrated process design for biocatalytic synthesis by a Leloir glycosyltransferase: UDP-glucose production with sucrose synthase[J]. Biotechnol Bioeng, 2016,doi: 10.1002/bit.26204.
[18] Adeva-Andany M M, Pérez-Felpete N, Fernández-Fernández C, et al. Liver glucose metabolism in humans[J]. Bioscience Rep, 2016, 36(6): e00416.
[19] Maiuolo J, Oppedisano F, Gratteri S, et al. Regulation of uric acid metabolism and excretion[J]. Int J Cardiol, 2016, 213: 8.
[20] Saigal R, Agrawal A. Pathogenesis and clinical management of gouty arthritis[J]. J Assoc Physicians India, 2015, 63(12):56.
[責任编辑 曹阳阳]

