GDF11在棕榈酸诱导骨骼肌细胞胰岛素抵抗中的作用研究
敬媛媛,吴 凡,李 蓉
(重庆医科大学附属第一医院内分泌科,重庆 400016)
GDF11在棕榈酸诱导骨骼肌细胞胰岛素抵抗中的作用研究
敬媛媛,吴 凡,李 蓉
(重庆医科大学附属第一医院内分泌科,重庆 400016)
GDF11;骨骼肌细胞;胰岛素抵抗;PGC-1α;棕榈酸;葡萄糖摄取
胰岛素抵抗增加2型糖尿病、心血管疾病和高血压的发病风险[1-2]。胰岛素抵抗的特征为胰岛素作用的敏感性或反应性降低,主要表现在骨骼肌、肝脏和脂肪组织。骨骼肌胰岛素抵抗与线粒体数目减少或功能紊乱密切相关。既往研究发现肥胖伴胰岛素抵抗人群骨骼肌内线粒体数目减少[3]。骨骼肌线粒体减少或功能紊乱可降低其氧化脂肪酸的能力,致肌细胞内脂质沉积最终导致胰岛素抵抗[4-5]。
GDF11(growth differential factor 11)是新近发现的一种具有逆转衰老作用的分泌性蛋白,近年来备受关注。研究发现血循环中GDF11随年龄的增长而下降,并且GDF11有明显改善骨骼肌代谢,逆转心肌肥厚,改善大脑认知等功能[6-9],显示出GDF11广泛的生物学活性和潜在的应用价值。Sinha等[6]发现GDF11可改善衰老骨骼肌的线粒体的形态结构,增强线粒体功能,同时增加老年小鼠骨骼肌中PGC-1α的表达。PGC-1α为PPARs的转录共激活因子,参与机体线粒体生物合成[10]。研究发现过表达小鼠骨骼肌PGC-1α可改善糖代谢[11]。基于GDF11在改善衰老骨骼肌功能方面的重要作用,本研究首次从体外实验探索GDF11是否可改善骨骼肌细胞胰岛素抵抗。
1 材料与方法
1.1 材料 C2C12小鼠成肌细胞购自中国科学院上海细胞库;棕榈酸(PA)购自美国Sigma公司;GDF11购自美国R&D公司;2NBDG购自美国Invitrogen公司;CCK-8试剂盒购自美国Biotool公司;实时定量逆转录及扩增试剂盒购自日本TaKaRa公司;兔抗鼠PGC-1α一抗购自美国Abcam公司,羊抗兔二抗购自德国Millipore公司。
1.2 方法
1.2.1 细胞培养及实验分组 C2C12小鼠成肌细胞用高糖DMEM培养基(含10%胎牛血清、1%青霉素及链霉素)于37℃,饱和湿度,5% CO2培养箱中培养。细胞汇合达到80%~100%时,换用诱导培养基(含2%马血清,1%青霉素及链霉素)培养,每天更换培养基。经过6 d诱导分化,形成多核肌管细胞用于后续实验研究。将实验分为以下6组:对照组;GDF11(50 μg·L-1)干预组; GDF11(100 μg·L-1)干预组;棕榈酸(0.5 mmol·L-1)干预组;GDF11(50 μg·L-1)联合棕榈酸(0.5 mmol·L-1)干预组;GDF11(100 μg·L-1)联合棕榈酸(0.5 mmol·L-1)干预组。
1.2.2 CCK-8 法检测细胞活力 取对数生长期细胞,以5×106·L-1细胞悬液按每孔100 μL接种于96孔板。培养24 h细胞贴壁后,吸弃培养液,分别加入含不同浓度的GDF11(0、50、100 μg·L-1)的培养基培养24 h。吸弃培养液,每孔加入100 μL含CCK-8的无血清培养基(CCK-8 ∶培养基=1 ∶10)培养30 min。在酶标仪上以450 nm波长测吸光度值。
1.2.3 2NBDG糖摄取的检测 细胞接种于6孔板,诱导分化6 d后形成肌管。细胞经干预后加入100 nmol·L-1胰岛素作用30 min。用预冷的HBSS缓冲液洗3遍后,加入含有100 μmol·L-12NBDG的HBSS缓冲液培养30 min。分别提取6孔板每孔细胞的总蛋白,操作过程需避光。将提取的总蛋白分别转移至96孔板中,在荧光酶标仪上以激发波长/发射波长(Ex/Em,485/535 nm)测吸光度值。每组吸光度值以相应蛋白浓度进行校正。
1.2.4 实时荧光定量PCR检测mRNA的表达 采用TRIzol法提取细胞总RNA,反转录为cDNA,进行实时荧光定量PCR扩增反应。具体操作步骤按照说明书进行,引物设计见Tab 1。根据扩增曲线测得内参基因及目的基因的Ct值,目的基因的表达用GAPDH进行标化,采用2-△△ct法分析。

Tab 1 Sequences of primers for RT-PCR

Fig 1 C2C12 myoblasts successfully differentiate into ±s,n=3)
A: C2C12 myoblasts(×100); B: C2C12 myotubes(×100);C:The mRNA level of desmin after differentiation;D:The mRNA level of myogenin after differentiation.*P<0.05,**P<0.01vsundifferentiation group
1.2.5 Western blot检测蛋白的表达 提取细胞总蛋白,BCA法测定蛋白浓度。蛋白经SDS-PAGE电泳分离后转至PVDF膜;5%脱脂奶粉封闭2 h后,加入兔抗鼠PGC-1α一抗4℃孵育过夜,TBST 缓冲液洗3次后,加入羊抗兔二抗室温孵育1 h;TBST充分洗膜3次,ECL试剂显影及成像。用蛋白条带吸光度与相应内参吸光度比值进行分析。
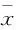
2 结果
2.1 C2C12成肌细胞分化鉴定 C2C12成肌细胞经2%马血清完全培养基培养6 d后分化为长梭形且含有多个细胞核的肌管细胞。分化细胞较未分化细胞肌管标志基因desmin及myogenin的表达明显升高(P<0.05,P<0.01)。提示诱导分化条件适当。见Fig 1。
2.2 GDF11对骨骼肌细胞葡萄糖摄取的影响 如Fig 2A所示,不同浓度GDF11(50、100 μg·L-1)干预对细胞活性无明显影响,所以后续实验采用这两个浓度。2NBDG糖摄取结果显示,与对照组相比,棕榈酸干预组胰岛素介导的葡萄糖摄取明显降低(P<0.01),提示胰岛素抵抗模型建立成功。而GDF11(50、100 μg·L-1)干预组与对照组相比葡萄糖摄取无明显变化。与棕榈酸干预组比较,GDF11 (50、100 μg·L-1)联合棕榈酸干预组葡萄糖摄取无明显变化。棕榈酸干预组GLUT4及IRS-1的表达较对照组明显降低(P<0.01)。而联合GDF11干预后与单纯棕榈酸组比较GLUT4及IRS-1表达无明显变化。见Fig 2。
2.3 GDF11对PGC-1α表达的影响 与对照组比较,棕榈酸干预组PGC-1α mRNA及蛋白的表达均降低(P<0.01),而GDF11(50、100 μg·L-1)干预对PGC-1α mRNA及蛋白的表达无明显影响。与棕榈酸干预组比较,GDF11(50、100 μg·L-1)联合棕榈酸干预组PGC-1α mRNA及蛋白的表达无明显变化。见Fig 3。
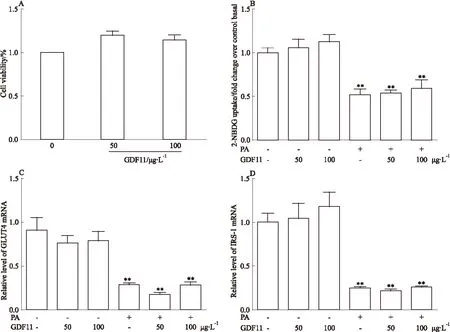
Fig 2 Effect of GDF11 on insulin resistance induced by palmitate in C2C12 ±s,n=3)
A:Cell viability was measured after different concentrations of GDF11 intervention; B:Glucose uptake in each group; C:The mRNA level of GLUT4 in each group; D:The mRNA level of IRS-1 in each group.**P<0.01vsControl group
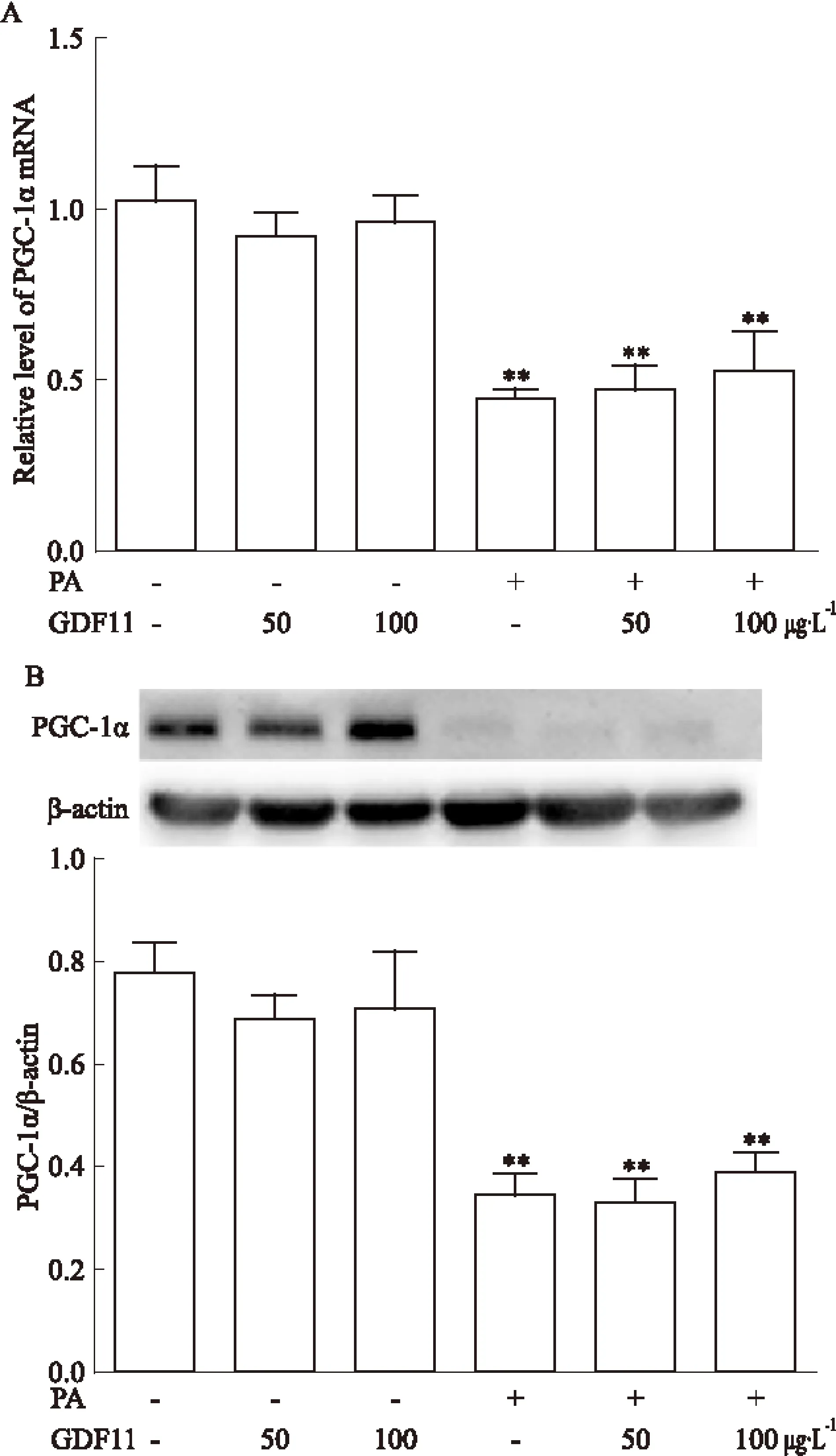
Fig 3 Effect of GDF11 on expression of PGC-1α in
A:The mRNA level of PGC-1α in each group;B:The protein level of PGC-1α in each group.**P<0.01vsControl group
3 讨论
骨骼肌是胰岛素刺激后摄取葡萄糖的主要部位,占全身葡萄糖摄取的80%以上[12]。既往研究发现棕榈酸可诱导胰岛素抵抗[13],本实验采用棕榈酸干预C2C12肌管细胞,使胰岛素介导的葡萄糖摄取明显减少,成功构建骨骼肌细胞胰岛素抵抗模型。过多的游离脂肪酸进入肌细胞,线粒体氧化脂肪酸能力降低,致骨骼肌内脂质沉积[4]。骨骼肌内脂质沉积与骨骼肌胰岛素抵抗密切相关[14]。本研究发现棕榈酸同时可降低PGC-1α的表达,这与Coll等[15]的研究结果一致。PGC-1α主要通过调节线粒体的数量和功能来调节细胞能量代谢[16,17]。特异性过表达骨骼肌中PGC-1α不仅可增加线粒体生物合成,还可增强胰岛素敏感性,促进葡萄糖的吸收[11]。而在胰岛素抵抗患者的骨骼肌中PGC-1α的表达明显下降[3]。
GDF11是一种分泌型生长分化因子,属于TGF-β超家族一员,在骨骼肌、胰腺、肾脏、心脏等组织广泛表达[18]。近年GDF11逆转衰老的作用备受瞩目,Loffredo等[7]报道恢复老年小鼠血液中GDF11到年轻小鼠的水平可逆转年龄相关的心肌肥厚。Sinha等[6]发现血液中GDF11随着小鼠年龄增长而降低,补充GDF11可改善衰老骨骼肌结构和功能,促进PGC-1α的表达,增加线粒体生物合成。本研究旨在探索GDF11是否可改善骨骼肌胰岛素抵抗。结果发现GDF11未明显改善棕榈酸诱导骨骼肌细胞胰岛素抵抗。GDF11对棕榈酸诱导后下调的PGC-1α表达也没有明显改善作用,这与Sinha等[6]研究显示GDF11可促进PGC-1α表达的结果不一致。其原因可能是模型不一样,Sinha等的研究模型是老年小鼠模型,体内是一个相对较复杂的整体环境,而本研究是体外构建的骨骼肌细胞胰岛素抵抗模型,环境较单一。目前的研究对GDF11逆转衰老的作用存在争议。与Sinha的研究结果相反,Egerman等[19]发现大鼠血液和骨骼肌中的GDF11蛋白随着年龄增长而升高,并且补充GDF11抑制老龄化骨骼肌的再生能力和骨骼肌细胞的分化;Egerman等提出Sinha对GDF11蛋白的检测方法难以将GDF11蛋白与Myostatin蛋白区分开来,而后者具有抑制肌肉生成的作用。Smith等[20]研究发现GDF11对老年小鼠心脏结构和功能没有改善作用,也没有减少心肌细胞肥大,而是诱导心肌细胞肥大。
综上所述,本研究在体外成功构建了骨骼肌胰岛素抵抗模型,棕榈酸干预使骨骼肌细胞葡萄糖摄取减少及GLUT4和IRS-1的表达下降,而加用GDF11干预后,骨骼肌细胞葡萄糖摄取及GLUT4和IRS-1的表达无明显改善。本研究首次探讨GDF11对骨骼肌细胞胰岛素抵抗的影响。可为目前GDF11的作用提供参考。
(致谢:感谢重庆医科大学附属第一医院脂糖代谢实验室提供的实验条件和技术支持。)
[1] Cooper S A, Whaley-Connell A, Habibi J, et al. Renin-angiotensin-aldosterone system and oxidative stress in cardiovascular insulin resistance[J].AmJPhysiolHeartCircPhysiol,2007,293(4):H2009-23.
[2] Reaven G M, Chen Y D. Insulin resistance, its consequences, and coronary heart disease. Must we choose one culprit[J]?Circulation,1996,93(10):1780-3.
[3] Patti M E, Butte A J, Crunkhorn S, et al. Coordinated reduction of genes of oxidative metabolism in humans with insulin resistance and diabetes: Potential role of PGC1 and NRF1[J].ProcNatlAcadSciUSA,2003,100(14):8466-71.
[4] Lowell B B, Shulman G I. Mitochondrial dysfunction and type 2 diabetes[J].Science,2005,307(5708):384-7.
[5] Kelley D E, He J, Menshikova E V, et al. Dysfunction of mitochondria in human skeletal muscle in type 2 diabetes[J].Diabetes,2002,51(10):2944-50.
[6] Sinha M, Jang Y C, Oh J, et al. Restoring systemic GDF11 levels reverses age-related dysfunction in mouse skeletal muscle[J].Science,2014,344(6184):649-52.
[7] Loffredo F S,Steinhauser M L,Jay S M, et al. Growth differentiation factor 11 is a circulating factor that reverses age-related cardiac hypertrophy[J].Cell,2013,153(4):828-39.
[8] Olson K A, Beatty A L, Heidecker B, et al. Association of growth differentiation factor 11/8, putative anti-ageing factor, with cardiovascular outcomes and overall mortality in humans: analysis of the Heart and Soul and HUNT3 cohorts[J].EurHeartJ, 2015,36(48):3426-34.
[9] Katsimpardi L, Litterman N K, Schein P A, et al. Vascular and neurogenic rejuvenation of the aging mouse brain by young systemic factors[J].Science,2014,344(6184):630-4.
[10]Wu Z, Puigserver P, Andersson U, et al. Mechanisms controlling nitochondrial biogenesis and respiration through the Thermogenic coactivator PGC-1[J].Cell, 1999,98(1):115-24.
[11]Summermatter S, Shui G, Maag D, et al. PGC-1alpha improves glucose homeostasis in skeletal muscle in an activity-dependent manner[J].Diabetes, 2013,62(1):85-95.
[12]Abdul-Ghani M A, DeFronzo R A. Pathogenesis of insulin resistance in skeletal muscle[J].JBiomedBiotechnol, 2010,2010:476279.
[13]吴文君,汤孙寅炎,时俊锋,等. 二甲双胍抑制SREBP-1c改善高脂诱导的骨骼肌胰岛素抵抗[J].中国药理学通报,2016,32(1):55-9.
[13]Wu W J, Tang S Y Y, Shi J F, et al. Metformin ameliorates PA-induced skeletal muscle insulin resistance by suppressing SREBP-1c[J].ChinPharmacolBull,2016,32(1):55-9.
[14]Krssak M, Falk Petersen K, Dresner A, et al. Intramyocellular lipid concentrations are correlated with insulin sensitivity in humans: a 1H NMR spectroscopy study[J].Diabetologia, 1999,42(1):113-6.
[15]Coll T, Jove M, Rodriguez-Calvo R, et al. Palmitate-mediated downregulation of peroxisome proliferator-activated receptor-gamma coactivator 1alpha in skeletal muscle cells involves MEK1/2 and nuclear factor-kappaB activation[J].Diabetes, 2006,55(10):2779-87.
[16]Arany Z. PGC-1 coactivators and skeletal muscle adaptations in health and disease[J].CurrOpinGenetDev, 2008,18(5):426-34.
[17]Buler M, Aatsinki S M, Izzi V, et al.SIRT5 is under the control of PGC-1alpha and AMPK and is involved in regulation of mitochondrial energy metabolism[J].FASEBJ, 2014,28(7):3225-37.
[18]McPherron A C. Metabolic functions of myostatin and Gdf11[J].ImmunolEndocrMetabAgentsMedChem, 2010,10(4):217-31.
[19]Egerman Marc A, Cadena Samuel M, et al. GDF11 increases with age and inhibits skeletal muscle regeneration[J].CellMetabolism,2015,22(1):164-74.
[20]Smith S C,Zhang X, Zhang X, et al. GDF11 does not rescue aging-related pathological hypertrophy[J].CircRes,2015,117(11):926-32.
Role of GDF11 in skeletal muscle cell insulin resistance induced by palmitate
JING Yuan-yuan, WU Fan, LI Rong
(DeptofEndocrinology,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China)
Aim To investigate the role of GDF11 in palmitate induced skeletal muscle insulin resistance.Methods The C2C12 cells were sorted into control group, GDF11 intervention group, palmitate group and GDF11 combined with palmitate group. Cell viability was measured by CCK-8, and the glucose uptake was determined by 2NBDG. The mRNA level of myotube marker genes(desmin,myogenin), insulin mediate glucose uptake related genes(GLUT-4,IRS-1) and PGC-1α were tested by RT-PCR. The protein expression of PGC-1α was detected by western blot.Results GDF11 had little effect on cell viability of skeletal muscle cells. Compared with control group, the glucose uptake and the expression of GLUT-4,IRS-1,PGC-1α were significantly decreased by palmitate intervention. Compared with palmitate group, the glucose uptake and the expression of GLUT-4,IRS-1,PGC-1α were not significantly changed by GDF11.Conclusion Palmitate can induce skeletal muscle cell insulin resistance, but GDF11 may not significantly improve the skeletal muscle cell insulin resistance.
GDF11;skeletal muscle cell;insulin resistance;PGC-1α;palmitate;glucose uptake
时间:2017-5-25 17:44 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170525.1744.014.html
2017-01-18,
2017-03-16
国家自然科学基金资助项目(No 81200588);国家临床重点专科建设项目(No 2011-170)
敬媛媛(1991-),女,硕士生,研究方向:内分泌及代谢,E-mail:776839843@qq.com; 李 蓉(1972-),女,博士,教授,主任医师,硕士生导师,研究方向:内分泌及代谢,通讯作者,E-mail:rongli232006@163.com
10.3969/j.issn.1001-1978.2017.06.007
A
1001-1978(2017)06-0767-05
R322.74;R329.24; R347.8;R458.5;R977.6摘要:目的 探讨GDF11对棕榈酸诱导骨骼肌细胞胰岛素抵抗的影响。方法 用棕榈酸构建骨骼肌细胞胰岛素抵抗模型,分为对照组、GDF11干预组、棕榈酸干预组和GDF11联合棕榈酸干预组。CCK-8检测细胞活力,2NBDG检测细胞葡萄糖摄取。实时荧光定量PCR检测肌管标志基因(desmin、myogenin),胰岛素介导葡萄糖摄取相关基因(GLUT-4、IRS-1)及PGC-1α的表达。Western blot检测PGC-1α蛋白水平的表达。结果 不同浓度GDF11对骨骼肌细胞活力无明显影响。与对照组相比,棕榈酸干预组葡萄糖摄取及GLUT-4、IRS-1、PGC-1α的表达明显降低(P<0.05)。与棕榈酸干预组相比,GDF11联合棕榈酸干预组葡萄糖摄取及GLUT-4、IRS-1、PGC-1α的表达无明显变化。结论 棕榈酸可成功诱导骨骼肌细胞胰岛素抵抗,而GDF11对骨骼肌细胞胰岛素抵抗没有明显改善作用。