中药穿山甲的DNA分子鉴定研究
尹艳+刘逊+王兵+高琳惠+张夏楠


[摘要] 对中药穿山甲及其混伪品进行分子鉴定研究,建立一个稳定、准确的位点特异性PCR鉴别体系。收集整理穿山甲属动物组织样本及NCBI序列,提取基因组总DNA,PCR扩增Cytb和COⅠ序列并测序,通过BioEdit软件进行序列比对,应用MEGA 6.0构建序列系统聚类树,并根据序列特异位点设计和筛选中华穿山甲特异性鉴别引物,并对PCR反应条件进行退火温度、DNA模板上样量和PCR循环数等条件的适应性考查。结果表明:Cytb和COⅠ序列均能有效对穿山甲正、伪品进行聚类分析;在位点特异性PCR反应体系中,当退火温度为55~60 ℃,DNA模板量3~100 ng,PCR扩增35个循环时,基于COⅠ序列的引物COⅠ-S10/A5 能使中華穿山甲扩增出约400 bp的特异性条带,而其他穿山甲品种扩增结果为阴性。该文基于COⅠ序列的引物COⅠ-S10/A5能实现中华穿山甲与伪品印度穿山甲、马来穿山甲、树穿山甲等的准确、稳定鉴别。
[关键词] 穿山甲;COⅠ;Cytb;分子鉴定
[Abstract] The study was aimed to establish a stable,accurate site specific PCR identification system to identify Manis pentadactyla and its adulterants using DNA molecular identification. The genomic DNA was extracted from experimental samples using the DNA extraction kit. The Cytb and CO Ⅰ genes were amplified using PCR and sequenced bi-directionally. Obtained sequences were assembled using the BioEdit software. The neighbor-joining tree was constructed by MEGA 6.0. Specific identification primers were designed according to the specific allelets,and PCR reaction system was optimized. The results indicated that the Cytb and CO Ⅰ sequence both were able to be used to identify M. pentadactyla and its adulterants. With the specific primers CO Ⅰ-S10/A5,the M. pentadactyla could be amplified a 400 bp DNA band when the annealing temperature ranged from 55 to 60 ℃ and the amount of DNA template ranged from 3 to 100 ng within 35 PCR cycles. However,other adulterants displayed no relevant bands. So that primers CO Ⅰ- S10 / A5 can be used to identify the M. pentadactyla with the adulterants.
[Key words] Manis pentadactyla;COⅠ;Cytb;molecular identification
穿山甲为鲮鲤科Manidae穿山甲属Mains动物,全球现存包括分布亚洲的中华穿山甲M. pentadactyla、印度穿山甲M. crassicaudata、马来穿山甲M. javanica、菲律宾穿山甲M.culionensis 4种,分布非洲的树穿山甲M. tricuspis、大穿山甲M. gigantea南非穿山甲M.temminckii和长尾穿山甲 M. tetradactyla 4种[1]。其中中华穿山甲是我国药典规定的中药穿山甲的唯一正品来源,是我国传统名贵中药之一[3-6],具有活血消癥、通经下乳、消肿排脓、搜风通络之功效,用于经闭症瘕、乳汁不通、痈肿疮毒、风湿痹痛、中风瘫痪、麻木拘挛等症。然而近年来中华穿山甲的资源极度稀缺,早在2013年世界自然保护联盟(IUCN) 物种生存委员会(SSC) 穿山甲专家组(PSG) 会议中,中华穿山甲和马来穿山甲在受胁物种红色名录(Redlist) 中的等级就被上调为极度濒危级(Cr),而其他6 种穿山甲的等级也全部提升为濒危级(En) [2]。穿山甲除药用之外,其肉可食且被认为味道鲜美兼具较高营养价值。穿山甲人工繁殖困难[7],药材等来源依靠野生资源捕猎且缺乏科学可持续手段。基于以上原因,穿山甲野生资源逐渐匮乏[8],穿山甲市场售价昂贵[9],是以导致穿山甲非法捕猎和走私贸易泛滥[10-11]。
Gaudin T J等基于计算机技术对现存的7种和已经灭绝的5种穿山甲的骨骼特征进行了系统发育关系分析,从形态学上解释了穿山甲生物地理学分布特征和物种进化史[12]。刘逊等对穿山甲商品状况及基源进行了调查和鉴定,并总结了系列穿山甲鳞甲的基源鉴别依据[13],但穿山甲鳞甲大小、颜色、纹理等随源动物年龄、生活生态环境、鳞片部位等有所差异[14],种内变化大,种间辨识度低,非经验丰富专家不能正确鉴别。与之相比,DNA分子技术具有不受样品形态、数量等限制的优点,对于穿山甲这一类珍稀物种的种源鉴定具有独特的优势,Tobe S S等也曾提出用DNA特异性片段作为珍贵濒危物种的鉴定新方法[15]。目前关于穿山甲分子鉴定方面的研究较少,尤其缺乏穿山甲属内种间分子鉴别的研究。本文应用分子标记方法对穿山甲属不同种动物进行鉴别,并基于标记序列建立一个位点特异性PCR体系,以准确快速区分中华穿山甲与其他穿山甲品种。
1 材料
1.1 样品
共收集穿山甲样品供24份(表1),其中鳞甲19份,筋膜5份。由首都医科大学中医药学院教学实验中心和江苏卫生职业技术学院刘逊副教授鉴定保存并馈赠。
1.2 仪器
PCR仪(Applied Biosystems Veriti);微量核酸定量仪(NanoDrop 2000C);高级荧光化学发光系统(FUSION-SL)。
1.3 试剂
Wizard SV Genomic DNA Purification System (Promega,0000178703);2×EasyTaq PCR SuperMix (TRANS,AS111);2×KAPA HiFi Hotstart ReadyMix(KAPA,00061748);2K DNA Marker(TRANS,E110);Gene Green Nucleic Acid Dye(TIANGEN,P4829)。
2 方法
2.1 基因組DNA的提取、通用引物PCR扩增及测序
选用了Promega Wizard SV Genomic DNA Purification System进行穿山甲鳞甲和筋膜的DNA提取,按照试剂盒的说明,样品粉碎后取30~50 mg 加入275 μL消化液55 ℃消化处理过夜(16~18 h),随后进行裂解,释放基因组DNA,并利用吸附柱吸附,经漂洗液去除蛋白质等杂质后,用双蒸水500 μL分2次洗脱获得基因组DNA。各样品分别用通用引物(表2)以高保真酶扩增COⅠ和Cytb序列并进行测序。PCR扩增体系为2×KAPA HiFi Hotstart ReadyMix 25 μL,正反向引物各1.5 μL,DNA 5 μL,无菌水补足至50 μL。PCR产物经过1.5%琼脂糖凝胶电泳后对目的片段切胶回收,由北京睿博兴科生物技术有限公司测序部测序,各样品均采用正反双向测序,以保证结果的准确性。
2.2 序列分析
将测序结果使用MEGA 6.0进行比对并建立构建系统聚类树(邻接法),Bootstrap(1 000次重复)检验各分支的支持率。
2.3 特异性鉴别引物的设计
将所测得的序列与GenBank中下载的穿山甲序列用BioEdit软件进行多重比对分析,找出具有稳定差异的特异性片段,筛选获得变异位点,通过该位点运用Premier Primer 5.0软件针对中华穿山甲的特异性片段设计鉴别引物,并由睿博兴科生物技术有限公司合成。
2.4 特异性鉴别引物筛选
取穿山甲不同样品DNA进行位点特异性PCR,所用20 μL反应体系为:2×EasyTaq PCR Super Mix 10 μL,正反向引物各0.4 μL,DNA经微量核酸定量仪定量并稀释至10 mg·L-1后取1 μL,无菌水补齐。PCR产物通过添加Gene Green 核酸染料染色的1%琼脂糖凝胶电泳,紫外光下显色观察。以结果出现特异扩增片段为阳性,无扩增为阴性,由此判断引物特异性。
2.5 特异性PCR反应条件优化
为优化位点特异性PCR反应条件,分别考察了DNA模板上样量(3,5,10,30,50,100 ng)、退火温度(55,57,60 ℃)、PCR循环数对特异性PCR结果的影响。
3 结果与分析
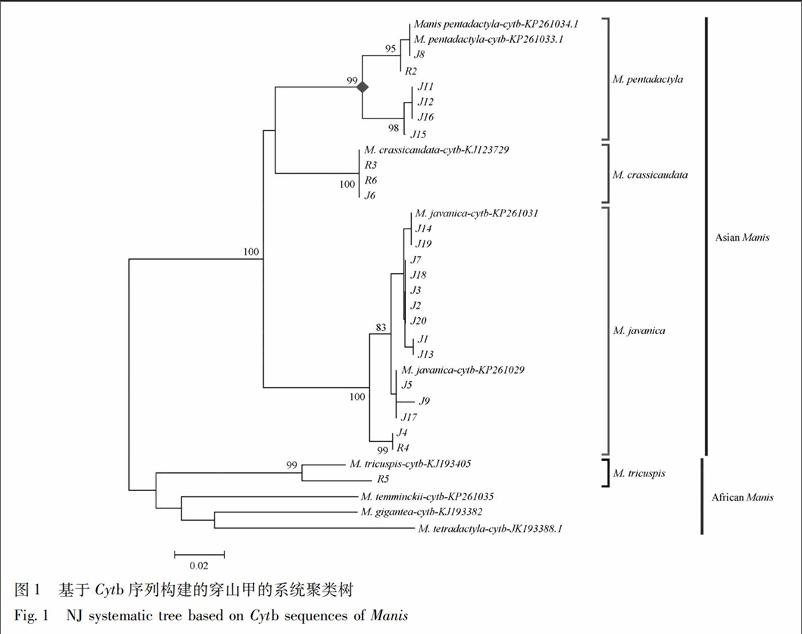
3.1 基于Cytb和COⅠ序列的系统聚类树构建结果
采用MEGA 6.0分析软件进穿山甲属动物Cytb和COⅠ序列系统聚类树的构建(图1,2)。亚洲产区与非洲产区的穿山甲分别聚为2支,亚洲产穿山甲中,中华产山甲、印度穿山甲与马来产山甲又分别聚为一支,种间区分置信度≥99%,表明Cytb和COⅠ序列用于穿山甲的分子鉴定具有可行性。2种序列所建NJ树中,样品J8,J11,J12,J15,J16,R2均与NCBI上下载的中华穿山甲序列聚为一支,说明这6个样品为正品中华穿山甲。而样品R6,R3,J6为印度穿山甲,R5为树穿山甲,其余样品为马来穿山甲。
3.2 特异性引物筛选结果
用基于Cytb和COⅠ序列设计的中华穿山甲位点特异性引物以各穿山甲样品DNA为模板进行PCR扩增,筛选获得一对特异性引物COⅠ-S10/A5。该对引物对中华穿山甲在一定条件下能扩增出400 bp的特异片段,而印度穿山甲、马来穿山甲和树穿山甲扩增结果均为阴性;而COⅠ通用引物对所有DNA模板均能有效扩增出750 bp明亮清晰的片段,证明引物COⅠ-S10/A5对中华穿山甲具有良好的特异性(图3)。
3.3 PCR扩增反应条件优化
3.3.1 DNA模板量的考查 对20 μL PCR 反应体系中的模板DNA用量进行了考察(图4),DNA在3~100 ng时,中华穿山甲(1,2)能扩增出特异性条带,且随模板量减少条带变暗,模板量降至3 ng时条带已经难以辨识;伪品在DNA模板量3~100 ng扩增结果均为阴性,因此建议本方法中DNA模板用量以3~100 ng为宜。
3.3.2 退火温度和PCR循环次数对结果的影响 如退火温度在55~60 ℃,PCR扩增35个循环时,中华穿山甲(1,2)能扩增出特异性条带(阳性),且伪品扩增结果为阴性。当PCR循环数减少至28个,正品特异性条带明显变弱,甚至无法辨识;循环数增加至时,伪品出现假阳性扩增(图5,6)。
4 结论与讨论
2016年9月举行的第17届《濒危野生动植物种国际贸易公约》缔约方大会(CITESCoP17)拟通过了将亚洲和非洲的全部8种穿山甲由原来的《公约》附Ⅱ提升到附录Ⅰ的提案,全面禁止穿山甲的国际贸易。调查数据显示,野生穿山甲在亚洲地区已经很难找到,对穿山甲药用和食用需求,刺激了非洲穿山甲非法走私贸易网络的形成[17]。Zhang H等收集了大量走私穿山甲样本并应用法医学中DNA取证的方法对这些样本的来源及可能的走私路径进行了分析,论证了DNA取证的方法在野生动物非法贸易检测上的应用价值[18]。作为中国传统用药的唯一正品来源,中华穿山甲的准确便捷鉴别能一定程度上有效抑制外来穿山甲品种向中国的输入,并有效打击国内中华穿山甲的非法捕猎。
本研究通过特异引物筛选和条件优化,确定20 μL PCR反应体系时,基于COⅠ序列设计的引物COⅠ-S10/A5在DNA模板加样量3~100 ng,退火温度55~60 ℃时,扩增35个循环可将正品中华穿山甲与其他伪品进行有效的鉴别。由于穿山甲样品组织的特殊性,选用了Promega Wizard SV Genomic DNA Purification System进行穿山甲鳞甲和筋膜的DNA提取。该方法操作简单,无酚、氯仿等污染,提取的穿山甲DNA经微量核酸定量仪检测,其质量浓度在5~100 mg·L-1,可直接用于本文所筛选的特异性引物进行鉴定。本研究采用该试剂盒进行了炮制穿山甲片DNA的提取实验,发现取样量20 mg左右时,DNA量为5~20 mg·L-1,且蛋白和小分子污染较为严重,采用特异性引物进行鉴别时重复性不高,因此对于炮制甲片的鉴别研究有待进一步优化实验过程。
对于标记片段,分别扩增了线粒体基因片段COⅠ(cytochrome oxidaseⅠ)和Cytb(cytochrome b),其中COⅠ序列为目前研究者普遍推荐的动物DNA通用条形码序列,对鸟类、鱼类、节肢动物、哺乳动物等均具有很好的物种鉴别能力[19]。此外,线粒体DNA具有的分子结构相对简单,较核DNA容易检测且不易降解的优势,适用于穿山甲鳞甲这类DNA提取困难的样品检测。
此外,本研究中还构建了穿山甲基于Cytb和COⅠ序列的系统聚类(NJ)树,成功将不同种穿山甲区分开来,证明Cytb和COⅠ序列均适用于穿山甲的分子鉴定。NJ树图显示,亚洲产区和非洲产区的穿山甲分别聚为一支,其下不同种穿山甲又各自分支聚集。中华穿山甲在我国分布有3个亚种:指名亚种(M. p. pentadactyla)分布于台湾;华南亚种(M. p. aurita)见于华南一带 14 个省区;海南亚种(M. p. pusilla )产于海南[1]。但三者具体鉴别信息少有文献报道。本文中Cytb和COⅠ序列的NJ树均显示,在中华穿山甲分支内部,样品J11,J12,J15,J16与样品J8,R2及NCBI上下载的中华穿山甲序列又分别聚为一支,说明这2个分支所在样品可能为两个不同的中华穿山甲亚种,为中华穿山甲分类保护与研究提供参考依据。
[参考文献]
[1] 张立,李麒麟,孙戈,等. 穿山甲种群概况及保护[J]. 生物学通报,2010,45(9):1.
[2] 吴诗宝. 穿山甲专家组会议在新加坡召开,中国穿山甲升级为极度濒危动物[J]. 兽类学报,2013,33(3):214.
[3] Soewu D A,Adekanola T A. Traditional-medical knowledge and perception of pangolins (Manis sps) among the Awori people,Southwestern Nigeria[J]. J Ethnobiol Ethnomed,2011,7(5):446.
[4] Boakye M K,Pietersen D W,Kotzé A,et al. Ethnomedicinal use of African pangolins by traditional medical practitioners in Sierra Leone[J]. J Ethnobiol Ethnomed,2013,10(1):76.
[5] Boakye M K,Pietersen D W,Kotzé A,et al. Knowledge and uses of African pangolins as a source of traditional medicine in Ghana[J]. PLoS ONE,2014,10(1):e0117199.
[6] 胡轩铭,温成平,谢志军. 穿山甲古今应用的沿革研究[J]. 中华中医药学刊,2012,30(3):590.
[7] 唐松元,段文武,黄兴国,等. 穿山甲资源现状和人工养殖对策及发展前景[J]. 湖南林业科技,2012,39(3):75.
[8] 吴诗宝,刘延发,张迎梅,等. 中国穿山甲受危状况评估[J]. 应用与环境生物学报,2004,10(4):456.
[9] 吴诗宝,马广智,唐玫,等. 中国穿山甲资源现状及保护对策[J]. 自然资源学报,2002,17(2):174.
[10] 刘曦庆,彭建军,高赛飞,等. 穿山甲的走私贸易概况、物种鉴定与形态比较[J]. 林业实用技术,2011,29(5):11.
[11] 尹峰,卢琳琳,梦梦,等. 穿山甲的贸易与保护[J]. 野生动物学报,2016,37(2):157.
[12] Gaudin T J,Emry R J,Wible J R. The phylogeny of living and extinct pangolins (Mammalia,Pholidota) and associated taxa: a morphology based analysis[J]. J Mamm Evol,2009,16(4):235.
[13] 刘逊,朱缨,胡芳,等. 濒危物种穿山甲的商品调查及其基源鉴定[J]. 亚太传统医药,2015,11(15):35.
[14] Zhang Y P,Shi L M. Genetic diversity in the Chinese pangolin (Manis pentadactyla ): inferred from restriction enzyme analysis of mitochondrial DNAs[J]. Biochem Genet,1991,29(9/10):501.
[15] Tobe S S,Linacre A. A new assay for identifying endangered species in traditional east Asian medicine[J]. Forensic
Sci Int Genet,2011,3(1):e232.
[16] Gaubert P,Machordom A,Morales A,et al. Comparative phylogeography of two African carnivorans presumably introduced into Europe: disentangling natural versus human-mediated dispersal across the Strait of Gibraltar[J]. J Biogeogr,2011,38(2):341.
[17] Nijman V,Zhang M X,Shepherd C R. Pangolin trade in the Mong La wildlife market and the role of Myanmar in the smuggling of pangolins into China[J]. Gecco,2016,5:118.
[18] Zhang H,Miller M P,Yang F,et al. Molecular tracing of confiscated pangolin scales for conservation and illegal trade monitoring in southeast Asia[J]. Gecco,2015,4:414.
[19] 張辉,姚辉,崔丽娜,等. 基于COⅠ条形码序列的《中国药典》动物药材鉴定研究[J]. 世界科学技术——中医药现代化,2013,15(3):371.
[责任编辑 吕冬梅]

